


2. 九江学院附属医院心内科, 江西 九江 332000;
3. 九江学院转化医学实验室, 江西 九江 332000
 ,
GU Xiang1,2
,
GU Xiang1,2
 ,
HUANG Wen-yin2,
ZHANG Pu-hua2,
YU Huan3,
YIN Chang-chang3,
WANG Li-li3,
MAO Wei-wei2
,
HUANG Wen-yin2,
ZHANG Pu-hua2,
YU Huan3,
YIN Chang-chang3,
WANG Li-li3,
MAO Wei-wei2
2. Medicine Graduate School, Nanchang University, Nanchang 330006, China;
3. Basic Medical College of Jiujang University, Jiujang Jiangxi 332000, China
晚期糖基化终末产物 (advanced glycation end products,AGEs) 是过量糖与蛋白质、脂质、核酸之间经非酶糖基化反应的终末产物,可通过诱导活性氧 (ROS)、细胞凋亡及炎性反应等导致细胞损伤或死亡,在糖尿病心肌病发生发展过程中发挥重要作用[1]。最近研究发现,自噬作为糖尿病心肌病的新颖发病机制,在调节AGEs诱导的心肌细胞凋亡、ROS诱导的糖尿病心肌损伤等方面的作用引起关注[2-3],有望成为糖尿病心肌病治疗的潜在靶向机制。
胰高血糖素样肽 (glucagon-like peptide-1,GLP-1) 是机体中一种具有“肠促胰素效应”的肠源性激素,在发挥综合降糖作用外,还可影响糖尿病心肌病的多种发病机制,其中包括缓解糖尿病心肌内质网应激、减少高糖诱导的心肌细胞凋亡等[4-5]。此外,GLP-1还可通过抑制自噬保护高糖诱导的人肾小管上皮细胞损伤[6],通过减少氧化应激改善冠脉血管内皮损伤[7],以及减少急性心肌梗死面积及心梗后心肌重构等[8],这些研究结果提示GLP-1在糖尿病心肌病中的作用及机制值得进一步探究。本研究通过观察GLP-1对AGEs诱导的H9C2心肌细胞ROS及自噬影响,初步探讨自噬在GLP-1糖尿病心肌损伤中的保护作用及潜在机制。
1 材料与方法 1.1 主要材料H9C2大鼠心肌细胞株由南昌大学第二附属医院实验室细胞库惠赠。AGEs (121800,Calbiochem公司,美国),DMEM-F12培养基 (Hyclone公司,美国),胎牛血清 (BI公司,以色列),GLP-1(Sigma公司,美国),活性氧检测试剂盒、细胞计数CCK-8试剂盒 (碧云天生物技术研究所,中国),兔抗老鼠GAPDH (10494-1-AP) 多克隆抗体 (Peprotech公司,美国),LC-3B (#3868)、Beclin1(#3495)(CST公司,美国),吖啶橙 (索莱宝公司,中国)。
1.2 方法 1.2.1 细胞培养H9C2细胞株复苏后,接种于15%胎牛血清DMEM-F12培养液中,在37 ℃、5% CO2、饱和湿度培养箱中培养。在细胞贴壁80%时,用0.25%胰酶消化,取对数生长期的细胞并接种于6孔板中,分别加入0.9%生理盐水、100 mg·L-1 AGEs、100 mg·L-1+10 nmol·L-1 GLP-1、100 mg·L-1+10 nmol·L-1 GLP-1+5 μmol·L-1 rapamycin,并在培养箱中培养24 h后进行各项指标检测。
1.2.2 CCK-8法检测细胞成活率按照CCK-8试剂盒说明书操作流程,取对数生长期细胞,以2×107·L-1细胞浓度接种于96孔板中,在37 ℃培养箱中培养2 h后,用酶标仪 (Elx800,BioTek,美国) 记录450 nm波长处的吸光度。取4孔光密度 (optical density,OD) 的平均值,按下列公式计算细胞存活率:生存率/%=(OD处理组-OD空白组)/(OD对照组-OD空白组)×100%。实验重复3次。
1.2.3 Hoechst 33258核染色法检测心肌细胞凋亡H9C2心肌细胞经不同因素处理后, 小心弃去培养基,PBS洗1遍,4%多聚甲醛固定10 min,PBS漂洗后,加入5 mg·L-1 Hoechst 33258试剂,室温轻摇30 min。在荧光显微镜 (BX50-FLA, Olympus, Japan) 下摄片, 染色质均匀分布, 核被染成均匀蓝色的细胞认为是正常细胞,核呈浓缩、碎裂的明亮蓝色细胞认为是凋亡细胞,随机选取视野在荧光显微镜下摄片。
1.2.4 DCFH-DA荧光探针检测细胞内ROS水平根据活性氧试剂盒操作流程,标本用10 μmol·L-1 DCFH-DA染液于37 ℃孵育20 min。在荧光显微镜下随机选取5个不重复区摄片,用Image J 1.410软件分析4个视野绿色荧光强度的平均值,再对每组的各样本进行统计分析。
1.2.5 流式细胞仪检测自噬溶酶体水平收集H9C2细胞,用预冷的PBS洗1次,1 000 r·min-1离心5 min后,加入已配制好的等体积吖啶橙 (Acridine orange, AO) 染色液,冰上染色10~15 min,样品在1h内用流式细胞仪 (BD FACSCalibur,美国) 检测细胞自噬溶酶体水平 (激发光488 nm)。
1.2.6 Western blot测定自噬相关蛋白表达收集H9C2细胞,用预冷的PBS洗涤3次,RIPA全细胞裂解液冰上裂解30 min,离心取上清,BCA法进行蛋白定量。每孔蛋白上样量30 μg在0.1聚丙烯酰胺凝胶 (SDS-PAGE) 中进行电泳70 V,电泳15~20 min,待指示剂到浓缩胶与分离胶交界处后,改为120 V继续电泳,直至溴酚蓝完全到凝胶底部停止电泳。置于电转液中,在250 mA恒定电流下将蛋白转移至PVDF膜上。50 g·L-1脱脂奶粉封闭1 h,LC3B、Beclin1一抗 (1 :1 000稀释)4 ℃孵育过夜,TBST洗膜3次。二抗室温孵育1 h,漂洗3次,ECL显色。用ECL检测液发光显影定影后,用Image J软件进行灰度分析。
1.2.7 统计学分析数据以x±s描述,采用SPSS11.5软件进行统计学分析。组间比较采用方差分析和t检验。
2 结果 2.1 GLP-1减少AGEs诱导H9C2心肌细胞损伤 2.1.1 各组细胞形态学特征在倒置显微镜下,各组细胞形态学特征表现为:Control组细胞呈梭形,排列规整,大小均一,胞核、胞质境界清楚;AGEs组细胞大小不规则,一些胞体变圆、皱缩,胞核增大,胞质有空泡出现;AGEs+GLP-1组细胞大小较为均一,形态趋向正常,细胞皱缩变形和胞质空泡化减少;与AGEs+GLP-1组相比,AGEs+GLP-1+rapamycin组细胞形态学损伤较为严重 (Fig 1)。
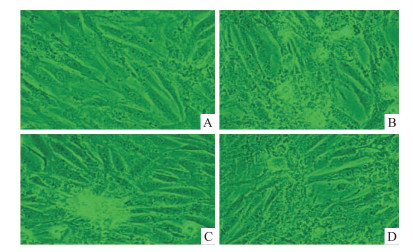
|
| Fig 1 Cellular morphology observation (×400) A:Control; B:AGEs; C:AGEs+GLP-1;D:AGEs+GLP-1+Rapamycin |
CCK-8法检测各组细胞存活率结果显示,与Control组相比,AGEs组细胞生存率明显减低 (70.16±1.98 vs 93.37±3.66,P < 0.01);AGEs+GLP-1组较AGEs组明显提高细胞生存率 (80.66±1.78 vs 70.16±1.98,P < 0.05)。见Tab 1。
| Group | Cell viability% of control (x±s deviations) |
| Normal control | 93.37±3.73 |
| 100 mg·L-1 AGEs | 70.16±1.98## |
| 100 mg·L-1 AGEs+10 nmol·L-1 GLP-1 | 80.66±1.78* |
| 100 mg·L-1 AGEs+10 nmol·L-1 GLP-1+5 μmol·L-1 rapamycin | 71.58±3.36 |
| ##P < 0.01 vs control; *P < 0.05 vs 100 mg·L-1 AGEs group. | |
Hoechst 33258核染色检测结果显示, 与Control比较,100 mg·L-1 AGEs处理H9C2心肌细胞24 h能使H9C2细胞凋亡率明显增加;与100 mg·L-1 AGEs组损伤相比100 mg·L-1 AGEs+10 nmol·L-1 GLP+5 μmol·L-1 Rapamycin与100 mg·L-1 AGEs组对比,细胞凋亡率差异无统计学意义 (P>0.05)。见Fig 2。
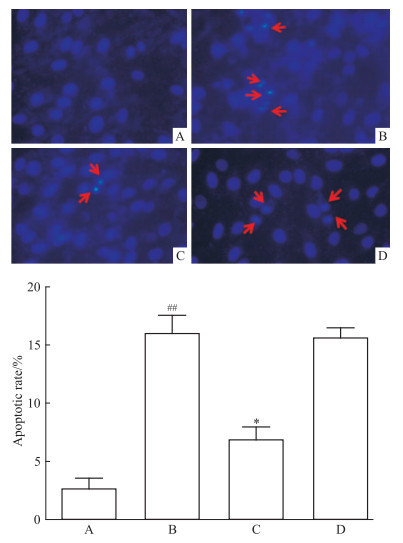
|
| Fig 2 Effect of GLP-1on AGEs-inducedapoptosis of H9C2(x±s, n=4) A:Control; B:AGEs; C:AGEs+GLP-1;D:AGEs+GLP-1+Rapamycin.##P < 0.01 vs control; *P < 0.05 vs AGEs group. |
运用荧光探针DCFH-DA对各组心肌细胞内ROS进行标记,用Image J 1.410软件分析荧光强度结果显示 (Fig 3),AGEs组荧光强度明显高于Control组 (P < 0.01);与AGEs组相比,AGEs+GLP-1组荧光强度明显减弱 (P < 0.05);以上结果提示,AGEs可导致H9C2心肌细胞内ROS升高,GLP-1干预后可明显降低AGEs诱导的细胞内ROS产物。
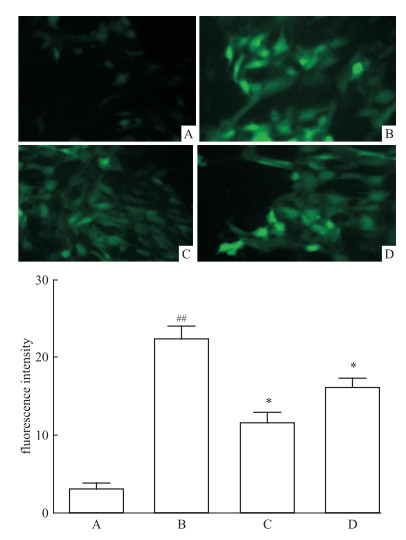
|
| Fig 3 Effect of GLP-1 on AGEs-inducedROS of H9C2(x±s, n=4) A:Control; B:AGEs; C:AGEs+GLP-1;D:AGEs+GLP-1+Rapamycin.##P < 0.0 1 vs control; *P < 0.05 vs 100 mg·L-1 AGEs group. |
A为正常Control组;B为AGEs组;C为AGEs+GLP-1组,D为AGEs+GLP-1+Rapamycin组。运用吖啶橙 (Acridine orange, AO) 对细胞内酸性囊泡细胞器 (包括自噬溶酶体) 进行染色标记,经流式细胞仪检测AO荧光强度结果显示 (Fig 4),AGEs组平均荧光强度明显高于Control组 (3 302.03±9.84 vs 162.05±3.20,P < 0.01);在经GLP-1干预后显示,AGEs+GLP-1组平均荧光强度较AGEs组明显减低 (2 756.67±3.84 vs 3 302.03±9.84,P < 0.05);用Rapamycin进一步干预后,AGEs+GLP-1+Rapamycin组平均荧光强度与AGEs组差异无显著性 (3 206±8.80 vs 3 302.03±9.84,P>0.05)。上述结果提示,GLP-1可明显减少细胞自噬溶酶体水平,Rapamycin干预后可削弱GLP-1对细胞自噬溶酶体作用效果。
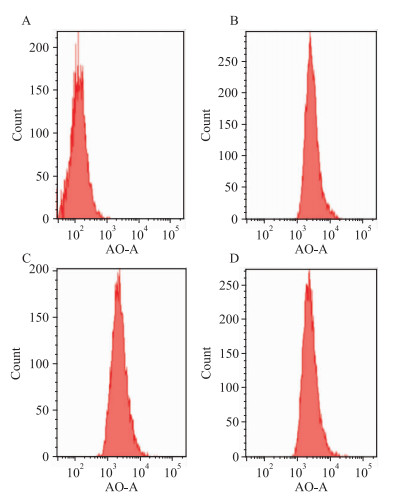
|
| Fig 4 Effect of GLP-1 on AGEs-induced autophagy of H9C2(x±s, n=4) A:Control; B:AGEs; C:AGEs+GLP-1;D:AGEs+GLP-1+Rapamycin. |
运用免疫印迹方法分别检测50、100、200 mg·L-1浓度AGEs对H9C2心肌细胞LC3Ⅱ、Beclin1蛋白表达影响。结果显示,随着AGEs浓度升高,LC3Ⅱ、Beclin1蛋白表达逐步增强,根据实验结果选用100 mg·L-1 AGEs作为最适宜自噬激活浓度。与Control组相比,AGEs组中LC3Ⅱ、Beclin1表达均明显增高 (P < 0.05),表明AGEs可明显激活自噬,该结果与流式细胞检测结果基本一致;在经GLP-1干预后,自噬相关蛋白表达均明显降低 (AGEs+GLP-1组vs AGEs组,P < 0.05)(Fig 5),提示GLP-1可能具有抑制自噬作用。
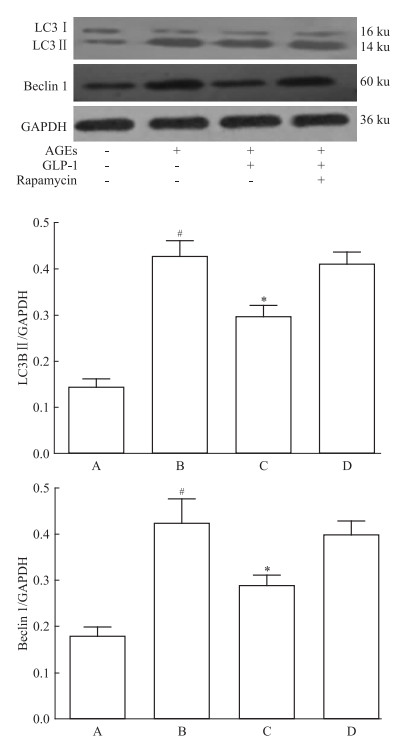
|
| Fig 5 Effect of GLP-1 on the autophagy LC3BⅡ, Beclin1 protein expression (x±s, n=4) A:Control; B:AGEs; C:AGEs+GLP-1;D:AGEs+GLP-1+Rapamycin.#P < 0.05 vs control; *P < 0.05 vs AGEs group |
为了进一步验证GLP-1通过抑制细胞自噬产生心肌损伤保护作用,本研究运用自噬诱导剂rapamycin对GLP-1作用进行干预,结果显示,rapamycin可明显削弱GLP-1对自噬相关蛋白表达的影响 (AGEs+GLP-1+Rapamycin组vs AGEs组,P>0.05)。因此,结合rapamycin对细胞损伤和细胞内ROS影响 (Fig 1、Tab 1、Fig 2、Fig 3),本结果提示,GLP-1可通过抑制自噬保护AGEs诱导的H9C2心肌细胞损伤。
3 讨论糖尿病心肌病 (diabetic cardiomyopathy, DCM) 是一种由多重致病机制共同参与的心肌疾病,其中,AGEs在DCM发病进程中的作用尤为关键[9-10]。AGEs可通过两种途径参与DCM致病过程:①直接导致胶原蛋白分子交联,抑制胶原蛋白降解,进而增加心肌间质纤维化;②与其受体RAGE结合,诱导ROS形成、炎性反应,进而激活一系列信号转导途径导致心肌细胞损伤[1, 11]。最近研究发现,AGEs还可通过与RAGE结合,抑制PI3K/AKT/mTOR途径从而激活自噬引起心肌细胞损伤[12]。因此,自噬在AGEs诱导的心肌细胞损伤过程中的调节作用值得深入探讨。
GLP-1是由肠道L型细胞分泌的一种肠促胰岛素 (incretin),通过促进胰岛细胞增殖、胰岛素分泌,抑制胰岛细胞凋亡、胰高血糖素分泌,发挥综合降血糖的生物学功效。在内皮细胞、胰岛细胞等研究中发现,GLP-1还可通过降低RAGE表达、减少ROS形成或抑制细胞凋亡,发挥抗AGEs诱导的细胞损伤作用[13-15]。最近研究也证实,AGEs可诱导RAGE受体表达,而GLP-1可抑制RAGE表达及细胞凋亡,进而提高心肌细胞存活率[16-17]。上述研究结果表明,GLP-1对AGEs诱导的细胞损伤保护机制,可能与减少ROS形成、降低RAGE表达及抑制细胞凋亡有关。
本研究结果显示,AGEs可明显诱导H9C2心肌细胞损伤,主要表现为:与Control组相比,AGEs组出现胞体变形、胞核增大、胞质见空泡等细胞形态学损伤;细胞生存率检测结果也显现较低水平。结合ROS检测结果分析,AGEs组中细胞内ROS升高可能与AGEs诱导的细胞损伤有关,且其损伤程度随AGEs浓度升高而增加。在经GLP-1干预后显示,GLP-1可明显降低由AGE诱导的细胞内ROS形成,并有效改善细胞损伤。以上结果表明,GLP-1可能通过减少细胞内ROS形成而发挥抗AGEs诱导的H9C2心肌细胞损伤作用。
AGEs是诱导细胞内ROS升高的重要原因之一[18],ROS异常升高除直接通过氧化反应造成细胞DNA、蛋白质损伤外,还可作为信号分子激活细胞内多种应激敏感信号通路,包括自噬信号通路。研究表明,在氧化应激状态下,ROS升高可通过多种分子信号通路诱导自噬发生,而自噬激活后也可通过线粒体自噬、分子伴侣自噬 (CMA) 等途径来降低ROS水平[19]。目前认为,ROS与自噬之间这种负向反馈机制一般发生在ROS轻微升高情况下,是机体应对氧化应激的一种代偿调节机制;而当ROS过多增高时,自噬会被过度激活,ROS与自噬之间将形成正向反馈调节,诱导细胞进入自噬型细胞死亡[20-22]。从本研究结果分析,AGEs诱导的细胞损伤、ROS升高及自噬活性上调,在经GLP-1干预后出现明显缓解或下降,推测GLP-1可能通过减少ROS形成,将ROS与自噬之间正向反馈关系转变成负向反馈,从而减少由正向反馈带来的不良后果。
为了进一步验证GLP-1心肌保护作用与自噬活性关系,本研究运用自噬诱导剂rapamycin干预发现,rapamycin在不影响ROS水平情况下,可明显削弱GLP-1对AGEs诱导的心肌细胞损伤保护作用,并有效地干扰了GLP-1对自噬溶酶体形成及自噬相关蛋白表达影响。上述结果提示,在AGEs环境下,GLP-1心肌保护作用与自噬抑制存在一定关联,其保护机制除了涉及ROS介导的自噬外,可能还存在其他自噬调节途径。因此,从本研究结果分析,GLP-1对AGEs诱导的H9C2心肌细胞损伤具有保护作用,其保护机制可能部分通过抑制ROS介导的自噬来实现。
( 致谢: 本实验于九江学院基础医学院转化医学实验室完成。本实验主要参与人谷翔、殷嫦嫦、李卫东老师给予课题设计及修改;黄问银、王丽丽老师给予实验技术指导;张普华、管高鹏、陈文杰同学给予具体实验上的帮助。 )
| [1] | Bugger H, Abel E D. Molecular mechanisms of diabetic cardiomyopathy[J]. Diabetologia, 2014, 57 (4): 660-71. doi:10.1007/s00125-014-3171-6 |
| [2] | Hu P F, Zhou H, Lu M, et al. Autophagy plays a protective role in advanced glycation end product-induced apoptosis in cardiomyocytes[J]. Cell Physiol Biochem, 2015, 37 (2): 697-706. doi:10.1159/000430388 |
| [3] | Kobayashi S, Liang Q. Autophagy and mitophagy in diabetic cardiomyopathy[J]. Biochim Biophys Acta, 2015, 1852 (2): 252-61. doi:10.1016/j.bbadis.2014.05.020 |
| [4] | Liu J, Liu Y, Chen L, et al. Glucagon-like peptide-1 analog liraglutide protects against diabetic cardiomyopathy by the inhibition of the endoplasmic reticulum stress pathway[J]. J Diabetes Res, 2013, 2013 : 630537. |
| [5] | Younce C W, Burmeister M A, Ayala J E. Exendin-4 attenuates high glucose-induced cardiomyocyte apoptosis via inhibition of endoplasmic reticulum stress and activation of SERCA2a[J]. Am J Physiol Cell Physiol, 2013, 304 (6): C508-18. doi:10.1152/ajpcell.00248.2012 |
| [6] | Zhao X, Liu G, Shen H, et al. Liraglutide inhibits autophagy and apoptosis induced by high glucose through GLP-1R in renal tubular epithelial cells[J]. Int J Mol Med, 2015, 35 (3): 684-92. |
| [7] | Wang D, Luo P, Wang Y, et al. Glucagon-like peptide-1 protects against cardiacmicrovascular injury in diabetes via a cAMP/PKA/Rho-dependent mechanism[J]. Diabetes, 2013, 62 (5): 1697-708. doi:10.2337/db12-1025 |
| [8] | Yin M, Westenbrink B D, Meissner M, et al. Variable effects of anti-diabetic drugs in animal models of myocardial ischemia and remodeling: a translational perspective for the cardiologist. Int[J]. J Cardiol, 2013, 169 (6): 385-93. |
| [9] | Singh V P, Bali A, Singh N, Jaggi A S. Advanced glycation end products and diabetic complications[J]. Korean J Physiol Pharmacol, 2014, 18 (1): 1-14. doi:10.4196/kjpp.2014.18.1.1 |
| [10] | Ramasamy R, Yan S F, Schmidt A M. Receptor for AGE (RAGE): signaling mechanisms in the pathogenesis of diabetes and its complications[J]. Ann New York Acad Sci, 2011, 1243 : 88-102. doi:10.1111/j.1749-6632.2011.06320.x |
| [11] | Bodiga V L, Eda S R, Bodiga S. Advanced glycation end products: role in pathology of diabetic cardiomyopathy[J]. Heart Fail Rev, 2014, 19 : 49-63. doi:10.1007/s10741-013-9374-y |
| [12] | Hou X W, Hu Z H, Xu H Y, et al. Advanced glycation end products trigger autophagy in cardiomyocyte Via RAGE/PI3K/AKT/mTOR pathway[J]. Cardiovasc Diabetol, 2014, 13 : 78. doi:10.1186/1475-2840-13-78 |
| [13] | Ishibashi Y, Matsui T, Takeuchi M, Yamagishi S I. Glucagon-like peptide-1(GLP-1) inhibits advanced glycation end product (AGE)-induced up-regulation of VCAM-1 mRNA levels in endothelial cells by suppressing AGE receptor (RAGE) expression[J]. Biochem Biophys Res Commun, 2010, 391 (3): 1405-8. doi:10.1016/j.bbrc.2009.12.075 |
| [14] | Puddu A, Storace D, Durante A, et al. Glucagon-like peptide-1 counteracts the detrimental effects of advanced glycation end-products in the pancreatic beta cell line HIT-T 15[J]. Biochem Biophys Res Commun, 2010, 398 (3): 462-6. doi:10.1016/j.bbrc.2010.06.100 |
| [15] | Zhan Y, Sun H L, Chen H, et al. Glucagon-like peptide-1(GLP-1) protects vascular endothelial cells against advanced glycation end products (AGEs)-induced apoptosis[J]. Med Sci Mon, 2012, 18 (7): BR286-91. |
| [16] | Yi B, Hu X, Wen Z, et al. Exendin-4, a glucagon-like peptide-1 receptor agonist, inhibits hyperglycemia-induced apoptosis in myocytes by suppressing receptor for advanced glycation end products expression[J]. Exp Ther Med, 2014, 8 : 1185-90. |
| [17] | 张秋艳, 唐灵, 王艳, 等. 绞股蓝皂苷对AGEs诱导下人肾小球系膜细胞中RAGE及转化生长因子-β1表达的影响[J]. 中国药理学通报, 2016, 32 (9): 1301-6. Zhang Q Y, Tang L, Wang Y, et al. Effect of gypenosides on RAGE and TGF-β1expression in human mesangial cells induced by AGEs[J]. Chin Pharmacol Bull, 2016, 32 (9): 1301-6. |
| [18] | Panigrahy S K, Bhatt R, Kumar A. Reactive oxygen species: sources, consequences and targeted therapy in type 2 diabetes[J]. J Drug Target, 2016, 19 : 1-9. |
| [19] | Li L, Tan J, Miao Y, et al. ROS and autophagy: interactions and molecular regulatory mechanisms[J]. Cell Mol Neurobiol, 2015, 35 (5): 615-21. doi:10.1007/s10571-015-0166-x |
| [20] | Zhang X, Yu L, Xu H. Lysosome calcium in ROS regulation of autophagy[J]. Autophagy, 2016, 12 (10): 1954-5. doi:10.1080/15548627.2016.1212787 |
| [21] | Dadakhujaev S, Jung E J, Noh H S, et al. Interplay between autophagy and apoptosis in TrkA-induced cell death[J]. Autophagy, 2009, 5 (1): 103-5. doi:10.4161/auto.5.1.7276 |
| [22] | Morales C R, Pedrozo Z, Lavandero S, Hill J A. Oxidative stress and autophagy in cardiovascular homeostasis[J]. Antioxid Redox Signal, 2014, 20 (3): 507-18. doi:10.1089/ars.2013.5359 |