


 ,
DAI Yi-fei,
ZHOU Wei-wei,
LI Qian,
ZHOU Hai-yu,
JI Hai-nan,
DAI Li,
WANG Peng-qian,
HUO Hai-ru,
SUI Feng
,
DAI Yi-fei,
ZHOU Wei-wei,
LI Qian,
ZHOU Hai-yu,
JI Hai-nan,
DAI Li,
WANG Peng-qian,
HUO Hai-ru,
SUI Feng
寒热药性是中药的一种特殊的核心属性,由其共性规律凝练升华而成的中药寒热药性理论是中医药理论体系的重要组成部分,对于中医临床潜方用药起着至关重要的作用。近年来, 国家科技部、国家中医药管理局、国家自然科学基金委等部分先后立项以解析中药药性、尤其是寒热药性的生物学基础和分子机制,但总体看仍未取得突破性进展。我们课题组长期从事中药药性理论的客观化研究,以往研究发现部分热性中药成分可能通过激活或调节寒热感受通道蛋白 (如TRPV1等) 影响机体的能量代谢过程而表征中药的热性属性[1-4]。为进一步深入解析热性中药基于能量代谢环节的生物学分子机制,本研究以列入2010版中国药典的具有辛热药性的温里中药辣椒为关注点,以其主要活性成分—辣椒碱 (已列入24版和25版《美国药典》) 为研究对象,在采用热偶检测分析方法评价辣椒碱对小鼠产热和散热环节的调节作用的基础上,引入了机体能量开关——解偶联蛋白亚型1(UCP1),分别从基因和蛋白层面深入解析辣椒碱的药性生物分子基础,挖掘中药-物质基础-药效-药性之间的内在规律性,为全面揭示中药药性奠定实验和方法学基础。
1 仪器与材料 1.1 主要实验仪器精密温度采集系统,Physitemp Instruments Inc;5402冷冻离心机Eppendorf公司;ABI 2720 Thermal Cycle Applied Biosystem;ABI 7500荧光定量PCR仪,Applied BioSystem;HT300电泳设备,北京鸿涛基业科技发展有限责任公司;5402冷冻离心机,Eppendorf公司;TY-80A脱色摇床,常州菲普实验仪器厂;BSA223S型电子分析天平,赛多利斯科学仪器 (北京) 有限公司;ND-8000型核酸定量仪,Gene Company Limited基因有限公司。
1.2 主要实验药品辣椒碱,Sigma产品 (批号:BCBM1193);总RNA提取试剂盒 (离心柱型)(批号:04210)、QuantScript RT Kit (批号:03529)、SuperReal PreMix Plus (SYBR Green)(批号:04128) 均购于天根生化科技有限公司;乙二胺四乙酸磷酸氢二钠 (批号:20110326)、甘氨酸 (批号:20130205)、过硫酸铵 (批号:20130517)、N,N-亚甲基双丙烯酰胺 (批号:20121101)、十二烷基硫酸钠 (批号:20130625)、丙烯酰胺 (批号:20130513) 等均为国药集团化学试剂有限公司;Tris (三羟甲基氨基甲烷)(批号:201-064-4) 购于AMERCO;RIPA裂解液 (批号:47S001100) 购于北京鼎国昌盛生物技术有限责任公司;Coomase Brilliant Blu R-250(批号:228-0605) 购于北京东胜泰博科技有限公司;Trizma base (批号:BCBD2752V) 购于Sigma公司;兔抗-UCP1(批号:12J08) 为博士德生物工程有限公司产品;5×蛋白上样缓冲液 (批号:140506),购于北京庄盟国际生物基因科技有限公司;蛋白marker (批号:00298242) 为Thermo Scientific产品。
1.3 实验动物昆明小鼠,♀♂各半,体质量 (20±2) g,64只,购自北京大学医学部 (实验动物科学部),许可证号SCXK (京)2011-0012。
2 方法 2.1 小鼠机体热学变化的检测分析小鼠禁食2 h,用乌拉坦麻醉 (1.35 g·kg-1体重)。将检测仪中一个探头放置在小鼠尾根部检测尾部皮肤温度,另一个小鼠探头插入肛门用以检测小鼠机体深部核心温度。在测试过程中,动物放置在加热毯上维持机体温度的相对恒定,并使环境温度保持在30℃~32℃。辣椒碱用含80%生理盐水、10% Tween 80和10%乙醇的溶液溶解后,分别按照高 (0.02 mg·g-1)、中 (0.01 mg·g-1)、低 (0.002 mg·g-1) 剂量分组,皮下注射给药;另设溶剂 (含80%生理盐水、10% Tween 80和10%乙醇) 对照组,每组4只鼠,待动物肛温与鼠尾皮肤温度稳定30 min后给药。
2.2 小鼠BAT中UCP1基因表达的检测分析将小鼠分为辣椒碱高、中、低剂量组和对照组。每组分别给药5 d、7 d后,小鼠断颈处死,取出背部脂肪组织,剪切成小块装入EP管中备用。按照NCBI genebank上公布的基因序列对UCP1和GAPDH引物设计后由英潍捷基上海贸易有限公司合成,GAPDH:正向5′-CTCAGGATTGGCCTCTACGACTC-3′,反向5′-TTGGTGTACATGGACATCGCA-3′;UCP1:正向5′-GAAGGTCGGTGTGAACGGATT-3′,反向5′-GAAGACACCAGTAGACTCCACGACATA-3′。采用吸附柱吸附的方法提取总RNA。在基因扩增仪上进行逆转录。取出逆转录的产物取出引物和模板,置于冰上解冻。按说明书配制Real-Time PCR反应液。盖上反应管,轻柔混匀,短暂离心。将反应体系置于荧光定量PCR仪中,按Tab 1中的扩增条件进行荧光定量PCR反应。
| Stage | Cycle | Temperature | Time | Content |
| Predenature | 1× | 95℃ | 15 min | Predenature |
| PCR reaction | 40× | 95℃ | 10 s | Denature |
| 64℃ | 2 s | Annealing/extension |
本实验采用荧光定量相对定量的方法,并以2-ΔΔCt表示实验结果,其计算公式如下:ΔΔCt=(Ct, Target-Ct, GAPDH) X-(Ct, Target-Ct, GAPDH) Control。X表示任意组,Control表示经GAPDH校正后1倍量的目标基因表达。
2.3 Western检测小鼠BAT中UCP1蛋白的表达小鼠的分组和给药同“2.2”部分。把剥离下的组织用PBS清洗两次,按每20 mg组织100 μL的比例加入裂解液,12 000 r·min-1离心5 min,吸取上清液检测蛋白浓度。取50 μg组织上样进行SDS聚丙烯酰胺凝胶电泳。将电泳后的蛋白转移到PVDF膜上,室温下在摇床摇动封闭2 h。封闭后,用0.2% PBST洗3次。将膜放入盛有兔多克隆抗体 (1 :200,封闭液稀释) 的自封袋中,室温在摇床上孵育2 h,孵育后用0.2% PBST洗3次。然后将膜放入辣根过氧化物酶标记的羊抗兔IgG (1 :2 000) 中孵育2 h,孵育后用0.2% PBST洗3次。在膜上加入适量超敏ECL发光底液,放入凝胶成像系统中检测。
2.4 统计学方法实验所得数据利用SPSS17.0统计软件进行统计分析,多组间比较采用单因素方差分析 (one-way ANOVA),两两比较采用t检验。
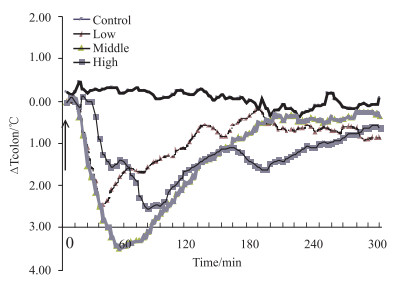
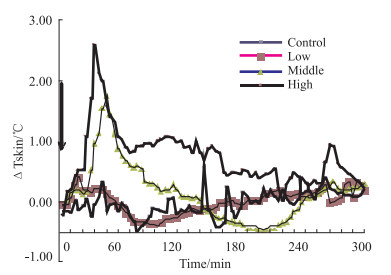
3 结果 3.1 辣椒碱对小鼠基础能量代谢的影响如Tab 2、Fig 1所示,给药后,小鼠的肛温开始下降,各给药组在60 min左右时下降的幅度与对照组相比,差异均有显著性 (P < 0.01);而在60 min左右时,各给药组小鼠肛温渐渐上升,240 min左右时,各给药组小鼠肛温升至基础水平。由Tab 3、Fig 2可见,灌胃辣椒碱后,伴随肛温下降,小鼠尾部皮肤温度迅速上升,一段时间后下降,各给药组在30 min左右时,与对照组相比,上升幅度差异有显著性 (P < 0.01)。
| Group | 0 min | 60 min | 120 min | 180 min | 240 min | 300 min |
| Control | 0.22±0.32 | 0.30±0.15 | 0.23±0.21 | -0.19±0.18 | -0.18±0.16 | 0.07±0.30 |
| Low | -0.07±0.11 | -1.66±0.55** | -0.70±0.55 | -0.21±0.75 | -0.69±0.33 | -0.87±0.57 |
| Middle | 0.02±0.15 | -3.29±0.17** | -1.57±0.48** | -0.57±0.14 | -0.46±0.44 | -0.44±0.11 |
| High | -0.01±0.14 | -1.90±0.52** | -1.51±0.76** | -1.62±0.14* | -1.00±0.42 | -0.66±0.37 |
| *P < 0.05, **P < 0.01 vs control | ||||||
| Group | 0 min | 8 min | 16 min | 24 min | 32 min | 40 min |
| Control | -0.14±0.11 | -0.07±0.11 | -0.03±0.12 | -0.05±0.11 | 0.04±0.12 | 0.04±0.13 |
| Low | 0.05±0.11 | 0.88±0.18** | 0.98±0.19** | 0.87±0.21 | 0.81±0.18** | 0.56±0.11 |
| Middle | 0.05±0.15 | 0.28±0.13 | 0.29±0.16 | 0.96±0.33 | 1.59±0.14** | 1.45±0.56** |
| High | 0.20±0.25 | 0.51±0.38 | 1.08±0.13** | 2.60±0.67** | 1.90±0.18** | 1.41±0.21** |
| **P < 0.01 vs control | ||||||
|
| Fig 1 Effect of capsaicin on anus temperature of mice (x±s, n=4, ℃) |
|
| Fig 2 Effect of capsaicin on tail-skin temperature of mice (x±s, n=4, ℃) |
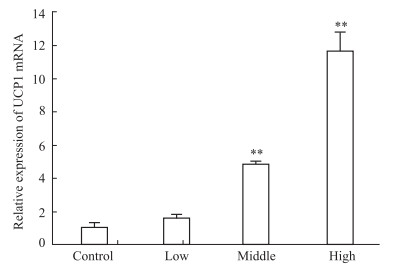
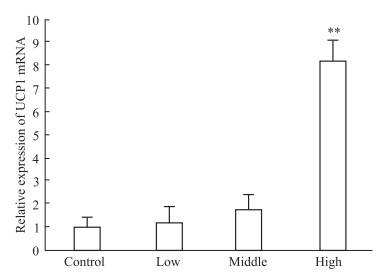
如Tab 4、Fig 3所示,给药5 d后,低、中和高剂量胡椒碱组UCP1 mRNA的相对表达分别增加了1.58倍、5.46倍、11.67倍,呈现良好的剂量依赖性,其中中剂量胡椒碱组和高剂量胡椒碱组的UCP1 mRNA的表达与对照组相比差异有显著性 (P < 0.01)。由Tab 5、Fig 4可见,给药7 d后,低、中、高胡椒碱组UCP1 mRNA的相对表达分别增加了1.22倍、1.81倍、8.22倍,呈现明显的剂量依赖性,其中高剂量胡椒碱组UCP1mRNA表达与对照组相比差异均有显著性 (P < 0.01)。
| Group | Relative expression (2-△△CT) |
| Control | 1.00±0.29 |
| Low | 1.58±0.24 |
| Middle | 5.46±0.42** |
| High | 11.67±1.19** |
| **P < 0.01 vs control | |
|
| Fig 3 Effect of capsaicin on expression of UCP1mRNA of mice 5 days post treatment (x±s, n=6) **P < 0.01 vs control |
|
| Fig 4 Effect of capsaicin on expression of UCP1mRNA of mice 7 days post treatment (x±s, n=6) **P < 0.01 vs control |
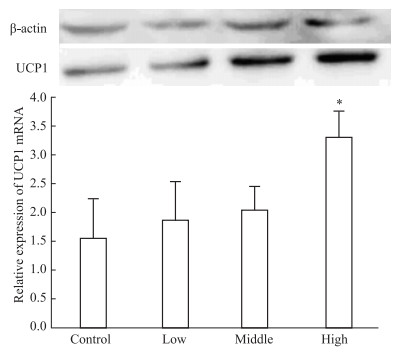
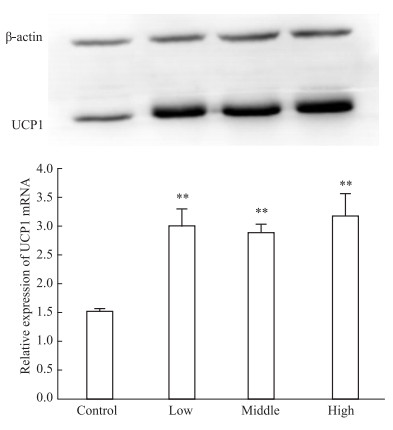
如Fig 5所示,小鼠灌胃辣椒碱5 d后,UCP1蛋白表达增加,呈明显的剂量相关,其中高剂量辣椒碱组的UCP1蛋白表达与对照组相比,差异有显著性 (P < 0.05)。如Fig 6所示,小鼠灌胃辣椒碱7 d后,UCP1蛋白表达明显增加,辣椒碱各给药组与空白对照组相比,UCP1蛋白表达差异均有显著性 (P < 0.05)。
|
| Fig 5 Effect of capsaicin on expression of UCP1 protein of mice 5 days post treatment (x±s, n=6) *P < 0.05 vs contro |
|
| Fig 6 Effect of capsaicin on expression of UCP1 protein of mice 7 days post treatment (x±s, n=6) **P < 0.01 vs control |
对于包括人在内的恒温动物来说,保持体温的恒定是适应外界环境得以生存的必要条件。正常生理状态下,环境温度升高时,机体通过减少产热和增加散热来维持体温相对恒定。反之,当环境温度下降时,则产热增加而散热减少[5-6]。现已明确,机体的散热过程主要是在神经系统的调节下,机体内部的体热通过血液循环和热传导两种方式转移到皮肤,皮肤再通过辐射、传导、对流和蒸发四种方式完成的[6-7]。其中,血管舒张会引起皮肤血管血流增加,热量散失增多;血管收缩则导致皮肤血管血流量减少,热量散失减少[8-9]。而机体的产热主要包括非战栗性产热和战栗性产热。非战栗性性产热代表了机体主要的产热渠道,源于不同组织的新陈代谢,如受肾上腺素和甲状腺激素调节的棕色脂肪组织,以及肝脏产热等。战栗性产热主要来自骨骼肌[10-11]。
本研究中,我们选择了肛温作为机体核心温度 (core body temperature) 变化的指标,而鼠尾皮肤温度与血管收缩和舒张引起的血流量密切相关,因而可以作为散热量的评价指标。两个指标综合分析能够说明药物对小鼠能量代谢的调节作用。本研究中发现,热性中药成分辣椒碱灌胃小鼠后,肛温开始降低,而鼠尾皮肤温度迅速升高,表明此阶段机体的散热大于产热。而在大约60 min后,肛温慢慢上升,提示此时机体的产热大于散热。现已明确,在棕色脂肪组织 (BAT) 线粒体内膜上高丰度表达着解偶联蛋白-1(UCP1)[12-13]。UCP1是解偶联蛋白 (UCP) 家族中主要表达在BAT细胞线粒体膜内的重要成员之一,其主要功能是通过将呼吸链与ATP产生过程解偶联最终将其消耗的脂肪转化为热量而非ATP[14-15]。
业已证实,机体在寒冷、应激、伤害等刺激条件下,机体BAT中的UCP1表达量上调,产热能力增强[15-16],表明UCP1对机体能量代谢平衡的维持起着关键性的作用。本研究中发现,辣椒碱连续给药5 d或7 d后,UCP1基因和蛋白表达均上调,意味着小鼠的产热能力增强,这与试验中我们检测到的小鼠给药辣椒碱后机体的产热量增加相吻合。结合我们以往的实验研究结果,可以认为上调UCP1的表达进而提高机体的能量代谢是辣椒碱作为辣椒的热性成分表征热性属性的生物分子机制之一。当然,从辣椒碱入体后小鼠的整体代谢情况看,小鼠既有体温的下降,也出现了体温逐步回升的过程;既有散热,也有产热过程,两者均参与了辣椒碱调节机体代谢的生物学作用。但这两个热学变化是由辣椒碱作用于机体同一靶点引起的,还是作用于多个靶点通过不同的作用机制整合后的生物效应,尚有待深入研究。
( 致谢: 本实验是在中国中医科学院中药研究所中药理论与本草文献研究中心实验室完成,由孟晶、戴逸飞、周炜炜、李倩、周海玉、姬海南、戴丽、王朋倩、霍海如、隋峰等共同参与。 )
| [1] | 隋峰, 戴丽, 李倩, 等. TRPV1通道介导的热生成是辛热 (温) 中药药性表征的重要模式[J]. 药学学报, 2015, 50 (7): 836-41. Sui F, Dai L, Li Q, et al. TRPV1 channel-mediated thermogenesis is a common mode for the Chinese pungent-hot or pungent-warm herbs to demonstrate their natures[J]. Acta Pharmaceut Sin, 2015, 50 (7): 836-41. |
| [2] | 隋峰, 姜廷良. 从机体TRP寒热感受环节挖掘中药四气的现代科学内涵[J]. 中国中药杂志, 2012, 37 (16): 2501-4. Sui F, Jiang T L. Study on scientific connotation of four herbal properties on basis of cold and hot perceptions[J]. China J Chin Mat, 2012, 37 (16): 2501-4. |
| [3] | 隋峰, 杨娜, 张畅斌, 等. 寒热性中药成分对TRPV1和TRPM8通道蛋白基因表达的影响[J]. 中国中药杂志, 2010, 35 (12): 1594-8. Sui F, Yang N, Zhang CB, et al. Effects of ingredients from Chinese herbs with nature of cold or hot on expression of TRPV1 and TRPM8[J]. China J Chin Mat Med, 2010, 35 (12): 1594-8. |
| [4] | 周海玉, 戴丽, 王德凤, 等. 基于荧光定量PCR评测热性中药成分对TRPV1通道功能的影响[J]. 中国药理学通报, 2016, 32 (10): 1395-8. Zhou H Y, Dai L, Wang D F, et al. Evaluation of regulational function of ingredients from hot herbs on TRPV1 channel based on 7900 PCR instrument[J]. Chin Pharmacol Bull, 2016, 32 (10): 1395-8. |
| [5] | Turner J B, Kumar A, Koch C A. The effects of indoor and outdoor temperature on metabolic rate and adipose tissue-the Mississippi perspective on the obesity epidemic[J]. Rev Endocr Metab Disord, 2016, 17 (1): 61-71. doi:10.1007/s11154-016-9358-z |
| [6] | Tansey E A, Johnson C D. Recent advances in thermoregulation[J]. Adv Physiol Educ, 2015, 39 (3): 139-48. doi:10.1152/advan.00126.2014 |
| [7] | Celi F S, Le T N, Ni B. Physiology and relevance of human adaptive thermogenesis response[J]. Trends Endocrinol Metab, 2015, 26 (5): 238-47. doi:10.1016/j.tem.2015.03.003 |
| [8] | Contreras C, Gonzalez F, Fern J, et al. The brain and brown fat[J]. Ann Med, 2015, 47 (2): 150-68. doi:10.3109/07853890.2014.919727 |
| [9] | Blondin D P, Tingelstad H C, Mantha O L, et al. Maintaining thermogenesis in cold exposed humans: relying on multiple metabolic pathways[J]. Compr Physiol, 2014, 4 (4): 1383-402. |
| [10] | Morrison S F, Madden C J. Central nervous system regulation of brown adipose tissue[J]. Compr Physiol, 2014, 4 (4): 1677-713. |
| [11] | 余苏云, 刘兆国, 贾琦, 等. 葡萄糖转运蛋白1与肿瘤能量代谢关系的研究进展[J]. 中国药理学通报, 2016, 32 (7): 906-9. Yu S Y, Liu Z G, Jia Q, et al. Research progress on relationship between glucose transporter 1 and tumor energy metabolism[J]. Chin Pharmacol Bull, 2016, 32 (7): 906-9. |
| [12] | Van der Lans AA, Wierts R, Vosselman M J, et al. Cold-activated brown adipose tissue in human adults: methodological issues[J]. Am J Physiol Regul Integr Comp Physiol, 2014, 307 (2): R103-13. doi:10.1152/ajpregu.00021.2014 |
| [13] | Morrison S F, Madden C J, Tupone D. Central neural regulation of brown adipose tissue thermogenesis and energy expenditure[J]. Cell Metab, 2014, 19 (5): 741-56. doi:10.1016/j.cmet.2014.02.007 |
| [14] | Clapham J C. Central control of thermogenesis[J]. Neuropharm, 2012, 63 (1): 111-23. doi:10.1016/j.neuropharm.2011.10.014 |
| [15] | Oelkrug R, Polymeropoulos E T, Jastroch M. Brown adipose tissue: physiological function and evolutionary significance[J]. J Comp Physiol B, 2015, 185 (6): 587-606. doi:10.1007/s00360-015-0907-7 |
| [16] | Harper M E, Gerrits M F. Mitochondrial uncoupling proteins as potential targets for pharmacological agents[J]. Curr Opin Pharmacol, 2004, 4 (6): 603-7. doi:10.1016/j.coph.2004.06.006 |