


2. 河北北方学院,河北 张家口 075000
2. Hebei North University, Zhangjiakou Hebei 075000, China
细胞色素P450酶(cytochrome P450,CYP450) 主要存在于肝脏中,代谢大量的内源性和外源性物质。CYP450系统组成复杂,具有遗传多态性,是引起种族间和个体间对同一底物代谢能力不同的原因之一。CYP450酶主要的代谢酶亚型有CYP1A2(参与代谢约4%临床用药)、CYP2C19(2%)、CYP2D6(30%) 和CYP3A4(50%),这4种代谢酶亚型参与临床85%以上的药物代谢[1]。药物代谢酶被抑制或者诱导是引起肝代谢层面上药物相互作用的机制之一。FDA指导原则《体内药物代谢/药物相互作用研究-试验设计、数据分析、关于剂量和药品说明书的建议》中要求,“应在新药开发过程中确定该药物的代谢作用,同时探究其与其他药物的相互作用,作为适当评价安全性和有效性的一部分”[2]。检测药物代谢酶活性是研究药物相互作用的基石之一。
鸡尾酒(Cocktail) 探针药物法是指同时给予多种相对低剂量的探针药物,测定生物样本中各探针药物的代谢率或其他代谢分型指标,获取多个CYP450同工酶表型信息的方法[3]。“Cocktail”探针药物法通过定量分析探针药物,反映CYP450亚型酶的活性,确定是否被诱导或抑制,从而确定中西药间可能的相互作用,降低不良反应[4]。“Cocktail”探针药物法可应用于快速测定肝药酶活性、确证药物代谢途径、评价药物相互作用、验证临床结果等研究领域。为快速评价药物(化药、中药等) 对CYP450酶活性的影响,以及为临床前高通量筛选提供快速的分析方法,本研究选取特异性探针底物/代谢产物,咖啡因/副黄嘌呤、奥美拉唑/5-羟基奥美拉唑、右美沙芬/右啡烷和咪达唑仑/1′-羟基咪达唑仑作为CYP1A2、CYP2C19、CYP2D6和CYP3A4酶活性的表征指标,建立评价测定酶活性的体内研究方法。通过测定探针药物的代谢率或其他代谢分型指标,为化药、中药对肝药酶活性影响进行早期预评,对临床合理用药具有重要的指导意义。
1 材料 1.1 仪器Agilent 1200液相色谱仪(美国Agilent公司);3200 QTrap串联四极杆线性离子阱质谱仪(美国AB SCIEX公司),Turbo Ionspray离子源,Analyst 1.4.2数据处理系统;Milli-Q Gradient A10超纯水器(美国Millipore公司);真空旋转蒸发仪(美国Labconco公司)。
1.2 药品与试剂咪达唑仑(midazolam,MDZ,批号FE042209-01)、1′-羟基咪达唑仑(1′-hydroxymidazolam,1′OH-MDZ,批号FD050034-02) 和副黄嘌呤(paraxanthine,PX,批号FN081810-03) 对照品购自美国Cerilliant公司;咖啡因(caffeine,CAF,批号C11693000) 对照品购自德国Dr. EhrenStorfer公司;右美沙芬(dextromethorphan,DM,批号D9684) 和右啡烷(dextrorphan,DX,批号D127) 对照品购自美国Sigma公司;5-羟基奥美拉唑(5-dydroxyomeprazole,5OH-OPZ,批号H948863) 对照品购自加拿大Toronto Research Chemicals公司;注射用奥美拉唑钠(omeprazole,OPZ,批号F110219) 购自江苏奥赛康药业有限公司;咪达唑仑注射液(批号20120106) 购自江苏恩华药业股份有限公司;地西泮(diazepam,DZP,批号1217-9201) 对照品购自中国食品药品检定研究院。乙腈和甲醇购自美国Fisher Scientific公司,色谱纯;乙酸乙酯购自美国Honeywell公司,色谱纯;甲酸购自德国Merk公司,色谱纯;甲酸铵购自美国Roe Scientific公司,色谱纯;其他试剂均为市售分析纯,实验用水为超纯水。
1.3 动物SPF级健康♂SD大鼠6只,体质量(250±20) g,由北京维通利华实验动物技术有限公司提供,合格证号SCXK (京)2012-0001。
2 方法与结果 2.1 测定条件色谱条件:Agilent Eclipse Plus-C18色谱柱(50 mm×2.1 mm, 3.5 μm);流动相A 0.01%甲酸水(1 mmol·L-1甲酸铵),B乙腈,梯度洗脱(0~1 min,5%~20% B;1~7.5 min,20%~40% B;7.5~8 min,40%~85% B),流速0.3 mL·min-1;进样量10 μL;柱温30 ℃。
质谱参数:电喷雾离子化(ESI);离子极性Positive;多反应正离子监测(MRM+);离子喷雾电压(4 500 V);离子源温度(450 ℃);Gas1(60 psi);Gas2(65 psi);气帘气压力(20 psi);CAF m/z:195.0/138.1;PX m/z:181.1/124.1;OPZ m/z:346.1/198.1;5OH-OPZ m/z:362.1/214.1;DM m/z:272.2/147.1;DX m/z:258.1/157.1;MDZ m/z:326.1/291.1;1′OH-MDZ m/z:342.1/324.1;DZP m/z:285.1/154.0。
2.2 对照品溶液的制备精密称定CAF、OPZ、DM、DX和IS DZP对照品1 mg,置于1 mL甲醇中,配制成1 g·L-1溶液作为贮备液(于4 ℃下避光保存)。精密量取CAF、OPZ、DM和MDZ贮备液适量,用甲醇稀释成4.8、9.8、19.5、39.1、78.1、156、625、391、1 250、2 500、5 000、10 000、20 000 μg·L-1标准系列溶液;精密量取PX、5OH-OPZ、DX、1′OH-MDZ贮备液适量,用甲醇稀释成4.8、9.8、19.5、39.1、78.1、156、391、625、1 250、2 500 μg·L-1标准系列溶液;精密量取DZP贮备液适量,用甲醇稀释成1 mg·L-1的标准溶液。
2.3 静脉注射混合探针药物溶液的制备精密称取CAF 3 mg、DM 15 mg和OPZ 20 mg分别溶解于生理盐水中。分别吸取3 g·L-1 CAF 0.5 mL、15 g·L-1 DM 0.5 mL、20 g·L-1 OPZ 0.375 mL、5 g·L-1 MDZ 0.3 mL配制成3 mL混合探针药物溶液。
2.4 血浆样品处理100 μL血浆精密加入内标DZP 10 μL (1 mg·L-1) 混匀,加入0.2 mol·L-1乙酸铵溶液100 μL及4 mL乙酸乙酯,振荡提取5 min,离心,吸取3.5 mL上清液真空挥干,用1 mmol·L-1碳酸钠水和乙腈混合液200 μL复溶,高速离心,取上清10 μL进样分析。
2.5 血浆中标准曲线及最低定量限100 μL血浆精密加入不同量的标准品。在上述条件下,CAF、PX、OPZ、5OH-OPZ、DM、DX、MDZ、1′OH-MDZ最低定量限分别为1.95、0.98、0.48、0.98、0.98、0.48、1.95、1.95 μg·L-1,检测灵敏度较好,见Tab 1。
| Probe drug/Met | RT/min | Calibration range/μg·L-1 |
Standard curve /μg·L-1 |
R2 | LLOQ/ μg·L-1 |
| CAF | 4.21 | 1.95-62.5 | R=0.000 4C-0.000 03 | 0.996 0 | 1.95 |
| 31.25-2 000 | R=0.000 4C+0.006 1 | 0.999 7 | |||
| PX | 2.03 | 0.98-250 | R=0.002 2C-0.000 04 | 0.999 9 | 0.98 |
| OPZ | 7.30 | 0.48-31.25 | R=0.008 1C+0.004 5 | 0.997 3 | 0.48 |
| 31.25-2 000 | R=0.004 7C+0.242 | 0.997 3 | |||
| 5OH-OPZ | 6.25 | 0.98-125 | R=0.000 44C-0.000 07 | 0.997 2 | 0.98 |
| DM | 7.59 | 0.98-62.5 | R=0.019 8C+0.068 9 | 0.997 3 | 0.98 |
| 31.25-2 000 | R=0.012 2C+0.545 8 | 0.999 1 | |||
| DX | 5.54 | 0.48-125 | R=0.014 4C+0.001 | 0.998 7 | 0.48 |
| MDZ | 7.91 | 1.95-125 | R=0.012 7C+0.003 1 | 0.999 2 | 1.95 |
| 31.25-2 000 | R=0.011 7C+0.221 9 | 0.999 7 | |||
| 1′OH-MDZ | 8.26 | 1.95-250 | R=0.000 8C+0.003 1 | 0.999 2 | 1.95 |
本实验条件下,CAF、PX、OPZ、5OH-OPZ、DM、DX、MDZ、1′OH-MDZ及内标DZP色谱峰形良好,血浆中内源性物质不干扰待测物及内标物的测定。如Fig 1、2所示,本方法具有较好的专属性。
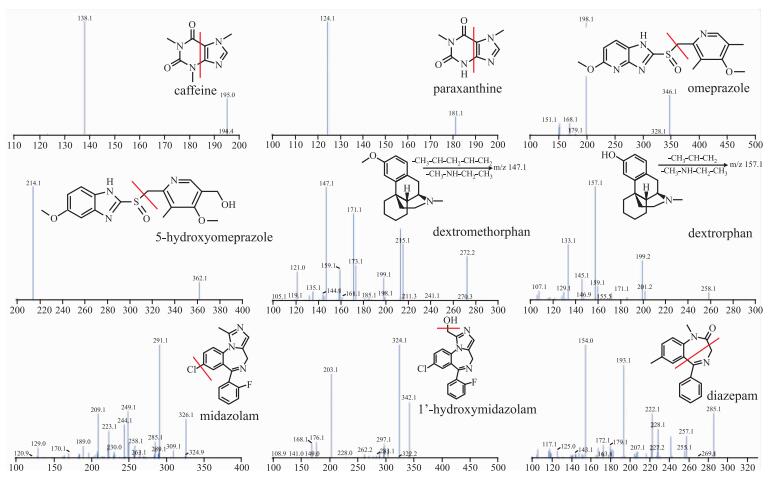
|
| Fig 1 MS2 chromatograms of probe drugs, metabolites and internal standard |
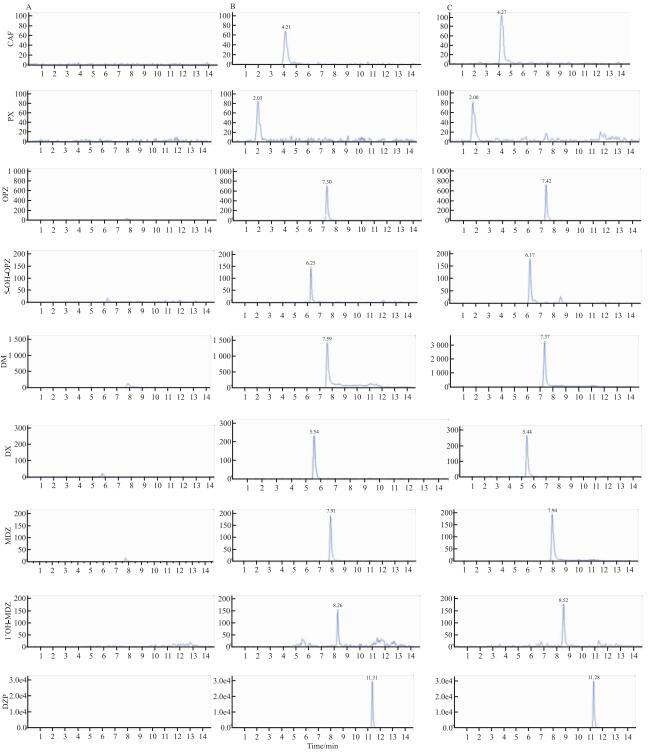
|
| Fig 2 XIC of CAF, PX, OPZ, 5OH-OPZ, DM, DX, MDZ, 1′OH-MDZ and DZP A:Blank plasma; B: Plasma sample spiked with probe drugs/mets and IS (CAF: 1.95 μg·L-1, PX: 0.98 μg·L-1, OPZ: 0.48 μg·L-1, 5OH-OPZ: 0.98 μg·L-1, DM: 0.98 μg·L-1, DX: 0.48 μg·L-1, MDZ: 1.95 μg·L-1, 1′OH-MDZ: 1.95 μg·L-1, DZP: 100 μg·L-1); C: Plasma obtained from rat after intravenous administration of probe drugs (CAF:0.05 h, PX:1.5 h, OPZ:0.05 h, 5OH-OPZ: 0.05 h, DM: 0.05 h, DX: 0.25 h, MDZ: 0.05 h, 1′OH-MDZ:0.25 h) |
100 μL空白血浆,精密加入不同量的标准品。使CAF终浓度为7.81、31.25、125、1 000 μg·L-1,PX终浓度为3.91、15.63、62.5 μg·L-1,OPZ终浓度为7.81、31.25、125、1 000 μg·L-1,5OH-OPZ终浓度为3.91、15.63、62.5 μg·L-1,DM终浓度为7.81、31.25、125、1 000 μg·L-1,DX终浓度为3.91、15.63、62.5 μg·L-1,MDZ终浓度为7.81、31.25、125、1 000 μg·L-1,1′OH-MDZ浓度为3.91、15.63、62.5 μg·L-1。按“2.2”项下处理样品,测定血浆中CAF、PX、OPZ、5OH-OPZ、DM、DX、MDZ、1′OH-MDZ的批内和批间差异及提取回收率(n=5)。测得CAF批内和批间RSD分别为(1.65%~9.97%和-2.50%~5.70%);PX (1.99%~4.18%和5.75%~9.15%);OPZ (4.09%~5.45%和6.65%~10.92%);5OH-OPZ (3.10%~4.59%和9.08%~13.20%);DM (2.89%~5.70%和4.78%~7.12%);DX (1.21%~6.43%和6.64%~10.03%);MDZ (2.23%~8.15%和2.92%~10.39%);1′OH-MDZ (2.44%~12.96%和5.10%~12.15%)。测得探针药物/代谢产物的提取回收率分别为:CAF (86.51±3.40)%/PX (81.60±6.67)%、OPZ (61.50±2.27)%/5OH-OPZ (49.98±5.66)%、DM (87.16±5.29)%/DX (89.19±3.09)%、MDZ (93.19±3.16)%/1′OH-MDZ (85.48±9.11)%。
2.8 稳定性100 μL空白血浆精密加入不同量的标准品,使CAF、PX、OPZ、5OH-OPZ、DM、DX、MDZ、1′OH-MDZ浓度同“2.7”。测得CAF在-80 ℃冰箱保存7 d和4 ℃放置24 h后,RSD分别为(2.68%~9.49%和-7.58%~12.94%);PX (3.41%~13.50%和2.23%~5.56%);OPZ (3.08%~6.13%和1.87%~6.76%);5OH-OPZ (4.36%~12.03%和3.24%~5.65%);DM (6.73%~15.27%和0.71%~4.58%);DX (3.21%~6.20%和2.43%~11.05%);MDZ (4.93%~13.16%和2.41%~5.65%);1′OH-MDZ (4.96%~12.43%和2.97%~10.88%)。上述实验结果表明血浆样品稳定性较好。
2.9 基质效应6只大鼠血浆和超纯水各100 μL,按照“2.2”项下处理样品,不加内标,挥干后加入标准工作液,挥干复溶,使CAF、PX、OPZ、5OH-OPZ、DM、DX、MDZ、1′OH-MDZ浓度同“2.7”。各基质每个浓度平行设置6个样品,分别记录峰面积为A1和A2。内标DZP (100 μg·L-1) 同时进行考察。测得结果A1/A2的值在85%~115%之间,表明上述探针药物/代谢产物基本无基质效应。
3 药代动力学研究大鼠股静脉给予混合探针药物,剂量为CAF 1 mg·kg-1、OPZ 5 mg·kg-1、DM 5 mg·kg-1、MDZ 1 mg·kg-1,于给药后0.05、0.12、0.25、0.5、1、2、4、6、8、10、12、16、24 h由眼内眦取血250 μL于肝素化试管中,离心取血浆,于-80 ℃冷冻保存。测定探针药物及代谢产物浓度,绘制药时曲线,结果如Fig 3所示。WinNonlin软件以非房室模型计算其主要的代谢动力学参数,结果见Tab 2。
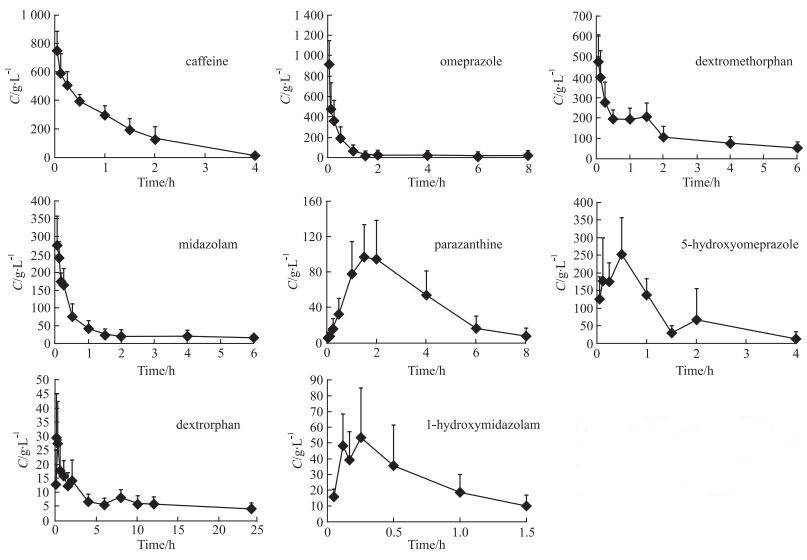
|
| Fig 3 Mean plasma concentration-time profiles of the CAF, OPZ, DM and MDZ after intravenous administration of probe drugs (n=5) |
| CYP1A2 | CYP2C19 | CYP2D6 | CYP3A4 | ||||||||
| CAF probe drug |
PX metabolite |
OPZ probe drug |
5OH-OPZ metabolite |
DM probe drug |
DX metabolite |
MDZ probe drug |
1′OH-MDZ metabolite |
||||
| Parameter | 1 mg·kg-1 | 5 mg·kg-1 | 5 mg·kg-1 | 1 mg·kg-1 | |||||||
| Ke/h-1 | 1.02±0.19 | 0.56±0.22 | 0.42±0.24 | 0.66±0.24 | 0.20±0.03 | 0.07±0.02 | 0.35±0.10 | 1.27±0.23 | |||
| T1/2/h-1 | 0.70±0.14 | 1.43±0.66 | 2.20±1.24 | 1.18±0.49 | 3.52±0.48 | 11.31±3.15 | 2.17±0.82 | 0.56±0.11 | |||
| AUC0-t/h·μg·L-1 | 814.3±207.5 | 376.8±109.0 | 573.6±356.3 | 351.0±170.1 | 809.6±252.0 | 177.4±38.6 | 242.6±68.9 | 46.53±22.09 | |||
| AUC0-∞/h·μg·L-1 | 835.8±221.2 | 400.3±124.4 | 678.1±524.9 | 379.9±205.4 | 1 234.2±646.72 | 254.3±73.3 | 303.6±75.6 | 55.02±25.13 | |||
| CL/mL·h-1·kg-1 | 1 276.8±383.7 | - | 9 816.4±4 165.6 | - | 4 747.8±1 736.4 | - | 3 476.1±935.7 | - | |||
| Vd/mL·h-1·kg-1 | 1 267.3±354.1 | - | 37 463.2±15 483.2 | - | 23 251.1±6 703.0 | - | 10 555.3±3 664.4 | - | |||
| MRT0-t/h | 0.98±0.18 | 2.79±0.62 | 1.57±1.06 | 1.03±0.29 | 2.03±0.46 | 9.24±1.21 | 1.80±0.36 | 0.60±0.03 | |||
| MRT0-∞/h | 1.08±0.25 | 3.18±1.08 | 2.60±2.14 | 1.34±0.50 | 4.74±1.77 | 18.35±5.75 | 3.30±0.56 | 0.88±0.13 | |||
CYP底物具有重叠性,且表达调控机制具有种属差异性。实验中选择适当的实验动物及特异性探针对实验结果可产生明显影响。为确保探针的特异性及灵敏性,选择时应考虑底物是否经单一CYP亚型代谢;代谢物是否进行连续代谢等因素[5-6]。本研究建立了同时测定大鼠血浆中4种探针药物及代谢产物的LC-MS/MS方法。目前,“Cocktail”探针药物法用于研究CYP450酶活性,探针药物的选择主要有以下几种,结果见Tab 3。基于探针药物组合在体内的安全性、对酶活性检测的灵敏度和特异性,本研究选择了CAF、OPZ、DM、MDZ作为CYP1A2、CYP2C19、CYP2D6和CYP3A4的探针药物。这种组合探针底物之间几乎不发生药物相互作用,且能准确反映酶活性。
| Enzyme subtype | CYP1A2 | CYP2C19 | CYP2D6 | CYP3A4 | Reference |
| Phenacetin | S-mephenytoin | Dextromethorphan | Midazolam | 7 | |
| Caffeine | Omeprazole | - | Midazolam | 8 | |
| Probe drug | Caffeine | S-mephenytoin | Metoprolol | Midazolam | 9 |
| Caffeine | Omeprazole | Dextromethorphan | Midazolam | 10 | |
| Theophylline | Omeprazole | Dextromethorphan | Midazolam | 11 |
CYP1A2选择CAF作为特异性探针药物,其代谢产物为PX。以往研究使用茶碱[11]作为测定CYP1A2活性的探针药物,但是由于茶碱类药物代谢差异大,有效血浓度安全范围窄,易发生中毒事件,在临床使用中要监测其血药浓度[12],不适合作为探针药物测定代谢酶活性。非那西丁主要用于体外实验,但是也有文献证明其在体内研究中也可反映CYP1A2活性[13]。OPZ是评价人和大鼠CYP2C19活性的常用探针药物。OPZ经CYP450催化代谢,主要的代谢途径由CYP2C19介导,代谢产物为5OH-OPZ[14],OPZ已经成为CYP2C19的特异性探针,经与S-美芬妥英比较得到一致的实验结果[15]。S-美芬妥英是最经典的CYP2C19的探针药物,但由于其存在潜在的毒性、催眠和镇静作用,限制了其在体内测定代谢酶活性研究中的应用。CYP2D6在肝脏中约占CYP酶量的1%~2%,却代谢30%的处方药,DM是其代谢的特异性探针药物,O-去甲基作用由CYP2D6特异性催化[16]。而美托洛尔在口服使用中,存在巨大的个体差异,70%的代谢由CYP2D6介导[17],故本实验未采用其作为CYP2D6的探针底物。MDZ是咪唑苯并二氮类药物,在体内主要经CYP3A4/5(人体) 或CYP3A1/2(大鼠) 代谢转化成1′OH-MDZ[18],由于其代谢的特异性可以较为准确地反映CYP3A4的活性,因此MDZ是CYP3A4的推荐探针药物。
4.2 前处理方法本实验采用液液萃取的方式一次提取出全部的探针药物和代谢产物,成本低、操作简单。在预实验中,比较乙醚和乙酸乙酯的液液萃取、甲醇和乙腈蛋白沉淀的方法,发现乙酸乙酯的提取率最高。其次,由于探针药物和代谢产物的化合物性质不同,在血浆样品中加入了乙酸铵、无水碳酸钠、磷酸二氢钠、纯水处理,经比较后发现,加入碳酸钠后,OPZ的回收率高,但DM的回收率不稳定;提取中加入乙酸铵,OPZ和5OH-OPZ的回收率在40%~60%之间且比较稳定,不影响其定量测定,其他的探针药物及代谢产物提取回收率稳定且大于70%。全部的提取过程中,每个样品只需要100 μL血浆,采血量少,能使大鼠保持较好的生理状态,从而真实地反映探针药物及代谢产物在大鼠体内的药动学过程。
4.3 色谱质谱条件优化质谱条件下选择MRM+进行质谱扫描,确定CAF/PX、OPZ/5OH-OPZ、DM/DX、MDZ/1′OH-MDZ在正离子模式响应更好。在流动相选择方面,乙腈的洗脱强度大于甲醇,在流动相中加入0.01%甲酸和1 mmol·L-1甲酸铵,能提高各离子对的质谱响应值。采用梯度洗脱,有利于待测药物以较好的峰形在较短时间内出峰,缩短分析时间至12 min内。液液萃取后的样品在复溶过程中,加入1 mmol·L-1碳酸钠可以提高OPZ、5OH-OPZ、MDZ、1′OH-MDZ的质谱响应值。
4.4 体内研究目前肝药酶研究中,主要是基于“Cocktail”探针药物法,通过体外微粒体温孵的方法评价P450酶的活性[19]。通过体外的研究可以直接观察酶对底物的选择性及底物对酶的抑制和诱导,简单快速,但是体内代谢环境复杂,体外实验不能完全真实反映代谢酶在体内的变化,所以应综合考虑药物对代谢酶活性影响的体内和体外实验结果。在研究肝药酶活性的体内实验中,主要集中在通过测定探针药物原型的药代参数,反映肝药酶的活性[20-21]。由于单一探针药物的局限性,不能较系统全面地反映肝药酶活性。“Cocktail”探针药物法可同时使用多种探针药物,研究多个代谢途径,使多种同工酶的表型信息被同时检测出来,真实地反映药物的代谢途径[22]。这种方法能在同一只动物上得到多个数据,减小个体间差异对数据波动的影响,是药物研发早期高通量筛选、药物代谢机制研究以及上市药物再评价等的有效手段[23]。所以选择探针药物和代谢产物同时测定的方法,才能更加准确反映肝药酶活性,得到有效、系统的实验数据。
在动物的给药剂量方面,与以往文献报道探针药物给药剂量比较,高剂量CAF能引起CYP1A2 mRNA表达增加,诱导其活性[24];高剂量MDZ具有镇静催眠作用,并可能影响酶的活性及改变动物的生理状态,从而掩盖化合物对CYP3A的抑制作用[25],同时混合探针药物采用静脉给药方式,可避免MDZ被肠CYP3A代谢所引起的实验误差。基于上述原因,我们选择了比以往研究报道更低的给药剂量,可以使探针药物对大鼠生理状况的影响降至更低水平,有利于得到更为准确的肝药酶代谢活性数据。
本研究建立的LC-MS/MS检测方法,运用多反应正离子监测模式同时检测探针药物的母离子和子离子碎片信息可有效排除干扰,提高检测的准确性。该检测方法具有较好的灵敏度、准确度和稳定性,适用于药物对肝药酶CYP1A2、CYP2C19、CYP2D6和CYP3A4代谢活性影响的深入研究。
| [1] | Wang H, Tompkins L M. CYP2B6: new insights into a historically overlooked cytochrome P450 isozyme[J]. Curr Drug Metab, 2008, 9 (7): 598-610. doi:10.2174/138920008785821710 |
| [2] | Food and Drug Administration. Drug interaction studies-study design, data analysis, and recommendations for dosing and labeling[S].Rockville, MD: FDA, 2006. |
| [3] | Lee B, Ji H K, Lee T, et al. Simultaneous screening of activities of five cytochrome P450 and four uridine 5′-diphospho-glucuronosyltransferase enzymes in human liver microsomes using cocktail incubation and liquid chromatography-tandem mass spectrometry[J]. Drug Metab Dispos, 2015, 43 (7): 1137-46. doi:10.1124/dmd.114.063016 |
| [4] | Spaggiari D, Geiser L, Daali Y, et al. A cocktail approach for assessing the in vitro activity of human cytochrome P450s: an overview of current methodologies[J]. J Pharm Biomed Anal, 2014, 101 : 221-37. doi:10.1016/j.jpba.2014.03.018 |
| [5] | 张晓璐, 乐江. 细胞色素P450的工具药选择及种属差异的研究进展[J]. 中国药理学与毒理学杂志, 2012, 26 (5): 697-701. Zhang X L, Yue J. Progress in selection of tool drugs and species differences of cytochrome P450[J]. Chin J Pharmacol Toxicol, 2012, 26 (5): 697-701. |
| [6] | 王菊, 陆兔林, 毛春芹, 等. Cocktail探针药物法评价生、醋莪术对CYP450酶亚型的影响[J]. 中国药理学通报, 2012, 28 (11): 1562-5. Wang J, Lu T L, Mao C Q, et al. Application of probe drugs for detecting influences of Rhizoma Curcumae and processed Rhizoma Curcumae on cytochrome P450 isoforms[J]. Chin Pharmacol Bull, 2012, 28 (11): 1562-5. |
| [7] | Or P M, Lam F F, Kwan Y W, et al. Effects of Radix Astragali and Radix Rehmanniae, the components of ananti-diabetic foot ulcer herbal formula, on metabolism of model CYP1A2, CYP2C9, CYP2D6, CYP2E1 and CYP3A4 probe substrates in pooled human liver microsomes and specific CYP isoforms[J]. Phytomedicine, 2012, 19 (6): 535-44. doi:10.1016/j.phymed.2011.12.005 |
| [8] | Zhang Y T, Zhang D F, Ge N Y, et al. Effect of evodiamine on CYP enzymes in rats by a cocktail method[J]. Pharmacology, 2016, 97 (5-6): 218-23. doi:10.1159/000443178 |
| [9] | Oh K S, Park S J, Shinde D D, et al. High-sensitivity liquid chromatography-tandem mass spectrometry for the simultaneous determination of five drugs and their cytochrome P450-specific probe metabolites in human plasma[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2012, 895-896 : 56-64. doi:10.1016/j.jchromb.2012.03.014 |
| [10] | Wohlfarth A, Naue J, Lutz-Bonengel S, et al. Cocktail approach for in vivo phenotyping of 5 major CYP450 isoenzymes: development of an effective sampling, extraction, and analytical procedure and pilot study with comparative genotyping[J]. J Clin Pharmacol, 2012, 52 (8): 1200-14. doi:10.1177/0091270011410570 |
| [11] | Otten J N, Hingorani G P, Hartley D P, et al. An in vitro, high throughput seven CYP cocktail inhibition assay for the evaluation of new chemical entities using LC-MS/MS[J]. Drug Metab Lett, 2011, 5 (1): 17-24. doi:10.2174/187231211794455235 |
| [12] | 张峻, 姚勤, 周琼, 吴晖. RP-HPLC法同时测定人血浆中茶碱和多索茶碱的浓度[J]. 中国药房, 2010, 21 (42): 3974-5. Zhang J, Yao Q, Zhou Q, Wu H. Simultaneous determination of the concentration of theophylline and doxofylline human plasma by RP-HPLC[J]. J China Pharm, 2010, 21 (42): 3974-5. |
| [13] | Gao N, Qi B, Liu F J, et al. Inhibition of baicalin on metabolism of phenacetin, a probe of CYP1A2, in human liver microsomes and in rats[J]. PLoS One, 2014, 9 (2): e89752. doi:10.1371/journal.pone.0089752 |
| [14] | 景欣悦, 彭蕴茹, 王新敏, 段金廒. 体内、体外相结合测定及评价CYP2C19酶活性研究的方法建立[J]. 中国实验方剂学杂志, 2012, 18 (16): 148-53. Jing X Y, Peng Y R, Wang X M, Duan J O. In vivo and in vitro research method for determination and evaluation of CYP2C19 activity[J]. Chin J Exp Tradit Med Form, 2012, 18 (16): 148-53. |
| [15] | Chang M, Dahl M L, Tybring G, et al. Use of omeprazole as a probe drug for CYP2C19 phenotype in Swedish Caucasians: comparison with S-mephenytoin hydroxylation phenotype and CYP2C19 genotype[J]. Pharmacogenetics, 1995, 5 (6): 358-63. doi:10.1097/00008571-199512000-00004 |
| [16] | Chen R, Rostami-Hodjegan A, Wang H, et al. Application of a physiologically based pharmacokinetic model for the evaluation of single-point plasma phenotyping method of CYP2D6[J]. Eur J Pharm Sci, 2016, 92 : 131-6. doi:10.1016/j.ejps.2016.07.001 |
| [17] | Johnson J A, Burlew B S. Metoprolol metabolism via cytochrome P450 2D6 in ethnic populations[J]. Drug Metab Dispos, 1996, 24 (3): 350-5. |
| [18] | Mao J, Mohutsky M A, Harrelson J P, et al. Prediction of CYP3A-mediated drug-drug interactions using human hepatocytes suspended in human plasma[J]. Drug Metab Dispos, 2011, 39 (4): 591-602. doi:10.1124/dmd.110.036400 |
| [19] | Misaka S, Kawabe K, Onoue S, et al. Effect of green tea on cytochrome P450 2B6, 2C8, 2C19, 2D6 and 3A activities in human liver and intestinal microsomes[J]. Durg Metab Pharmacokinet, 2013, 28 (3): 244-9. doi:10.2133/dmpk.DMPK-12-RG-101 |
| [20] | Xia C H, Sun J G, Wang G J, et al. Herb-drug interactions: in vivo and in vitro effect of Shenmai injection, a herbal preparation, on the metabolic activities of hepatic cytochrome P450 3A1/2, 2C6, 1A2, and 2E1 in rats[J]. Planta Med, 2010, 76 (3): 245-50. doi:10.1055/s-0029-1186082 |
| [21] | 龚文奇, 梁晓光, 李芹, 等. Cocktail探针药物法评价灯盏花素对大鼠CYP450体内代谢活性的影响[J]. 中国临床药理学杂志, 2012, 28 (6): 440-3. Gong W Q, Liang X G, Li Q, et al. Influence of breviscapinum on CYP450 isoforms by cocktail probe drugs method[J]. Chin J Clin Pharmacol, 2012, 28 (6): 440-3. |
| [22] | 孙冰婷, 居文政, 谈恒山. Cocktail法研究CYP450酶活性影响因素的探讨[J]. 中国医院药学杂志, 2015, 35 (6): 558-62. Sun B T, Ju W Z, Tan H S. Investigation on factors influencing activity of CYP450 enzymes by Cocktail method[J]. Chin Hosp Pharm J, 2015, 35 (6): 558-62. |
| [23] | 何雪辉, 杨志宏, 孙晓波. 微透析与LC-MSn联用测定脑组织中咪达唑仑/1′-羟基咪达唑仑及其脑内药代特征的研究[J]. 中国药理学通报, 2014, 30 (4): 578-82. He X H, Yang Z H, Sun X B. Quantification of midazolam/1′-hydroxymidazolam and their pharmacokinetic characteristics in rat brain by microdialysis combined with LC-MSn[J]. Chin Pharmacol Bull, 2014, 30 (4): 578-82. |
| [24] | Goasduff T, Dréano Y, Guillois B, et al. Induction of liver and kidney CYP1/1A2 by caffeine in rat[J]. Biochem Pharmacol, 1996, 52 (12): 1915-9. doi:10.1016/S0006-2952(96)00522-9 |
| [25] | 覃小玲, 段文海, 薛新平, 等. CYP3A探针底物咪达唑仑在大鼠体内的非线性药动学过程及剂量优化[J]. 药学学报, 2016, 51 (5): 834-8. Qin X L, Duan W H, Xue X P, et al. Optimization of midazolam dosage and pharmacokinetics of CYP3A probe substrate in rats[J]. Acta Pharm Sin, 2016, 51 (5): 834-8. |

