


2. 南华大学生物技术系,湖南 衡阳 421001;
3. 常德市职业技术学院医学系,湖南 常德 415000
 ,
MA Yan-ni2
,
MA Yan-ni2 ,
ZHANG Cai-ping2,
LIU Ying3,
ZHANG Min2,
YU Xin-xin2,
DUAN Li-ren2,
LONG Shi-yin2
,
ZHANG Cai-ping2,
LIU Ying3,
ZHANG Min2,
YU Xin-xin2,
DUAN Li-ren2,
LONG Shi-yin2
 ,
TIAN Ying2
,
TIAN Ying2

2. Dept of Biotechnology, University of South China, Hengyang Hunan 421001, China;
3. Dept of Medicine, Changde Vocational Technical College, Changde Hunan 415000, China
烟酸(niacin) 又称维生素B3或尼克酸,具有重要的生理作用,然而,让它备受关注的是其调脂作用[1]。早在20世纪60年代,烟酸就作为调脂药物开始应用于临床[2]。研究表明[2-3],烟酸通过影响Apo AI、CETP、ABCA1的表达,进而调节HDL-C水平。在药理剂量下,烟酸是最有效的升高血浆HDL含量的调脂药物,同时能降低血浆低密度脂蛋白(low density lipoprotein cholesterol, LDL)、脂蛋白a (lipoprotein a, Lip a) 以及甘油三酯(triglycerides, TG) 等的含量,具有预防和治疗心血管疾病的作用[4-5]。作为既能升高HDL,又能降低LDL的调脂药物,烟酸升高HDL的作用已被广泛认可,但是其降低LDL的作用及机制却有待完善。
血浆高LDL-C水平是心血管疾病(cardiovascular disease, CVD) 的危险因素之一[6]。超过70%的血浆LDL-C通过LDLR途径经肝细胞代谢[7]。而LDLR的表达同时受到固醇调节元件结合蛋白2(sterol regulatory element binding proteins 2, SREBP2) 等因子的转录水平调节[8],又受到前蛋白转化酶枯草杆菌蛋白酶9型(proprotein convertase subtilisin/kexin type 9, PCSK9) 等因子的转录后调节[9]。SREBP2是存在于内质网上的固醇敏感器,当细胞内胆固醇水平处于失平衡状态时,它能相应调节下游靶基因LDLR及PCSK9等因子的表达[10-11]。PCSK9蛋白成熟体则能与LDLR的EGF-A区域结合,并诱导LDLR进入溶酶体降解[12]。为证实烟酸是否通过调节SREBP2和PCSK9的表达而降低LDL-C水平,本研究运用烟酸作用HepG2细胞,检测调控LDLR的相关因子的表达变化,试图寻找烟酸的新的降血浆LDL-C的机制。
1 材料与方法 1.1 细胞与试剂人肝癌细胞系HepG2购自中国科学院细胞生物学研究所上海细胞库。烟酸购自Biosharp公司;人源性LDL购自广州弈源公司;人源性缺脂蛋白血清(human lipoprotein-deficient serum, LPDS) 购自美国Biomedical Technologies Inc.公司;油红O和DMSO购自Amresco公司;苏木精购自博士德生物公司;组织总胆固醇/游离胆固醇酶法测定试剂盒(E1015/E1016) 购自北京普利莱基因技术公司;25-羟胆固醇(25-HC) 购自美国Sigma公司;总RNA提取试剂盒(TRIzon Reagent) 购自康为世纪生物科技有限公司;Donkey anti-rabbit IgG (Alexa Fluor 647)、兔抗人LDLR和PCSK9抗体购自美国Abcam公司;兔抗人β-actin购自美国CST公司;山羊抗人的SREBP2抗体购自美国R&D公司;辣根过氧化物酶标记的二抗:山羊抗兔和兔抗山羊均购自上海优维宁生物科技公司。其余试剂均为国产分析纯。
1.2 药物配制烟酸工作液:DMSO配制成400 mmol·L-1的母液,胎牛血清稀释,0.22 μm滤器过滤分装,-20℃避光保存。
1.3 实验分组油红O染色以及胆固醇含量测定实验分组为:① Basal; ② Control; ③ Niacin 300 μmol·L-1; ④ Vehicle 0.075% DMSO);其中②~④组加入25 mg·L-1 LDL。
在溶媒对实验无影响的情况下,调整分组为:① Basal; ② Control; ③ LPDS (10%); ④ 25-HC (10 mg·L-1); ⑤ Niacin 300 μmol· L-1;其中②~⑤组加入25 mg·L-1 LDL。
1.4 油红O实验细胞培养至对数生长期,1×105个细胞/孔接种至预先放置好无菌盖玻片的6孔板内,培养24 h,药物孵育24 h。多聚甲醛固定30 min,油红O染色约7 min,苏木精染色约4 s,甘油封片,观察并拍照。
1.5 酶法测定胆固醇含量细胞培养至对数生长期,1×105个细胞/孔接种至6孔板培养24 h,药物孵育24 h。收集细胞裂解液,离心,取上清。按照总胆固醇含量酶法测定试剂盒(E1015/E1016) 的说明书操作,37℃水浴20 min后,酶标仪测定A570胆固醇含量。BCA试剂盒测定的细胞内总蛋白含量用以标化各样本的胆固醇值,标化后的胆固醇浓度单位为总胆固醇(游离胆固醇)/蛋白=μmol·g-1。
1.6 细胞表面LDLR含量流式检测对数期生长的HepG2以1×105个细胞/孔接种至6孔板内培养24 h,药物孵育24 h。收集细胞,PBS洗涤,0.50% BSA封闭,抗体孵育及洗涤。FL3 emission filter流式细胞仪检测,Cell Quest Pro software (BD Biosciences) 分析对比各组与Control的平均荧光强度。
1.7 mRNA含量检测对数期生长HepG2细胞以1×106个细胞/孔接种至50 mL培养瓶,培养24 h,药物孵育24 h。根据TRIzon Reagent说明书提取总RNA。紫外分光光度仪测定OD260/OD280比值介于1.9~2.1;琼脂糖凝胶电泳分析RNA完整性,28S rRNA、18S rRNA条带清晰可见,提取的总RNA可用于后续实验。
根据逆转录试剂盒说明书操作,取2 μg总RNA逆转录合成cDNA,PCR扩增条件为:42℃、30 min,85℃、10 min;再取2 μg逆转录产物进行qPCR,反应体系为20 μL。引物由上海诺伦生物医药技术有限公司设计与合成(Tab 1)。qPCR扩增条件为:95℃预变性3 min;95℃变性12 s,62℃延伸40 s,40个循环。用ΔΔCT来计算基因的表达水平,计算公式如下:ΔCT=目的基因CT值-β-actin基因CT值;ΔΔCT=实验组ΔCT-对照组ΔCT;实验组/对照组基因表达水平的倍数=2-ΔΔCT。
| Gene | Primer sequence | Size/bp |
| β-actin | F:5′-CCCTGGCACCCAGCAC-3′ | 70 |
| R:5′-GCCGATCCACACGGAGTAC-3′ | ||
| LDLR | F:5′-GACTGGTCAGATGAACCCATCAAAG-3′ | 79 |
| R:5′-AGGTCATTGCAGACGTGGGAAC-3′ | ||
| SREBP-2 | F:5′-CAGCAGCCTTTGATATACCAGAATG-3′ | 86 |
| R:5′-AGGATGTCACCAGGCTTTGGAC-3′ | ||
| PCSK9 | F:5′-CCAGTTTCTCCAGGAGTGGGAAG-3′ | 112 |
| R:5′-GCAATGGCGTAGACACCCTCAC-3′ |
对数期生长HepG2细胞以1×106个细胞/孔接种至50 mL培养瓶,培养24 h,药物孵育24 h。收集细胞裂解液,离心,取上清,取5 μL蛋白液进行BCA蛋白定量。剩余蛋白液加入SDS-loading buffer,100℃条件下煮沸10 min,于-20℃保存,用于Western blot实验。Tanon ECL高敏成像系统对结果进行检测。各组细胞目的蛋白与内参β-actin的光密度比值,分别代表各目的蛋白表达水平。
1.9 统计学分析数据均采用SPSS 20、Image J及GraphPad Prism 5.0等软件进行统计学分析和图标绘制,数值以x±s表示,两组间的比较用t检验及方差分析。
2 结果 2.1 油红O染色观察烟酸对HepG2细胞内脂质蓄积的影响油红O染色观察,HepG2细胞中脂滴颗粒被染成橘红色,核呈蓝色。结果显示:与Basal组相比,Control组细胞内脂滴增多,提示本实验荷脂成功;与Control相比,Vehicle组细胞内红染脂滴无明显变化,提示溶媒对实验无影响。Niacin组油红O阳性细胞数及细胞内红染脂滴明显增加,见Fig 1。
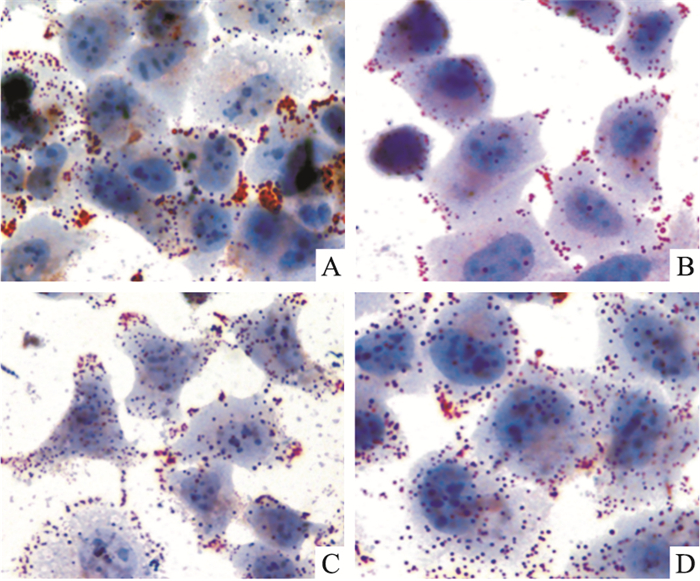
|
| Fig 1 Oil red O staining of HepG2 cells treatedwith niacin co-incubated with LDL (×40) A:Niacin; B:Basal; C:Control; D:Vehicle |
为了进一步定量分析细胞内胆固醇含量,酶法测定结果显示:与Basal组相比,Control细胞内TC、FC水平增高,提示本研究细胞荷脂造模成功;与Control相比,Vehicle组细胞内TC水平有增高的趋势,FC水平有所下降,但差异无统计学意义(P > 0.05),提示溶媒对细胞摄取胆固醇无影响;Niacin组细胞内TC、FC水平明显增高(P < 0.01)。提示烟酸促使HepG2细胞摄取胆固醇,见Fig 2。
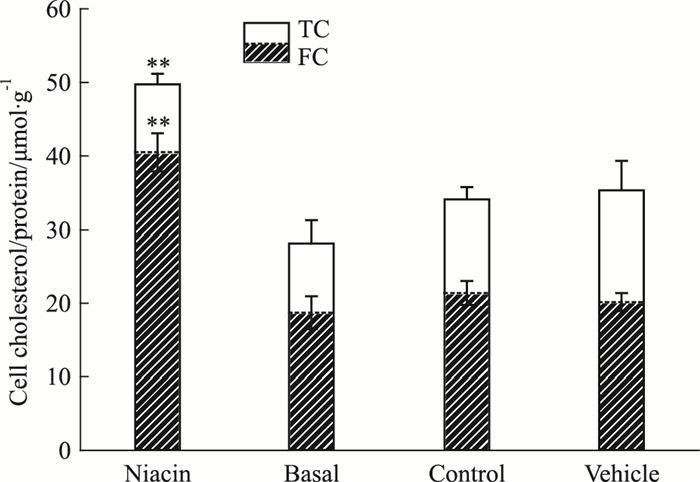
|
| Fig 2 Effect of niacin on totalcholesterol and free cholesterol in HepG2 cells **P < 0.01 vs control |
本研究推测细胞内胆固醇含量增加可能是烟酸通过上调LDLR的表达,进而促进HepG2细胞对LDL-C的摄取。接下来运用流式细胞术、qPCR及Western blot检测LDLR的表达。结果显示,与对照组相比,烟酸处理的HepG2细胞中,LDLR mRNA含量升高,但差异无统计学意义(P > 0.05);细胞膜表面LDLR分布丰度及细胞内LDLR蛋白含量却明显增加(P < 0.05),见Fig 3。
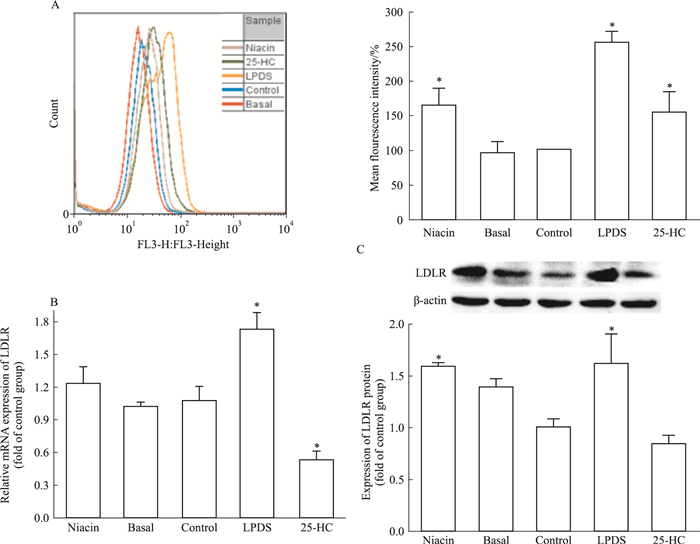
|
| Fig 3 Effect of niacin on expression of LDLR in HepG2 cells A:Cell surface LDLR was determined by FACS analysis. The relative expression of LDLR mRNA (B) and protein (C).*P < 0.05 vs control |
LDLR的表达主要在转录水平受到SREBP2的调节,为了探究烟酸是否影响SREBP2,进而调控LDLR的表达,本研究检测了烟酸对SREBP2表达的影响。结果显示,烟酸处理组细胞内SREBP2的mRNA和蛋白表达都无明显改变。提示烟酸升高LDLR含量并不是通过SREBP2的转录水平调节,见Fig 4。
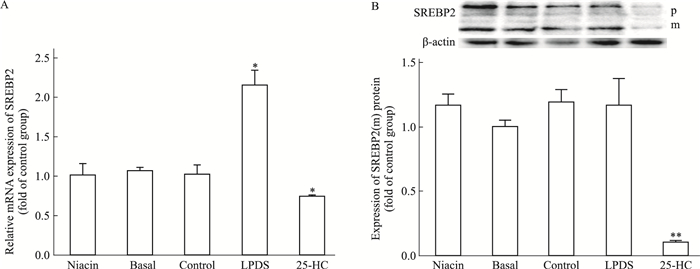
|
| Fig 4 Effect of niacin on expression of SREBP2 in HepG2 cells The relative expression of SREBP2 mRNA (A) and protein (B). SREBP2 precursor (p) and mature form (m).*P < 0.05, **P < 0.01 vs control |
PCSK9是LDLR转录后水平的主要调控者。在生理条件下,PCSK9前体(PCSK9 precursor, pPCSK9) 经过加工剪切形成成熟体(mature PCSK9, mPCSK9),而mPCSK9则可以在翻译后水平调节LDLR的表达。为了探究在烟酸的作用下,LDLR是否受到PCSK9的转录后调节,本研究检测了烟酸对PCSK9表达的影响,并检测了mPCSK9的相对含量。结果显示,烟酸明显减少了PCSK9的mRNA和成熟体蛋白含量(P < 0.05)。提示烟酸可能通过下调PCSK9的表达,减少PCSK9成熟体蛋白含量,使得LDLR降解减少,进而增加LDLR含量,促进HepG2细胞摄取LDL-C。见Fig 5。
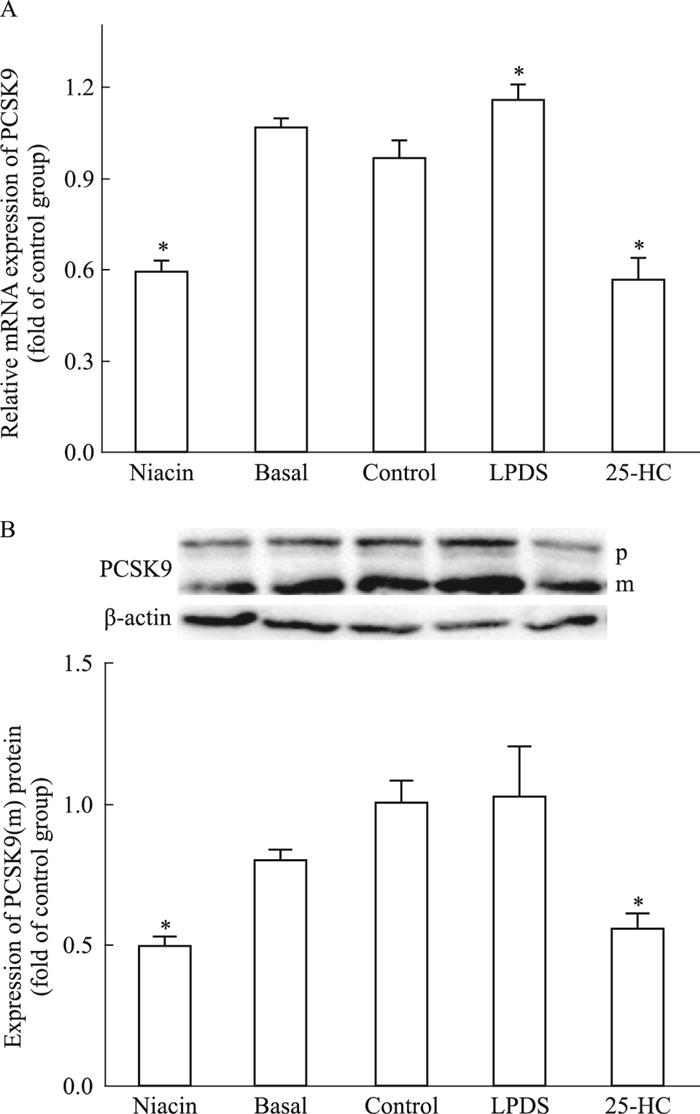
|
| Fig 5 Effect of niacin on expression of PCSK9 in HepG2 cells The relative expression of PCSK9 mRNA (A) and protein (B). PCSK9 precursor (p) and mature form (m).*P < 0.05 vs control |
在世界各地,心血管疾病的发病率逐渐升高,严重威胁着人类的健康。据世界卫生组织预测,到2020年,心血管疾病死亡率将占据我国非传染性死亡率的首位[13]。LDL-C升高是心血管疾病发生的独立危险因素[14],因此,有效地降低血浆LDL-C对预防和治疗心血管疾病至关重要。
烟酸作为目前临床上常用的一种降脂药物[15-16],在药理剂量下,单独使用烟酸可以增加血浆HDL-C水平,并且明显降低血浆中LDL-C、VLDL及LDL水平[17-18];烟酸联合其他降脂药物(如他汀类、贝特类、胆酸螯合剂类药物),可以使HDL-C水平升高,LDL及TG水平明显下降[19]。烟酸升高血浆HDL的作用已被认可,但降低LDL-C的作用却有待完善。
为找寻烟酸降低血浆LDL-C的分子靶点,本实验以HepG2细胞为研究对象,LDL孵育细胞,模拟高脂环境,烟酸药物处理。油红O染色观察细胞内脂滴蓄积,并用酶法定量检测胆固醇含量,充分考虑溶媒对细胞的影响。在溶媒对实验无影响的前提下,合理地设计了LPDS的阳性对照[20]及25-羟胆固醇(25-HC) 的阴性对照[21]。
本研究发现,在模拟的高脂环境下,烟酸能上调HepG2细胞LDLR蛋白的表达,进而促进细胞摄取及代谢LDL。检测LDLR表达的主要调节因子发现,SREBP2的表达并没有受到影响,这也意味着,烟酸并没有在转录水平上影响LDLR的表达。qPCR结果亦证实烟酸处理组LDLR的mRNA表达水平无明显升高。检测LDLR转录后调节因子的表达发现,烟酸处理组细胞中的PCSK9成熟体蛋白含量明显减少。提示烟酸可能通过下调PCSK9的表达,阻碍PCSK9蛋白成熟过程,进而减少PCSK9的成熟体蛋白含量,使得LDLR降解减少。这一点与前面的结果相一致:烟酸影响LDLR的蛋白水平,却对其mRNA含量无影响。本研究只是做了初步探讨,要进一步确定PCSK9是烟酸降低LDL-C的分子靶点,还有大量的研究工作要做。
( 致谢: 感谢给予本文实验提供研究场所的生物技术系的分子生物学实验室、蛋白化学实验室、细胞培养室、技能实验室及生物信息室的所有老师及同学,感谢本校省部级重点心血管病研究所、肿瘤研究所、病原微生物研究所对本实验无偿提供流式细胞仪、激光共聚焦显微镜等服务。 )
| [1] | Julius U. Niacin as antidyslipidemic drug[J]. Can J Physiol Pharmacol, 2015, 93 (12): 1043-54. doi:10.1139/cjpp-2014-0478 |
| [2] | Kramer W. Antilipidemic drug therapy today and in the future[J]. Handb Exp Pharmacol, 2016, 233 : 373-435. |
| [3] | Hu M, Tomlinson B. Niacin for reduction of cardiovascular risk[J]. N Engl J Med, 2014, 371 (20): 1941-2. |
| [4] | Ronsein G E, Hutchins P M, Isquith D, et al. Niacin therapy increases high-density lipoprotein particles and total cholesterol efflux capacity but not ABCA1-specific cholesterol efflux in statin-treated subjects[J]. Arterioscler Thromb Vasc Biol, 2016, 36 (2): 404-11. doi:10.1161/ATVBAHA.115.306268 |
| [5] | 魏江涛, 陈聪, 方正旭, 等. 烟酸对高密度脂蛋白亚型及动脉粥样硬化的影响[J]. 江西医药, 2011, 46 (3): 236-7. Wei J T, Chen C, Fang Z X. Effect of nicotinic acid on high density lipoprotein and atherosclerosis[J]. Jiangxi Med J, 2011, 46 (3): 236-7. |
| [6] | Goldstein J L, Brown M S. Binding and degradation of low density lipoproteins by cultured human fibroblasts.Comparison of cells from a normal subject and from a patient with homozygous familial hypercholesterolemia[J]. J Biol Chem, 1974, 249 (16): 5153-62. |
| [7] | Keys A, Taylor H L, Blackburn H, et al. Mortality and coronary heart disease among men studied for 23 years[J]. Arch Intern Med, 1971, 128 (2): 201-14. doi:10.1001/archinte.1971.00310200037002 |
| [8] | 欧露, 张彩平, 刘英. PCSK9及IDOL在姜黄素促进HepG2细胞摄取LDL-C中的作用[J]. 中国药理学通报, 2015, 31 (9): 1286-91. Ou L, Zhang C P, Liu Y, et al. Role of PCSK9 and IDOL in curcumin accelerating LDL-C uptake in HepG2 cells[J]. Chin Pharmacol Bull, 2015, 31 (9): 1286-91. |
| [9] | Gupta S. LDL cholesterol, statins and PCSK9 inhibitors[J]. Indian Heart J, 2015, 67 (5): 419-24. doi:10.1016/j.ihj.2015.05.020 |
| [10] | Dong B, Singh A B, Fung C, et al. CETP inhibitors downregulate hepatic LDL receptor and PCSK9 expression in vitro and in vivo through a SREBP2 dependent mechanism[J]. Atherosclerosis, 2014, 235 (2): 449-62. doi:10.1016/j.atherosclerosis.2014.05.931 |
| [11] | Xie W, Liu J, Wang W, et al. Association between plasma PCSK9 levels and 10-year progression of carotid atherosclerosis beyond LDL-C:a cohort study[J]. Int J Cardiol, 2016, 215 : 293-8. doi:10.1016/j.ijcard.2016.04.103 |
| [12] | Tveten K, Strøm T B, Berge K E, et al. PCSK9-mediated degradation of the LDL receptor generates a 17 kDa C-terminal LDL receptor fragment[J]. J Lipid Res, 2013, 54 (6): 1560-6. doi:10.1194/jlr.M034371 |
| [13] | 张立新. WHO专家预测:发展中国家面临心血管病大流行[J]. 中国卫生, 2000 (2): 7. Zhang L X. WHO experts predict: developing countries facing a pandemic of cardiovascular disease[J]. China Health, 2000 (2): 7. |
| [14] | 畅学艳. 心血管疾病的危险因素[J]. 实用医技杂志, 2006, 13 (23): 4264-5. Chang X Y. Risk factors for cardiovascular disease[J]. J Pract Med Tech, 2006, 13 (23): 4264-5. |
| [15] | Kalil R S, Wang J H, de Boer I H, et al. Effect of extended-release niacin on cardiovascular events and kidney function in chronic kidney disease: a post hoc analysis of the AIM-HIGH trial[J]. Kidney Int, 2015, 87 (6): 1250-7. doi:10.1038/ki.2014.383 |
| [16] | la Paz S M, Bermudez B, Naranjo M C, et al. Pharmacological effects of niacin on acute hyperlipemia[J]. Curr Med Chem, 2016, 23 (25): 2826-35. doi:10.2174/0929867323666160411142909 |
| [17] | 于瑞杰, 洪骏, 汪俊军. 烟酸抗动脉粥样硬化研究进展[J]. 临床检验杂志, 2014, 32 (5): 337-9. Yu R J, Hong J, Wang J J. Advances in research on antiatherosclerosis of nicotinic acid[J]. Chin J Clin Lab Sci, 2014, 32 (5): 337-9. |
| [18] | Boden W E, Sidhu M S, Toth P P. The therapeutic role of niacin in dyslipidemia management[J]. J Cardiovasc Pharmaco Ther, 2014, 19 (2): 141-58. doi:10.1177/1074248413514481 |
| [19] | El Khoury P, Waldmann E, Huby T, et al. Extended-release niacin/laropiprant improves overall efficacy of postprandial reverse cholesterol transport[J]. Arterioscler Thromb Vasc Biol, 2016, 36 (2): 285-94. doi:10.1161/ATVBAHA.115.306834 |
| [20] | Ward L C, Shankar R, Sallis J D. A possible antiatherogenic role for phosphocitrate through modulation of low density lipoprotein uptake and degradation in aortic smooth muscle cells[J]. Atherosclerosis, 1987, 65 (1-2): 117-24. doi:10.1016/0021-9150(87)90013-X |
| [21] | 杨大春, 曾智. 氧化甾醇与动脉粥样硬化研究进展[J]. 临床与病理杂志, 2002, 22 (2): 188-90. Yang D C, Zeng Z. Progress in research of oxidation of cholesterol and atherosclerosis[J]. J Clin Pathol Res,, 2002, 22 (2): 188-90. |