


 ,
LI Jing-xian,
TANG Biao,
LIU Xiao-dan,
LI Ling,
TANG Ying-hong,
DENG Chang-qing
,
LI Jing-xian,
TANG Biao,
LIU Xiao-dan,
LI Ling,
TANG Ying-hong,
DENG Chang-qing
 ,
HUANG Xiao-ping
,
HUANG Xiao-ping

细胞自噬(autophagy) 是细胞受到刺激后,通过溶酶体途径降解细胞内物质,以实现细胞本身的代谢需要和某些细胞器更新的过程[1]。自噬既可以作为一种防御机制清除胞质内受损的细胞器、代谢产物,进行亚细胞水平上的重构,保护受损的细胞,同时它作为一种细胞死亡程序诱导细胞主动性死亡[2-3]。已有研究表明,在神经细胞氧糖剥夺后再复糖复氧模拟的脑缺血/再灌注模型中,缺糖缺氧可诱发自噬[4-5]。近期研究也表明,PC12细胞在缺糖缺氧2 h/复糖复氧不同时间均可出现不同程度的损伤,在复糖复氧6~12 h,自噬可减轻神经细胞的损伤,而在复糖复氧24~36 h后,过度的自噬可加重神经细胞损伤,提示过度自噬是脑缺血/再灌注损伤的重要原因。
前期研究表明,中药黄芪的有效成分和三七的有效成分具有抗缺血性脑损伤的作用,二者联合应用可增强其抗缺血性脑损伤的作用,进一步的研究表明,其作用可能来自于其主要有效成分黄芪甲苷和人参皂苷Rg1的相互作用[6]。但其对脑缺血/再灌注后神经细胞自噬性损伤有何影响还不清楚,二者配伍具有怎样的相互作用也未阐明。因此,本研究采用PC12细胞氧糖剥夺后再复糖复氧诱导的细胞自噬性损伤模型,研究了黄芪甲苷和人参皂苷Rg1配伍对细胞自噬性损伤的影响及其相互作用,为其临床合理应用提供科学依据。
1 材料与方法 1.1 材料 1.1.1 试剂胰蛋白酶(中国Solarbio,批号:T1350-100);DMEM高糖培养基(美国Hyclone,批号:NZM1290);无糖Earle′s (中国Biotopped,批号:Top0063);胎牛血清(美国Hyclone,批号:NWK0489);神经生长因子(nerve growth factor, NGF)(美国Sigma,批号:N2513);二甲基亚砜(dimethyl sulfoxide, DMSO)(美国MP Biomedicals,批号:196055);噻唑蓝[(4, 5-dimethyl-2-thiazolyl)-2, 5-diphenyl-2-H-tetrazolium bromide,MTT](中国Solarbio公司,批号:M8181);乳酸脱氢酶(lactate dehydrogenase, LDH) 试剂盒(中国南京建成生物有限公司,批号:20140327);兔抗大鼠微管相关蛋白1轻链3(microtubule associated protein 1 light chain 3, MAP1LC3, LC3) 一抗(日本MBL,批号:PM036);荧光素四甲基异硫氰酸罗丹明(fluorescein four methyl isocyanate Luo Danming, TRITC) 标记羊抗兔二抗(中国Boster,批号:BA1090);兔抗大鼠sequesto-some-1(SQSTM1/p62) 一抗(美国Proteintech,批号18420-1-AP);小鼠抗大鼠β-actin一抗(美国Proteintech,批号60008-1-lg);辣根过氧化物酶(horseradish peroxidase, HRP) 标记的羊抗兔、羊抗小鼠二抗(美国Proteintech,批号SA00001-1、SA00001-2);ECL化学发光剂(Tamper Evident seal,批号203-14401);曲拉通X-100(上海国药集团,批号:T20100705);牛血清白蛋白(bovine serum albumin, BSA)(美国Sigma,批号:A1933-100G);Hoechst 33258(中国Solarbio,批号:COO20-10);链霉素青霉素(10 kU·mL-1青霉素、10 g·L-1链霉素) 混合溶液、0.01 mol·L-1磷酸盐缓冲液(PBS,pH 7.2) 购自美国Gibco公司;自噬抑制剂3-甲基腺嘌呤(3-methyladenin, 3-MA)(美国Selleck,批号S2767),自噬诱导剂雷帕霉素(rapamycin)(美国Gene Operation,批号53123-88-9)。
1.1.2 细胞株PC12细胞,来源于大鼠的肾上腺嗜铬细胞瘤细胞,高分化,永生性,在美国模式培养物收集中心(American Type Culture Collection, ATCC) 中的编号CRL-1721,购自武汉大学中国典型培养物保存中心。
1.1.3 受试药物黄芪甲苷(批号:A0070)、人参皂苷Rg1(批号:A0237),购自中国成都曼思特生物科技有限公司,纯度≥98%。黄芪甲苷以含0.1% DMSO-PBS溶解,人参皂苷Rg1以PBS溶解。
1.2 方法 1.2.1 PC12细胞的培养及氧糖剥夺后再复氧复糖(oxygen-glucose deprivation/reoxygenation, OGD/R) 自噬性损伤模型的建立根据以往的研究,PC12细胞在缺糖缺氧2 h再复糖复氧24 h,细胞产生自噬性损伤,且损伤程度达高峰。因此,在本研究中,采用缺糖缺氧2 h再复糖复氧24 h制作细胞自噬性损伤模型。细胞以DMEM高糖培养基(含葡萄糖4.5 g·L-1、10%胎牛血清和1%青链霉素) 于37℃、20% O2、75% N2、5% CO2及饱和湿度下培养,2 d换液1次,待细胞生长融合后传代培养。细胞以1×107·L-1接种于12孔或96孔培养板中,培养24 h,待细胞贴壁后再加终浓度50 μg·L-1的NGF诱导分化48 h后[7],弃原培养液,加入无血清培养基培养24 h,使细胞同步化于G0期。然后进行如下处理:细胞加无糖Earle′s培养液,置于三气培养箱中(5% CO2、1% O2、94% N2) 模拟缺糖缺氧培养2 h后,换成DMEM高糖培养液常规培养进行复糖复氧24 h,造成OGD/R模型。
1.2.2 黄芪甲苷与人参皂苷Rg1抗自噬性损伤的相互作用 1.2.2.1 黄芪甲苷、人参皂苷Rg1单用对细胞自噬的抑制作用细胞接种于24孔板中,制作细胞爬片。实验分为正常对照组、OGD/R模型组和药物干预组。细胞常规培养后进行如下处理:正常对照组换DMEM高糖培养液同上常规培养。模型组同前造模。药物组于缺糖缺氧前30 min加入黄芪甲苷0、9.81、19.63、39.25、78.5 mg·L-1,人参皂苷Rg1 0、10、20、40、80 mg·L-1[8]。复糖复氧24 h后吸去上清,PBS洗涤后加4%多聚甲醛固定,以PBS洗3次,加0.5%曲拉通后,PBS洗3次,再以1%牛血清白蛋白封闭液封闭,加兔抗大鼠LC3一抗(1 :500)4℃孵育过夜,PBS洗3次,加TRITC标记的羊抗兔荧光二抗(1 :100) 室温孵育,PBS洗3次后,加Hoechst 33258(1 :200),PBS洗涤后,甘油封片,用激光共聚焦显微镜观察斑片状荧光体。斑片状荧光体为LC3-Ⅱ,斑片的数量可作为自噬体的相对定量,也可在一定程度上反映细胞自噬活性。然后,随机选取5个不同的视野,用Image Pro-Plug6.0图像分析软件测定细胞面积及斑片状荧光体个数,计算单位面积的斑片状荧光体个数,以(模型组自噬体数量-药物组自噬体数量)/模型组自噬体数量×100%计算药物对自噬的抑制率。以药物浓度为自变量,抑制率为因变量进行曲线回归分析(即以药物浓度的自然对数为自变量,抑制率为因变量),并计算药物的半数抑制浓度(median inhibitory concentration, IC50) 和95%可信区间。
1.2.2.2 黄芪甲苷与人参皂苷Rg1不同比例配伍对自噬的抑制作用以上述黄芪甲苷与人参皂苷Rg1单独作用的IC50为1个剂量单位,选择黄芪甲苷与人参皂苷Rg1 3个不同比例的剂量单位(2 :1、1 :1、1 :2) 进行相互作用实验。同上进行自噬抑制实验,测定两药配伍后的自噬抑制率,计算黄芪甲苷和人参皂苷Rg1不同剂量单位配伍的IC50及其95%可信区间。
1.2.2.3 黄芪甲苷与人参皂苷Rg1配伍抗自噬性损伤的相互作用分析Isobologram[9-10]分析法可用于判断药物的相互作用性质。在Isobolograph图中,横轴为一个药物单用的IC50(或ED50) 和标准差,纵轴为另一个药物单用的IC50(或ED50) 和标准差。将两个药物的IC50(或ED50) 均值用直线连接后即为相加线。如果两药合用后测得的IC50(或ED50) 落在相加线上则相互作用为相加,落在左下方则为协同,落在右上方则为拮抗。按Isobologram分析法分析黄芪甲苷与人参皂苷Rg1以不同比例配伍后的相互作用。该方法常结合95%可信区间进行分析,分析两个药物配伍时IC50的95%可信区间与其分别单用时IC50的95%可信区间是否互相重叠,若无重叠,则差异存在显著性,否则无显著性差异。此外,相互作用指数γ也可判断相互作用的性质,若γ < 1则相互作用为协同,γ > 1则相互作用为拮抗,γ=1则相互作用为相加。

|
式中,IC50总A与IC50总B分别为配伍时A、B两药的IC50,IC50A与IC50B分别为A、B两药单独作用时的IC50值。
1.3 黄芪甲苷与人参皂苷Rg1配伍抗PC12细胞OGD/R后自噬性损伤的验证由于自噬在脑缺血后发挥了双刃剑的作用[11-12],抑制自噬不一定就表明对抗了OGD/R后细胞的损伤。因此,为了了解黄芪甲苷与人参皂苷Rg1协同作用配伍下对OGD/R后细胞损伤是否具有抑制作用,对两药具有抗OGD/R后细胞自噬协同作用的剂量单位为1 :1配伍时是否具有协同抗细胞损伤的作用进行了进一步验证。根据“1.2.2.2”实验,黄芪甲苷与人参皂苷Rg1剂量单位为1 :1配伍时IC50的剂量分别为:黄芪甲苷IC50 3.45 mg·L-1,人参皂苷Rg1 IC50 1.71 mg·L-1。将两药的IC50剂量作为1个剂量单位进行1 :1配伍,将细胞分为正常对照组、OGD/R模型组、3-MA (25 mmol·L-1) 组、雷帕霉素(200 nmol·L-1) 组、黄芪甲苷(3.45 mg·L-1) 单用组、人参皂苷Rg1(1.71 mg·L-1) 单用组、配伍(3.45 mg·L-1黄芪甲苷+1.71 mg·L-1人参皂苷Rg1) 组及不同药物+3-MA或雷帕霉素组。实验方法同前。处理结束后进行以下检测:
自噬体的电镜检测:吸去上清,细胞以PBS洗涤后,加入2.5%戊二醛固定液固定过夜,再1%锇酸后固定2 h,依次以50%、70%、90%、100%的丙酮脱水,包埋、染色后,以透射电子显微镜(美国FEI,型号Tecnai G2 spirit) 观察细胞自噬体形态,检测细胞单位面积(μm2) 自噬体的数量。每个样本随机选取5个不同的视野进行计数,计算自噬体数量的平均值。
细胞活力测定(MTT法):分别取上述各组细胞,加入20 μL的MTT (5 g·L-1) 继续培养4 h后,弃上清,加200 μL DMSO,震荡10 min,于490 nm处检测光密度值(OD)。OD值越大,则细胞存活越多。
LDH漏出率测定:分别吸取各组培养液,1 000 r·min-1离心10 min,检测上清液中LDH含量。然后将细胞用PBS洗涤3次,再用等量培养液悬浮,置-20℃、37℃反复冻融3次,再将冻融液1 000 r·min-1离心10 min,取上清检测细胞冻融液的LDH含量。计算细胞LDH漏出率[13]:LDH漏出率/%=培养液LDH含量/(培养液LDH含量+细胞冻融液LDH含量)×100%。
细胞LC3Ⅱ定位及相对定量检测:同前用激光共聚焦显微镜测定单位面积的LC3Ⅱ阳性斑片荧光体数量(10-1个/μm2)。
细胞p62蛋白定量检测:以Western blot法测定。细胞培养及处理同前,吸去上清,PBS洗涤,刮下细胞,1 000 r·min-1离心5 min后弃去上清,加入100 μL的蛋白裂解液和1 μL蛋白酶抑制剂,冰上充分混匀后静置20 min后,12 000 r·min-1离心10 min,取上清,BCA试剂盒测定总蛋白含量。取30 μg蛋白100℃水浴10 min变性后,120 V恒压电泳70 min,200 mA转膜2 h,5%脱脂牛奶封闭1 h,再分别与兔抗大鼠p62一抗(1 :500) 和小鼠抗大鼠β-actin一抗(1 :1 000) 溶液混合,4℃静置过夜,TBS洗3次后,TBST洗1次;然后分别加羊抗兔二抗(1 :2 000) 或羊抗小鼠二抗(1 :2 000),37℃孵育1 h,TBS洗3次后,TBST洗1次,暗室下加ECL化学发光剂显影。Image Pro-Plug6.0图像分析软件测定目的条带的累积光密度值(IOD),以目的条带的IOD与β-actin条带的IOD的比值作为该目的蛋白的相对表达量。
1.4 统计学分析用SPSS 16.0进行统计学分析,实验数据用x±s表示。两药配伍后药物相互作用性质的判断采用Isobologram分析法和固定比例法,方法见前。各组计量资料比较采用单因素方差分析,组间两两比较方差齐者用LSD检验,方差不齐者用Dunnet T3检验。实验验证部分的交互作用分析采用析因设计的方差分析。
2 结果 2.1 黄芪甲苷、人参皂苷Rg1对OGD/R细胞自噬的抑制作用不同浓度的黄芪甲苷与人参皂苷Rg1单用对OGD/R后细胞自噬具有抑制作用,且呈剂量效应关系,见Fig 1。根据各药物对自噬的抑制率计算其IC50及95%可信区间,见Tab 1。

|
| Fig 1 Inhibition of Astragaloside Ⅳand Ginsenoside Rg1 alone of different concentrationson PC12 cell autophagy induced by OGD/R (x±s, n=3) **P < 0.01 vs model |
| IC50/mg·L-1 | 95% confidenceinterval/mg·L-1 | |
| Astragaloside Ⅳ | 27.22±0.614 | [25.96, 29.03] |
| Ginsenoside Rg1 | 13.68±1.334 | [10.27, 16.95] |
以黄芪甲苷与人参皂苷Rg1单用的IC50为1个剂量单位(分别为27.22、13.68 mg·L-1),分别设定黄芪甲苷、人参皂苷Rg1 3个不同剂量单位(2 :1、1 :1、1 :2) 配伍,测定不同配伍对自噬的抑制率,并计算配伍时各药的IC50和95%可信区间,见Tab 2、3。
| Group | Drug concentration/mg·L-1 | Inhibitionrate/% | |
| AstragalosideⅣ | GinsenosideRg1 | ||
| Model | 0 | 0 | 0 |
| Astragaloside Ⅳ :Ginsenoside Rg1 2 :1 | 13.61 | 3.42 | 25.46±5.901** |
| 27.22 | 6.84 | 35.35±4.774** | |
| 54.44 | 13.68 | 42.49±4.001** | |
| 108.88 | 27.36 | 50.53±5.924** | |
| 217.76 | 54.72 | 57.09±2.729** | |
| Astragaloside Ⅳ:Ginsenoside Rg1 1 :1 | 6.81 | 3.42 | 57.03±1.607** |
| 13.61 | 6.84 | 66.52±1.336** | |
| 27.22 | 13.68 | 72.84±3.322** | |
| 54.44 | 27.36 | 79.86±3.248** | |
| 108.88 | 54.72 | 88.53±1.199** | |
| Astragaloside Ⅳ:Ginsenoside Rg1 1 :2 | 6.81 | 6.84 | 37.98±4.627** |
| 13.61 | 13.68 | 49.49±5.234** | |
| 27.22 | 27.36 | 61.70±5.778** | |
| 54.44 | 54.72 | 64.77±5.161** | |
| 108.88 | 109.44 | 70.67±2.305** | |
| 3-MA | - | - | 87.32±2.127 |
| **P < 0.01 vs model | |||
| Astragaloside Ⅳ :Ginsenoside Rg1 | 2 :1/mg·L-1 | 1 :1/mg·L-1 | 1 :2/mg·L-1 |
| Astragaloside Ⅳ IC50 | 111.82±10.971 | 3.45±0.573 | 15.49±1.771 |
| Ginsenoside Rg1 IC50 | 27.77±3.017 | 1.71±0.284 | 15.31±2.294 |
| Astragaloside Ⅳ95% confidence interval | [84.39, 139.25] | [2.02, 4.88] | [11.06, 19.92] |
| Ginsenoside Rg195% confidence interval | [20.23, 35.31] | [1.00, 2.42] | [9.58, 21.05] |
采用Isobologram分析法分析两药配伍后相互作用的性质。根据药物单独作用时的IC50值及95%可信区间绘制Isobologram曲线。将黄芪甲苷的IC50及95%可信区间绘制在X轴上,人参皂苷Rg1的IC50及95%可信区间绘制在Y轴上,将两IC50值相连后构成相加线,并作出相加线的95%可信区间(Fig 2)。由Fig 2可知,黄芪甲苷与人参皂苷Rg1以剂量单位为1 :1配伍时的IC50落在相加线的左下方,且两个药物配伍时IC50的95%可信区间与其分别单用时IC50的95%可信区间无重叠,表明黄芪甲苷与人参皂苷Rg1以剂量单位为1 :1配伍时具有协同抗细胞自噬的相互作用,各自的IC50剂量分别为黄芪甲苷(3.45±0.573) mg·L-1、人参皂苷Rg1(1.71±0.284) mg·L-1。而黄芪甲苷与人参皂苷Rg1以剂量单位为2 :1和1 :2配伍时IC50及95%可信区间均落在相加线的右上方,表明黄芪甲苷与人参皂苷Rg1以2 :1及1 :2配伍时对细胞自噬的作用呈现拮抗的相互作用。
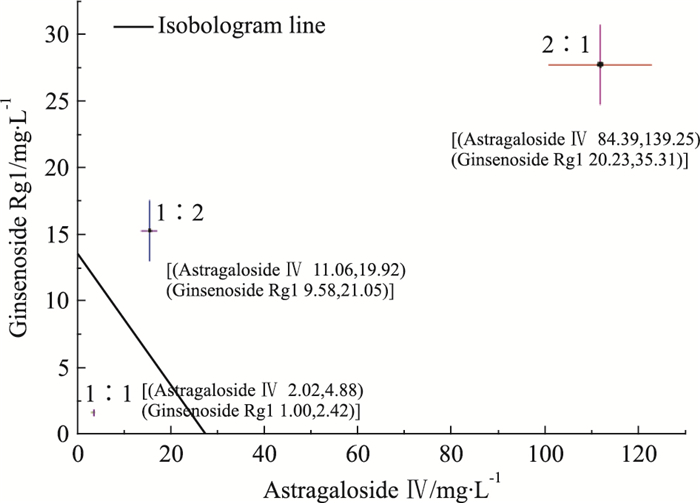
|
| Fig 2 Isobologram analysis of different ratiocombinations of Astragaloside Ⅳ and Ginsenoside Rg1 () represents the lower limit and upper limit of 95% confidence interval of each drug IC50 |
不同比例配伍的相互作用指数γ见Tab 4。黄芪甲苷与人参皂苷Rg1以剂量单位为2 :1和1 :2配伍时γ值均大于1,而1 :1配伍时则小于1。提示黄芪甲苷与人参皂苷Rg1以剂量单位为1 :1配伍时具有协同抗细胞自噬的相互作用,与Isobologram的分析结果一致。
| Combination ratio | γ | |
| Astragaloside Ⅳ :Ginsenoside Rg1 | 2 :1 | 6.1081 |
| 1 :1 | 0.2511 | |
| 1 :2 | 1.6884 |
见Tab 5, 细胞活性实验(MTT法) 结果表明,与正常组比较,模型组细胞存活减少、LDH漏出率增加(P < 0.01)。与模型组比较,3-MA组细胞存活均增加、LDH漏出率减少(P < 0.01),雷帕霉素组则作用相反(P < 0.01);黄芪甲苷组、人参皂苷Rg1组及配伍组细胞存活增加、LDH漏出率减少(P < 0.01),且配伍组细胞存活的增加和LDH漏出率的减少高于黄芪甲苷单用和人参皂苷Rg1单用(P < 0.01)。与模型组比较,黄芪甲苷+3-MA、人参皂苷Rg1+3-MA和配伍+3-MA组细胞存活进一步增加、LDH漏出率进一步降低(P < 0.01),且黄芪甲苷+3-MA、人参皂苷Rg1+3-MA和配伍+3-MA组增加细胞存活、降低LDH漏出率的效应分别强于黄芪甲苷、人参皂苷Rg1和配伍组(P < 0.01)。与模型组比较,黄芪甲苷+雷帕霉素、人参皂苷Rg1+雷帕霉素和配伍+雷帕霉素组细胞存活增加、LDH漏出率降低(P < 0.01),但黄芪甲苷+雷帕霉素、人参皂苷Rg1+雷帕霉素和配伍+雷帕霉素组增加细胞存活、减少LDH漏出率的效应低于黄芪甲苷、人参皂苷Rg1及配伍组(P < 0.01)。
| Group | MTT/OD | LDH leakage rate/% |
| Normal | 0.683±0.034 | 14.370±2.553 |
| Model | 0.218±0.023▲▲ | 58.790±3.258▲▲ |
| Astragaloside Ⅳ | 0.530±0.022△△★★ | 28.950±1.779△△★★ |
| Ginsenoside Rg1 | 0.506±0.021△△★★ | 30.670±2.517△△★★ |
| Combination | 0.628±0.023△△ | 23.120±3.101△△ |
| Astragaloside Ⅳ+3-MA | 0.668±0.027△△☆☆●● | 17.490±2.367△△☆☆● |
| Ginsenoside Rg1+3-MA | 0.664±0.027△△##●● | 17.670±2.517△△##● |
| Combination+3-MA | 0.703±0.024△△★★●● | 13.270±1.804△△★★●● |
| Astragaloside Ⅳ+Rapamycin | 0.348±0.025△△☆☆〇〇 | 36.960±2.669△△☆☆〇〇 |
| Ginsenoside Rg1+Rapamycin | 0.342±0.025△△##〇〇 | 37.000±2.000△△##〇〇 |
| Combination+Rapamycin | 0.420±0.026△△★★〇〇 | 32.670±2.517△△★★〇〇 |
| 3-MA | 0.620±0.029△△ | 22.570±2.629△△ |
| Rapamycin | 0.178±0.023△△ | 65.110±2.437△△ |
| ▲▲P < 0.01 vs normal; △△P < 0.01 vs model; ☆☆P < 0.01 vs Astragaloside Ⅳ; ##P < 0.01 vs Ginsenoside Rg1;★★P < 0.01 vs combination; ●P < 0.05, ●●P < 0.01 vs 3-MA; 〇〇P < 0.01 Rapamycin | ||
电镜显示(Fig 3、Tab 6):正常对照组未见明显自噬体形成。OGD/R后,细胞内可见大量自噬体形成,大部分呈完整的双膜或单膜结构,少部分被溶酶体溶解。与正常对照组比较,模型组自噬体数量增加(P < 0.01)。与模型组比较,雷帕霉素组自噬体数目增加(P < 0.01),3-MA组自噬体数量减少(P < 0.01);黄芪甲苷组、人参皂苷Rg1组、配伍组自噬体数量均减少(P < 0.01),且配伍组低于黄芪甲苷单用和人参皂苷Rg1单用组(P < 0.05或P < 0.01)。析因设计实验的交互作用分析表明,黄芪甲苷和人参皂苷Rg1配伍后抑制自噬体形成的交互作用差异具有显著性(P < 0.01)。
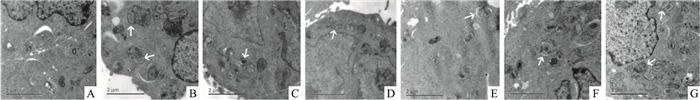
|
| Fig 3 Ultrastructure of autophagosome in PC12 cells of each group (×15 000, bar=2 μm) A:Normal; B:Model; C:Astragaloside Ⅳ; D:Ginsenoside Rg1;E:Combination; F:3-MA; G:Rapamycin. Arrows indicate autophagosome |
| Group | Autophagosome number/μm2 | LC3 Ⅱ positive puncta number (10-1/μm2) | p62 protein expression |
| Normal | 0.292±0.013 | 0.174±0.013 | 0.728±0.030 |
| Model | 0.734±0.027▲▲ | 0.650±0.026▲▲ | 0.390±0.030▲▲ |
| Astragaloside Ⅳ | 0.592±0.019△△★ | 0.417±0.023△△★★ | 0.533±0.025△△★ |
| Ginsenoside Rg1 | 0.606±0.011△△★★ | 0.468±0.029△△★★ | 0.537±0.025△△★ |
| Combination | 0.564±0.024△△ | 0.342±0.024△△ | 0.589±0.030△△ |
| 3-MA | 0.450±0.022△△ | 0.340±0.027△△ | 0.606±0.031△△ |
| Rapamycin | 0.87±0.036△△ | 0.720±0.019△△ | 0.330±0.030△ |
| ▲▲P < 0.01 vs normal; △P < 0.05, △△P < 0.01 vs model; ★P < 0.05, ★★P < 0.01 vs combination | |||
激光共聚焦结果显示(Fig 4、Tab 6):正常对照组细胞胞质内可见均匀分布的红色荧光点,无斑片状荧光体形成。OGD/R后,胞质内可见斑片状荧光体聚集。与正常组比较,模型组细胞内LC3Ⅱ阳性斑片状荧光体数目增多(P < 0.01)。与模型组比较,雷帕霉素组斑片状荧光体数目增加(P < 0.01),3-MA组斑片状荧光体数目均减少(P < 0.01);黄芪甲苷单用组、人参皂苷Rg1单用组、配伍组斑片状荧光体数目均减少(P < 0.01),且配伍组斑片状荧光体数目低于黄芪甲苷和人参皂苷Rg1单用组(P < 0.01)。析因设计实验的交互作用分析表明,黄芪甲苷和人参皂苷Rg1配伍后降低斑片状荧光体数目的交互作用具有显著性意义(P < 0.01)。
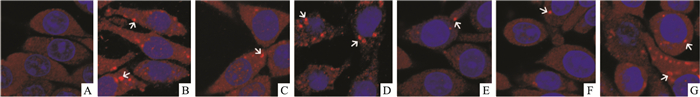
|
| Fig 4 Localization detection of LC3 Ⅱ(×600, bar=20 μm) A:Normal; B:Nodel; C:Astragaloside Ⅳ; D:Ginsenoside Rg1;E:Combination; F:3-MA; G:Rapamycin.Arrows indicate LC3 Ⅱ positive puncta |
p62蛋白检测表明(Fig 5、Tab 6):OGD/R后,p62蛋白表达下降(P < 0.01)。与模型组比较,雷帕霉素组p62蛋白表达降低(P < 0.05),3-MA组p62蛋白表达增加(P < 0.01);黄芪甲苷组、人参皂苷Rg1组、配伍组p62蛋白表达增加(P < 0.01),且配伍的效应大于各药物单用(P < 0.05)。析因设计实验的交互作用分析表明,黄芪甲苷和人参皂苷Rg1配伍后增加p62蛋白表达的交互作用具有显著性意义(P < 0.01)。
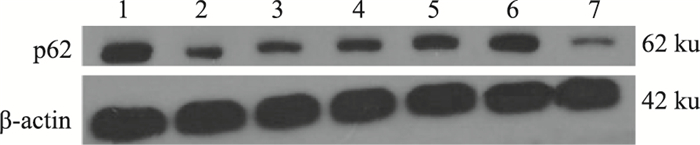
|
| Fig 5 Western blot pattern of p62 proteinexpression among each group 1:Normal; 2:Model; 3:Astragaloside Ⅳ; 4:Ginsenoside Rg1;5:combination; 6:3-MA; 7:Rapamycin |
中医学常将具有不同功效的中药进行配伍,使不同药物成分作用于不同的靶点,从而对疾病发挥综合治疗的作用。因此,中药配伍主要是通过药物的相互作用而实现的,这种相互作用常表现为协同、相加和拮抗3种形式。Isobologram分析法[9-10]是国际上常用于判断药物相互作用性质的一种方法,常被称为评价药物相互作用的黄金标准。在运用Isobologram分析法评价药物相互作用的性质时,常结合其95%可信区间和相互作用指数γ,来进一步判断药物相互作用的性质,这些方法相互佐证,可以更加客观地评价药物的相互作用。因此,本研究采用Isobologram分析法并结合相互作用指数,研究黄芪甲苷与人参皂苷Rg1配伍的相互作用。
本实验根据前期实验结果,在建立PC12细胞OGD/R后细胞自噬性损伤模型的基础上,利用激光共聚焦显微镜检测自噬标志物LC3,以判断药物对自噬的影响。细胞内存在两种形式的LC3蛋白:LC3-Ⅰ和LC3-Ⅱ。LC3蛋白在合成后其C端即被Atg4蛋白酶切割变成LC3-Ⅰ。当自噬体形成后,LC3-Ⅰ和磷脂酰乙醇胺偶联形成LC3-Ⅱ并定位于自噬体内膜和外膜,并始终稳定地保留在自噬体膜上参与自噬体的形成直到与溶酶体融合,因此被用来作为自噬体的标记物[1, 14]。正常情况下LC3蛋白主要以LC3-Ⅰ形式散在分布于胞质中,激光共聚焦显微镜检测LC3蛋白可见胞质中出现弥散状荧光。若细胞出现自噬则表现为LC3-Ⅱ的形成和在胞质的聚集,激光共聚焦显微镜检测LC3蛋白可见胞质中出现斑片状荧光体,这种斑片状荧光体的多少可在一定程度上反映自噬体的数量或自噬的强度[15-16]。
本研究结果表明,在缺糖缺氧2 h复糖复氧24 h,细胞内出现LC3-Ⅱ形成及胞质中含量增加,自噬体形成增加,且细胞存活减少、LDH漏出率增加。给予自噬抑制剂3-MA干预后,可使细胞存活增加、LDH漏出减少,减轻了OGD/R引起的细胞损伤;而自噬诱导剂则使细胞存活进一步减少、LDH漏出率增加,细胞损伤加重。表明OGD/R后,细胞出现过度自噬,参与了OGD/R诱导的细胞损伤,细胞损伤可能与细胞自噬被过度激活有关。黄芪甲苷和人参皂苷Rg1对OGD/R诱导的细胞自噬具有抑制作用,且作用呈量效关系。黄芪甲苷与人参皂苷Rg1在剂量单位为1 :1配伍时呈现协同增效作用,其协同作用的IC50分别是黄芪甲苷(3.45±0.573) mg·L-1、人参皂苷Rg1(1.71±0.284) mg·L-1。而黄芪甲苷与人参皂苷Rg1在剂量单位为1 :2和2 :1配伍时,则呈拮抗作用。因此,黄芪甲苷与人参皂苷Rg1合理的配伍对抗神经细胞缺血性损伤是有益的。
为进一步验证黄芪甲苷和人参皂苷Rg1配伍抗OGD/R后细胞自噬的协同作用,研究了两药在IC50剂量配伍下对细胞损伤、自噬体数量和自噬相关蛋白LC3-Ⅱ、p62表达的影响。p62可与LC3-Ⅱ结合,参与了自噬形成过程的选择性自噬,从而靶向自噬体并促进泛素化蛋白的清除和自身的特异性降解,其蛋白水平与自噬活性在一定范围内呈负相关[17],与LC3-Ⅱ共同用于自噬活性的判断。研究发现,因LC3缺陷引起的自噬途径阻滞,p62及其连接的泛素化蛋白会出现明显的堆积[18]。
本研究结果表明,黄芪甲苷和人参皂苷Rg1可抑制OGD/R后细胞活性的降低和LDH漏出。析因设计实验分析表明,二者在IC50剂量下配伍时具有协同增效作用。自噬激动剂雷帕霉素可部分抵消药物抗细胞损伤的作用,而自噬抑制剂3-MA与药物合用可进一步减轻细胞的损伤。提示黄芪甲苷和人参皂苷Rg1在IC50剂量配伍时对细胞损伤具有协同抑制作用,其作用与抑制OGD/R诱导的细胞自噬性损伤有关。自噬体数目和p62蛋白表达结果也表明,黄芪甲苷和人参皂苷Rg1可抑制OGD/R后细胞自噬体形成,增加p62蛋白表达。析因设计实验分析也表明,黄芪甲苷和人参皂苷Rg1在IC50剂量配伍时对OGD/R诱导的细胞自噬具有协同抑制作用。这也进一步验证了黄芪甲苷和人参皂苷Rg1在IC50剂量配伍时抗细胞损伤与其协同抑制细胞自噬有关。
综上所述,在缺糖缺氧2 h时再复糖复氧24 h,细胞出现过度自噬和细胞损伤,提示过度自噬参与了细胞损伤。黄芪甲苷和人参皂苷Rg1在IC50剂量配伍时,对细胞过度自噬和细胞损伤具有抑制作用。相互作用分析表明,黄芪甲苷和人参皂苷Rg1在IC50剂量配伍时对细胞自噬的抑制呈协同作用。这表明在临床应用黄芪和三七或其有效成分防治缺血性脑血管病时,合理的配伍将起到协同增效作用。
| [1] | Xu F, Gu J H, Qin Z H. Neuronal autophagy in cerebral ischemia[J]. Neurosci Bull, 2012, 28 (5): 658-66. doi:10.1007/s12264-012-1268-9 |
| [2] | Qin H D, Tan W G, Zhang Z, et al. 15d-prostaglandin J2 protects cortical neurons against oxygen-glucose deprivation/reoxygenation injury:involvement of inhibiting autophagy through upregulation of Bcl-2[J]. Cell Mol Neurobiol, 2015, 35 (3): 303-12. doi:10.1007/s10571-014-0125-y |
| [3] | Roy S, Debnath J. Autophagy and tumorigenesis[J]. Semin Immunopathol, 2010, 32 (4): 383-96. doi:10.1007/s00281-010-0213-0 |
| [4] | Kuma A, Hatano M, Matsui M, et al. The role of autophagy during the early neonatal starvation period[J]. Nature, 2004, 432 (7020): 1032-6. doi:10.1038/nature03029 |
| [5] | Zhu C, Wang X, Xu F, et al. The influence of age on apoptotic and other mechanisms of cell death after cerebral hypoxia-ischemia[J]. Cell Death Differ, 2005, 12 (2): 162-76. doi:10.1038/sj.cdd.4401545 |
| [6] | 黄小平, 邓常清, 邱咏园, 等. 黄芪甲苷和三七的三种有效成分配伍对小鼠脑缺血再灌注后氧化应激和Nrf2/HO-1途径的影响[J]. 中国药理学通报, 2013, 29 (11): 1596-601. Huang X P, Deng C Q, Qiu Y Y, et al. Effects of the combinations between AstragalosideⅣ and three active components in notoginseng on oxidative stress and Nrf2/HO-1 pathway after cerebral ischemic reperfusion in mice[J]. Chin Pharmacol Bull, 2013, 29 (11): 1596-601. |
| [7] | Li H, Pinto A R, Duan W, et al. Telomerase down-regulation does not mediate PC12 pheochromocytoma cell differentiation induced by NGF, but requires MAP kinase signaling[J]. J Neurochem, 2005, 95 (3): 891-901. doi:10.1111/jnc.2005.95.issue-3 |
| [8] | 刘晓丹, 邓常清. 黄芪甲苷和三七总皂苷中主要有效成分抗PC12细胞氧化损伤的配伍研究[J]. 湖南中医药大学学报, 2012, 32 (1): 8-12. Liu X D, Deng C Q. Compatibility study of main effective components in PNS and AST on oxidative damage of PCI2[J]. J TCM Univ Hunan, 2012, 32 (1): 8-12. |
| [9] | Tallarida R J. An overview of drug combination analysis with isobolograms[J]. J Pharmacol Exp Ther, 2006, 319 (1): 1-7. doi:10.1124/jpet.106.104117 |
| [10] | Won H K, Hyun J A, Jie A K. Interactions of propofol and remifentanil on bispectral index under 66% N2O:analysis by dose-effect curve, isobologram, and combination index[J]. Korean J Anesthesiol, 2010, 59 (6): 371-6. doi:10.4097/kjae.2010.59.6.371 |
| [11] | Wei K, Wang P, Miao C Y. A double-edged sword with therapeutic potential: an updated role of autophagy in ischemic cerebral injury[J]. CNS Neurosci Ther, 2012, 18 (11): 879-86. doi:10.1111/cns.2012.18.issue-11 |
| [12] | 丁煌, 唐映红, 黄小平. 自噬在脑缺血性损伤中的作用[J]. 中国药理学通报, 2015, 31 (8): 1048-52. Ding H, Tang Y H, Huang X P. Effects of authophagy in cerebral ischemic injury[J]. Chin Pharmacol Bull, 2015, 31 (8): 1048-52. |
| [13] | Sheng R, Liu X Q, Zhang L S, et al. Autophagy regulates endoplasmic reticulum stress in ischemic preconditioning[J]. Autophagy, 2012, 8 (3): 310-25. doi:10.4161/auto.18673 |
| [14] | Barth S, Glick D, Macleod K F. Autophagy: assays and artifacts[J]. J Pathol, 2010, 221 (2): 117-24. doi:10.1002/path.2694 |
| [15] | Tanida I, Ueno T, Kominami E. LC3 conjugation system in mammalian autophagy[J]. Int J Biochem Cell Biol, 2004, 36 (12): 2503-18. doi:10.1016/j.biocel.2004.05.009 |
| [16] | Kimura S, Fujita N, Noda T, et al. Monitoring autophagy in mammalian cultured cells through the dynamics of LC3[J]. Methods Enzymol, 2009, 452 : 1-12. doi:10.1016/S0076-6879(08)03601-X |
| [17] | Xiong J, Xia M, Xu M. Autophagy maturation associated with CD38-mediated regulation of lysosome function in mouse glomerular podocytes[J]. J Cell Mol Med, 2013, 17 (12): 1598-607. doi:10.1111/jcmm.2013.17.issue-12 |
| [18] | Maruyama Y, Sou Y S, Kageyama S. LC3B is indispensable for selective autophagy of p62 but not basal auphagy[J]. Biochem Biophys Res Commun, 2014, 446 (1): 309-15. doi:10.1016/j.bbrc.2014.02.093 |