


近年来,随着人们生活水平的提高和饮食结构的改变,高尿酸血症(hyperuricemia, HUA) 发病率明显升高,且有年轻化的趋势[1]。HUA不仅是痛风的生化基础,还与高血压、冠心病、代谢综合征、糖尿病等密切相关[2],如何防治HUA已成为全世界关注的公共健康问题。尿酸是嘌呤碱代谢产物,其在体内的产生主要受肝脏中的黄嘌呤氧化酶(xanthine oxidase, XOD) 催化调节,而排泄则主要依赖于肾脏中的尿酸转运子如尿酸盐阴离子转运子(urate anion transporter, URAT)1、有机阴离子转运子(organic anion transporter, OAT)1和3转运调节,因此,尿酸生成增加和(或) 排泄障碍被认为是HUA发病的主要原因[3]。当前临床治疗HUA主要是应用XOD抑制剂如别嘌醇、非布司他,以及促尿酸排泄药如苯溴马隆,但存在着药物品种少、副作用明显的缺陷[4],因此,寻找新的疗效确切且副作用低的降尿酸药物意义重大。
茶多酚(green tea polyphenols, GTP) 是绿茶叶中酚类化合物及其衍生物的总称,主要包括表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)、没食子儿茶素没食子酸酯(gallocatechin gallate, GCG)、表儿茶素没食子酸酯(epicatechin gallate, ECG)、表没食子儿茶素(epigallocatechin, EGC)、咖啡碱(caffeine, CAF)、表儿茶素(epicatechin, EC) 及儿茶素(Catechin, C) 等,是绿茶的主要活性部位[5]。已有的研究证实GTP有减肥、降血脂、抗癌、抗骨质疏松等药理活性[6],但是GTP对高尿酸血症的影响如何,至今未见报道。本研究应用氧嗪酸钾(PO) 诱导的小鼠HUA模型,观察了GTP对HUA小鼠血尿酸水平的影响,并从尿酸产生和排泄途径探讨其作用机制,为明确GTP降尿酸的药理作用提供科学依据。
1 材料 1.1 试剂绿茶购自重庆云岭茶叶科技责任有限公司(产品标准:Q/YLC0002S,生产许可:QS508314010005);别嘌醇(allopurinol, API) 购自重庆青阳药业有限公司(国药准字:H50021422,产品批号:120903);尿酸试剂盒、XOD试剂盒及BCA蛋白测定试剂盒均购自南京建成生物工程研究所;茶多酚各成分标准品、PO均购自Sigma公司;XOD、URATl、OAT1、OAT3和β-actin抗体均购自Santa Cruz公司;PVDF膜和ECL试剂购自Millipore公司;免疫组织化学染色试剂盒(二步法) 购自北京中杉金桥生物技术有限公司;其他试剂均为国产分析纯。
1.2 仪器Infinite M200型全标仪为BioTek公司产品;RC24型高速冷冻离心机为Thermo Scientific Sorvall公司产品;Mill-iQ型纯水系统为Millipore公司产品;1100型高效液相色谱仪为Agilent公司产品;ChemiDoc XRS成像系统为Bio-Rad公司产品。
1.3 实验动物昆明种小鼠,♂,18 g~22 g,购自重庆医科大学实验动物中心(动物合格证号:SCXK (渝)2002-0001)。所有动物适应性喂养1周后开始实验。
2 方法 2.1 茶多酚的制备与检测依据文献所述方法[7]制备GTP,提取率为15.6%(W/W),并用高效液相色谱法检测GTP中主要成份含量(Fig 1、Tab 1)。
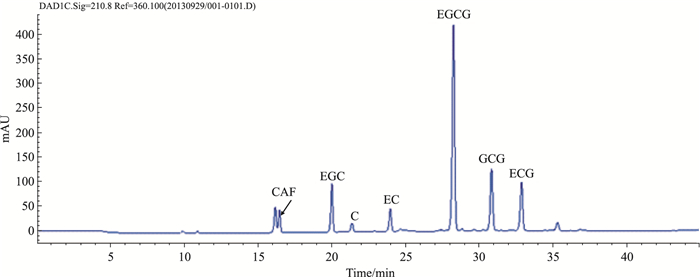
|
| Fig 1 Chromatogram of GTP using a HPLC system |
| Ingredient | Content/g·100 g-1 GTP |
| EGCG | 42.46±0.73 |
| GCG | 13.48±0.48 |
| ECG | 11.68±0.12 |
| EGC | 8.02±0.07 |
| EC | 4.36±0.04 |
| C | 1.41±0.24 |
| CAF | 4.96±0.16 |
60只昆明小鼠随机分成6组,每组10只,分别为对照组、模型组、API组(阳性药,5 mg·kg-1)、GTP组(150、300、600 mg·kg-1)。本实验所用的GTP剂量依据预实验结果确定。对照组给予生理盐水,其他组每天上午9点开始给予250 mg·kg-1 PO灌胃,10点灌胃给予相应药物,连续用药7 d。d 7灌胃给药1 h后,小鼠麻醉处死、取材。
2.3 尿酸检测麻醉小鼠后心脏取血,4℃静置过夜,3 000 r·min-1离心10 min,取血清,尿酸含量检测依照试剂盒说明书进行。
2.4 XOD活性检测取小鼠肝脏组织于冰上按1 :9的比例(W/V) 加入生理盐水充分研磨,4℃下12 000 r·min-1离心15 min,取上清液[8],XOD活性与蛋白浓度检测均依照试剂盒说明书进行。
2.5 XOD表达分析肝组织总蛋白提取依照文献进行[9],取小鼠肝脏组织液氮速冻后,加入RIPA裂解液和蛋白酶抑制剂充分匀浆,4℃下12 000 r·min-1离心15 min,取上清液。取等量蛋白进行SDS-PAGE电泳,转移蛋白至PVDF膜,5%脱脂奶粉封闭,4℃下与XOD抗体或者β-actin抗体共同孵育过夜,再与相应的二抗在室温下共同孵育1 h,滴加ECL试剂后,成像系统检测分析信号。
2.6 尿酸转运子表达分析取小鼠肾脏于10%多聚甲醛缓冲液中固定24 h,石蜡包埋、切片。切片脱蜡至水,免疫组化检测按照试剂盒说明书进行,显微镜下(400×) 分析阳性染色的光密度值,每张切片取5个视野的平均光密度值纳入该蛋白表达的统计分析。
2.7 统计学分析数据用x±s表示,采用单因素方差分析,用SPSS18.0软件进行统计学处理。
3 结果 3.1 GTP对HUA小鼠血尿酸水平的影响如Tab 2所示,与对照组比较,灌胃PO使模型组小鼠血尿酸水平明显升高(P < 0.01)。给予阳性药物别嘌醇灌胃后,小鼠血尿酸水平明显降低,与模型组比较有明显的统计学意义(P < 0.01)。同时,灌胃给予300、600 mg·kg-1 GTP后小鼠血尿酸水平也明显降低,与模型组比较有明显的统计学意义(P < 0.05或P < 0.01);但灌胃150 mg·kg-1 GTP后小鼠血尿酸水平与模型组比较无统计学差异。
| Group | Dose/ mg·kg-1 |
Uric acid level/ g·L-1 |
XOD activity/ U·g-1 Pro |
| Control | - | 3.88±0.26 | 61.4±6.3 |
| Model | - | 5.98±0.73** | 80.3±9.1** |
| API | 5 | 3.58±0.36## | 44.1±7.1## |
| GTP | 150 | 5.68±0.53 | 76.9±6.6 |
| 300 | 5.10±0.35# | 69.9±2.9# | |
| 600 | 4.64±0.38## | 64.9±3.2## | |
| **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model | |||
如Tab 2所示,灌胃PO后模型组小鼠肝脏XOD活性与对照组相比明显增高(P < 0.01)。使用别嘌醇后小鼠肝脏XOD活性与模型组相比明显降低(P < 0.01)。灌胃给予300、600 mg·kg-1 GTP后,小鼠肝脏XOD活性与模型组相比也明显降低(P < 0.05,P < 0.01),且呈现明显的剂量依赖性。
3.3 GTP对HUA小鼠肝脏XOD表达的影响与对照组比较,灌胃给予PO诱导模型组小鼠肝脏中XOD表达明显增加(P < 0.01)。给予别嘌醇治疗后,小鼠肝脏XOD表达明显减少,与模型组相比差异有明显统计学意义(P < 0.01)。灌胃给予300、600 mg·kg-1 GTP后,小鼠肝脏XOD表达与模型组相比也明显降低(P < 0.05,P < 0.01),且呈现明显的剂量依赖性。见Fig 2。

|
| Fig 2 Effect of GTP on XODexpression in liver of hyperuricemic mice XOD protein was analyzed by Western blot assay (A) and semi-quantitative analysis of XOD bands was performed by densitometry (B). Three independent experiments performed in duplicate.**P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model |
与对照组比较,灌胃给予PO诱导了模型组小鼠肾脏URAT1表达明显增加,同时OAT1、OAT3表达明显降低(P < 0.01)。灌胃给予300、600 mg·kg-1 GTP后,小鼠肾脏URAT1表达明显减少,同时OAT1、OAT3表达明显增加(P < 0.05,P < 0.01)。给予别嘌醇治疗后,小鼠肾脏URAT1、OAT1、OAT3的表达与模型组比较差异无统计学意义。见Fig 3、Tab 3。

|
| Fig 3 Effect of GTP on expression of URAT1, OAT1 andOAT3 in kidney of hyperuricemic mice |
| Group | Dose/ mg·kg-1 |
URAT1 | OAT1 | OAT3 |
| Control | - | 0.19±0.04 | 0.6±0.11 | 0.53±0.1 |
| Model | - | 0.55±0.07** | 0.35±0.07** | 0.33±0.04** |
| API | 5 | 0.52±0.11 | 0.33±0.05 | 0.36±0.06 |
| GTP | 150 | 0.55±0.09 | 0.32±0.08 | 0.36±0.09 |
| 300 | 0.48±0.07# | 0.44±0.07## | 0.44±0.09## | |
| 600 | 0.38±0.05## | 0.49±0.09## | 0.45±0.09## | |
| **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model | ||||
本研究应用PO诱导的HUA小鼠模型,发现GTP可降低HUA小鼠血尿酸水平,同时GTP降低了肝脏XOD活性和表达,减少了肾脏中URAT1蛋白的表达,且肾脏中OAT1、OAT3蛋白的表达有所增加。
近年来,HUA发病率在全世界范围内明显增高,而且年轻化趋势明显,如何控制HUA已成为当今医药学界重点关注领域[1]。目前,已有多种动物模型用于HUA基础研究和药物研发,其中PO诱导的HUA模型被广泛应用。PO可抑制啮齿类动物体内尿酸酶活性,阻断尿酸代谢成为水溶性更高的尿囊素,从而导致血尿酸水平异常升高[9]。该模型用时短,费用也相对低廉,高尿酸水平能稳定维持,故本实验选用该模型用于观察GTP的降尿酸作用及药理机制研究。我们发现,给予小鼠灌胃250 mg·kg-1 PO连续7 d,诱导了小鼠血尿酸水平明显升高,与对照组比较差异有统计学意义;同时给予临床常用的降尿酸药物API,小鼠血尿酸水平明显降低,与模型组比较差异有统计学意义。上述结果表明,GTP有较明显的降尿酸药理作用,
尿酸是嘌呤碱代谢终产物,黄嘌呤在XOD作用下代谢为次黄嘌呤,再继续在XOD作用下代谢成为尿酸[2]。机体内XOD含量最高的器官是肝脏,所以肝脏是人体尿酸产生的主要器官。抑制肝脏XOD活性或者表达势必明显减少尿酸的产生,降低血尿酸水平[10]。XOD一直是治疗HUA的药物研发的靶点,且当今临床常用的XOD抑制剂如别嘌醇及非布司他表现出有效的降尿酸作用,凸显了调控XOD对维持机体尿酸稳态的重要性[11]。本研究中我们发现,给予PO连续灌胃7 d明显诱导了小鼠肝脏XOD活性增强,XOD表达也明显增加,这一结果与其他文献报道的研究结果相似[12]。给予API用药后,HUA小鼠肝脏XOD活性和表达均明显降低。给予GTP治疗后,PO诱导升高的小鼠肝脏XOD活性和表达也均明显降低,与模型组比较有明显的统计学差异。这些结果表明,GTP对PO诱导的高尿酸血症小鼠血尿酸水平有明显的降低作用,其机制与抑制肝脏XOD活性和表达,从而减少尿酸产生密切相关。
机体的尿酸约70%由肾脏排泄,剩下的30%通过消化道排泄[13]。血液中的尿酸盐几乎全部从肾小球过滤,但是90%过滤后的尿酸在肾小管被重吸收[14]。URAT1主要表达于肾小管上皮细胞刷状缘,是迄今发现的介导尿酸重吸收最强有力的有机阴离子转运体,在维持血尿酸稳态中的重要作用[15]。OAT1和OAT3大量表达于肾近端小管基底膜,主要功能是将管周隙的有机阴离子包括尿酸盐通过基底膜转运到肾近曲小管上皮细胞中,由此排泌到尿液,是公认的人体内介导尿酸分泌入肾小管的关键转运体[16-17]。在本研究中,给予PO连续灌胃7 d诱导了肾脏组织中的URAT1表达明显增高,同时OAT1和OAT3表达明显降低,提示PO导致了肾脏尿酸代谢紊乱,即尿酸盐重吸收增强而分泌减弱,最终使得血尿酸水平升高。给予GTP治疗7 d后,PO诱导高表达的URAT1则明显减少,而PO诱导低表达的OAT1和OAT3则明显增加,提示GTP通过减少尿酸盐重吸收和增强尿酸盐分泌改善了PO导致的肾脏尿酸代谢紊乱,最终使得血尿酸水平降低。
综上所述,本研究结果发现GTP可降低PO诱导的HUA小鼠血尿酸水平,其机制既与抑制XOD介导的尿酸产生有关,又与调控尿酸转运子介导的尿酸排泄密切相关。本研究证实了GTP具有降低血尿酸水平的作用,并初步阐明了其药理机制,为开发利用GTP为新的降尿酸健康产品提供了科学依据。
( 致谢: 本实验均在重庆工商大学重庆市天然药物研究重点实验室完成。感谢该实验室孔淑贞博士、冯敏博士给予的技术支持。 )
| [1] | Rho Y H, Zhu Y, Choi H K. The epidemiology of uric acid and fructose[J]. Semin Nephrol, 2011, 31 (5): 410-9. doi:10.1016/j.semnephrol.2011.08.004 |
| [2] | Kuwabara M. Hyperuricemia, cardiovascular disease, and hypertension[J]. Pulse (Basel), 2016, 3 (3-4): 242-52. doi:10.1159/000443769 |
| [3] | Mandal A K, Mount D B. The molecular physiology of uric acid homeostasis[J]. Annu Rev Physiol, 2015, 77 : 323-45. doi:10.1146/annurev-physiol-021113-170343 |
| [4] | 吴新荣, 臧路平, 刘志刚. 抗高尿酸血症药物作用靶点研究进展[J]. 中国药理学通报, 2010, 26 (11): 1414-7. Wu X R, Zang L P, Liu Z G. Research advances on drug therapy targets in hyperuricemia[J]. Chin Pharmacol Bull, 2010, 26 (11): 1414-7. |
| [5] | Wang Y, Ho C T. Polyphenolic chemistry of tea and coffee: a century of progress[J]. J Agric Food Chem, 2009, 57 (18): 8109-14. doi:10.1021/jf804025c |
| [6] | Chen Z M, Lin Z. Tea and human health: biomedical functions of tea active components and current issues[J]. J Zhejiang Univ Sci B, 2015, 16 (2): 87-102. doi:10.1631/jzus.B1500001 |
| [7] | Yokozawa T, Noh J S, Park C H. Green tea polyphenols for the protection against renal damage caused by oxidative stress[J]. Evid Based Complement Alternat Med, 2012, 2012 : 845917. |
| [8] | 苏爱, 朱红燕, 徐宏伟, 等. 海兔素对大鼠原代肝细胞酒精性氧化损伤的保护作用[J]. 中国药理学通报, 2016, 32 (2): 251-7. Su A, Zhu H Y, Xu H W, et al. Effects of Aplysin on ethanol-induced oxidative damage in rat primary hepatocytes[J]. Chin Pharmacol Bull, 2016, 32 (2): 251-7. |
| [9] | Iwaki K, Yonetani Y. Hyperuricemic effects of cholinergic agents in rats[J]. Jpn J Pharmacol, 1982, 32 (2): 343-9. doi:10.1254/jjp.32.343 |
| [10] | Doehner W, Landmesser U. Xanthine oxidase and uric acid in cardiovascular disease: clinical impact and therapeutic options[J]. Semin Nephrol, 2011, 31 (5): 433-40. doi:10.1016/j.semnephrol.2011.08.007 |
| [11] | Burns C M, Wortmann R L. Gout therapeutics: new drugs for an old disease[J]. Lancet, 2011, 377 (9760): 165-77. doi:10.1016/S0140-6736(10)60665-4 |
| [12] | Wang X, Wang C P, Hu Q H, et al. The dual actions of Sanmiao wan as a hypouricemic agent: down-regulation of hepatic XOD and renal mURAT1 in hyperuricemic mice[J]. J Ethnopharmacol, 2010, 128 (1): 107-15. doi:10.1016/j.jep.2009.12.035 |
| [13] | Marangella M. Uric acid elimination in the urine. Pathophysiological implications[J]. Contrib Nephrol, 2005, 147 : 132-48. |
| [14] | Ichida K, Matsuo H, Takada T, et al. Decreased extra-renal urate excretion is a common cause of hyperuricemia[J]. Nat Commun, 2012, 3 : 764. doi:10.1038/ncomms1756 |
| [15] | Enomoto A, Kimura H, Chairoungdua A, et al. Molecular identification of a renal urate anion exchanger that regulates blood urate levels[J]. Nature, 2002, 417 (6887): 447-52. |
| [16] | Jutabha P, Kanai Y, Hosoyamada M, et al. Identification of a novel voltage-driven organic anion transporter present at apical membrane of renal proximal tubule[J]. J Biol Chem, 2003, 278 (30): 27930-8. doi:10.1074/jbc.M303210200 |
| [17] | Erdman A R, Mangravite L M, Urban T J, et al. The human organic anion transporter 3(OAT3, SLC22A8): genetic variation and functional genomics[J]. Am J Physiol Renal Physiol, 2006, 290 (4): F905-12. |

