


放射性肺损伤是胸部放疗常见并发症,其包括早期放射性肺炎和和晚期放射性肺纤维化。晚期放射性肺纤维化是胸部放疗最严重的副作用,其通常不可避免而严重影响患者生活质量。尽管一些药物曾用于放射性肺纤维化的治疗,但效果不佳,且有严重不良反应,因此,寻找安全有效的治疗药物已成为目前亟待解决的问题。
甘草酸是甘草根提取物的主要生物活性物质,为三萜皂苷类化合物,具有抗炎、抗病毒、抗过敏、保护肝细胞等多种药理作用。此外,研究表明1、2、3代甘草酸制剂可明显改善内毒素、体外循环、博来霉素等因素诱发的急性肺损伤、肺纤维化[1-3]。异甘草酸镁(magnesium isoglycyrrhizinate,MgIG) 是第4代甘草酸制剂,由甘草酸经过碱催化、异构化后成盐精制而得[4]。Xiao等[5]通过大鼠百草枯肺损伤模型发现MgIG可以改善肺组织MDA、SOD、羟脯氨酸及血清TGF-β1等氧化指标及肺纤维化指标,对肺损伤有一定疗效。而MgIG对放射性肺纤维化是否有改善作用,目前尚无报道。因此,本实验拟研究MgIG对放射性肺纤维化的改善作用,并初步探讨其作用机制。
1 材料与方法 1.1 材料 1.1.1 动物SPF级C57BL/6 ♀小鼠50只(6~8周),体质量18~22 g,购自第三军医大学实验动物中心,合格证号:SGXK (渝)2012-0003。
1.1.2 试剂异甘草酸镁注射液购自江苏正大天晴药业股份有限公司,国药准字H20051942,生产批号150718204。地塞米松磷酸钠注射液购自河南润弘制药股份有限公司,国药准字H41020330,生产批号1602182。TGF-β1、p-Smad2、p-Smad3抗体购自英国Abcam公司。CollagenⅠ抗体购自上海Santa Cruz公司。Collagen Ⅲ抗体购自美国Thermo Fisher公司。
1.1.3 仪器倒置显微镜(日本Nikon公司),石蜡切片机(德国徕卡公司)。
1.2 方法 1.2.1 动物分组与模型制备将小鼠随机分为5组:Control组、RT组、MgIG组、RT+MgIG组、RT+DXM组,每组10只。参照文献[6]的方法造模,辐照前2 h,MgIG组和RT+MgIG组腹腔注射MgIG (100 mg·kg-1);Control组和RT组腹腔注射生理盐水(20 mL·kg-1);RT+DXM组腹腔注射DXM (0.5 mg·kg-1)。除Control组和MgIG组小鼠,其余各组小鼠腹腔注射质量浓度为0.5 g·L-1戊巴比妥溶液(10 mL·kg-1) 麻醉后,背位固定于动物台上,暴露胸部,其余部位以10 cm铅砖屏蔽,15Gy 60Co γ射线全胸单次照射, 建立放射性肺纤维化模型。照射后24 h开始,给药组小鼠每日给药1次,至照射后12周。辐照前20 h各组小鼠均禁食,不禁水,其余时间自由进食和饮水。
1.2.2 小鼠一般状况监测观察小鼠毛色、活动状态、精神状态等变化,并每周定时测量小鼠体质量。
1.2.3 病理组织学观察照射后12周,脱颈处死小鼠,取左肺下叶固定于10%甲醛溶液中,常规脱水、包埋、切片,行HE染色和Masson染色用于评估小鼠肺泡炎和肺纤维化程度。肺泡炎症程度采用Szapiel法进行评分,纤维化程度采用Ashcroft法进行评分。Szapiel评分[7]标准:0分:无肺泡炎;1分:轻度肺泡炎,局部及近胸部可见单核细胞浸润,面积小于全肺20%,肺泡结构大致正常;2分:中度肺泡炎,病变面积占全肺的20%~50%;3分:重度肺纤维化,病变面积大于全肺的50%。Ashcroft评分[8]标准:0分:正常肺组织;1分:肺泡或支气管壁轻微增厚;3分:肺泡或支气管壁中度增厚,但不伴有明显的肺泡结构紊乱;5分:肺泡结构受到破坏,条索状纤维带或小范围纤维灶形成;7分:肺泡结构被严重破坏,广泛的纤维灶形成,蜂窝状肺可归于此级;8分:全视野纤维化病变,2、4、6分介于相应的分数之间。
1.2.4 肺免疫组化检测石蜡组织切片脱蜡至水,高压热修复,双氧水灭活内源性酶,滴加正常山羊血清封闭液,弃血清,滴加一抗,4℃过夜,滴加二抗,显色,自来水冲洗,苏木精复染,脱水、透明、封片。胞质内呈棕黄色颗粒为阳性反应,每张切片随机选5个视野,用Image-Pro Plus6.0图像分析系统进行图像分析,测定积分光密度值。
1.2.5 统计学处理实验数据用x±s表示,采用SPSS 19.0软件进行单因素方差分析。
2 结果 2.1 一般情况Control组和MgIG组小鼠活泼好动,精神好,皮毛光滑,色泽正常,胸部未出现白毛。RT组、RT+MgIG组和RT+DXM组小鼠辐照后均表现出活动减慢,精神萎靡,皮毛无光泽,辐照后2周小鼠活动和精神逐渐恢复。造模后8周左右,小鼠胸部不同程度出现白毛,相较于RT组,RT+MgIG组和RT+DXM组小鼠胸部出现白毛情况明显减轻。见Fig 1。
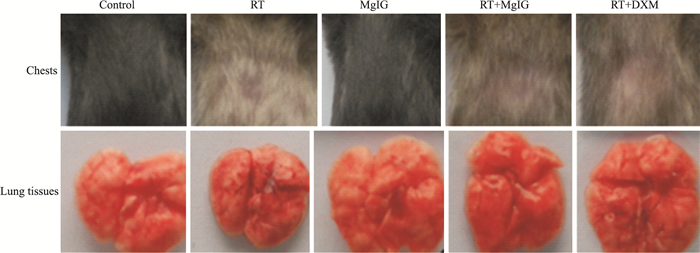
|
| Fig 1 Photographs of chests and lung tissues of mice in each group |
Control组和MgIG组小鼠体质量平稳增加。辐照后1周,RT组、RT+MgIG组和RT+DXM组小鼠体质量下降,RT组小鼠体质量明显小于Control组和RT+MgIG组(P<0.05),明显大于RT+DXM组(P<0.05)。2周以后体质量逐渐回升,RT组和RT+DXM组体质量回升较RT+MgIG组慢,而RT+DXM组体质量回升最慢。辐照后12周,RT组小鼠体质量明显小于Control组和RT+MgIG组(P<0.05),明显大于RT+DXM组(P<0.05)。见Fig 2。
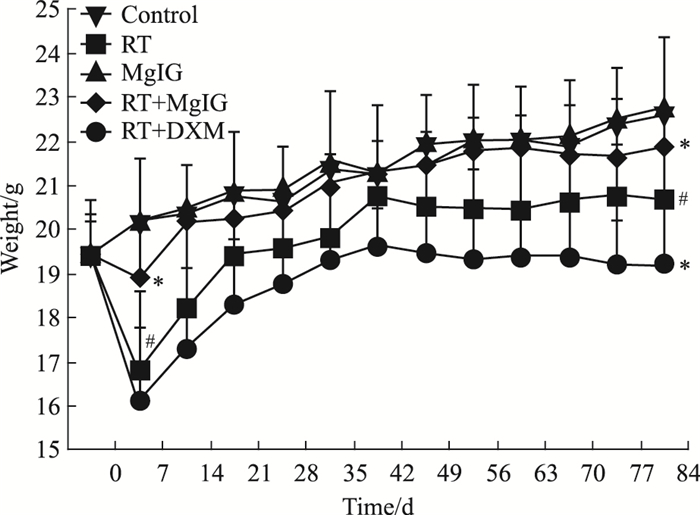
|
| Fig 2 Weight of mice at different time in each group *P < 0.05 vs RT; #P < 0.05 vs control |
Control组和MgIG组小鼠肺脏呈淡粉红色,表面光滑,弹性良好,无充血。RT组小鼠肺脏呈暗红色,充血严重,弹性较差,局部可见白色结节。RT+MgIG组和RT+DXM组情况较RT组有好转,肺脏红润,只见少量出血点。见Fig 1。
2.3.2 肺组织病理学及胶原沉积观察Control组和MgIG组小鼠肺组织未出现明显的病理学变化,肺组织结构完整,肺泡壁及毛细血管壁未见明显增厚,肺泡腔及支气管腔内未见炎性渗出。RT组小鼠肺组织结构破坏严重,肺泡壁增厚,肺泡结构不完整,肺泡塌陷,有大片的肺实变区,纤维化明显,纤维多沉积在气管壁及血管壁周围。RT+MgIG组和RT+DXM组小鼠肺组织病理学改变与RT组一致,但较轻。见Fig 3。Szapiel、Ashcroft评分结果分别显示,与RT组相比,RT+MgIG组和RT+DXM组肺泡炎症减轻(P < 0.05),纤维化程度亦明显降低(P < 0.05)。见Tab 1。
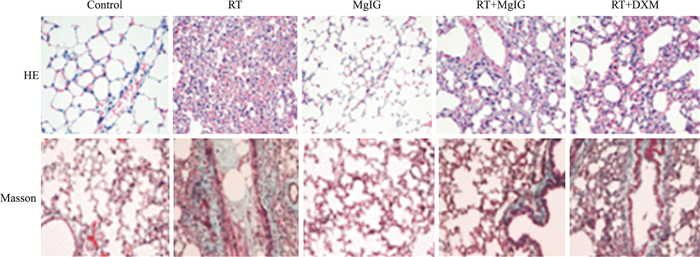
|
| Fig 3 HE staining and Masson staining (×200) |
| Group | Alveolitis | Pulmonary fibrosis |
| Control | 1.30±0.42 | 1.67±0.58 |
| RT | 2.80±0.26# | 6.33±0.58# |
| MgIG | 1.25±0.35 | 1.67±0.58 |
| RT+MgIG | 1.60±0.52* | 3.67±1.53* |
| RT+DXM | 1.65±0.34* | 4.00±1.00* |
| *P < 0.05 vs RT; #P < 0.05 vs control | ||
免疫组化结果显示,Control组和MgIG组仅有少量Collagen Ⅰ、Collagen Ⅲ沉积,而RT组肺组织胶原纤维沉积明显增加(P<0.05),大部分肺泡腔和肺泡间隔被胶原占据,肺泡间隔明显增厚,间质胶原纤维明显增多。RT+MgIG组和RT+DXM组较RT组Collagen Ⅰ、Collagen Ⅲ沉积明显减少(P<0.05)。见Fig 4及Tab 2。
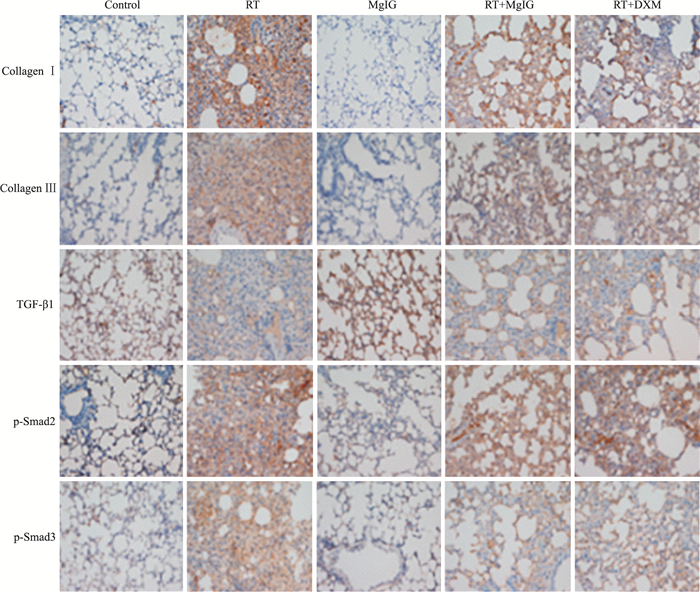
|
| Fig 4 Collagen Ⅰ, collagen Ⅲ, TGF-β1, p-Smad2, p-Smad3 examined by immunohistochemical staining (×200) |
| Group | Collagen Ⅰ | Collagen Ⅲ | TGF-β1 | p-Smad2 | p-Smad3 |
| Control | (3.4±1.1)×104 | (52.8±9.7)×103 | (64.5±3.2)×103 | (3.5±1.2)×104 | (23.8±4.6)×103 |
| RT | (37.1±15.0)×104# | (218.4±5.3)×103# | (341.8±12.6)×103# | (34.1±5.8)×104# | (159.33±25.0)×103# |
| MgIG | (2.9±1.2)×104 | (62.5±13.7)×103 | (66.6±1.9)×103 | (2.6±1.2)×104 | (17.4±2.7)×103 |
| RT+MgIG | (16.2±2.1)×104* | (135.1±12.6)×103* | (107.8±11.0)×103* | (17.9±4.7)×104* | (62.7±5.7)×103* |
| RT+DXM | (16.8±2.4)×104* | (125.1±19.4)×103* | (124.0±15.7)×103* | (14.6±4.1)×104* | (98.7±14.3)×103* |
| *P < 0.05 vs RT; #P < 0.05 vs control | |||||
结果显示,RT组肺组织TGF-β1、p-Smad2和p-Smad3蛋白表达较Control组明显增加(P<0.05),而这些蛋白的表达在RT+MgIG组和RT+DXM组均明显减少(P<0.05)。见Fig 4及Tab 2。
3 讨论放射性肺纤维化发生的机制目前尚不清楚,而建立放射性肺纤维化动物模型对进一步研究其机制及防治作用至关重要。Yue等[9]研究发现,辐照后8周和12周,HE染色显示肺组织肺泡壁增厚,与未辐照的动物肺组织相比,炎细胞、成纤维细胞增多,纤维组织增生,Masson染色显示肺胶原纤维增加。本实验中,我们采用15Gy单次全胸照射,HE和Masson结果显示,辐照后12周,小鼠肺泡炎症明显、胶原蛋白沉积增加,与文献报道一致,提示造模成功。同时本研究观察到,MgIG治疗后,可明显改善上述全身反应及肺组织病变,提示MgIG能明显减轻放射性肺损伤。
肺纤维化主要病理特征为成纤维细胞增生和细胞外基质的过度分泌。肺组织受刺激后,成纤维细胞转化为肌成纤维细胞,肌成纤维细胞合成大量以Ⅰ型和Ⅲ型胶原为主要成分的细胞外基质,肺组织结构破坏,最终形成肺纤维化[10-11]。本实验发现,辐照后小鼠肺组织Ⅰ型、Ⅲ型胶原纤维沉积明显增加,而MgIG治疗后,肺组织Ⅰ型、Ⅲ型胶原沉积明显减少,表明MgIG可缓解放射性肺纤维化,对放射性肺纤维化有明显防护作用。
TGF-β是促进纤维化形成的重要细胞因子,它可通过多条信号通路介导纤维化发生,其中TGF-β/Smad信号通路是最主要的通路。首先,活化的TGF-β与TGF-β Ⅱ型受体相结合,形成异源二聚体复合物,后者与TβRI/ALK5相结合形成四聚体复合物,促使TβRI/ALK5活化,导致Smad2/3磷酸化与Smad4形成复合物,转入细胞核,调控核内一系列靶基因表达,包括细胞增殖、分化及基质蛋白表达[12-17]。已有研究表明[18],氧化苦参碱改善肺纤维化的作用与抑制TGF-β1/Smad信号通路有关。本实验中,RT组小鼠肺组织TGF-β1、p-Smad2、p-Smad3蛋白表达增加,表明TGF-β1/Smad信号通路被激活,而MgIG治疗后,明显抑制小鼠肺组织相应蛋白表达,提示MgIG可能通过抑制TGF-β/Smad信号通路治疗小鼠放射性肺纤维化。
糖皮质激素是治疗放射性肺纤维化的经典药物,故本研究采用地塞米松(DXM) 为阳性对照药,结果提示,DXM的确能较好地改善放射性肺纤维化病变,减少胶原沉积。同时,我们也观察到DXM对小鼠体质量的增长有明显抑制作用,这与以往研究发现一致[19],而MgIG对小鼠体质量增长无明显影响,表明MgIG可改善小鼠放射性肺纤维化,同时可避免DXM抑制动物体质量增长的不良反应。
综上,MgIG可有效改善小鼠放射性肺纤维化,调控TGF-β/Smad信号通路可能是其重要的机制。与阳性药物DXM相比,MgIG没有抑制动物体质量增长的不良反应,值得进一步研究。
| [1] | Qamar W, Khan R, Khan A Q, et al. Alleviation of lung injury by glycyrrhizic acid in benzo (a) pyrene exposed rats: probable role of soluble epoxide hydrolase and thioredoxin reductase[J]. Toxicology, 2012, 291 (3): 25-31. |
| [2] | Wu X, Zhang L, Gurley E, et al. Prevention of free fatty acid-induced hepatic lipotoxicity by 18beta-glycyrrhetinic acid through lysosomal and mitochondrial pathways[J]. Hepatology, 2008, 47 (6): 1905-15. doi:10.1002/hep.v47:6 |
| [3] | 吕小华, 吴铁, 覃冬云. 甘草酸对肺纤维化模型大鼠羟脯氨酸、玻璃酸、层粘连蛋白的干预作用[J]. 中国药房, 2008, 19 (25): 1954-5. Lyu X H, Wu T, Qin D Y. Interventional effect of glycyrrhizin on hydroxyproline, hyaluronic acid, and laminin in pulmonary fibrosis model rats[J]. China Pharm, 2008, 19 (25): 1954-5. |
| [4] | 孙黎, 曹惠明, 沈金芳, 等. 静滴异甘草酸镁注射液的人体药代动力学研究[J]. 中国药理学通报, 2005, 21 (11): 1348-51. Sun L, Cao H M, Shen J F, et al. Study on the pharmacokinetics of magnesium isoglycyrrhizinate injections in Chinese healthy volunteers[J]. Chin Pharmacol Bull, 2005, 21 (11): 1348-51. |
| [5] | Xiao Z W, Zhang W, Ma L, Qiu Z W. Therapeutic effect of magnesium isoglycyrrhizinate in rats on lung injury induced by paraquat poisoning[J]. Eur Rev Med Pharmacol Sci, 2014, 18 (3): 311-20. |
| [6] | Huang Y, Liu W, Liu H, et al. Grape seed pro-anthocyanidins ameliorates radiation-induced lung injury[J]. J Cell Mol Med, 2014, 18 (7): 1267-77. doi:10.1111/jcmm.2014.18.issue-7 |
| [7] | Szapiel S V, Elson N A, Fulmer J D, et al. Bleomycin-induced interstitial pulmonary diseases in the nude, athymic mouse[J]. Am Rev Respir Dis, 1979, 120 (4): 893-9. |
| [8] | Ashcroft T, Simpson J M, Timbrell V. Simple method of estimating severity of pulmonary fibrosis on a numerical scale[J]. J Clin Pathol, 1988, 41 (4): 467-70. doi:10.1136/jcp.41.4.467 |
| [9] | Yue H, Hu K, Liu W, et al. Role of matrix metalloproteinases in radiation-induced lung injury in alveolar epithelial cells of Bama minipigs[J]. Exp Ther Med, 2015, 10 (4): 1437-44. |
| [10] | Katzenstein A L, Myers J L. Idiopathic pulmonary fibrosis:clinical relevance of pathologic classification[J]. Am J Respir Crit Care Med, 1988, 157 (4): 1301-15. |
| [11] | Chung M P, Monick M M, Hamzeh N Y, et al. Role of repeated lung injury and genetic backgound in bleomycin-induced fibrosis[J]. Am J Respir Cell Mol Biol, 2003, 29 (3 pt 1): 375-80. |
| [12] | 梁冠男, 胡永斌, 周建华. 肺纤维化中上皮-间质转型信号转导机制研究进展[J]. 国际病理科学与临床杂志, 2008, 28 (6): 500-3. Liang G N, Hu Y B, Zhou J H. Progression of the signal transduction mechanisms of epithelialmesenchymal transition in pulmonary[J]. Int J Pathol Clin Med, 2008, 28 (6): 500-3. |
| [13] | Gu L, Zhu Y J, Yang X, et al. Effect of TGF-beta/Smad signaling pathway on lung myofibroblast differentiation[J]. Acta Pharmacol Sin, 2007, 28 (3): 382-91. doi:10.1111/aphs.2007.28.issue-3 |
| [14] | Meyer C, Liu Y, Kaul A, et al. Caveolin-1 abrogates TGF-β mediated hepatocyte apoptosis[J]. Cell Death Dis, 2013, 4 (1): e466. doi:10.1038/cddis.2012.204 |
| [15] | Gauldie J, Kolb M, Ask K, et al. Smad3 signaling involved in pulmonary fibrosis and emphysema[J]. Proc Am Thorac Soc, 2006, 3 (8): 696-702. doi:10.1513/pats.200605-125SF |
| [16] | 陈丽丽, 刘学军. TGF-β/Smad信号通路在小鼠肺纤维化发病机制中的作用及对纤维连接蛋白、骨桥蛋白表达的影响[J]. 国际呼吸杂志, 2015, 35 (12): 914-9. Chen L L, Liu X J. Role of TGF-β/Smad signaling pathways in pathogenesis and expressions of fibronection and osteopontin in mice with pulmonary fibrosis[J]. Int J Respir, 2015, 35 (12): 914-9. |
| [17] | Weiss C H, Budinger G R, Mutlu G M, et al. Proteasomal regulation of pulmonary fibrosis[J]. Proc Am Thorac Soc, 2010, 7 (1): 77-83. doi:10.1513/pats.200906-055JS |
| [18] | Liu L, Lu W, Ma Z, Li Z. Oxymatrine attenuates bleomycin-induced pulmonary fibrosis in mice via the inhibition of inducible nitric oxide synthase expression and the TGF-β/Smad signaling pathway[J]. Int J Mol Med, 2012, 29 (5): 815-22. |
| [19] | 陈晓丽, 肖奇明, 刘晶晶, 等. 罗格列酮联合地塞米松上调GR减缓博莱霉素诱导的大鼠肺纤维化[J]. 现代生物医学进展, 2011, 23 (11): 4609-12. Chen X L, Xiao Q M, Liu J J, et al. PPARγ agonist and dexamethasone alleviate the pulmonary fibrosis induced by bleomycin in rats through upregulating glucocorticoid receptors[J]. Prog Mod Biomed, 2011, 23 (11): 4609-12. |

