


动脉粥样硬化(atherosclerosis, AS) 是一种慢性炎症性疾病, 胆固醇在动脉壁的积累促进动脉粥样硬化斑块的形成, 血管壁的增厚与狭窄, 随后导致心脑血管疾病[1], AS作为心血管疾病的重要病理基础, 是世界范围内导致死亡的主要原因[2], 成为人类健康的头号杀手, 给社会带来沉重的经济和医疗负担。随着生活水平的提高和人口老年化的日益严重, AS的发病率越来越高, 其防治也越来越引起了人们的重视。
生物总黄酮是一大类黄酮类天然产物, 广泛存在于植物界, 是许多植物的有效成分, 常见于人们的日常饮食中[3]。近年研究发现, 高黄酮的摄入对AS有较好的预防和治疗作用[4-5]。本文中的复方总黄酮由本实验室自行提制, 主要成分是陈皮、山楂和葛花等, 前期实验已证明其有非常好的抗氧化作用[6]。本文拟通过ApoE基因敲除(ApoE-/-) 小鼠高脂饮食建立AS模型, 探讨复方总黄酮对其的保护作用及其可能的作用机制, 为AS寻求有效的治疗药物。
1 材料与方法 1.1 实验材料 1.1.1 实验动物7周龄♂ C57BL/6J小鼠, 体质量(20±2) g, 由武汉大学动物实验中心提供, 动物许可证号: SCXK (鄂)2014-0004; 7周龄♂ ApoE-/-小鼠, 体质量(20±2) g, 由北京维通利华实验动物技术有限公司提供, 实验动物生产许可证号:SCXK (京)2014-0004, 合格证号: 11401300032681, 适应性喂养(SPF级)1周后开始实验。
1.1.2 高脂饲料、药品、试剂高脂饲料购于北京华阜康生物科技有限公司; 复方总黄酮(主要成分陈皮、山楂和葛花等, 由本实验室自行提炼, 浸膏中总黄酮的含量为870 mg·g-1); 辛伐他汀(东京化成工业株式会社); 甘油三酯(TG) 试剂盒、总胆固醇(TC) 试剂盒、低密度脂蛋白胆固醇(LDL-C) 试剂盒、高密度脂蛋白胆固醇(HDL-C) 试剂盒、总超氧化物歧化酶(SOD) 测定试剂盒, 均购于南京建成生物研究所; 小鼠白介素-1 beta (IL-1β) 酶联免疫吸附测定试剂盒、小鼠核因子κB (NF-κB) 酶联免疫吸附测定试剂盒均购于伊莱瑞特生物科技有限公司。
1.1.3 仪器3-18K高速冷冻离心机(德国Sigma公司), 血糖仪(罗氏), 多功能酶标仪(美国Bio-Tek公司), 电子分析天平(德国Sartorius公司), 光学显微镜(OLYMPUS公司)。
1.2 方法 1.2.1 实验分组及给药方法实验小鼠共分为6组。75只7周龄的♂ ApoE-/-小鼠随机分成5组, 每组15只: 分别为模型组(M组)、辛伐他汀组(S组)、复方总黄酮低、中、高组(FL、FM、FH组), 均高脂饮食。S组每日5 mg·kg-1辛伐他汀灌胃; FL、FM、FH组每日分别给予200、400、800 mg·kg-1复方总黄酮灌胃, M组每日灌胃等体积生理盐水。15只7周龄的C57BL/6小鼠为正常对照组(C组), 普通饮食, 每日灌胃等量生理盐水。连续饲养给药16周, 所有动物均饲养在SPF级动物房。
1.2.2 指标检测 1.2.2.1 体质量监测和血糖检测每周一8点定时称量记录小鼠体质量。在实验第16周剪断小鼠尾巴尖端, 从尾根挤压到尾稍取血, 血糖测定仪检测血糖。
1.2.2.2 生化测定小鼠眼球取血处死, 全血直接取在1.5 mL EP管中, 静置2 h, 3 000 r·min-1, 4℃离心15 min后取上清液, 采用ELISA试剂盒测定IL-1β、NF-κB值。生化试剂盒测定TC、TG、HDL-C、LDL-C、SOD值。
1.2.2.3 病理形态学检查取出胸主动脉, 固定于4%的多聚甲醛中24 h, 常规石蜡包埋切片, HE染色。光镜下观察胸主动脉形态学改变。
1.3 统计学方法所有数据用x±s表示, 采用GraphPad Prism5统计软件进行处理, 多组间比较采用单因素方差分析。
2 结果 2.1 复方总黄酮对小鼠体质量和血糖的影响小鼠体质量均稳步增长, M组小鼠体质量增加幅度最大, 给药组小鼠体质量增长幅度均小于模型组, 但大于C组(Fig 1A)。M组血糖较C组升高, 且差异有显著性(P < 0.01), 给药组较M组均有降低, FM组降低差异有显著性(P < 0.05)(Fig 1B)。

|
| 图 1 Effect of different treatment on body weight (A) and blood glucose (B) in mice **P < 0.01 vs control; #P < 0.05 vs model |
C组胸主动脉平滑肌细胞形态正常, 排列紧密有序。内膜、中膜、外膜均未见泡沫细胞及脂质沉积; M组血管内膜有大片斑块形成, 泡沫细胞堆积、部分破裂, 动脉粥样硬化病灶明显; 各给药组较M组胸主动脉内膜斑块明显变小, FH组小鼠胸主动脉较FL、FM组小鼠胸主动脉病变轻, 血管内壁有少量泡沫细胞聚集, 斑块较小(Fig 2)。

|
| Fig 2 Histopathology of thoracic aortain different groups (HE staining×200) A:Control; B:Model; C:Simvastatin; D:Low compound flavonoids; E:Middle compound flavonoids; F:High compound flavonoids |
M组的TC、TG、LDL-C较C组均明显升高, HDL-C较C组明显降低, 且差异有显著性(P < 0.01); 给药组的TC、TG、LDL-C较M组均明显降低, HDL-C与M组比较明显升高, 且复方总黄酮中剂量、大剂量组与M组相比差异均有显著性(P < 0.05)(Fig 3)。

|
| Fig 3 Effect of different treatment on serum TC, TG, LDL-C, HDL-C in mice (x±s, n=15) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model |
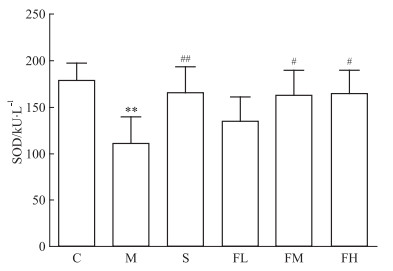
M组的SOD值较C组明显降低, 且差异有显著性(P < 0.01)。给药组的SOD值均有升高, FM、FH组与M组相比差异有显著性(P < 0.05)(Fig 4)。
|
| Fig 4 Effect of different treatmenton serum SOD in mice (x±s, n=15) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model |
M组的IL-1β、NF-κB值较C组均明显升高, 且差异有显著性(P < 0.01), 给药组均有所降低, FM、FH组降低与M组相比差异有显著性(P < 0.05)(Fig 5)。

|
| Fig 5 Effect of different treatment on serumNF-κB, IL-1β in mice (x±s, n=15) **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs model |
AS是胆固醇和脂质积累在血管内壁的一种慢性血管性炎性病变, 其特征是血管内壁有脂质斑块, 管腔内变窄和变硬。AS发病机制非常复杂, 大量研究显示, 异常的脂质代谢和慢性炎症在AS的发生发展中起着重要的作用[7-8]。
他汀类药物是心血管疾病一级预防和二级预防的基石, 但其并不能解决所有的血脂异常相关问题, 且长期使用会导致多种副作用, 如肝损伤、肌肉毒性等[9-10]。因此, 我们在充分重视他汀类药物核心地位的同时, 也在试图寻求新的药物, 植物来源的黄酮类化合物备受关注。已知黄酮类化合物是一类大自然中广泛存在的多分子天然化合物, 为植物体多酚类的代谢物, 已报道了10 000多个结构物[11]。本研究以ApoE-/-♂小鼠高脂饮食复制AS模型, 给予复方总黄酮治疗, 目的在于探究复方总黄酮对AS小鼠的早期干预作用。16周后, 黄酮组斑块明显减小, 血清中血脂和炎症因子水平明显下降, 抗氧化水平明显增强。
一些研究表明, 黄酮类化合物包括淫羊藿苷[12]、山柰酚[13]等能有效降低AS动物模型体内的血脂水平, 在本实验中复方总黄酮也能较好改善血脂代谢异常, 与已知文献一致。IL-1β是致AS的重要炎性细胞因子。实验研究显示, 缺乏IL-1β或IL-1受体的小鼠颈动脉内膜增生减轻; 相反, IL-1受体拮抗剂缺乏的小鼠易发生AS[14]。人IL-1β的单克隆抗体Canakinumab, 能选择性中和IL-1β, 降低IL-6等炎症因子的产生, 抑制炎症反应, 产生抗AS作用[15]。NF-κB是“Rel”家族中一个重要转录因子, NF-κB参与炎症反应中的多种信号通路, 对AS的发生发展过程起着重要作用[16]。在Leyva-Lopez等[17]研究中表明, 黄酮类化合物能调节免疫功能, 减少炎性细胞因子, 如IL-1β、NF-κB, 可治疗炎症相关疾病。超氧化物歧化酶(SOD) 是目前研究最多的一种自由基清除剂, 对机体的氧化和抗氧化平衡起着至关重要的作用, 其活性与血管功能有着密切关系[18]。在我们的研究中, 复方总黄酮组的SOD明显升高, IL-1β、NF-κB明显下降, 说明复方总黄酮较好地提高了机体的抗氧化能力, 其抗炎效应也与已知文献报道相一致。
综上所述, 复方总黄酮可能通过调节血脂紊乱, 抑制炎症反应来减缓小鼠动脉粥样硬化进程, 我们的研究可能为AS的药物治疗提供新思路。
| [1] | Qin L, Zhu N, Ao B X, et al. Caveolae and caveolin-1 integrate reverse cholesterol transport and inflammation in atherosclerosis[J]. Int J Mol Sci, 2016, 17 (3): 429-45. doi:10.3390/ijms17030429 |
| [2] | Witztum J L, Lichtman A H. The influence of innate and adaptive immune responses on atherosclerosis[J]. Annu Rev Pathol Mech, 2014, 9 (1): 73-102. doi:10.1146/annurev-pathol-020712-163936 |
| [3] | Zhang X, Wang G, Gurley E C, et al. Flavonoid apigenin inhibits lipopolysaccharide-induced inflammatory response through multiple mechanisms in macrophages[J]. PLoS One, 2014, 9 (9): e107072. doi:10.1371/journal.pone.0107072 |
| [4] | Choi J S, Choi Y J, Park S H, et al. Flavones mitigate tumor necrosis factor-alpha-induced adhesion molecule upregulation in cultured human endothelial cells: role of nuclear factor-kappa B[J]. J Nutr, 2004, 134 (5): 1013-9. |
| [5] | Choi J S, Choi Y J, Shin S Y, et al. Dietary flavonoids differentially reduce oxidized LDL-induced apoptosis in human endothelial cells: role of MAPK-and JAK/STAT-signaling[J]. J Nutr, 2008, 138 (6): 983-90. |
| [6] | 查文良, 柯志强, 高卉, 等. 复方总黄酮对小鼠慢性酒精性睾丸损伤的作用研究[J]. 中国药理学通报, 2016, 32 (2): 285-8. Zha W L, Ke Z Q, Gao H, et al. Protective effects of compound flavones against chronic alcohol-induced testicular injury in mice[J]. Chin Pharmacol Bull, 2016, 32 (2): 285-8. |
| [7] | Lusis A J. Atherosclerosis[J]. Nature, 2000, 407 (6801): 233-41. doi:10.1038/35025203 |
| [8] | Rader D J, Daugherty A. Translating molecular discoveries into new therapies for atherosclerosis[J]. Nature, 2008, 451 (7181): 904-13. doi:10.1038/nature06796 |
| [9] | Maron D J, Lu G P, Cai N S, et al. Cholesterol-lowering effect of a theaflavin-enriched green tea extract: a randomized controlled trial[J]. Arch Intern Med, 2003, 163 (12): 1448-53. doi:10.1001/archinte.163.12.1448 |
| [10] | Bradford R H, Shear C L, Chremos A N, et al. Expanded clinical evaluation of lovastatin (EXCEL) study results. I. Efficacy in modifying plasma lipoproteins and adverse event profile in 8245 patients with moderate hypercholesterolemia[J]. Arch Intern Med, 1991, 151 (1): 43-9. doi:10.1001/archinte.1991.00400010067008 |
| [11] | Agati G, Azzarello E, Pollastri S, et al. Flavonoids as antioxidants in plants: location and functional significance[J]. Plant Sci, 2012, 196 (3): 67-76. |
| [12] | Zhang Z K, Li J, Yan D X, et al. Icaritin inhibits collagen degradation-related factors and facilitates collagen accumulation in atherosclerotic lesions: a potential action for plaque stabilization[J]. Int J Mol Sci, 2016, 17 (2): 169-84. doi:10.3390/ijms17020169 |
| [13] | Kong L, Luo C, Li X, et al. The anti-inflammatory effect of kaempferol on early atherosclerosis inhigh cholesterol fed rabbits[J]. Lipids Health Dis, 2013, 12 (1): 115-26. doi:10.1186/1476-511X-12-115 |
| [14] | Kirii H, Niwa T, Yamada Y, et al. Lack of interleukin-1beta decreases the severity of atherosclerosis in ApoE-deficient mice[J]. Arterioscler Thromb Vasc Biol, 2003, 23 (4): 656-60. doi:10.1161/01.ATV.0000064374.15232.C3 |
| [15] | Ridker P M, Howard C P, Walter V, et al. Effects of interleukin-1beta inhibition with canakinumab on hemoglobin A1c, lipids, C-reactive protein, interleukin-6, and fibrinogen: a phase IIb randomized, placebo-controlled trial[J]. Circulation, 2012, 126 (23): 2739-48. doi:10.1161/CIRCULATIONAHA.112.122556 |
| [16] | Monaco C, Andreakos E, Kiriakidis S, et al. Canonical pathway of nuclear factor kappa B activation selectively regulates proinflammatory and prothrombotic responses in human atherosclerosis[J]. Proc Natl Acad Sci USA, 2004, 101 (15): 5634-9. doi:10.1073/pnas.0401060101 |
| [17] | Leyva-Lopez N, Gutierrez-Grijalva E P, Ambriz-Perez D L, et al. Flavonoids as cytokine modulators: a possible therapy for inflammation-related diseases[J]. Int J Mol Sci, 2016, 17 (6): 921-36. doi:10.3390/ijms17060921 |
| [18] | Romero M, Jimenez R, Sanchez M, et al. Quercetin inhibits vascular superoxide production induced by endothelin-1: role of NADPH oxidase, uncoupled eNOS and PKC[J]. Atherosclerosis, 2009, 202 (1): 58-67. doi:10.1016/j.atherosclerosis.2008.03.007 |

