


2. 武警后勤学院 学员二旅,天津 300309;
3. 锦州医科大学研究生学院, 辽宁 锦州 121000
2. Undergraduate Dept, LogisticsUniversity of CAPF, Tianjin 300309, China ;
3. Postgraduate College, Medical University of Jinzhou, Jinzhou Liaoning 121000, China
对于肿瘤的化疗,目前临床已经有了很大的突破和进展。但仍存在许多严重技术难题及缺陷:毒副作用大、肿瘤多药耐药等大大阻碍了对肿瘤化疗的进展,其中如何克服肿瘤的多药耐药是影响化疗药物发展的难点。被称为经典耐药机制的由P糖蛋白(P-glycoprotein,P-gp)介导的肿瘤多药耐药是目前研究的一个热点。鬼臼毒素是提取自鬼臼属的盾叶鬼臼等一些近缘植物中的一种木质素天然产物[1]。鬼臼毒素本身就具有较好抗肿瘤活性,鬼臼毒素半合成衍生物如依托泊苷(VP-16)和替尼泊苷(ZM-26)自进入临床就是治疗相关癌症的首选药物[2]。目前由于鬼臼毒素及其现有衍生物(VP-16,VM-26)出现获得性耐药以及胃肠道反应和骨髓抑制等严重阻碍了其治疗应用[3]。因而,开发新型鬼臼毒素衍生物以克服其存在的治疗缺陷尤为重要,本课题组在鬼臼毒素母核的基础上进行结构改造,合成了大量衍生物,经前期筛选得到药效较好的新型鬼臼毒素衍生物LN-13,以依托泊苷(VP-16)为阳性对照药,选取人红白血病细胞的多药耐药细胞株K562/A02为研究对象进行相关探究。
1 材料与方法 1.1 材料LN-13为鬼臼毒素经结构改造后获得的化合物,由武警后勤学院生药学教研室提供,分子量为693.05,白色粉末,纯度大于95%。依托泊苷(Etoposide,VP-16)分子量为588.56(江苏恒瑞医药公司,纯度97%)。
1.2 方法 1.2.1 细胞培养人红白血病细胞K562、多药耐药株K562/A02培养于10% FBS的RPMI 1640培养基中。置37℃、5% CO2、饱和湿度的细胞孵育箱中连续培养。
1.2.2 MTT法测定LN-13对K562及K562/A02细胞的增殖影响[4-5]待K562及K562/A02细胞增殖至对数生长期,吹悬计数后均匀接种于96孔培养板(4 000个细胞/孔),接种培养24 h后实验组、阳性对照组分别加入不同浓度(10-8 mol·L-1~10-5 mol·L-1)的LN-13及VP-16,每个浓度设置5个平行复孔。阴性对照组加等量培养基,48 h后,加入5 g·L-1 MTT溶液继续作用4 h,DMSO充分溶解后,测定490 nm处吸光度值及计算得出IC50值。
1.2.3 Hoechst 33342、PI双染色观察K562/A02细胞形态收集不同浓度LN-13(2、4、8 μmol·L-1)及VP-16(4 μmol·L-1)作用48 h后K562/A02细胞,用PBS洗2次后,离心弃上清,加入终浓度10 mg·L-1的Hoechst 33342染液适量,避光染色10 min,然后加入终浓度10 mg·L-1 PI染液适量,避光染色5 min,离心后弃去染液,涂片后在荧光显微镜下观察照相。
1.2.4 流式细胞术检测K562A/02细胞凋亡率取处于对数生长期的K562A/02细胞,均匀接种于6孔板(每孔不少于3×105个细胞)中,培养24 h后,给药处理:LN-13(2、4、8 μmol·L-1)及VP-16(4 μmol·L-1)作用48 h,小心收集全部细胞,清洗两次后离心弃上清,依次加入FITC标记的Annexin V(终浓度为0.05 mg·L-1)和PI(终浓度为50 ug·mL-1),避光孵育15 min,用流式细胞仪检测分析凋亡情况。
1.2.5 RT-PCR 检测LN-13对Bcl-2、Bax、caspase-3和mdr-1 mRNA转录的影响[5-6]待K562和K562A/02细胞生长至对数生长期,吹悬后均匀接种于6孔板(3×106个细胞/孔)中,置37℃,5% CO2孵箱中培养24 h;给药处理:LN-13(2、4、8 μmol·L-1)及VP-16(4 μmol·L-1)作用K562A/02细胞48 h,收集细胞用TRIzol法提取总RNA,测定RNA纯度并定量进行逆转录,逆转录产物加特异性上、下游引物及相关酶以一定体系进行PCR扩增,用1.5%琼脂糖凝胶进行电泳检测。引物序列如下:
β-actin:Forward: 5'-GTGGGGCGCCCCAGGCACCA-3'
Reverse:5'-CTTCCTTAATGTCACGCACGATTTC-3'
mdr-1:5'-Forward: CCCATCATTGCAATAGCAGG-3'
Reverse:5'-GTTCAAACTTCTGCTCCTCA-3'
Bax:Forward:5'-CGTCCACCAAGAAGCTGAGCG-3'
Reverse:5'-AGCACTCCCGCCACAAAGATG-3'
Bcl-2:Forward:5'-GGTGCCACCTGTGGTCCACCT-3'
Reverse:5'-CTTCACTTGTGGCCCAGATAGG-3'
caspase-3:5'-Forward: GTGGAATTGATGCGTGATG-3'
Reverse: 5'-GGAATCTGTTTCTTTGCATG-3'
1.2.6 Western blot法检测LN-13对P-gp表达的影响[6]待K562和K562A/02细胞生长至对数生长期,吹悬后均匀接种于6孔板(3×106个细胞/孔)中,置37℃,5% CO2孵箱中培养24 h;给药处理:LN-13(2、4、8 μmol·L-1)及VP-16(4 μmol·L-1)作用K562A/02细胞48 h,收集细胞提取蛋白,BCA法定量后进行蛋白上样,采用ECL化学发光显影,Chmidoxr 化学发光成像检测分析。
1.2.7 统计学分析对实验结果分析采用SPSS 21.0进行处理。数据用x±s表示,采用单因素方差分析。
2 结果 2.1 MTT法测定LN-13对K562及K562/A02细胞的生长活性影响MTT结果显示LN-13在10-8~10-5 μmol·L-1的药物浓度范围对K562、K562/A02细胞增殖均有良好的抑制效果,IC50值分别为1.48 μmol·L-1和3.32 μmol·L-1,阳性药物VP-16对K562、K562/A02的IC50值分别为3.45 μmol·L-1和34.7 μmol·L-1,显示LN-13对细胞增殖抑制效果明显优于阳性药物VP-16,并具有明显的抗耐药性,耐药倍值仅有为2.24,明显低于VP-16的10.06倍。见Tab 1。
| Drug | IC50/μmol·L-1 | Drug resistance fold |
|
| K562 | K562A/02 | ||
| LN-13 | 1.48±0.21 | 3.32±0.34 | 2.24 |
| VP-16 | 3.45±0.34 | 34.7±1.21 | 10.06 |
经Hoechst 33342染色后正常及早期凋亡细胞呈强蓝色荧光,PI染色后晚期凋亡及坏死细胞呈红色。双染色结果显示药物作用后细胞明显出现凋亡形态,阴性对照组细胞呈规则圆形,无明显凋亡及坏死细胞,随着LN-13药物浓度的增加,细胞开始出现不规则椭圆形,细胞发生皱缩、破裂,产生凋亡小体,且晚期凋亡及坏死细胞逐渐增加,见Fig 2。
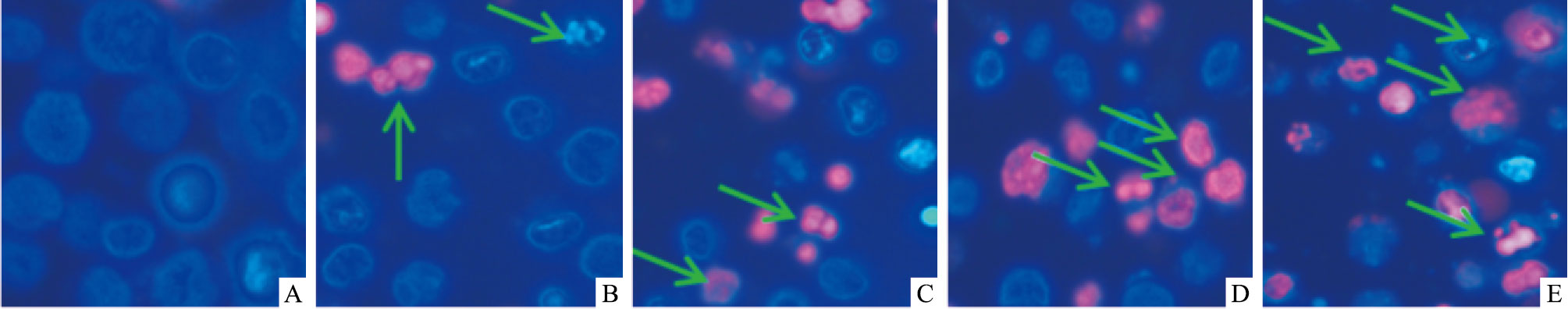
|
| Fig 1 Morphological changes of apoptosis of K562A/02 cell induced by LN-13 observed through Hoechst 33342 and PI staining observation A:Control;B:4 μmol·L-1 VP-16;C:2 μmol·L-1 LN-13;D:4 μmol·L-1 LN-13;E:8 μmol·L-1 LN-13 |
流式细胞术检测结果显示不同浓度的LN-13(2、4、8 μmol·L-1)作用K562/A02细胞48 h后,出现明显的剂量依赖性凋亡趋势,随LN-13剂量增加,细胞凋亡比例(早期凋亡Q2+晚期凋亡Q3)分别为15.0%、48.0%、68.96%,阳性对照药组(4 μmol·L-1)的凋亡比例11.74%。见Fig 2,Tab 2。
| Group | Proportion of apoptosis/% | |||
| Normal Q1 |
Early stage apoptosis Q2 |
Late stage apoptosis Q3 |
Necrotic cell Q4 |
|
| A | 94.1 | 1.80 | 3.15 | 0.91 |
| B | 87.9 | 4.52 | 7.22 | 0.377 |
| C | 78.5 | 7.61 | 7.39 | 6.49 |
| D | 48.9 | 37.2 | 10.8 | 3.15 |
| E | 21.6 | 2.36 | 66.6 | 9.36 |
| A:Control;B:4 μmol·L-1 VP-16;C:2 μmol·L-1 LN-13;D:4 μmol·L-1 LN-13;E:8 μmol·L-1 LN-13 | ||||
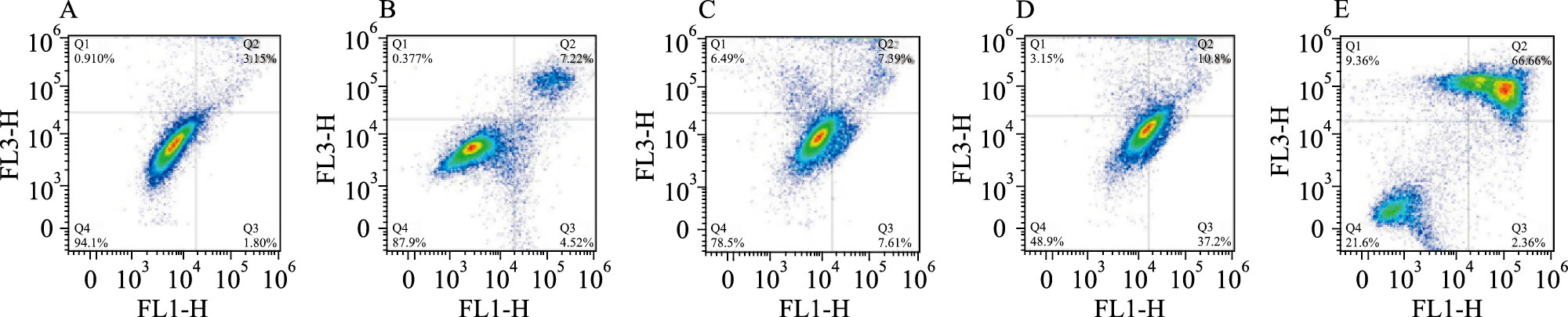
|
| Fig 2 Flow cytometry detected K562A/02 cell apoptosis ratio induced by LN-13 A:Control;B:4 μmol·L-1 VP-16;C:2 μmol·L-1 LN-13;D:4 μmol·L-1 LN-13;E:8 μmol·L-1 LN-13 |
不同浓度的LN-13(2、4、8 μmol·L-1)作用K562/A02细胞48 h,与K562/A02对照组(B)相比,随着LN-13浓度升高,促凋亡相关基因Bax、caspase-3的mRNA表达量逐渐上调,并呈现量效趋势(P<0.05),见Fig 3。而抑制凋亡基因Bcl-2基因的表达未见明显改变。与K562组(A)相比,K562/A02细胞中多药耐药基因mdr1明显上调,随着LN-13剂量增加,mdr1明显被下调。提示LN-13对耐药株K562/A02的抗药性与多药耐药基因mdr1相关。见Tab 3。
| Group | Ratio of IOD | |||
| Mdr-1/β-actin | Bax/β-actin | Bcl-2/β-actin | caspase-3/β-actin | |
| A | 0.45±0.01 | 0.86±0.01 | 0.81±0.02 | 0.41±0.02 |
| B | 0.81±0.05# | 0.51±0.06# | 0.78±0.04 | 0.52±0.04# |
| C | 0.61±0.05* | 0.71±0.02* | 0.77±0.03 | 0.74±0.03* |
| D | 0.73±0.04* | 0.81±0.05* | 0.71±0.05 | 0.71±0.05* |
| E | 0.59±0.02* | 0.91±0.02* | 0.77±0.03 | 0.76±0.03* |
| F | 0.44±0.03* | 0.83±0.02* | 0.73±0.02 | 0.82±0.02* |
| A:K562 control;B:K562A/02 control;C:4 μmol·L-1 VP-16;D:2 μmol·L-1 LN-13;E:4 μmol·L-1 LN-13;F:8 μmol·L-1 LN-13;#P<0.05 vs A:K562 control;*P<0.05 vs B:K562A/02 Control | ||||
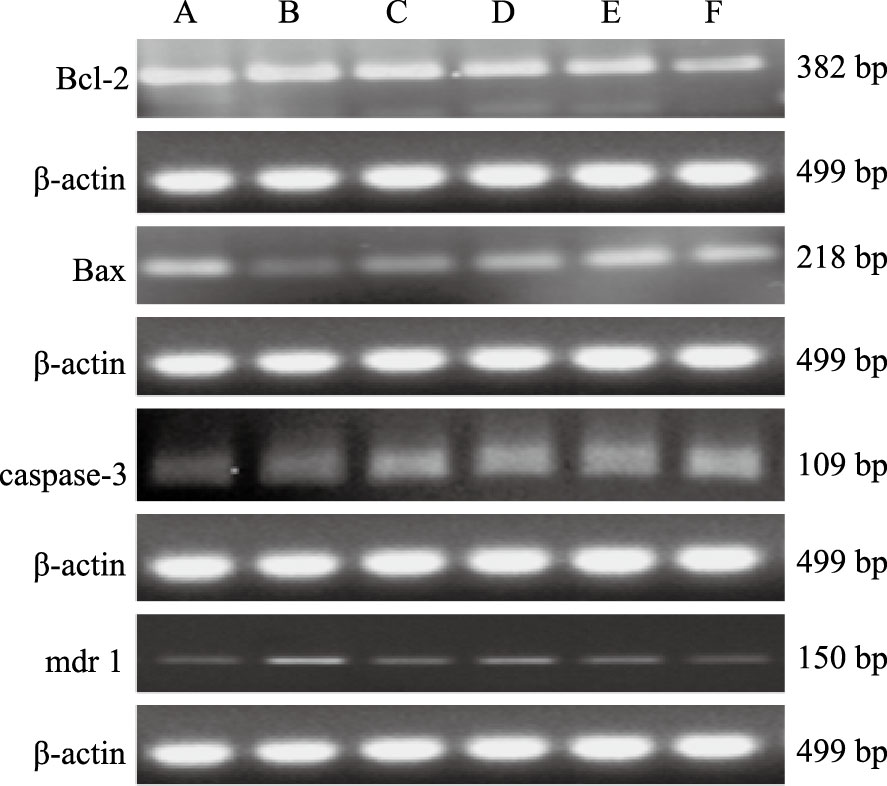
|
| Fig 3 Effect of LN-13 on K562A/02 cell Bcl-2,Bax,caspase-3,Mdr1 mRNA expression A:K562 control; B:K562A/02 control; C:4 μmol·L-1 VP-16;D:2 μmol·L-1 LN-13;E:4 μmol·L-1 LN-13;F:8 μmol·L-1 LN-13 |
与K562细胞组(A)比较,多药耐药K562/A02 细胞中P-gp明显高表达,不同浓度的LN-13(2、4、8 μmol·L-1)作用K562/A02细胞48 h后,与K562/A02对照组(B)相比,随着LN-13浓度升高,P-gp表达量逐渐下调,并呈现量效趋势(P<0.05)。见Fig 4,Tab 4。
| Group | Ratio of IOD(P-gp/β-actin) |
| A | 0.06±0.03 |
| B | 0.67±0.01# |
| C | 0.54±0.01* |
| D | 0.53±0.01* |
| E | 0.44±0.06* |
| F | 0.28±0.01* |
| A:K562 control;B:K562A/02 control;C:4 μmol·L-1 VP-16;D:2 μmol·L-1 LN-13;E:4 μmol·L-1 LN-13;F:8 μmol·L-1 LN-13;#P<0.05 vs A:K562 control;*P<0.05 vs B:K562A/02 control | |
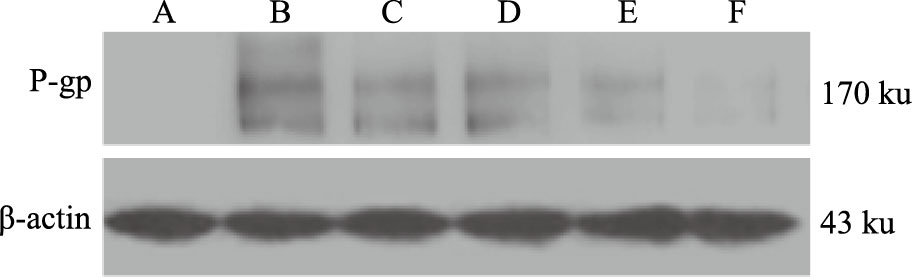
|
| Fig 4 Effect of LN-13 on K562A/02 cell P-gp expression A:K562 control;B:K562A/02 control;C:4 μmol·L-1 VP-16;D:2 μmol·L-1 LN-13;E:4 μmol·L-1 LN-13;F:8 μmol·L-1 LN-13 |
LN-13是本课题组合成筛选出的一种新颖结构,溶解性好、对多种癌细胞有较好抑制效果的新型鬼臼毒素衍生物。本实验结果表明LN-13不仅能对人红白血病细胞K562有较好抑制作用,而且能对阿霉素诱导的多药耐药细胞株K562A/02的增殖产生明显抑制,从药物剂量看明显优于阳性对照药VP-16,Hoechst 33342、PI双染色结果及流式细胞术凋亡检测凋亡结果同时证明:LN-13作用K562A/02细胞后出现明显的增殖抑制及诱导凋亡作用,明显课观察到细胞皱缩凋亡等特征,随着LN-13浓度增加,细胞凋亡比例也呈剂量增加趋势,进一步说明LN-13对K562A/02细胞的抑制效果。
在众多导致多药耐药的机制中,已经明确的重要机制是转运蛋白通过水解ATP获得能量对疏水性药物进行外排,由mdr1基因编码转录继而表达的P-gp是转运蛋白家族的重要代表。当药物穿过胞膜进入细胞,P-gp发挥生理功能,将药物泵出细胞膜外以致胞内药物浓度降低,产生耐药表征。本实验发现LN-13可以明显下调K562A/02中多药耐药基因mdr1及其转录表达产物P-gp,这可能是其能够较好地抑制耐药细胞增殖且优于阳性对照药活性的一个重要因素。Bcl-2和Bax是Bcl-2蛋白家族的一对重要组成蛋白,从功能上讲Bcl-2的活化可抑制细胞凋亡,Bax活化后可促进细胞凋亡,进而导致线粒体释放细胞色素C至细胞质中,产生系列级联活化反应,最终激活凋亡的执行分子caspase-3,启动凋亡程序导致细胞的凋亡[6-9]。本实验对凋亡相关基因Bcl-2、Bax及caspase-3进行了检测,结果表明LN-13作用后K562A/02细胞中促凋亡基因Bax、caspase-3基因明显上调,提示LN-13诱导K562A/02细胞发生凋亡可能是与激活线粒体凋亡通路相关的。
有文献表明P-gp还具有抑制凋亡作用,可使凋亡级联反应发生延迟[10],并能保护耐药细胞免于细胞毒性药物诱导的多种形式的caspase依赖性调亡[11]。本实验证明LN-13不仅降低K562A/02细胞P-gp的表达,而且激活caspase-3的表达,但是本实验对P-gp是否能够延迟caspase级联反应发生的凋亡尚未做深入研究。
综上,LN-13能够明显降低P-gp的表达,同时激活凋亡相关基因,从而有效抑制多药耐药细胞株K562/A02的体外增殖,发挥抗肿瘤作用。
( 致谢: 本实验完成于中国人民武装警察部队后勤学院生药学与药剂学教研室,在此由衷感谢! )
| [1] | Wang L, Yang F, Yang X, et al. Synthesis and biological evaluation of new 4β-anilino-4′-O-demethyl-4-desoxypodophyllotoxin derivatives as potential antitumor agents[J]. Eur J Med Chem, 2011, 46 (1): 285-6. doi:10.1016/j.ejmech.2010.11.016 |
| [2] | Kamal A, Kumar B A, Suresh P, et al. An efficient one-pot synthesis of benzothiazolo-4β-anilino-podophyllotoxin congeners:DNA topoisomeraseII inhibition and anticancer activity[J]. Bioorg Med Chem Lett, 2011, 21 (1): 350-3. doi:10.1016/j.bmcl.2010.11.002 |
| [3] | Miao R, Han Y, An L, et al. Seleno-podophyllotoxin derivatives induce hepatoma SMMC-7721 cell apoptosis through Bax pathway[J]. Cell Biol Int, 2008, 32 (2): 217-23. doi:10.1016/j.cellbi.2007.08.034 |
| [4] | 陈昌明, 刘慧芳, 曹雪姣, 等. 姜黄素对人宫颈癌Hela细胞增殖的抑制作用[J]. 中国药房, 2014, 25 (11) : 1006-8. Chen C M, Liu H F, Cao X J, et al. The inhibitory effect of curcumin on the proliferation of human cervical cancer Hela cells[J]. China Pharmacy, 2014, 25 (11): 1006-8. |
| [5] | 张元, 王火, 牛聪, 等. 多靶点鬼臼毒素新衍生物CCP-1抗肿瘤多药耐药作用机制研究[J]. 中国药理学通报, 2016, 32 (1) : 144-5. Zhang Y, Wang H, Niu C, et al. Anti-MDR tumor activities of CCP-1: a new multi-target podophyllotoxin derivative and its molecular mechanism[J]. Chin Pharmacol Bull, 2016, 32 (1): 144-5. |
| [6] | Shen Z T, Wu X H, Wang L, et al. Effects of gemcitabine on radiosensitization, apoptosis and Bcl-2 and Bax protein expression in human pancreatic cancer xenografts in nude mice[J]. Genet Mol Res, 2015, 14 (4): 15587-96. doi:10.4238/2015.December.1.10 |
| [7] | Zeng J, Yang J, Chen D B, Lao K. The mechanisms by which Bax Induces the apoptosis of human ovarian cancer cells[J]. Sichuan Da Xue Xue Bao Yi Xue Ban, 2015, 46 (5): 697-701. |
| [8] | Chetsawang J, Suwanjang W, Pirompul N, et al. Calpastatin reduces Meth- amphetaine induced induction in c-Jun phosphorylation, Bax and cell death in neuroblastoma SH-SY5Y cells[J]. Neurosci Lett, 2012, 506 (1): 7-11. doi:10.1016/j.neulet.2011.10.021 |
| [9] | Walters J, Pop C, Scott F L, et al. A constitutively active and uninhabitable Caspase-3 zymogen efficiently induces apoptosis[J]. Biochem J, 2009, 424 (3): 335-45. doi:10.1042/BJ20090825 |
| [10] | Breier A, Gibalova L, Seres M, et al. New insight into p-glycoprotein as a drug target[J]. Anticancer Agents Med Chem, 2013, 13 (1): 159-70. doi:10.2174/187152013804487380 |
| [11] | Johnstone R W, Cretney E, Smyth M J. P-glycoprotein protects leukemia cells against caspase-dependent, but not caspase-independent, cell death[J]. Blood, 1999, 93 (3): 1075-85. |

