


2. 安徽人口职业学院基础医学教研室,安徽 池州 247009;
3. 安徽中医药大学中医基础学教研室,安徽 合肥 230038
 ,
ZHU Yuan-mei1,
TAO Shan-jun1,
ZHENG Hao-wen1,
REN You-nan1,
ZHAO Meng-qiu2,
YANG Jie-ren1,
WU Yuan-jie3
,
ZHU Yuan-mei1,
TAO Shan-jun1,
ZHENG Hao-wen1,
REN You-nan1,
ZHAO Meng-qiu2,
YANG Jie-ren1,
WU Yuan-jie3
2. Dept of Basic Medicine, Anhui Vocational Institute of Population, Chizhou Anhui 247009, China ;
3. Dept of Basic Theory of Chinese Medicine, Anhui University of Chinese Medicine, Hefei 230038, China
近年来研究发现,由于存在胰岛素抵抗和胰岛功能缺陷,加之饮食控制不佳、用药不当等原因,糖尿病患者除表现为高血糖外,还常出现明显血糖波动,表现为血糖水平在波峰和波谷之间持续震荡的一种不稳定状态[1]。大量研究表明,血糖波动较持续性高血糖更易诱导胰岛β细胞凋亡,加重胰岛功能障碍,这也是糖尿病胰岛功能进行性减退的主要原因之一[2]。然而,目前临床仍无有效措施完全克服糖尿病患者血糖水平波动。因此,抑制血糖波动所致的胰岛β细胞凋亡,就成为保护胰岛功能、延缓糖尿病发生发展和改善糖尿病预后的有效措施。
丹酚酸B(salvianolic acid B,Sal B)是从唇形科植物丹参中提取的水溶性成分,具有抗氧化、抑制血小板聚集等多种药理活性[3]。近年来研究发现,Sal B可明显改善2型糖尿病糖脂代谢紊乱[4],并可有效改善糖尿病肾病、动脉粥样硬化等多种并发症[3],但对其确切机制至今仍未明确。本研究采用体外培养的大鼠胰岛素瘤细胞(INS-1),观察Sal B对间歇性高糖诱导的INS-1细胞凋亡及胰岛素分泌的影响,并探讨其可能机制,阐明Sal B改善糖尿病作用机制,以为临床用于防治糖尿病提供依据。
1 材料 1.1 药物与试剂INS-1细胞株,上海艾睿生物科技有限公司;Sal B(>98%),南京春秋生物工程有限公司; RPMI 1640培养基、胎牛血清,Hyclone公司;β-actin、p-JNK抗体,Abcam公司;JNK抗体、辣根过氧化物酶标记二抗、蛋白定量试剂盒、活性氧(reactive oxygen species,ROS)检测试剂盒,碧云天生物技术研究所;胰十二指肠同源盒-1(pancreatic and duodenal homeobox-1,PDX-1)抗体,CST公司;细胞凋亡检测试剂盒,上海贝博公司;其余试剂均为分析纯。
1.2 主要仪器高速冷冻离心机(5417 R),德国Eppendorf公司;Thermo Fisher多功能酶标仪,芬兰Thermo有限公司;流式细胞仪,美国BD公司;PowerPac300 型电泳仪、Mini PROTEAN 转膜系统,美国Bio Rad公司;FluorChem FC3 化学发光凝胶成像系统,美国ProteinSimple公司。
2 方法 2.1 细胞培养INS-1细胞在37℃、5% CO2、饱和空气湿度条件下培养于RPMI 1640培养基中(含10%胎牛血清、11.1 mmol·L-1葡萄糖、100 U·mL-1青霉素、100 mg·L-1链霉素、1 mmol·L-1丙酮酸钠、50 μmol·L-1 β-巯基乙醇),待细胞生长至近融合时,0.25%胰酶消化传代,取对数生长期细胞进行以下实验。
2.2 细胞活力检测细胞活力采用MTT法检测。INS-1细胞接种于96孔培养板(1×104/孔),24 h后更换培养液。细胞随机分为对照组(Control)、间歇性高糖组(IHG)、Sal B高(Sal B 10 μmol·L-1)、中(Sal B 1.0 μmol·L-1)、低剂量组(Sal B 0.1 μmol·L-1)。Sal B各组加入相应浓度Sal B预孵24 h。除对照组外,其余各组加入高浓度葡萄糖(33.3 mmol·L-1),孵育12 h,更换为普通浓度葡萄糖(11.1 mmol·L-1),持续12 h,连续3 d。每孔加入MTT溶液(5 g·L-1)20 μL孵育4 h。弃培养液,每孔加入二甲基亚砜150 μL,震荡混匀,570 nm测定吸光度(OD)值。
2.3 胰岛素分泌功能检测INS-1细胞以1×105/孔的密度接种于24孔培养板,细胞分组及处理同2.1项下。弃培养液,PBS洗涤后加入含5.6 mmol·L-1葡萄糖的Hanks液,37℃孵育30 min。弃培养液,分别加入含5.6 mmol·L-1和16.7 mmol·L-1葡萄糖的Hanks液孵育1 h,收集上清液,ELISA法检测胰岛素含量。
2.4 细胞凋亡水平检测INS-1细胞以1×106/孔的密度接种于6孔培养板,细胞分组及处理同2.1项下。弃培养液,0.25%胰酶消化后将细胞收集于离心管中,预冷PBS洗涤2次,每管加入Annexin V结合液400 μL悬浮细胞。在细胞悬液中加入5 μL Annexin V-FITC染色液,混匀,4℃避光孵育15 min,再加入10 μL PI染色液,4℃避光孵育5 min,流式细胞仪检测细胞凋亡水平。
2.5 Western blot检测将INS-1细胞接种于6孔培养板(1×106/孔),细胞分组及处理同2.1项下。收集细胞后RIPA裂解液冰浴裂解细胞,12000 g、4℃离心15 min,收集上清液,BCA法测定蛋白浓度,聚丙烯酰胺凝胶电泳(PAGE)分离蛋白,转膜、封闭后分别加入JNK、p-JNK、PDX-1和β-actin抗体4℃孵育过夜,TBST洗涤后加入辣根过氧化物酶标记的二抗,室温孵育2 h,ECL发光显色,凝胶图像分析系统拍照并分析条带光密度,结果以p-JNK/JNK和PDX-1/β-actin表示。
2.6 细胞内ROS水平测定INS-1细胞以接种于96孔培养板(1×104/孔),细胞分组及处理同2.1项下。弃培养液,PBS洗涤后加入含10 μmol·L-1二氯荧光素二乙酯(dichlorofluorescein diacetate,DCFH-DA)的无血清培养液,37℃孵育20 min。弃培养液,无血清培养液洗涤细胞3次,荧光酶标仪检测各孔荧光强度(激发波长488 nm,发射波长525 nm)。
2.7 统计学处理计量资料以x±s表示,采用SPSS 16.0统计软件进行分析。组间比较应用单因素方差分析和LSD法,以P<0.05为差异有统计学意义。
3 结果 3.1 Sal B对INS-1细胞活力的影响由Fig 1可见,暴露于间歇性高糖72 h后,INS-1细胞活力较对照组明显下降(P<0.01),而与Sal B预孵可明显提高INS-1细胞活力(P<0.05或P<0.01),提示Sal B可有效减轻间歇性高糖诱导的INS-1细胞损伤(Fig 1)。
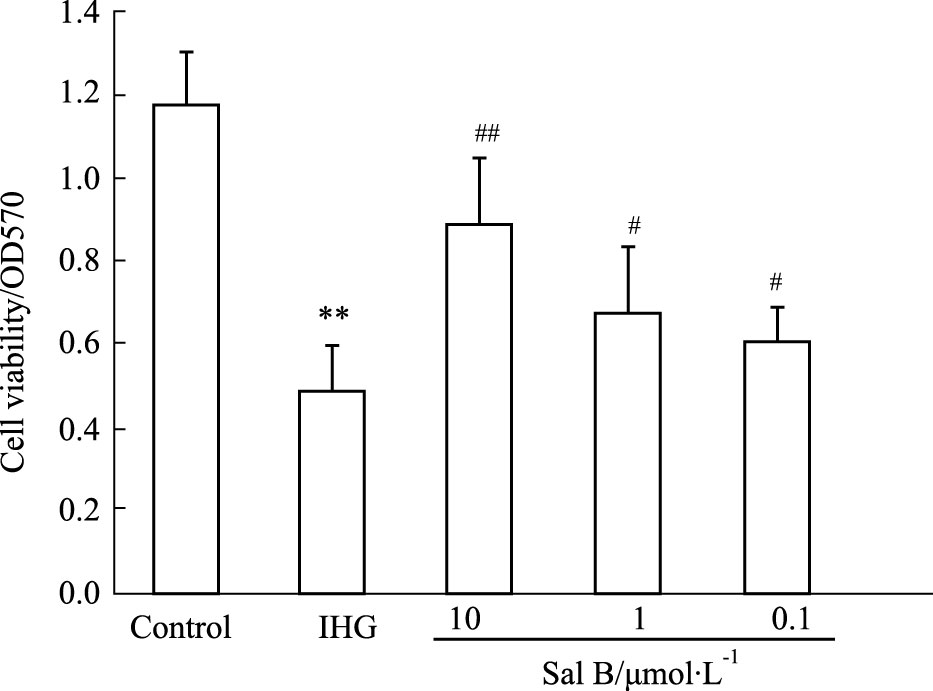
|
| Fig 1 Effect of Sal B on viability of INS-1 cells (x±s,n=8) **P<0.01 vs Control group; #P<0.05,##P<0.01 vs IHG group |
由Fig 2可见,基础状态下INS-1细胞胰岛素分泌水平较低,而在高浓度葡萄糖(16.7 mmol·L-1)刺激下,其胰岛素分泌量明显增加。当暴露于间歇性高糖72 h后,INS-1细胞基础状态和葡萄糖刺激的胰岛素分泌水平均明显下降(P<0.01),提示间歇性高糖损伤了INS-1细胞胰岛素分泌功能;与Sal B预孵可明显提高INS-1细胞基础状态和葡萄糖刺激的胰岛素分泌水平(P<0.05或P<0.01),提示Sal B可有效改善间歇性高糖诱导的INS-1细胞胰岛素分泌功能损伤。
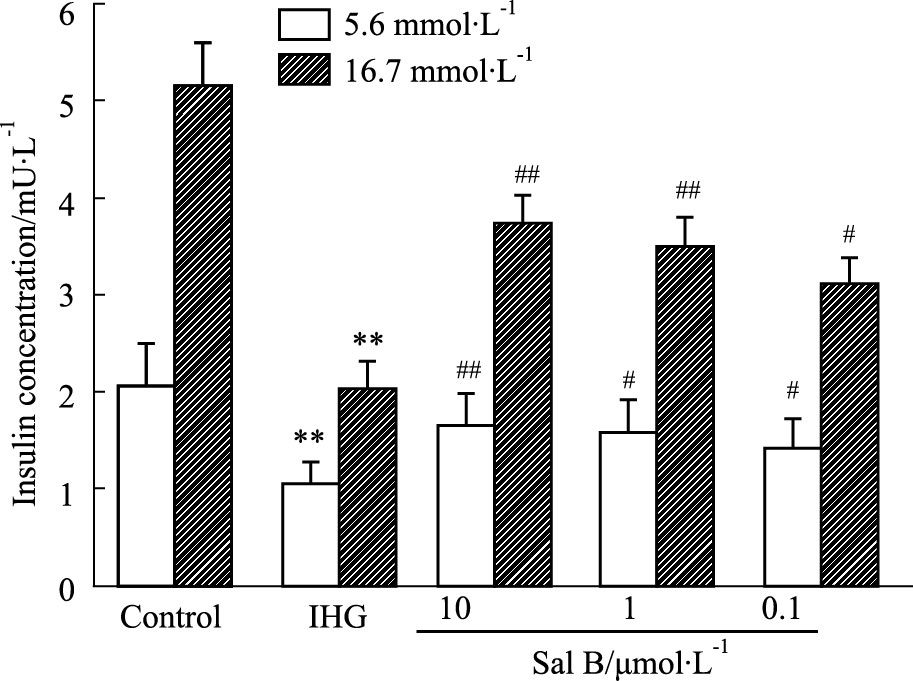
|
| Fig 2 Effect of Sal B on insulin secretion capacity in INS-1 cells (x±s,n=6) **P<0.01 vs Control group; #P<0.05,##P<0.01 vs IHG group |
正常培养条件下,INS-1细胞凋亡水平较低,而给予间歇性高糖刺激72 h后,细胞凋亡率明显升高(P<0.01),表现为凋亡早期和凋亡晚期细胞均明显增加;与Sal B预孵可明显抑制间歇性高糖诱导的INS-1细胞凋亡(P<0.05或P<0.01),这一结果与Sal B增强INS-1细胞活力、促进胰岛素分泌作用一致,提示Sal B减轻间歇性高糖诱导的INS-1细胞损伤、改善胰岛素分泌功能与抑制细胞凋亡有关(Fig 3)。
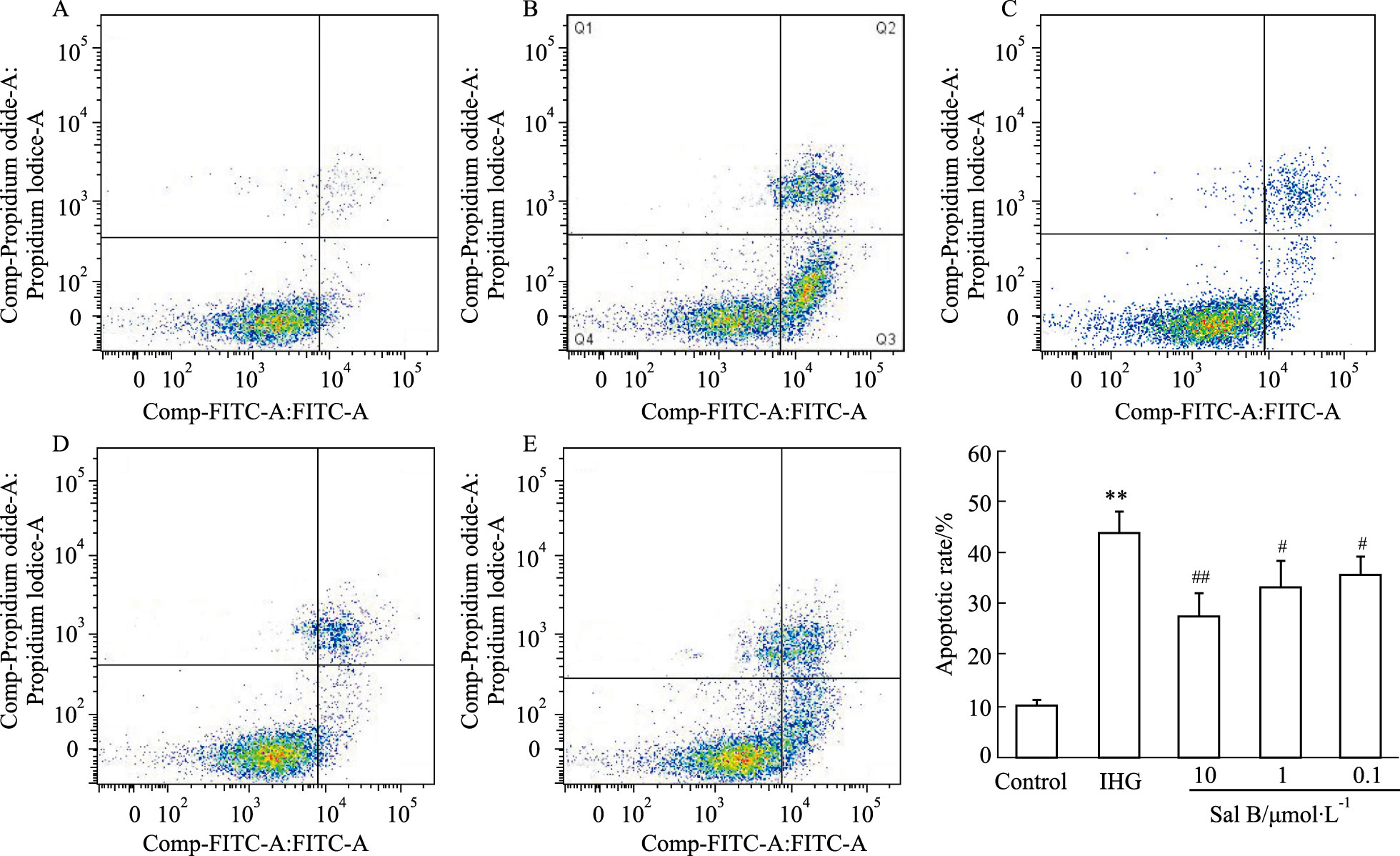
|
| Fig 3 Effect of Sal B on INS-1 cell apoptosis (x±s,n=4) A~E: Representative flow cytometric dot plots. A: Control; B: IHG; C: Sal B (10 μmol·L-1); D: Sal B (1 μmol·L-1); E: Sal B (0.1 μmol·L-1); F: Apoptotic rate of INS-1 cells. **P<0.01 vs Control group; #P<0.05,##P<0.01 vs IHG group |
由Fig 4可见,正常培养条件下,INS-1细胞JNK活化水平较低,而暴露于间歇性高糖72 h后,JNK活化水平明显升高(P<0.01),说明间歇性高糖可明显诱导JNK活化。当INS-1细胞与Sal B预孵后再暴露于间歇性高糖时,JNK活化水平明显下降(P<0.05或P<0.01),这一作用与Sal B抑制INS-1细胞凋亡作用一致,提示Sal B抑制间歇性高糖诱导的INS-1细胞凋亡与抑制JNK活化有关。
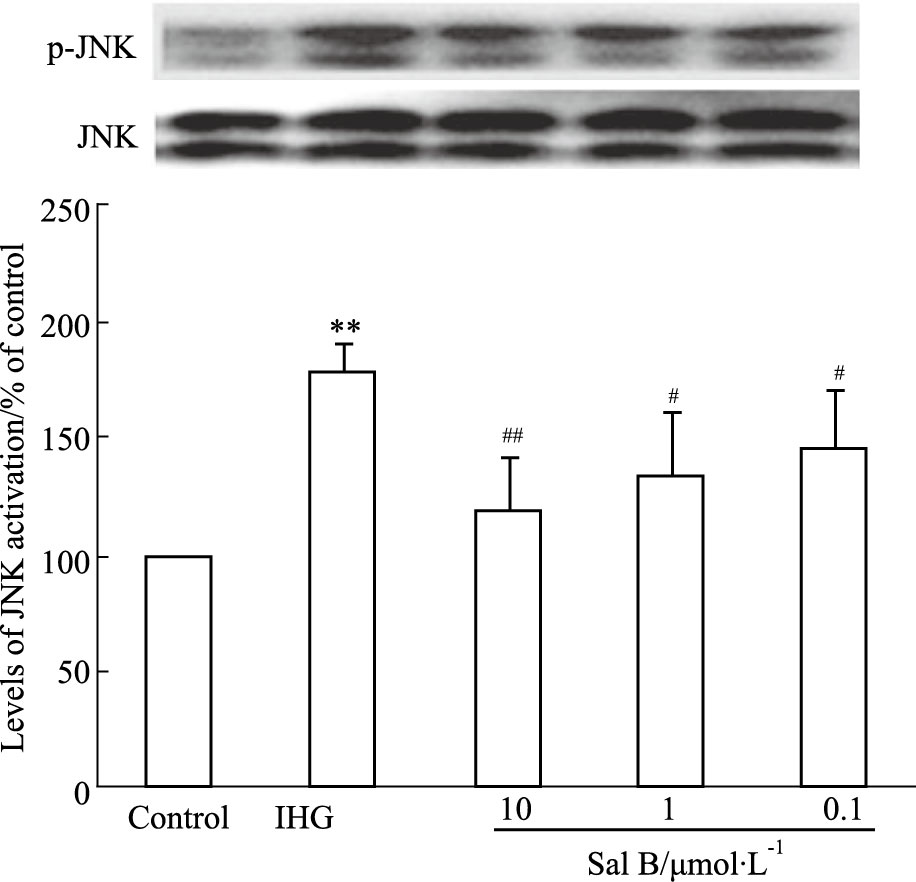
|
| Fig 4 Effect of Sal B on JNK activation in INS-1 cells (x±s,n=4) **P<0.01 vs Control group; #P<0.05,##P<0.01 vs IHG group |
暴露于间歇性高糖72 h后,INS-1细胞PDX-1蛋白表达水平明显下降(P<0.01),而与Sal B预孵可明显提高INS-1细胞PDX-1蛋白水平(P<0.05,P<0.01),这一结果与Sal B抑制INS-1细胞凋亡、增加胰岛素分泌作用一致,提示Sal B减轻间歇性高糖诱导的INS-1细胞损伤与上调PDX-1蛋白表达有关,见Fig 5。
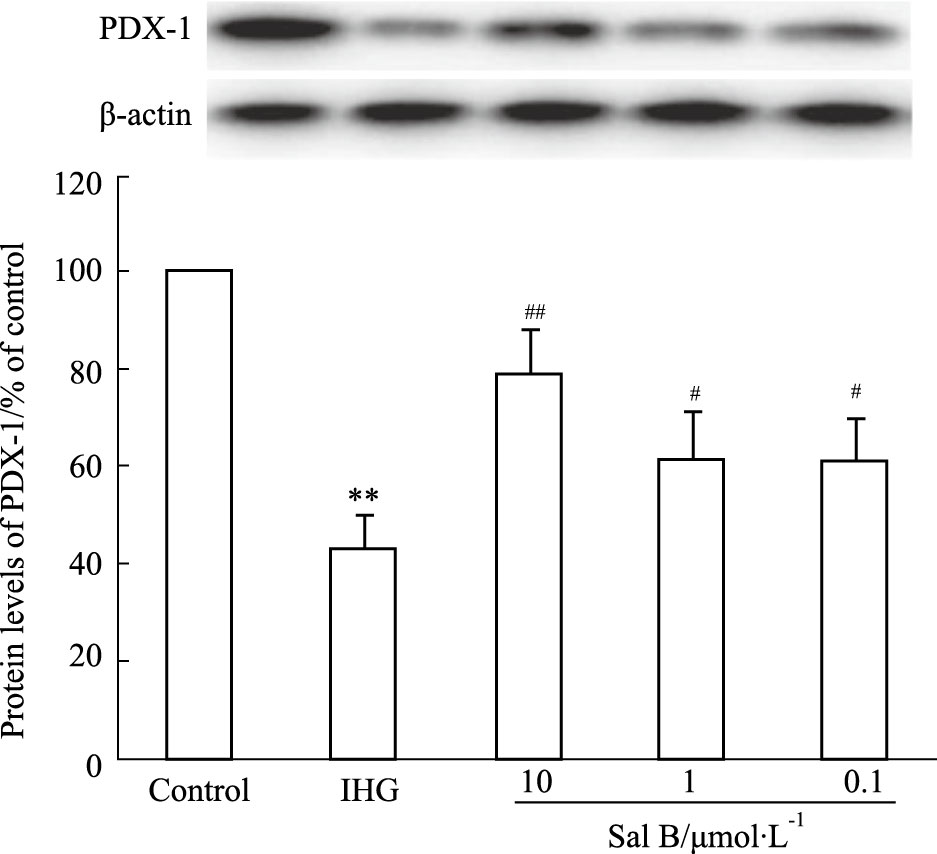
|
| Fig 5 Effect of Sal B on PDX-1 proteinexpression in INS-1 cells (x±s,n=4) **P<0.01 vs Control group; #P<0.05,##P<0.01 vs IHG group |
由Fig 6可见,暴露于间歇性高糖72 h后,INS-1细胞内ROS水平明显升高(P<0.01),而与Sal B预孵后再暴露于间歇性高糖,细胞内ROS水平明显下降(P<0.05或P<0.01)。
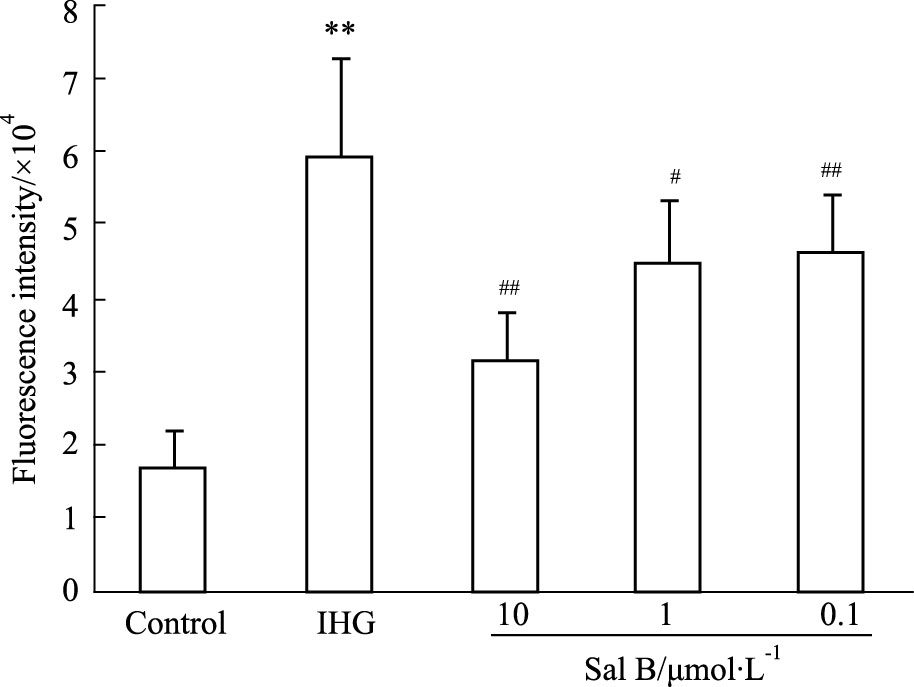
|
| Fig 6 Effect of Sal B on intracellularROS in INS-1 cells (x±s,n=8) **P<0.01 vs Control group; #P<0.05,##P<0.01 vs IHG group |
高血糖是糖尿病最典型的临床特征之一,长期高血糖一方面可引起各种急慢性并发症,另一方面又可诱导胰岛β细胞凋亡,导致胰岛素分泌进一步减少,血糖进一步升高,形成恶性循环。同时,由于胰岛功能减退,葡萄糖刺激的胰岛素分泌能力明显下降,加之广泛存在的胰岛素抵抗,致使餐后血糖水平常明显升高,引起血糖剧烈波动[5]。大量研究表明,血糖波动较持续性高血糖更易诱导胰岛β细胞凋亡,加重胰岛功能障碍,且血糖波动幅度越大,糖尿病预后越差,这也是糖尿病病情进行性加重的主要原因之一[6]。因此,有效抑制血糖波动所致的胰岛β细胞凋亡将是改善糖尿病及其并发症的有效措施之一。本研究结果显示,暴露于间歇性高糖72 h后,INS-1细胞凋亡水平明显升高,细胞活力和胰岛素分泌能力均明显下降,这一结果与文献报道一致[7]。与Sal B预孵可明显抑制间歇性高糖诱导的INS-1细胞凋亡,提高细胞活力和胰岛素分泌能力,提示Sal B可有效抑制间歇性高糖诱导的胰岛β细胞凋亡,改善胰岛功能,这一发现与体内研究结果基本一致[8]。由于本研究采用了更符合糖尿病临床特点的间歇性高糖环境,因此该研究结果可更客观地反映Sal B在体内对胰岛β细胞的保护作用,这为应用Sal B改善糖尿病胰岛功能提供依据。
大量研究表明,高血糖引起胰岛β细胞凋亡的机制与诱导氧化应激有关[9]。高血糖尤其是间歇性高糖可通过多种途径促进ROS产生,并可损伤机体抗氧化酶活性,诱导氧化应激状态[10]。由于胰岛β细胞表达的抗氧化酶水平较低,故其更易受到氧化应激损伤[11]。ROS既可直接损伤细胞生物膜中多不饱和脂肪酸及胞内蛋白质、DNA等生物大分子,诱导细胞凋亡,也可通过激活应激敏感性信号通路,启动细胞凋亡进程[12]。c-Jun氨基末端激酶(JNK)是丝裂原活化蛋白激酶(MAPK)家族成员之一,与多种疾病的发生发展密切相关。ROS可通过直接或间接等多种途径激活JNK信号通路,活化的JNK一方面可促进Fas L、Bim等促凋亡蛋白表达,另一方面可抑制Bcl-2、Bcl-xL等抗凋亡蛋白表达,从而导致线粒体膜通透性增加,细胞色素C等凋亡诱导因子从线粒体释出,启动凋亡进程[13]。体外研究显示,抗氧化剂可有效抑制高血糖诱导的JNK活化和胰岛β细胞凋亡[14],这些发现为应用抗氧化剂改善糖尿病胰岛功能提供了依据。本研究结果显示,暴露于间歇性高糖72 h后,INS-1细胞内ROS和JNK活化水平均明显升高,这一结果与文献报道一致[15]。当INS-1细胞与Sal B预孵后再暴露于间歇性高糖时,细胞内ROS和JNK活化水平均明显低于间歇性高糖对照组,说明Sal B可明显抑制间歇性高糖诱导的ROS产生和JNK活化,这一作用与Sal B抑制INS-1细胞凋亡作用一致,提示Sal B抑制间歇性高糖诱导的INS-1细胞凋亡与改善氧化应激状态、抑制JNK活化有关。本研究从ROS-JNK信号通路初步揭示了Sal B抑制INS-1细胞凋亡的分子机制,这一结果将为进一步探讨Sal B保护糖尿病胰岛β细胞的机制奠定基础。
此外,本研究结果还显示,间歇性高糖可明显抑制胰十二指肠同源盒-1(PDX-1)蛋白表达。作为胰岛β细胞特异表达的转录因子,PDX-1具有抑制β细胞凋亡、促进胰岛素合成及分泌等多种生理作用,是维持胰岛正常功能的重要因素之一[16]。ROS可减少PDX-1 mRNA表达,降低PDX-1与胰岛素启动子结合活性,下调胰岛素基因转录[17]。活化的JNK也可磷酸化PDX-1并使其发生核质易位,抑制胰岛素基因转录,导致胰岛素合成和分泌减少[18]。Sal B可明显提高INS-1细胞PDX-1蛋白水平,提示Sal B抑制INS-1细胞凋亡、改善胰岛素分泌能力,与改善氧化应激状态、增加PDX-1表达有关。
综上所述,本研究采用了更符合糖尿病临床特点的间歇性高糖环境,从ROS介导JNK活化信号通路揭示了Sal B对INS-1细胞凋亡的抑制作用及其分子机制。该研究为进一步阐明Sal B改善糖尿病胰岛细胞功能的机制奠定基础,并将为临床应用于改善糖尿病胰岛功能提供依据。
( 致谢: 本实验在皖南医学院药理学教研室中药药理三级实验室完成,在此表示感谢。 )
| [1] | 劳美玲, 郎江明, 魏爱生, 等. 血糖控制不佳的2型糖尿病患者动态血糖波动的观察[J]. 中国糖尿病杂志, 2013, 21 (3) : 256-9. Lao M L, Lang J M, Wei A S, et al. Observation on dynamic glycemic excursion of the T2DM patients with poor glucose control[J]. Chin J Diabetes, 2013, 21 (3): 256-9. |
| [2] | Kim M, Chung H, Yoon C, et al. Increase of INS-1 cell apoptosis under glucose fluctuation and the involvement of FOXO-SIRT pathway[J]. Diabetes Res Clin Pract, 2012, 98 (1): 132-9. doi:10.1016/j.diabres.2012.04.013 |
| [3] | 林超, 刘兆国, 钱星, 等. Sal B在心血管疾病中药理作用研究进展[J]. 中国药理学通报, 2015, 31 (4) : 449-52. Lin C, Liu Z G, Qian X, et al. Research progress of salvianolic acid B in cardiovascular diseases[J]. Chin Pharmacol Bull, 2015, 31 (4): 449-52. |
| [4] | 周才杰, 黄鸣清, 陈长青, 等. Sal B改善2型糖尿病大鼠糖脂代谢及胰岛素抵抗的实验研究[J]. 中国实验方剂学杂志, 2012, 18 (13) : 233-7. Zhou C J, Huang M Q, Chen C Q, et al. Salvianolic acid B improves glucose and lipid metabolism and insulin resistance in rat models with type 2 diabetes[J]. Chin J Exp Tradit Med Form, 2012, 18 (13): 233-7. |
| [5] | Kramer C K, Haysook C, Zinman B, Retnakaran R. Glycemic variability in patients with early type 2 diabetes: the impact of improvement in β-cell function[J]. Diabetes Care, 2014, 37 (4): 1116-23. doi:10.2337/dc13-2591 |
| [6] | Kohnert K D, Freyse E J, Salzsieder E. Glycaemic variability and pancreatic β-cell dysfunction[J]. Curr Diabetes Rev, 2012, 8 (5): 345-54. doi:10.2174/157339912802083513 |
| [7] | 郑书国, 赵梦秋, 吴元洁, 等. 丹蛭降糖胶囊对波动高糖诱导的INS-1细胞凋亡和胰岛素分泌的影响[J]. 中成药, 2015, 37 (5) : 345-54. Zheng S G, Zhao M Q, Wu Y J, et al. Effect of Danzhi Jiangtang Capsules on insulin secretion capacity and apoptosis of INS-1 cell exposed to intermittent high glucose[J]. Chin Tradit Pat Med, 2015, 37 (5): 345-54. |
| [8] | 陶善珺, 任尤楠, 赵梦秋, 等. Sal B对糖尿病血糖波动模型大鼠胰岛细胞的保护作用[J]. 中草药, 2016, 47 (9) : 3058-63. Tao S J, Ren Y N, Zhao M Q, et al. Protective effect of salvianolic acid B on pancreatic islet cells in diabetic rats with fluctuating blood glucose[J]. Chin Tradit Herbal Drugs, 2016, 47 (9): 3058-63. |
| [9] | Park M H, Heo S J, Kim K N, et al. 6,6'-Bieckol protects insulinoma cells against high glucose-induced glucotoxicity by reducingoxidative stress and apoptosis[J]. Fitoterapia, 2015, 106 : 135-40. doi:10.1016/j.fitote.2015.08.014 |
| [10] | 王景尚, 殷惠军, 黄烨, 等. 盐酸二甲双胍对2型糖尿病大鼠波动性高血糖状态下血管内皮功能的影响[J]. 中国药理学通报, 2011, 27 (5) : 686-90. Wang J S, Yin H J, Huang Y, et al. Effects of metformin hydrochloride on the endothelial function of type 2 diabetes mellitus rats with high blood glucose fluctuation[J]. Chin Pharmacol Bull, 2011, 27 (5): 686-90. |
| [11] | Lightfoot Y L, Chen J, Mathews G E. Oxidative stress and beta cell dysfunction[J]. Methods Mol Biol, 2012, 900 : 347-62. doi:10.1007/978-1-60761-720-4 |
| [12] | Circu M L, Aw T Y. Reactive oxygen species, cellular redox systems, and apoptosis[J]. Free Radic Biol Med, 2010, 48 (6): 749-62. doi:10.1016/j.freeradbiomed.2009.12.022 |
| [13] | Sinha K, Das J, Pal P B, Sil P C. Oxidative stress: the mitochondria-dependent and mitochondria-independent pathways of apoptosis[J]. Arch Toxicol, 2013, 87 (7): 1157-80. doi:10.1007/s00204-013-1034-4 |
| [14] | Lee B W, Kwon S J, Chae H Y, et al. Dose-related cytoprotective effect of alpha-lipoic acid on hydrogen peroxide-induced oxidative stress to pancreatic beta cells[J]. Free Radic Res, 2009, 43 (1): 68-77. doi:10.1080/10715760802590400 |
| [15] | 钟宇华, 梁华晟. 氯沙坦抑制高糖及间歇性高糖诱导INS-1细胞内质网应激作用[J]. 中国糖尿病杂志, 2012, 20 (2) : 144-8. Zhong Y H, Liang H S. The inhibitive effect of losartan on endoplasmic reticulum stress in INS-1 induced by high glucose and fluctuating high glucose[J]. Chin J Diabetes, 2012, 20 (2): 144-8. |
| [16] | Pedica F, Bedron S, Pedron S, et al. PDX-1 (pancreatic/duodenal homeobox-1 protein 1)[J]. Pathologica, 2014, 106 (4): 315-21. |
| [17] | Ryu G R, Yoo J M, Lee E, et al. Decreased expression and induced nucleocytoplasmic translocation of pancreatic and duodenal homeobox 1 in INS-1 cells exposed to high glucose and palmitate[J]. Diabetes Metab J, 2011, 35 (1): 65-71. doi:10.4093/dmj.2011.35.1.65 |
| [18] | Kawamori D, Kajimoto Y, Kaneto H, et al. Oxidative stress induces nucleo-cytoplasmic translocation of pancreatic transcription factor PDX-1 through activation of c-Jun NH2-terminal kinase[J]. Diabetes, 2003, 52 (12): 2896-904. doi:10.2337/diabetes.52.12.2896 |