


2. 重庆市公安局物证鉴定中心,重庆 400021
2. Institute of Forensic Science, Criminal Police Crops of Chongqing Public Security Bureau, Chongqing 400021, China
尖吻蝮蛇(Deinagkistrodon acutus),又俗称五步蛇,是我国独有的蛇种,其每年咬伤率在我国十大毒蛇中是较高的。其毒液主要由功能多样化的各种多肽或蛋白质(包括磷脂酶A2、5'-核苷酸酶、透明质酸酶、金属蛋白水解酶、丝氨酸蛋白水解酶等) 构成,并主要作用于血液系统,致使患者发病,或因抢救不及时或不当而致残甚至死亡,故其毒液属于典型的血液毒素[1-3]。
目前,虽然抗蛇毒血清是治疗毒蛇咬伤的首选有效药物,但是,它存在诸多不足,包括临床使用中出现的副作用(过敏性休克、致热反应及血清病等),以及其生产周期长、纯化成本高与价格昂贵、不易保存等缺点[4]。为此,寻找价格便宜、方便使用、保存容易及安全性好的治疗蛇伤的药物是非常必要而迫切的。
已有研究表明,用各种抗原(如致病原)免疫鸡产生的卵黄抗体(即IgY)具有很高的效价,而且拥有毒副作用低、生产成本低、使用方便等优势[4-5]。近年来,国内外开展了用蛇毒(包括响尾蛇、圆斑蝰、眼镜蛇、眼镜王蛇、锯鳞蝰、银环蛇、珊瑚蛇)免疫鸡的实验研究,并从其蛋黄制备出效价高的IgY[6-8],但是,至今这些IgY还未在临床上使用。我们已经首次用我国特有的尖吻蝮蛇毒来免疫鸡,从其卵黄中制备和分离纯化得到了抗尖吻蝮蛇毒的抗体IgY。本研究就该IgY对尖吻蝮蛇毒中的主要活性成分的中和作用进行实验研究与评估,为下一步开发IgY成为抗蛇毒药物提供理论依据。
1 材料与方法 1.1 主要仪器与设备Infinite ®200Pro多功能酶标仪(Tecan);恒温水浴锅(上海跃进医疗器械有限公司);TG16-W微量高速离心机(长沙湘仪离心机仪器有限公司);DHG-9023A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);冰箱(SIEMENS);电磁炉(SUPOR)。
1.2 主要材料与试剂抗尖吻蝮蛇毒IgY(本实验室自备);尖吻蝮蛇毒(本实验室保存);18 g~20 g健康的昆明种♀鼠(第三军医大学动物实验中心);未免鸡蛋;5'-核苷酸酶活性测定试剂盒(南京建成生物工程研究所);透明质酸钠(上海伊卡生物);十六烷基三甲基溴化铵(CTAB,厦门市先端科技);牛血纤维蛋白原(瑞楚生物);琼脂糖(Invitrogen);三氯乙酸(成都科龙化工);盐酸(重庆川东化工);Folin试剂(北京鼎国昌盛技术责任有限公司);乙醚(扬州三和化工);醋酸(成都科龙化工);Tris(genview);酪蛋白(北京奥博星生物技术责任有限公司);NaOH(北京红星化工);醋酸钠、CaCl2(重庆博艺化学试剂)。
1.3 方法 1.3.1 IgY中和蛇毒PLA2活性实验蛇毒PLA2活性测定按照Habermann等琼脂糖平板法进行[9]。在平板每孔中分别加入相同体积(10 μL)不同浓度的蛇毒(0.5、0.25、0.125、0.062 5、0.031 3、0.015 7 g·L-1),37 ℃孵育24 h后,测量透明圈直径。以生理盐水为阴性对照组。实验重复3次,选取直径11 cm的透明圈所作对应的蛇毒浓度作为IgY中和实验的蛇毒基础浓度。分别将不同浓度的抗尖吻蝮蛇毒 IgY (0、0.25、0.35、0.45、0.55、0.65、0.75、0.85、0.95 g·L-1)与以上所选蛇毒浓度混合(总体积10 μL)。37 ℃下水浴 45 min ,再离心5 min(1 737×g),取上清液加入平板孔中,37 ℃孵育24 h后,测量透明圈直径。以生理盐水为阴性对照组。实验重复3次。
1.3.2 IgY中和蛇毒5'-核苷酸酶活性按照厂家试剂盒说明书测定不同浓度(0、0.01 、0.05、0.1、0.15、0.2、0.3、0.4 g·L-1)的尖吻蝮蛇毒中的5'-核苷酸酶活性,选取其中酶活力最强的蛇毒浓度作为IgY中和能力测定的蛇毒基础浓度,再将其与不同浓度(0、0.05、0.1、0.2、0.4、0.6、0.8、1、1.5、3 g·L-1) 的IgY混和孵育(37 ℃)45 min,再离心5 min(1 737×g),取上清液进行5'-核苷酸酶活性测定。实验重复3次。
1.3.3 IgY中和蛇毒透明质酸酶活性按照Singer等[10-11]方法进行。在平板每孔中分别加入等体积(10 μL)不同浓度(0、0.5、1、2、3、4、6、8、10 g·L-1)的蛇毒,37 ℃孵育12 h后,再加入0.75%的CTAB溶液,反应1 h后,倒掉CTAB溶液。再将平板孵育12 h(4 ℃),测透明圈直径。用生理盐水为阴性对照组。实验重复3次,选取直径11 cm的透明圈所对应的蛇毒浓度作为IgY中和实验的蛇毒基础浓度。分别将不同浓度的(0、5、10、15、30、45、60、75、90、105 g·L-1)IgY与所选浓度的蛇毒混合(总体积10 μL),37 ℃水浴45 min,再离心5 min(1 737×g)。取上清液再进行透明质酸酶酶活性实验。以生理盐水为阴性对照组。实验重复3次。
1.3.4 IgY中和蛇毒蛋白水解酶活性实验按照Molander 等[12]方法进行。将等体积(10 μL)不同浓度(0、0.1、0.5、1、2、4、6 g·L-1)的尖吻蝮蛇毒溶液分别与30 μL 1.0%的酪蛋白溶液混合,37 ℃水浴40 min后,分别加入90 μL 0.44 mol·L-1 三氯乙酸,终止反应,再离心5 min(1 737×g),取50 μL上清液至96孔板中。再加入50 μL以1 ∶4稀释的Folin试剂及250 μL 0.4 mol·L-1碳酸钠溶液,混匀。溶液变蓝,室温放置20 min后,双蒸水调零,于630 nm读取吸光值。选取较高吸光度所对应的尖吻蝮蛇毒剂量作为IgY中和实验的蛇毒基础用量。分别将不同量的IgY (0、37.5、75、150、225、250) g·L-1与该蛇毒混合,37 ℃水浴45 min后,再离心5 min(1 737×g),取30 μL上清液进行蛋白水解酶活性测定。实验重复3次。
1.3.5 IgY中和蛇毒纤维蛋白水解活性按照Astrup等[13]纤维蛋白平板法进行 。在平板每孔中分别加入等体积(15 μL)不同浓度(1.33、2.66、4.00、5.33、6.66 g·L-1)的蛇毒,37 ℃孵育12 h后,测量透明圈环直径。以生理盐水为阴性对照组。选取能产生直径为11 cm的透明圈所对应的蛇毒量作为IgY中和实验的蛇毒基础用量。分别将15 μL不同浓度(0、60、80、100、120、140 g·L-1)的IgY与该蛇毒基础用量混合,37 ℃水浴45 min后,再离心5 min(1 737×g),取上清液进行纤维蛋白水解活性测定。以生理盐水为阴性对照组。实验重复3次。
1.3.6 IgY中和蛇毒保护性实验按照Paul等[14]所述法,取健康的昆明♀鼠( 18~20 g),随机分成7组,每组10只。100 μL不同浓度的IgY(0、2、4、8、16、32、64 g·L-1)与一定剂量(3×LD50,LD50=0.00 293 mg·g-1)的尖吻蝮蛇毒混合,37 ℃下水浴45 min后,再离心5 min(1 737×g),取上清液进行腹腔注射,24 h后记录小鼠存活情况。
1.3.7 统计分析实验结果(计量资料)均为3次重复实验的平均值,进行线性回归。
2 结果 2.1 IgY对蛇毒PLA2活性的中和作用不同量的尖吻蝮蛇毒的PLA2 活性与透明圈面积呈线性关系,其回归方程为$\hat{Y}$=4.711X+0.135 6,r2=0.995,并计算直径11 mm的透明圈所对应的蛇毒浓度是0.173 g·L-1(即是IgY中和PLA2 活性时所用的蛇毒基础浓度)。中和实验表明,随着IgY浓度的增加,蛇毒PLA2降解卵磷脂后所形成的透明圈的直径越来越小(Fig 1)。透明圈面积对IgY浓度进行线性回归:$\hat{Y}$=-1.087X+1.041 9,计算出抗尖吻蝮蛇毒IgY的ED50为4.568 μg。
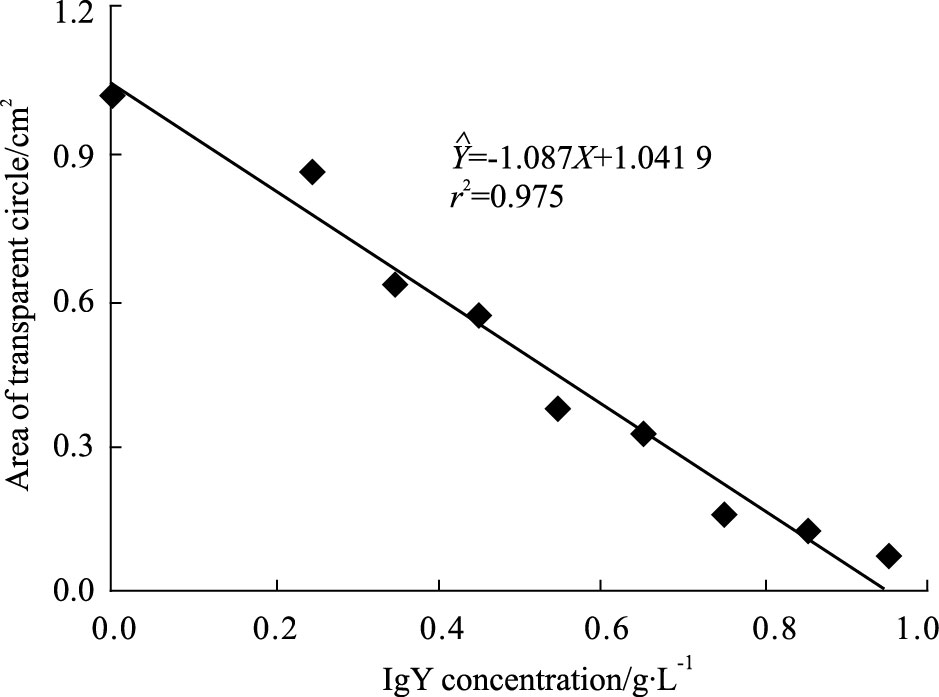
|
| Fig 1 Neutralization of anti-D. acutus venom IgY against activity of PLA2 in snake venom As demonstrated by the high r2 value,IgY dose-dependently decreases the area of transparent circle cased by PLA2 hydrolyzing the substrate |
蛇毒浓度在0~0.2 g·L-1范围内,其5'-核苷酸酶活力与蛇毒浓度呈线性关系,其回归方程为$\hat{Y}$=4 549.7X+31.731,r2=0.979 6;当蛇毒浓度超过0.2 g·L-1,线性相关性减弱。选取0.1 g·L-1作为IgY中和5'-核苷酸酶活性的蛇毒基础浓度。中和实验表明,随着IgY浓度的增加,尖吻蝮蛇毒的5'-核苷酸酶酶活力随之减小,当IgY浓度达3.0 g·L-1,尖吻蝮蛇毒5'-核苷酸酶活力几乎能被完全中和(Fig 2)。
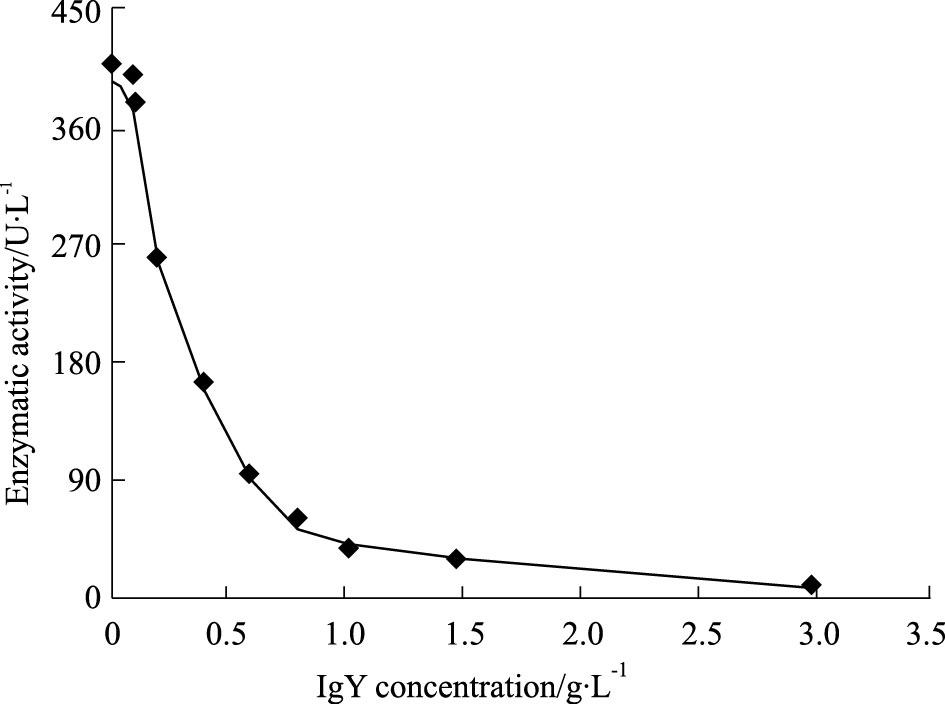
|
| Fig 2 Neutralization of anti-D. acutus venom IgY against 5'-nucleotidase activity in snake venom The activity of 5' nucleotidase among D. acutus vemon decreased with the increase of specific IgY dose . It almost completely neutralized the activity of 5' nucleotidase when Specific IgY up to 300 μg. |
蛇毒浓度在0~4 g·L-1范围内,其透明质酸酶活性与蛇毒量呈线性关系,其回归方程为=0. 444X+0.206,r2=0.970 9,并计算直径11 mm的透明圈所对应的蛇毒浓度是1.675 g·L-1(即是IgY中和透明质酸酶活性时所用的蛇毒基础浓度)。中和实验表明,随着IgY浓度的增加,蛇毒透明质酸酶降解底物形成的透明圈面积随之减小(Fig 3)。透明圈面积对IgY浓度线性回归:=-0.014X+0.857 2,计算出抗尖吻蝮蛇毒IgY的ED50为27.657 g·L-1。
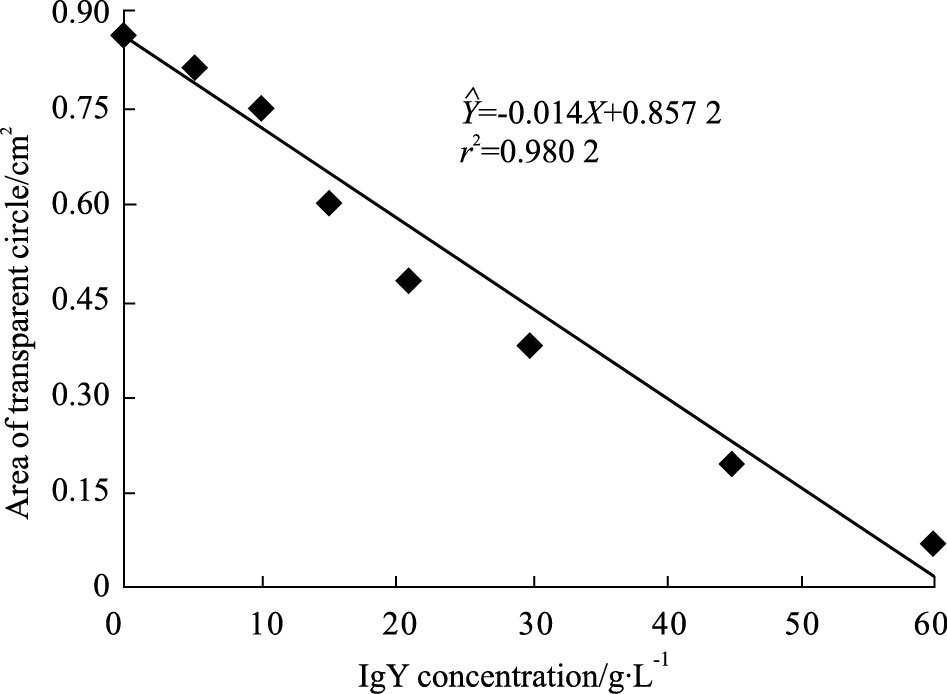
|
| Fig 3 Neutralization of anti-D. acutus venom IgY against hyaluronidase in snake venom IgY dose-dependently decreased the area of transparent circle caused by hyaluronidase hydrolyzing sodium hyaluronate,which had remarkable linear correlation. |
不同量的尖吻蝮蛇毒的蛋白水解酶活性与吸光度值呈量效关系,但无线性相关性。选取与阴性对照表现出明显的吸光度差异的蛇毒浓度(1 g·L-1)作为基础浓度。中和实验表明,IgY在0~250 g·L-1之间随着浓度增加,蛇毒蛋白水解酶活性降低,IgY浓度与蛇毒蛋白水解酶活力降低之间呈现量效关系。10 μg尖吻蝮蛇毒的蛋白水解酶活性几乎可被250 g·L-1 IgY完全中和,而IgY自身无蛋白水解酶活性(Fig 4)。
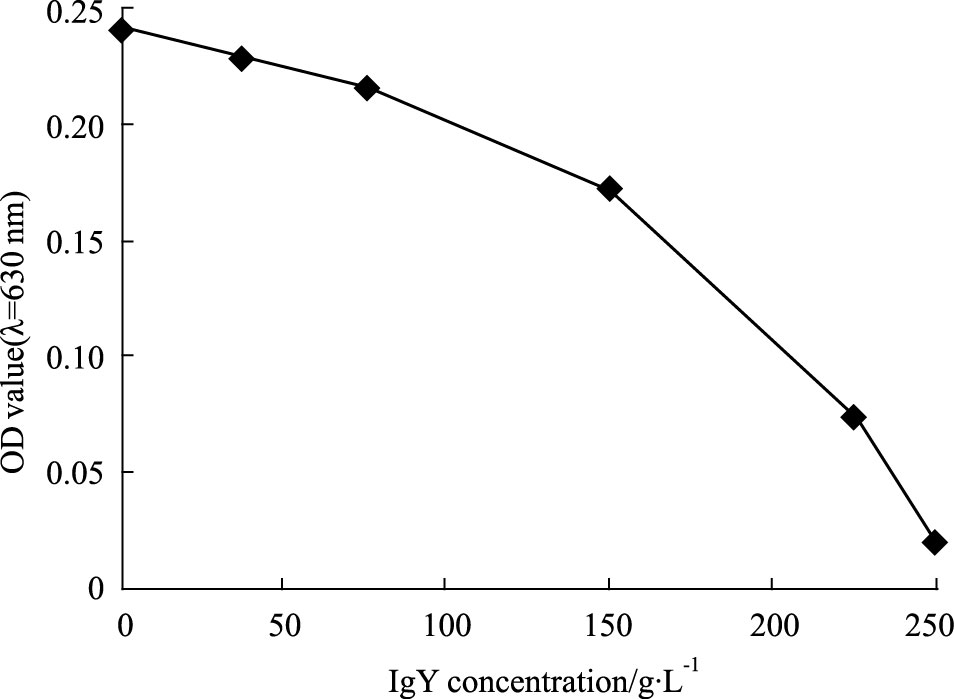
|
| Fig 4 Neutralization of anti-D. acutus venom IgY against metalloprotease in snake venom IgY dose-dependently decreased the absorbance value of the solution spectrophotometrically monitored at λ=630 nm. As demonstrated by the dose-effect relationship,it showed that the activity of protease of 10 μg venom was almost totally inhibited by 5 000 ug specific IgY. |
不同浓度的尖吻蝮蛇毒的纤维蛋白水解酶与透明圈面积呈线性关系,其回归方程为:=0.373 5X+0.016 4,r2=0.973 2,并计算直径11 mm的透明圈所对应的蛇毒浓度是2.499 g·L-1(抗尖吻蝮蛇毒IgY中和PLA2 活性的基础浓度)。随着抗尖吻蝮蛇毒IgY浓度的增加,蛇毒纤维蛋白水解酶降解纤维蛋白底物所形成的透明圈的面积越来越小(Fig 5)。透明圈面积对IgY浓度线性回归:$\hat{Y}$=-0.006X+0.905 3,计算出抗尖吻蝮蛇毒IgY的ED50为1 045 μg。
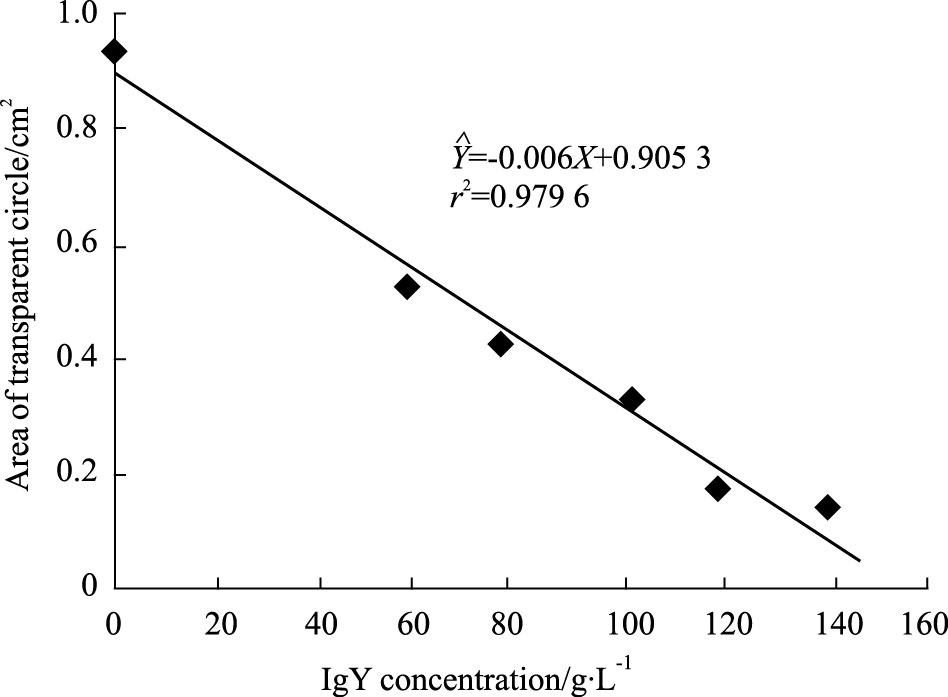
|
| Fig 5 Neutralization of anti-D. acutus venom IgY against serine proteinase ( fibrinogenase) in snake venom IgY dose-dependently decreases the relative area hydrolyzing fibrinogen from bovine plasma. It showed linearity in the area of transparent circle for the range of IgY. The ED50 value was calculated as described in methods section. |
采用蛇毒挑战剂量(3×LD50,LD50=2.93 mg·kg-1)进行IgY的保护性实验结果见Tab 1。 采用WHO推荐的方法[15],最后计算出IgY对小鼠的半有效保护剂量(ED50)为1 131.09 μg。
| Dose of IgY/μg | 0 | 200 | 400 | 800 | 1 600 | 3 200 | 6 400 |
| Number of death | 10 | 10 | 8 | 7 | 5 | 0 | 0 |
| Number of survivial | 0 | 0 | 2 | 3 | 5 | 10 | 10 |
采用现代转录组学与蛋白质组学技术和方法的匹配,人们对尖吻蝮蛇毒腺细胞的毒素基因转录表达谱和毒液蛋白质组进行了较多分析研究,目前基本搞清了尖吻蝮蛇毒中的蛋白质组分构成情况[16]。尖吻蝮蛇毒发挥致伤致毒的主要活性成分包括PLA2 、5'-核苷酸酶、透明质酸酶、金属蛋白水解酶、丝氨酸蛋白水解酶等,它们在毒理上主要扮演血液毒素和肌肉毒素的作用,给毒蛇咬伤患者带来致伤甚或致死的效应[1-3]。
实验表明,抗尖吻蝮蛇毒IgY能显著地中和该蛇毒主要活性成分的活性。IgY中和PLA2 活性呈现量效关系,其ED50为4.568 μg;IgY中和5'-核苷酸酶活性呈现量效关系,而且当IgY达到300 μg,蛇毒5'-核苷酸酶活力几乎完全被中和;IgY中和透明质酸酶活性呈现量效关系,其ED50为 276.57 μg;IgY中和金属蛋白水解酶活性呈现量效关系(Fig 4);IgY中和丝氨酸蛋白水解酶(如纤维蛋白水解酶)活性呈现量效关系,其ED50为1 045 μg;这些结果表明IgY完全能中和尖吻蝮蛇毒中的血液毒素(5'-核苷酸酶、金属蛋白水解酶、透明质酸酶和丝氨酸蛋白水解酶)和肌肉毒素(PLA2)的活性,从而阻止这些毒素引起尖吻蝮蛇咬伤患者的血液系统和肌肉系统紊乱。采用小白鼠活体保护实验表明,IgY的保护效果非常好,自身没有毒性,其半有效保护剂量(ED50)为1 131.09 μg。
当前,我国治疗尖吻蝮蛇咬伤的主要药物仍是通过蛇毒免疫马而制备出的抗蛇毒血清。由于抗蛇毒血清自身存在较多不足,再加之制备成本高,使用价格昂贵,而我国的实际情况是被毒蛇咬伤的患者一般是边远山区的贫穷村民,他们很难承担使用该抗蛇毒血清的费用。因此,本研究首次采用尖吻蝮蛇毒免疫鸡来制备抗尖吻蝮蛇毒的抗体即IgY,不仅大大降低了IgY制备成本,而且实验结果显示抗尖吻蝮蛇毒IgY对该蛇毒活性的中和能力非常理想,这些结果为开发抗尖吻蝮蛇毒IgY药物提供了前期基础。
| [1] | Ouyang C, Teng C M, Huang T F. Characterization of snake venom principles affecting blood coagulation and platelet aggregation[J]. Adv Exp Med Biol, 1990, 281 : 151-63. doi:10.1007/978-1-4615-3806-6 |
| [2] | Tu A T. Overview of snake venom chemistry[J]. Adv Exp Med Biol, 1996, 391 : 37-62. doi:10.1007/978-1-4613-0361-9 |
| [3] | Ouyang C, Teng C M, Huang T F. Characterization of the purified principles of Formosan snake venoms which affect blood coagulation and platelet aggregation[J]. Taiwan Yi Xue Hui Za Zhi, 1982, 81 (7): 781-90. |
| [4] | 王桂平, 余清声, 覃媛, 黄劭. 抗眼镜蛇王蛇毒鸡卵黄抗体的制备[J]. 中国药理学通报, 2004, 20 (12) : 1426-9. Wang G P, Yu Q S, Qin Y, Huang S. King cobra egg yolk antibody from the egg yolks of immunized hens[J]. Chin Pharmacol Bull, 2004, 20 (12): 1426-9. |
| [5] | Rǜdiger.Schade, Zhang X Y, Zheng L. IgY -technology and its applications in medicine(Ⅰ): theoretical background[J]. Chin Pharmacol Bull, 2004, 20 (5): 491-5. |
| [6] | Almeida C M, Kanashiro M M, Rangel Filho F B, et al. Development of snake antivenom antibodies in chickens and their purification from yolk[J]. Vet Rec, 1998, 143 (21): 579-84. doi:10.1136/vr.143.21.579 |
| [7] | Meenatchisundaram S, Parameswari G, Michael A, Ramalingam S. Neutralization of the pharmacological effects of Cobra and Krait venoms by chicken egg yolk antibodies[J]. Toxicon, 2008, 52 (2): 221-7. doi:10.1016/j.toxicon.2008.04.179 |
| [8] | Araújo A S, Lobato Z I, Chávez-Olórtegui C, Velarde D T. Brazilian IgY-Bothrops antivenom: Studies on the development of a process in chicken egg yolk[J]. Toxicon, 2010, 55 (4): 739-44. doi:10.1016/j.toxicon.2009.11.004 |
| [9] | Habermann E, Hardt K L. A sensitive and specific plate test for the quantitation of phospholipases[J]. Anal Biochem, 1972, 50 (1): 163-73. doi:10.1016/0003-2697(72)90495-2 |
| [10] | Singer R, Sagiv M, Allalouf D, et al. Estimation of hyaluronidase activity of human semen and its relationship with sperm density by means of a simplified method[J]. Int J Fertil, 1982, 27 (3): 176-80. |
| [11] | 苏昀, 周性明. 正常人精子透明质酸酶活性测定[J]. 铁道医学, 1998, 26 (1) : 31-2. Su Y, Zhou X M. Determination of hyalurondase activity in normal human sperm[J]. Railway Med, 1998, 26 (1): 31-2. |
| [12] | Molander M, Nielsen L, Søgaard S, et al. Hyaluronidase, phospholipase A2 and protease inhibitory activity of plants used in traditional treatment of snakebite-induced tissue necrosis in Mali, DR Congo and South Africa[J]. J Ethnopharmacol, 2014, 157 : 171-80. doi:10.1016/j.jep.2014.09.027 |
| [13] | Astrup T, Müllertz S. The fibrin plate method for estimating fibrinolytic activity[J]. Arch Biochem Biophys, 1952, 40 (2): 346-51. doi:10.1016/0003-9861(52)90121-5 |
| [14] | Paul K, Manjula J, Deepa E P, et al. Anti-Echis carinatus venom antibodies from chicken egg yolk: isolation, purification and neutralization efficacy[J]. Toxicon, 2007, 50 (7): 893-900. doi:10.1016/j.toxicon.2007.06.017 |
| [15] | Organization W H. Progress in the characterization of venoms and standardization of antivenoms[M]. 1981 : 1 -44 . |
| [16] | Zhang B, Liu Q, Yin W, et al. Transcriptome analysis of Deinagkistrodon acutus venomous gland focusing on cellular structure and functional aspects using expressed sequence tags[J]. BMC Genomics, 2006, 7 : 152. doi:10.1186/1471-2164-7-152 |

