


2. 广东省人民医院医学研究中心,广东省医学科学院,广东 广州 510080;
3. 广州医科大学药学院,广东 广州 511436;
4. 广东食品药品职业学院国际交流学院,广东 广州 510520
 ,
LI Xiao-hong2,
XIAO Jing2,
HU Jie-mei2,
FENG Juan1,4,
HUO Ran1,2,
HE Guo-dong2,
WU Yue-heng2,
YU Xi-yong1,2,3
,
LI Xiao-hong2,
XIAO Jing2,
HU Jie-mei2,
FENG Juan1,4,
HUO Ran1,2,
HE Guo-dong2,
WU Yue-heng2,
YU Xi-yong1,2,3

2. Guangdong General Hospital, Guangdong Academy of Medical Sciences, Guangzhou 510080,China ;
3. School of Pharmacy, Guangzhou Medical University, Guangzhou 511436, China ;
4. Guangdong Food and Drug Vocational College, Guangzhou 510520, China
外泌体是直径30~100 nm的胞外囊泡,内部包裹着丰富的蛋白质、RNA等生物活性分子,可以激活下游的、远程的信号分子,被认为是细胞与周围靶细胞间信息交流的重要“内分泌”物质 。间充质干细胞被认为是目前分泌外泌体能力最强的细胞之一[1],许多研究证实了MSC分泌的外泌体参与抑制淋巴细胞增殖、免疫抑制、促进干细胞增殖以及损伤修复。脐带间充质干细胞(human umbilical cord derived-mesenchymal stem cell,hUC-MSCs)因来源丰富、采集时对供体无损伤,体外增殖能力旺盛,具有良好的低免疫原性,成为继骨髓间充质干细胞后的最有应用前景的干细胞来源。但是,对hUC-MSCs外泌体研究甚少,尤其是病理微环境下的hUC-MSCs外泌体生物特性及功能的研究。干扰素γ( IFN-γ) 是炎性因子中重要的一员,本课题拟用IFN-γ模拟体内炎性病理微环境,探究炎性微环境下hUC-MSCs分泌的外泌体在免疫调节中的作用。
1 材料与方法 1.1 主要试剂Ⅱ胶原酶(Gibco),Exo-Quick exosome 提取试剂盒(System Bioscience),人脐带间充质干细胞完全培养基(赛业),MSC 无血清培养基(Life),RPMI 1640培养基(Gibco),CD73-PE、CD44-FITC、CD29-PE、CD90-FITC、CD31-PE、CD34-FITC、HLA-ABC-FITC、HLA-DR-PE等流式抗体(BD),干扰素γ(PeproTech),丝裂霉素(Sigma),植物凝血集素(PHA)(Sigma),羧基荧光素二醋酸盐琥珀酰亚胺酯(CFSE )染料(DOJINDO),人调节性T细胞标记试剂盒3(eBioscience),Ficoll分离液(GE),FACS Calibur型流式细胞仪(BD),Nanosight-NS500(Malveron),rabbit anti-CD63 抗体(Abcam),mouse anti-rabbit HRP二抗(CST),ECL发光液(Bioworld),自动曝光机(GE)。
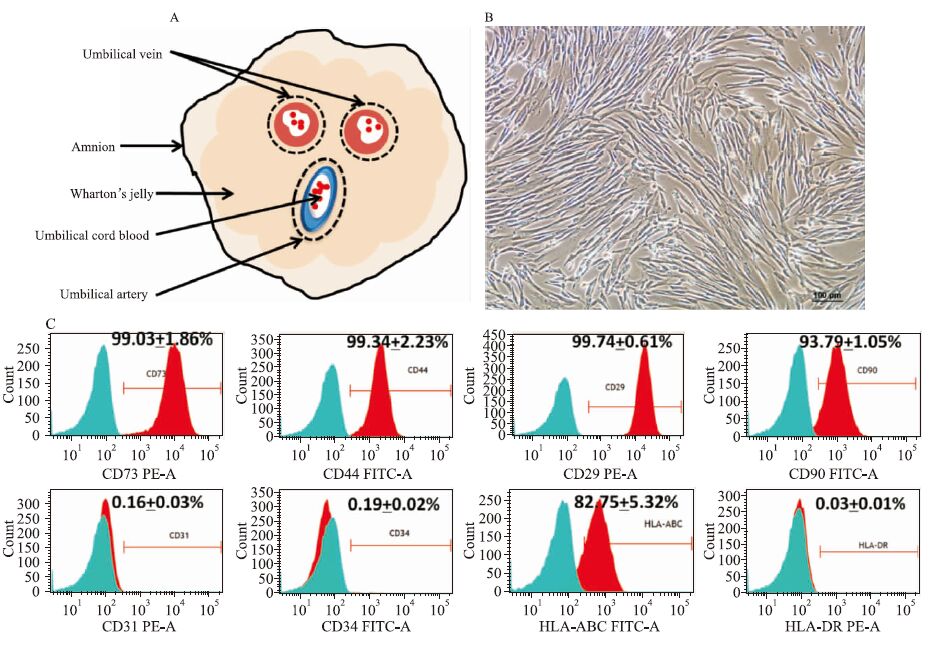
1.2 hUC-MSCs的分离培养本研究经医学伦理委员会批准,产妇签署知情同意书后,无菌取足月剖宫产新生儿脐带5~10 cm,在超净台内用含有双抗的PBS洗去脐带多余的残存血渍及血块,将脐带剪成2~3 cm小段。纵向剖开脐带,剔除脐静脉、脐动脉及其周围的血管外膜,剥离出华通氏胶(Fig 1A)。将华通氏胶剪碎,加入0.2% Ⅱ型胶原酶置于37℃、5% CO2培养箱消化。待消化16~18 h后,用10% DMEM终止消化,收集上清并过200目细胞筛,1 200 r·min-1离心后弃掉上清,用脐带间充质干细胞完全培养基重悬并接种,细胞放置在饱和湿度37℃、5% CO2培养箱培养,隔天更换1次培养基,采用倒置相差显微镜观察hUC-MSCs形态。待细胞融合达到80%时,0.25%胰蛋白酶消化传代,取生长状态良好的P3-P5代细胞进行实验。
1.3 流式细胞术鉴定细胞表型将P3代的hUC-MSCs消化下来,调整细胞数1.0×106个/管,室温避光孵育鼠抗人CD73-PE、CD44-FITC、CD29-PE、CD90-FITC、CD31-PE、CD34-FITC、HLA-ABC-FITC、HLA-DR-PE以及同型对照30 min,1 000 r·min-1离心5 min,弃去未结合的抗体。用PBS洗涤1遍后,用适量PBS重悬,使用流式细胞仪检测进行分析。用FlowJo7.6.1软件分析阳性细胞频数和分布直方图。
1.4 hUC-MSCs外泌体的提取P3代hUC-MSC用50 μg·L-1 IFN-γ处理24 h后,继续换用无血清培养基培养48 h,收集培养上清,同时以未处理的hUC-MSC作为对照。按照课题组建立的外泌体试剂盒提取法提取外泌体[2-3],具体方法为:2 000 r·min-1离心10 min,吸取上清,丢弃细胞碎片,上清通过0.22 μm滤膜过滤。按1 ∶5的比例加入SBI公司的Exo-Quick提取试剂,上下颠倒温和混匀,4℃静置过夜后1 500×g离心30 min,弃掉上清,1 500×g再次离心5 min,轻轻去除残留的液体,离心管管底的沉淀即为外泌体,分别标记为Nor-hUC-exo和IFN-γ-stimulated hUC-exo。用适量的PBS重悬后,-80℃保存备用。
1.5 hUC-exo的特性分析根据Nanosight-NS500记录的颗粒数,用适量超纯水调整稀释倍数,即Nor-hUC-exo稀释100倍,IFN-γ-stimulated hUC-exo稀释1 000倍,按照仪器使用说明书上机进行纳米粒子特性分析(Nanoparticle Tracking Analysis ,NTA),待仪器测量结束后,收集并分析报告。利用Western blot 鉴定外泌体表面标志物CD63(1 ∶500)。
1.6 健康人外周血单个核细胞(PBMCs)的分离签署知情同意书后,取健康志愿者外周血10 mL,用等体积的PBS稀释外周血,沿着管壁缓缓滴加到预先装有10 mL Ficoll分离液的离心管,600×g离心20 min。中间的白膜层即为人PBMCs,轻轻吸出来用含有血清的PBS洗涤1次洗净分离液。用2.5 mg·L-1的植物血凝素(PHA)刺激PBMCs即为活化的PBMCs(active PBMCs,a-PBMCs)。
1.7 hUC-MSCs分泌的外泌体对PBMCs增殖的影响刚分离的PBMCs用1mL含0.1% BSA的PBS重悬,用终浓度为5 μmol·L-1的CFSE 37℃孵育10 min,且每2 min颠倒混匀。用500 μL冷的PBS终止染色,再加入1 mL PBS洗去非特异性染色。50 μg·L-1 IFN-γ预处理24 h的hUC-MSCs及未经处理的hUC-MSCs,经10 mg·L-1丝裂霉素处理5h使hUC-MSCs失去增殖能力。然后按PBMCs ∶hU-MSCs=10 ∶1的比例事先在24孔板铺种,hUC-MSC、IFN-γ pretreated-hUC-MSC或者加入Nor-hUC-exo(2×1011个·L-1)和IFN-γ-stimulated hUC-exo(2×1011个·L-1),随后加入CFSE标记好的活化PBMCs与之共培养5 d,以单独培养的CFSE标记的活化PBMCs为对照,以未标记的初始PBMCs为空白。培养5 d后,采用流式细胞术测定PBMCs增殖率。
1.8 hUC-MSCs分泌的外泌体对调节性T细胞(regulatory cells,Tregs)比例影响按上述分组,与未标记CFSE的活化的PBMCs共培养5 d后,收集PBMCS并标记CD4-FITC、CD25-PE膜抗体,固定并破膜后再加入Foxp3- PerCP-Cy5.5及IgG1- PerCP-Cy5.5同型对照抗体,流式细胞术检测CD4+/CD25+/Foxp3+调节性T细胞的比例。
1.9 统计学处理应用SPSS 20.0统计软件统计分析,数据用x±s描述,多组组间均数比较用One Way ANOVA分析,两两比较方差齐时用LSD检验,方差不齐时用Dunnett′St3检验。统计结果均采用 GraphPad Prism 5作图。
2 结果 2.1 hUC-MSCs的分离及表型鉴定采用酶消化法原代分离培养人脐带间充质干细胞,原代培养至5 d左右,可见贴壁生长、长梭形或扁平性的成纤维样细胞,细胞折光性好,呈漩涡状生长(Fig 1 B)。P3代的hUC-MSCs高表达间充质干细胞标志物CD73(99.03±1.86)%、CD44(99.34±2.23)%、CD29(99.74±0.61)%、CD90(93.79±1.05)%以及主要组织相容性复合物MHC-Ⅰ类抗原HLA-ABC(82.75±5.32)%,低表达内皮细胞表面抗原CD31(0.16±0.03)%、造血干细胞表面抗原CD34(0.16±0.03)%,几乎不表达MHC-Ⅱ类抗原HLA-DR(0.03±0.01)%(n=3)(Fig 1C)。结果表明,本研究中制备的hUC-MSCs纯度较高,符合国际细胞治疗协会ISCT间充质干细胞标准[4]。
|
| Fig 1 Source,morphology and phenotypic characteristics of hUC-MSCs(n=3) A:The umbilical cord compartments;B:Phase-contrast image of isolated hUC-MSCs growing in spindle shape,scale bar=100 μm;C:Representative flow cytometry of hUC-MSCs in passage 3. Red histogram represents positive reactivity with the indicated antibody and isotype in blue |
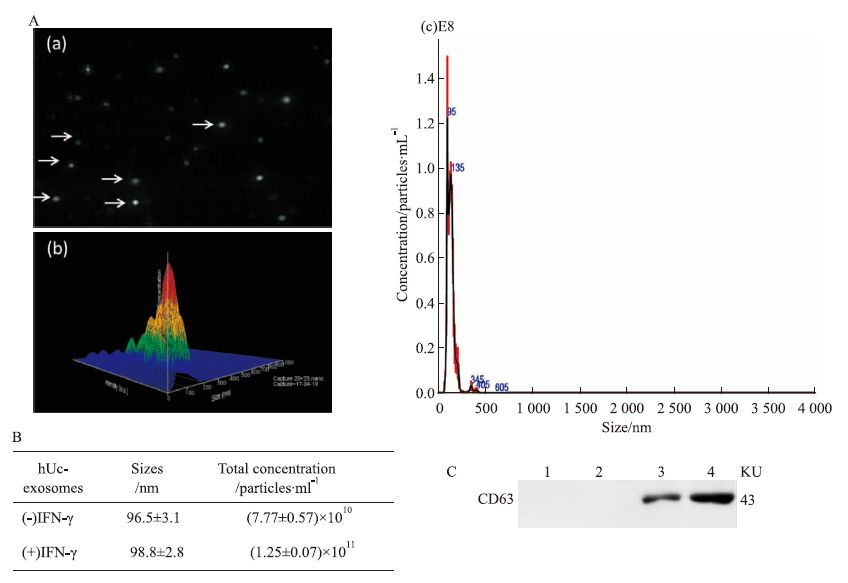
采用试剂盒法得到的白色沉淀,PBS重悬,Nanosight NS500实时动态记录纳米粒子的运动轨迹,测量粒径、浓度等参数(Fig 2A)。结果显示,Nor-hUC-exo粒径大多分布在(96.5±3.1) nm,浓度为(7.77±0.57)×1010 particles·mL-1,IFN-γ-stimulated hUC-exo粒径为(98.8±2.8) nm,浓度为(1.25+0.07)×1011 particles·mL-1(n=3)(Fig 2B),所获得的纳米粒子大多符合外泌体30~100 nm的范围,而且IFN-γ刺激后hUC-MSCs分泌的外泌体数量增加(P<0.05)。CD63是囊泡上的跨膜蛋白,蛋白质印迹结果显示,提取后的上清中不表达CD63,白色沉淀均阳性表达CD63,而且IFN-γ-stimulated hUC-exo 中CD63蛋白高于Nor-hUC-exo(Fig 2C),证实了提取到的沉淀确实是hUC-MSCs外泌体。
|
| Fig 2 Characterization of hUC-MSCs exosomes A:Nanoparticle tracking analysis(NTA) of hUC-MSCs exosomes.(a)A representative image showing moving particles(white row) from the NTA videos.(b)3D pattern of size,concentration and intensity distribution.(c)Averaged FTLA size and concentration for extracellular vehicles captured by NTA. B:Sizes and particel concentrations of hUC-MSCs exosomes with or without IFN-γ treated in 3 different batches. C:Equal amounts of proteins from supernatant and exosomes were analyzed by Western blot for exosomes marker CD63. Lane 1,Lane 2,supernatant of Nor-hUC-exo group and IFN-γ-stimulated hUC-exo group,respectively. Lane 3,Noraml hUC-MSCs exosomes and lane 4,IFN-γ-stimulated hUC-MSCs exosomes. |
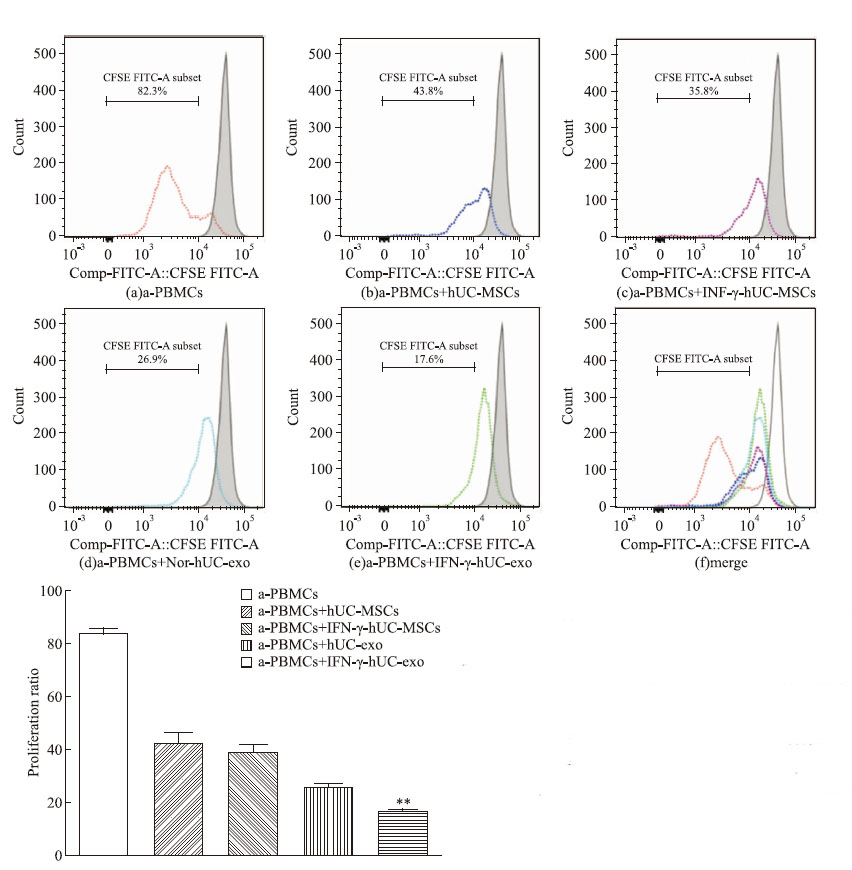
混合淋巴细胞反应共培养5 d后,CFSE标记法检测PBMCs的增殖。从Fig 3中可以看出,PHA刺激的非特异性T细胞增殖体系中,PBMCs增殖的比例为(83.9±1.18)%,而在该体系中加入hUC-MSCs、IFN-γ-hUC-MSCs共培养后,增殖比例下降到(42.67±2.27)%、(39.07±1.94)%,说明脐带间充质干细胞明显抑制PHA活化的PBMCs的增殖,但两组没有明显差异(P>0.05)。而加入Nor-hUC-exo、IFN-γ-stimulated hUC-exo,降低PBMCs增殖比例,分别为(26.07±0.92)%、(16.93±0.34)%(P<0.05),提示脐带间充质干细胞分泌的外泌体具有抑制T细胞增殖的负向免疫调节作用,IFN-γ能增强hUC-MSCs外泌体的免疫抑制功能。
|
| Fig 3 Immunosuppression by co-culture of active PBMCs with hUC-MSCs or hUC-MSCs exosomes assessed by the carboxyfluorescein succinimidyle ester(CFSE) dye(x±s,n=3) The proliferation proportions of PHA stimulated CFSE-labled PBMCs was analyzed by flow cytometry after 5 days.A:active PBMCs alone;B~E:active PBMCs co-cultured with hUC-MSCs,IFN-γ-pretreated-hUC-MSCs,hUC-MSCs exosomes or IFN-γ-stimulated-hUC-MSCs exosomes,respectively;F:overlay of all groups. Grey histogram indicated CFSE- labled PBMCs without any treatment. Comparison between groups were performed with one-way analysis of variance.*P<0.05,**P<0.01 vs hUC-exo group |
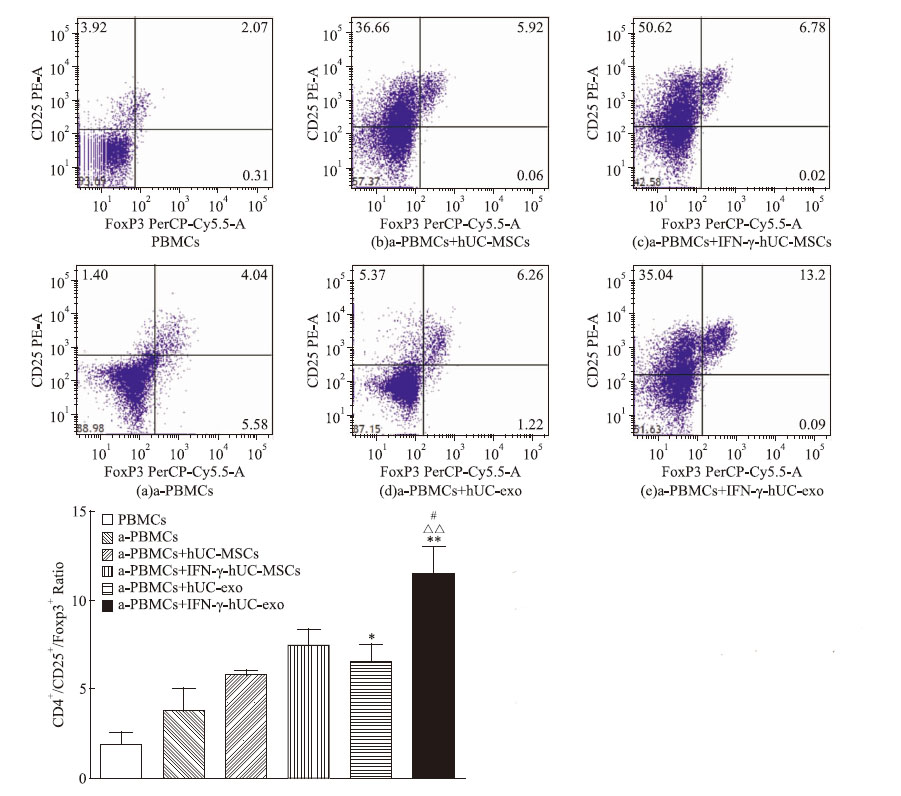
我们进一步用流式细胞术检测外泌体能否调节T细胞亚群。混合淋巴细胞体系共培养5 d后,初始PBMCs中Treg(CD4+/CD25+/Foxp3+)为(1.95±0.39)%,PHA刺激后活化PBMCs中 Treg上升到(3.87±0.73)%,而加入hUC-MSCs后Treg上升到(5.89±0.11)%(P<0.05),加入Nor-hUC-exo Treg为(6.60±0.56)%,外泌体仍然能增加Treg细胞亚群比例(P<0.05)。而IFN-γ pretreated-hUC-MSCs组中Treg为(7.54±0.50)%,FN-γ-stimulated hUC-exo组Treg为(11.53±0.88)%。IFN-γ刺激后分泌的外泌体与IFN-γ pretreated-hUC-MSCs组(P<0.05)、Nor-hUC-exo组(P<0.01)、对照组(P<0.01)相比,CD4+/CD25+/Foxp3+Treg比例升高。我们推测脐带间充质干细胞可以通过外泌体发挥免疫抑制作用,可能是由于外泌体能诱导免疫耐受Treg的产生,而且IFN-γ可以激发外泌体调节Treg的生成。
3 讨论调节性T 细胞(regulatory T cells,Treg)是1995年发现的一类具有免疫抑制功能的CD4+T细胞亚群,对于维持机体免疫稳态、发挥免疫调节及诱导外周免疫耐受有重要作用。根据CD4+T细胞表面分子CD25表达的不同,学者们将其分为CD4+/CD25-效应性T 细胞和CD4+/CD25+调节性T 细胞。由于叉头状转录因子(forkhead box protein P3,Foxp3)是CD4+/CD25+/Treg细胞的谱系决定因子,对Treg的分化、发育和Treg免疫抑制功能起到重要作用,Treg又以天然的CD4+/CD25+/Foxp3+表型最为重要[5-6]。Treg通过细胞接触或非接触的方式抗衡促进免疫反应的效应性T细胞,或者是通过树突状细胞等抗原呈递细胞而间接抑制其他T细胞的活化[7]。因此,调节性T细胞的数量和功能的缺失可能会引发类风湿性关节炎等免疫性疾病。为了缓解免疫过激疾病,临床上以提高Treg细胞水平为治疗策略。
MSC可以通过细胞直接接触、内分泌的可溶性小分子和旁分泌的胞外囊泡等方式发挥生物功能[8]。近几年的研究也逐渐证实了hUC-MSCs分泌的外泌体能模拟hUC-MSCs的生物学功能,如脐带来源的外泌体能减轻肾脏损伤和心肌损伤等[9-11]。免疫调节作用作为间充质干细胞主要功能之一,hUC-MSCs来源的外泌体是否也参与到免疫应答中呢?研究发现,正常的hUC-MSCs分泌的外泌体确实能抑制外周血单核细胞增殖、抑制IL-4等细胞因子的分泌,提示hUC-MSCs 外泌体具有多种免疫抑制方式[12]。刘明等[13]研究显示hUC-MSCs分泌的外泌体可在体外明显抑制CD4+T和CD8+T细胞增殖,并对T细胞亚群中的Treg有上调作用。在PHA活化的淋巴细胞混合培养实验中,我们的结果也证明生理状态下分泌的 hUC-MSCs外泌体能抑制PBMCs增殖、促进CD4+/CD25+/Foxp3+调节性T细胞的生成。
但是,个体体内微环境不同,MSCs活化状态不同,免疫功能也不同。炎性病理微环境对脐带间充质干细胞的外泌体数量和免疫活性会有怎样的影响呢?我们的实验结果显示,IFN-γ作为炎性微环境中的主要一员,刺激脐带间充质干细胞外泌体分泌量明显增加。而且IFN-γ就像“license”因子那样增强hUC-MSCs外泌体的免疫调节活性,IFN-γ-stimulated 外泌体能明显抑制活化的PBMCs增殖,升高CD4+/CD25+/Foxp3+调节性T细胞比例,而且这种作用比生理状态下分泌的外泌体、IFN-γ预处理的hUC-MSCs还强。我们的研究提示,早期炎症微环境下,hUC-MSCs来源的外泌体在免疫应答中依旧扮演着积极的免疫负调节角色。与此同时,相关研究报道了炎症因子脂多糖(LPS)也可以充当“license”因子。LPS预处理后,脐带间充质干细胞分泌的外泌体比未处理前外泌体蛋白质含量增加LPS pre-Exo富含let-7b,通过let-7b/TLR4/ NF-κB/STAT3/AKT信号通路调节巨噬细胞向抗炎的M2型巨噬细胞转化[14]。然而,炎性病理微环境下,hUC-MSCs调节外泌体的释放机制不详,hUC-MSCs分泌的外泌体尚不清楚能否作用于其他免疫细胞,外泌体调节免疫细胞与干细胞之间的相互作用机制不明确。这些问题都有待下一步的深入研究。
总之,我们的研究提示了hUC-MSCs在体外干扰素γ的刺激下,能够分泌大量外泌体,这些外泌体能促使Treg细胞比率升高,可能通过抑制效应性T细胞参与负向免疫调节作用,为体内输注脐带间充质干细胞外泌体或者IFN-γ预处理的外泌体治疗移植物抗宿主疾病和自身免疫疾病提供初步依据。与直接输注间充质干细胞相比,外泌体作为天然的细胞衍生物的纳米载体,更为安全、便于储存运输[15],在移植免疫和自身免疫疾病中极其有前景。
|
| Fig 4 hUC-MSCs-derived exosomes improved frequency of CD4+/CD25+/Foxp3+T regulatory cells in PBMCs(x±s,n=3) Dot plot results of FITC-CD4+/ PE-CD25+/PerCP-Cy5.5-Foxp3+Treg cells in lymphocytes subset in the absence(a) and presence of hUC-MSCs(b),IFN-γ-pretreate-hUC-MSCs(c),*P<0.05,**P<0.01 vs a-PBMCs group;#P<0.05 vs IFN-γpretreated-hUC-MSCs group;△△P<0.01 vs Nor-hUC-exo group |
( 致谢: 本实验主要是在广东省人民医院的医学研究中心实验室完成的,感谢导师余细勇教授及本课题组所有成员对该实验的指导与帮助。 )
| [1] | Yeo R W, Lai R C, Zhang B, et al. Mesenchymal stem cell: an efficient mass producer of exosomes for drug delivery[J]. Adv Drug Deliv Rev, 2013, 65 (3): 336-41. doi:10.1016/j.addr.2012.07.001 |
| [2] | Xiao J, Pan Y, Li X H, et al. Cardiac progenitor cell-derived exosomes prevent cardiomyocytes apoptosis through exosomal miR-21 by targeting PDCD4[J]. Cell Death Dis, 2016, 7 (6): e2277. doi:10.1038/cddis.2016.181 |
| [3] | 肖静, 潘宇, 李晓红, 等. 心脏干细胞分泌的 exosome对氧化应激下心肌细胞的保护作用研究[J]. 中国药理学通报, 2015, 31 (12) : 1656-60. Xiao J, Pan Y, Li X H, et al. CPC derived exosome protects cardiomyocytes from oxidative stress[J]. Chin Pharmacol Bull, 2015, 31 (12): 1656-60. |
| [4] | Dominici M, Le Blanc K, Mueller L, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement[J]. Cytotherapy, 2006, 8 (4): 315-7. doi:10.1080/14653240600855905 |
| [5] | Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3[J]. Science, 2003, 299 (5609): 1057-61. doi:10.1126/science.1079490 |
| [6] | Williams L M, Rudensky A Y. Maintenance of the Foxp3-dependent developmental program in mature regulatory T cells requires continued expression of Foxp3[J]. Nat Immnol, 2007, 8 (3): 277-84. doi:10.1038/ni1437 |
| [7] | Pandiyan P, Zheng L, Lenardo M J. The molecular mechanisms of regulatory T cell immunosuppression[J]. Front Immunol, 2011, 2 : 60. |
| [8] | Fierabracci A, Del F A, Muraca M. The Immunoregulatory activity of mesenchymal stem cells: state of art and future avenues[J]. Curr Med Chem, 2016, 23 (27): 3014-24. doi:10.2174/0929867323666160627112827 |
| [9] | Zhou Y, Xu H, Xu W, et al. Exosomes released by human umbilical cord mesenchymal stem cells protect against cisplatin-induced renal oxidative stress and apoptosis in vivo and in vitro[J]. Stem Cell Res Ther, 2013, 4 (2): 34. doi:10.1186/scrt194 |
| [10] | 李佳, 辛毅, 崔巍, 等. 人脐带间充质干细胞外泌小体保护缺氧复氧损伤的心肌细胞[J]. 中国病理生理杂志, 2016, 32 (04) : 577-83. Li J, Xin Y, Cui W, et al. Exosomes secreted by human umbilical mesenchymalstem cells protect cardiomyocytes from anoxia-reoxygenation injury[J]. Chin J Pathophysiol, 2016, 32 (04): 577-83. |
| [11] | Zhao Y, Sun X, Cao W, et al. Exosomes derived from human umbilical cord mesenchymal stem cells relieve acute myocardial ischemic injury[J]. Stem Cells Int, 2015, 2015 : 1-12. |
| [12] | 杨向荣, 丁娟, 徐正阳, 等. 人脐带间充质干细胞来源外泌体的生物学特性研究[J]. 华中科技大学学报(医学版), 2016, 45 (02) : 154-9. Yang X R, Ding J, Xu Z Y, et al. Biological characteristics of exosomes secreted by human umbilical cord-derived mesenchymal stromal cells[J]. Acta Med Univ Sci Technol Huazhong, 2016, 45 (02): 154-9. |
| [13] | Liu M, Wang J, Liu M, et al. Study of immunomodulatory function of exosomes derived from human umbilical cord mesenchymal stem cells[J]. Zhonghua Yi Xue Za Zhi, 2015, 95 (32): 2630-3. |
| [14] | Ti D, Hao H, Tong C, et al. LPS-preconditioned mesenchymal stromal cells modify macrophage polarization for resolution of chronic inflammation via exosome-shuttled let-7b[J]. J Transl Med, 2015, 13 (1): 308. doi:10.1186/s12967-015-0642-6 |
| [15] | Sun L, Xu R, Sun X, et al. Safety evaluation of exosomes derived from human umbilical cord mesenchymal stromal cell[J]. Cytotherapy, 2016, 18 (3): 413-22. doi:10.1016/j.jcyt.2015.11.018 |