


2. 广州中医药大学第二临床医学院,广东 广州 510405;
3. 潍坊医学院药理系,山东 潍坊 261053
 ,
CHENG Xiao1,
YANG Huan1,
YANG Yin-lin1,
ZHAO Ting-kun3,
WANG Qi2,
WANG Yue-hua1
,
CHENG Xiao1,
YANG Huan1,
YANG Yin-lin1,
ZHAO Ting-kun3,
WANG Qi2,
WANG Yue-hua1
 ,
DU Guan-hua1
,
DU Guan-hua1

2. Second Clinical Medical College, Guangzhou University of Chinese Medicine, Guangzhou 510405, China ;
3. Dept of Pharmacology, Weifang Medical University, Weifang Shandong 261053, China
慢性脑低灌注(chronic cerebral hypoperfusion,CCH)是指脑组织供血长期低于生理阈值,出现慢性脑缺血性神经系统损伤。CCH是一种常见的病理生理状态,是许多缺血性脑血管病发病的主要病理基础,导致认知功能障碍。研究表明,慢性脑组织血流供应不足是导致血管性痴呆(vascular dementia,VD)及阿尔兹海默病的重要因素,而且脑血流量降低程度与老年痴呆的严重程度相关[1-2]。双侧颈总动脉永久性结扎(bilateral common carotid artery occlusion,2VO)致慢性脑低灌注大鼠模型是目前公认度较好的慢性脑缺血模型,模型动物出现神经病理性改变、脑血流量降低以及脑白质损伤,这些改变与慢性脑血管疾病患者病理改变非常相似[3-5]。
山奈酚(kaempferol,KAE)是一种黄酮类化合物,主要来源于姜科植物山奈的根茎,在其他植物中也广泛存在。已有研究表明,KAE具有抗癌、抗糖尿病、抗脑缺血等多种药理活性[6-7]。本研究应用2VO大鼠模型,探讨KAE对慢性脑缺血大鼠认知功能、运动协调能力及其神经保护的作用及机制。
1 材料与方法 1.1 材料 1.1.1 实验动物SPF级♂ Wistar大鼠,体质量240~260 g,购自北京维通利华实验动物技术有限公司(合格证号:SCXK京2012-0001)。试验期间大鼠常规饲养,自由进食、进水。
1.1.2 药物和试剂KAE购自南京泽朗医药科技有限公司(纯度98%),应用0.5%羧甲基纤维素钠溶液制备混悬溶液;SOD和MDA检测试剂盒为碧云天生物科技公司产品;DJ-1蛋白抗体为Abcam产品。
1.1.3 主要仪器Morris水迷宫检测仪器为中国医学科学院药物研究所研制;SpectraMax M5酶标仪为美国MD公司产品;低温离心机为美国Beckman公司产品;SDS-PAGE电泳装置、电转移装置及分析系统为Bio-Rad产品。
1.2 方法 1.2.1 2VO模型制备采用双侧颈总动脉永久性结扎建立大鼠慢性脑缺血损伤模型,同时设立假手术组(Sham);术后21 d采用Morris水迷宫实验筛选2VO模型大鼠[8-9]。
1.2.2 动物分组与给药将2VO模型成功大鼠随机分为3组:2VO模型组灌胃给予溶剂对照;灌胃给予KAE 10 mg·kg-1剂量组(KAE-L);灌胃给予KAE 30 mg·kg-1剂量组(KAE-H);Sham组灌胃给予溶剂对照。连续给药4周后进行行为学测试,测试完毕处理动物进行其他指标的检测。
1.2.3 Morris水迷宫实验采用Morris水迷宫方法测试大鼠学习记忆能力,实验包括隐蔽平台实验及空间探索实验两部分[8]:① 隐蔽平台实验每只大鼠每天训练3次,连续训练5 d,记录大鼠找到平台的时间(潜伏期),3次测得潜伏期均数作为1 d的成绩,进行统计分析;② 空间探索实验:隐蔽平台实验结束后,于d 6撤去平台。记录每只动物第1次到达平台位置的时间(潜伏期),以及60 s内穿越平台所在位置的次数,作为衡量其学习记忆能力的指标。
1.2.4 抓握实验长约700 mm尼龙绳(直径约1 mm)水平悬挂固定于鼠盒上方,盒内装上足够多的垫料。大鼠前爪抓住绳子后,立刻松开大鼠,记录大鼠在绳子上的维持时间并评分[1]。评分标准:动物在10 s内从绳上掉下为0分;前爪挂在绳上为1分;试图爬上尼龙绳为2分;前爪和至少1只后爪同时挂在绳上为3分,四肢及尾巴绕在绳上为4分;试图逃到水平部的末端为5分。
1.2.5 病理组织形态学观察大脑标本经固定、脱水、包埋、切片,然后进行HE染色及尼氏染色,在光学显微镜下观察皮层、海马病理学组织形态变化[7]。
1.2.6 Western blot分析分别提取脑组织海马、皮层总蛋白,测定蛋白浓度,加入5×Loading buffer,100℃金属浴10 min。每孔上样20 μg,经12% SDS-PAGE电泳;湿法转移至PVDF膜上;含5% BSA的TBS-T溶液37℃摇床封闭1 h;加入anti-DJ-1抗体溶液(1 ∶1 000)于4℃孵育过夜;洗涤后加入辣根过氧化物酶标记的二抗抗体溶液,37℃摇床孵育2 h;TBS-T洗膜,采用ECL法检测蛋白条带,GelPro31凝胶分析软件分析条带。
1.2.7 统计学分析数据以x±s表示,利用Graphpad6.0软件中One-way ANOVA和Dunnett′s multiple comparisons test进行显著性检验。
2 结果 2.1 KAE对慢性脑缺血大鼠学习记忆能力的影响在Morris水迷宫隐蔽平台实验中,与Sham组大鼠比较,2VO组大鼠在d 3、d 4、d 5潜伏期延长(P<0.05,P<0.01,P<0.01)。与2VO组大鼠比较,KAE 30 mg·kg-1组大鼠在d 3和d 5缩短2VO大鼠潜伏期(P<0.05,P<0.05)。见Fig 1A。
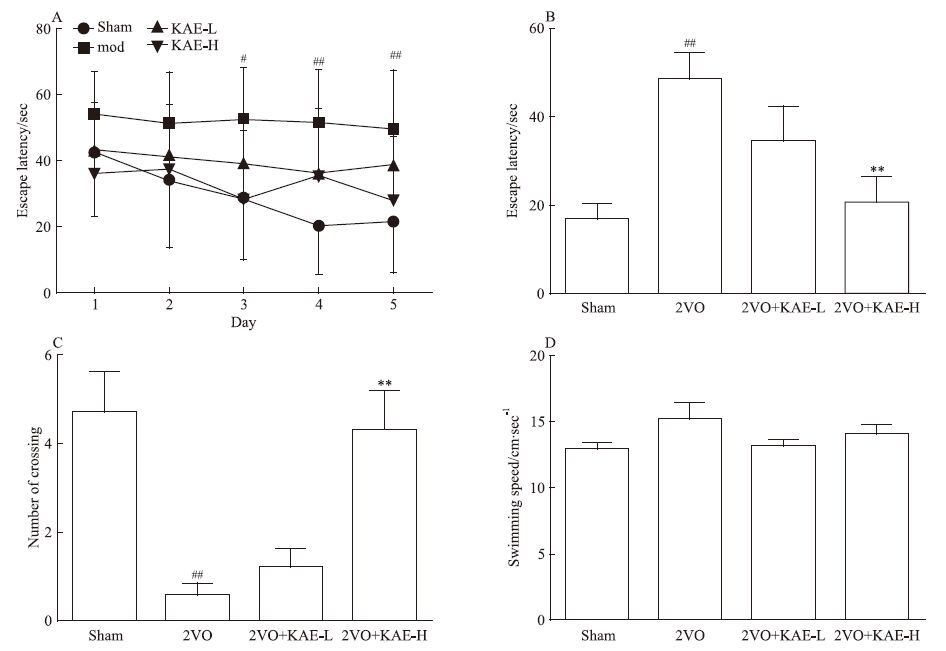
|
| Fig 1 Effect of KAE on learning and memory in rats with 2-VO using Morris water maze test(x±s,n=9~10) A:escape latency from day 1 to day 5;B:escape latency in the probe test;C:the number of crossing platform in the probe test;D:swimming speed in the probe test.#P<0.05,##P<0.01 vs Sham group;*P<0.05,**P<0.01 vs 2VO group |
在Morris水迷宫空间探索实验中,与假手术组大鼠比较,2VO大鼠60 s内第1次穿越平台所在位置的潜伏期延长(P<0.01),而且在60 s内穿越平台所在位置的次数降低(P<0.01);与2VO组大鼠比较,KAE 30 mg·kg-1缩短2VO大鼠空间探索实验中潜伏期(P<0.01),且在60 s内穿越平台所在位置的次数增加(P<0.01)。见Fig 1B和Fig 1C。空间探索实验中各组大鼠游泳速度差异无显著性(Fig 1D)。
2.2 KAE对2VO大鼠抓握能力的影响采用抓握实验评价大鼠肢体肌力及协调运动能力。与Sham组大鼠比较,2VO组大鼠在绳子上维持时间较短,行为能力评分降低(P<0.01)。与2VO组大鼠比较,KAE 10 mg·kg-1及30 mg·kg-1给药组大鼠抓握能力评分均增高(P<0.01,P<0.01),这表明KAE对慢性脑缺血大鼠的肌力具有较好的改善作用,见图 2。
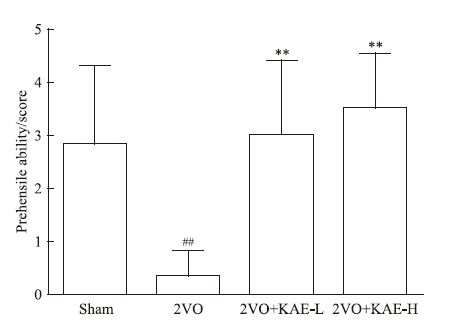
|
| Fig 2 Effect of KAE on motor ability in rats with 2VO using prehensile traction test(x±s,n=9~10) ##P<0.01 vs Sham group;**P<0.01 vs 2VO group |
大鼠海马CA1区和皮层神经元HE染色结果如Fig 3所示,Sham组大鼠神经元结构完整,排列整齐,核仁清晰,细胞核大而圆,胞质无红染;而2VO模型组大鼠神经元细胞排列散乱,细胞体积缩小,核不规则,核固缩深染的变性神经细胞数增多。与2VO模型组比较,KAE各给药组对神经元损伤具有一定改善作用,其中KAE 30 mg·kg-1组对神经元形态结构改善作用尤为明显,细胞排列整齐,深染细胞核数目明显减少。
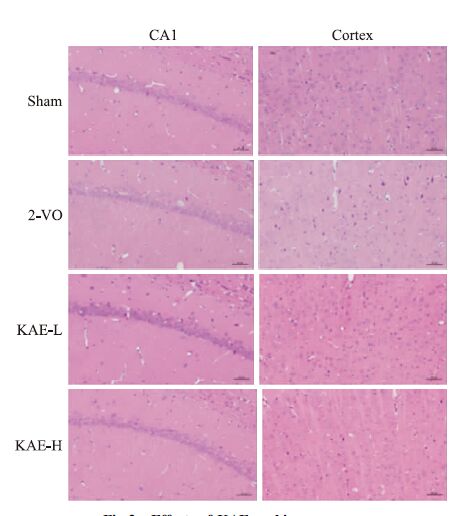
|
| Fig 3 Effects of KAE on hippocampus and cortex lesions induced by 2-VO Representative photographs of tissue sections stained with HE staining(200×) |
大鼠海马CA1区和皮层神经元尼氏染色如Fig 4所示,Sham组大鼠神经元细胞排列整齐、紧凑,基本没有尼氏体破裂现象;而2VO模型组大鼠神经元排列散乱,细胞带出现断裂,出现尼氏体碎裂现象的神经元数目增多,细胞核深染数目增多。与2VO模型组比较,KAE各给药组对神经元损伤具有一定改善作用,其中KAE 30 mg·kg-1组对神经元形态结构改善作用尤为明显,深染细胞核数目明显减少,尼氏体较完整清晰。
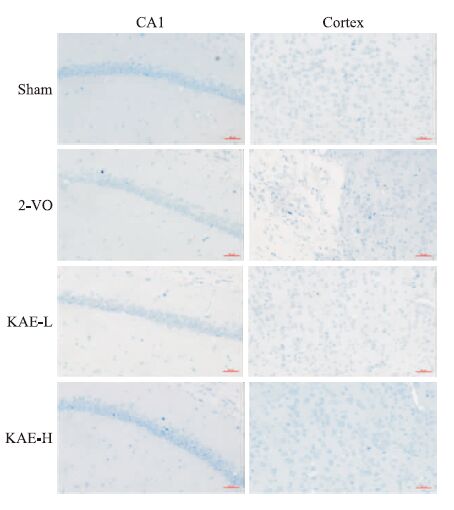
|
| Fig 4 Effects of KAE on hippocampus and cortex lesions induced by 2-VO Representative photographs of tissue sections stained with Nissl staining(200×) |
2VO模型组大鼠脑组织中MDA含量较Sham组有升高趋势,KAE各给药组脑组织中MDA含量较2VO组有降低趋势,但各组之间差异未显示出统计学意义(Fig 5A)。
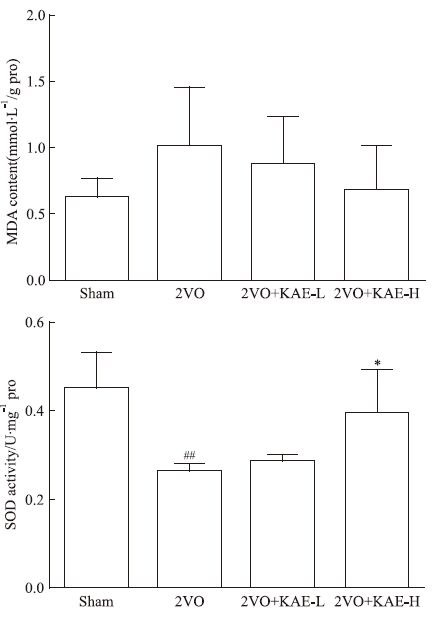
|
| Fig 5 Effect of KAE on content of MDA and activity of SOD in brain tissue of rats with 2-VO(x±s,n=6) A:MDA content in brain tissue;B:the activity of SOD in brain tissue.##P<0.01 vs Sham group;*P<0.05 vs 2VO group |
与Sham组比较,2VO模型组大鼠脑组织中SOD活性下降(P<0.01)。与2VO模型组比较,KAE 30 mg·kg-1给药组SOD活性升高(P<0.05)。见Fig 5B。
2.5 KAE对2VO大鼠海马和皮层中DJ-1蛋白表达的影响与Sham组比较,2-VO模型组大鼠海马中DJ-1表达水平降低(P<0.01);与2VO模型组比较,KAE 10 mg·kg-1及30 mg·kg-1给药组海马中DJ-1蛋白表达水平均增高(P<0.01,P<0.01)。见Fig 6A。
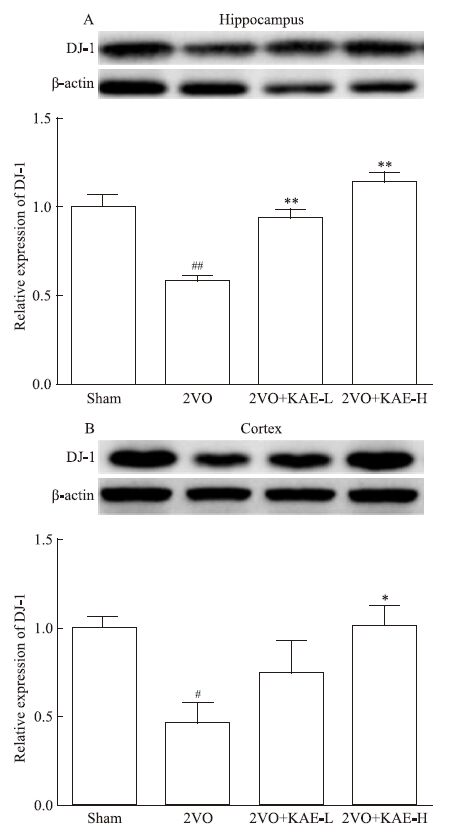
|
| Fig 6 Effect of KAE on DJ-1 protein expression in hippocampus and cortex of 2VO rats(x±s,n=3) A:DJ-1 protein expression in hippocampus;B:DJ-1 protein expression in cortex.#P<0.05,##P<0.01 vs Sham group;*P<0.05,**P<0.01 vs 2VO group |
与Sham组比较,2-VO模型组大鼠皮层中DJ-1表达水平降低(P<0.05);与2VO模型组比较,KAE 30 mg·kg-1给药组皮层中DJ-1蛋白表达水平增高(P<0.05),而KAE 10 mg·kg-1给药组皮层组织中DJ-1蛋白表达水平有增高趋势,但差异无统计学意义。见Fig 6B。
3 讨论慢性脑缺血是指各种原因诱发长期脑血流灌注不足,在血管性痴呆及阿尔兹海默病等多种神经系统疾病的发生发展过程起着重要作用。2VO模型已成为经典的研究慢性脑缺血疾病及评价相关治疗药物的重要动物模型。长期脑组织低灌注状态导致一系列生理病理变化,出现认知功能障碍,同时也会出现协调运动功能障碍[10-11]。因此,本研究采用Morris水迷宫实验检测大鼠学习记忆能力来评价动物的认知功能,采用抓握实验检测抓握能力来评价大鼠的协调运动功能。研究结果表明,2VO诱导慢性脑缺血模型大鼠出现认知功能和运动功能障碍,而KAE可以明显改善慢性脑缺血引起的认知功能障碍和协调运动功能障碍。
永久性结扎大鼠双侧颈总动脉导致脑组织出现缺血/缺氧性损害,在脑组织海马和皮层区尤为明显。这些部位的脑组织由于长期处于缺血性低灌注状态,使该部位的神经元发生迟发性坏死,从而逐渐出现认知功能障碍[12]。本实验中,采用HE染色和Nissl染色观察海马CA1区及皮层神经元数目和形态。结果表明,大鼠脑组织慢性低灌注后,海马和皮层神经元正常形态破坏,排列紊乱,细胞连接疏松,并出现神经元明显丢失的现象,而KAE能改善海马和皮层神经元形态结构的损伤和破坏。
慢性脑缺血诱导神经细胞内钙超载,刺激线粒体产生过多的超氧阴离子,产生大量氧自由基,作用于脂质发生过氧化反应,氧化终产物为MDA,造成蛋白质、核酸等生命大分子的交联聚合,产生细胞毒性,引起缺血后神经元坏死。SOD是机体内存在的超氧自由基清除因子,它通过一系列生理反应把有害的超氧自由基转化为过氧化氢,是机体抗氧化系统主要成分[13]。本研究检测发现,2VO组大鼠脑组织中MDA含量表现出增高趋势,KAE给药组较模型组脑组织中MDA含量表现出降低趋势,但差异无统计学意义,这可能是由于检测动物数偏少,提示在后期相关研究中,需要增加检测动物样本数。此外,本研究结果表明2VO模型组脑组织中SOD活性明显降低,表明慢性低灌注脑组织抗氧化能力降低,而KAE给药组可提高2VO大鼠脑组织中SOD活性,推测KAE可能通过提高抗氧化活性发挥保护脑组织的功能。
DJ-1蛋白是一个氧化还原性敏感蛋白,与细胞氧化应激密切相关,其通过多种途径发挥神经保护作用,最重要功能是在氧化应激下维持线粒体复合酶I的活性,从而降低线粒体氧化应激。已有研究表明,DJ-1蛋白是抗氧化应激的关键蛋白,可能成为中风的重要治疗靶点[14]。本实验室前期研究发现,2VO大鼠脑组织中线粒体功能明显降低,降低复合酶I的活性[15]。因此,在本研究中检测了海马、皮层中DJ-1蛋白表达水平,结果发现2VO模型组海马、皮层中DJ-1蛋白表达水平均明显降低,而KAE可以改善提高DJ-1蛋白的表达水平,其中海马部位更为明显,推测KAE可能通过提高机体大脑抗氧化水平发挥神经保护作用。
综上所述,KAE可改善2VO诱导的慢性脑缺血大鼠的学习记忆能力障碍和协调运动功能障碍,其机制可能与其提高脑组织抗氧化能力相关,对缺血性中风具有一定的治疗潜能。
( 致谢: 本文实验在中国医学科学院药物研究所药物靶点研究与新药筛选北京市重点实验室完成,程笑、杨欢、杨滢霖、赵廷坤参与了本实验工作。 )
| [1] | Bárez-López S, Bosch-García D, Gómez-Andrés D, et al. Abnormal motor phenotype at adult stages in mice lacking type 2 deiodinase[J]. PLoS One, 2014, 9 (8): e103857. doi:10.1371/journal.pone.0103857 |
| [2] | Edrissi H, Schock SC, Cadonic R, et al. Cilostazol reduces blood brain barrier dysfunction, white matter lesion formation and motor deficits following chronic cerebral hypoperfusion[J]. Brain Res, 2016, 1646 : 494-503. doi:10.1016/j.brainres.2016.06.036 |
| [3] | Farkas E, Luiten P G, Bari F. Permanent, bilateral common carotid artery occlusion in the rat: a model for chronic cerebral hypoperfusion related neurodegenerative diseases[J]. Brain Res Rev, 2007, 54 (11): 162-80. |
| [4] | Lee J H, Park S Y, Shin Y W, et al. Neuroprotection by cilostazol, a phosphodiesterase type 3 inhibitor, against apoptotic white matter changes in rat after chronic cerebral hypoperfusion[J]. Brain Res, 2006, 1082 (1): 182-91. doi:10.1016/j.brainres.2006.01.088 |
| [5] | Otori T, Katsumata T, Muramatsu H, et al. Long-term measurement of cerebral blood flow and metabolism in a rat chronic hypoperfusion model[J]. Clin Exp Pharmacol Physiol, 2003, 30 (4): 266-72. doi:10.1046/j.1440-1681.2003.03825.x |
| [6] | 陈育华, 周克云, 袁汉尧. 山奈酚药效的研究进展[J]. 广东药学, 2010, 31 (8) : 1064-6. Chen Y H, Zhou K Y, Yuan H Y. Research progress of kaempferol in pharmacodynamics[J]. Guandong Med J, 2010, 31 (8): 1064-6. |
| [7] | 仇炜, 赵娟, 吕雨虹, 等. 山奈酚诱导人小细胞肺癌H446细胞凋亡及机制[J]. 中国药理学通报, 2011, 27 (10) : 1422-5. Qiu W, Zhao J, Lyu Y H, et al. Kaempferol-induced apoptosis in human small cell lung cancer H446cells[J]. Chin Pharmacol Bull, 2011, 27 (10): 1422-5. |
| [8] | 王月华, 贺晓丽, 杨海光, 等. 小续命汤有效成分组对慢性脑缺血大鼠学习记忆能力及病理损伤的影响[J]. 中西医结合学报, 2012, 10 (1) : 91-9. Wang Y H, He X L, Yang H G, et al. Effects of the active components of Chinese herbal medicine Xiaoxuming decoction on memory behavior and brain injury in rats with chronic cerebral ischemia[J]. J Chin Integr Med, 2012, 10 (1): 91-9. doi:10.3736/jcim |
| [9] | 贺晓丽, 毕明刚, 杜冠华. 慢性脑缺血大鼠脑组织线粒体蛋白质组与能量代谢相关性研究[J]. 中国药理学通报, 2012, 28 (9) : 1200-5. He X L, Bi M-G, Du G H. Brain mitochondria proteome and energy metabolism in rats after chronic cerebral hypoperfusion[J]. Chin Pharmacol Bull, 2012, 28 (9): 1200-5. |
| [10] | De Jong G I, Farkas E, Stienstra C M, et al. Cerebral hypoperfusion yields capillary damage in the hippocampal CA1 area that correlates with spatial memory impairment[J]. Neuroscience, 1999, 91 (1): 203-10. doi:10.1016/S0306-4522(98)00659-9 |
| [11] | Ohta H, Nishikawa H, Kimura H, et al. Chronic cerebral hypoperfusion by permanent internal carotid ligation produces learning impairment without brain damage in rats[J]. Neuroscience, 1997, 79 (4): 1039-50. doi:10.1016/S0306-4522(97)00037-7 |
| [12] | Wakita H, Tomimoto H, Akiguchi I, et al. Glial activation and white matter changes in the rat brain induced by chronic cerebral hypoperfusion: an immunohistochemical study[J]. Acta Neuropathol, 1994, 87 (5): 484-92. doi:10.1007/BF00294175 |
| [13] | Nie C, Nie H, Zhao Y, et al. Betaine reverses the memory impairments in a chronic cerebral hypoperfusion rat model[J]. Neurosci Lett, 2016, 615 : 9-14. doi:10.1016/j.neulet.2015.11.019 |
| [14] | Sarbishegi M, Heidari Z, Mahmoudzadeh-Sagheb H, et al. Neuroprotective effects of with aniacoagulans root extract on CA1 hippocampus following cerebral ischemia in rats[J]. Avicenna J Phytomed, 2016, 6 (4): 399-409. |
| [15] | 王月华, 贺晓丽, 李晓秀, 等. 小续命汤有效成分组对慢性脑缺血大鼠脑线粒体的保护作用[J]. 中西医结合学报, 2012, 10 (5) : 569-76. Wang Y H, He X L, Li X X, et al. Effects of the active components of Chinese herbal medicine Xiaoxuming decoction on brain mitochondria in rats with chronic cerebral ischemia[J]. J Chin Integr Med, 2012, 10 (5): 569-76. doi:10.3736/jcim20120513 |