


2. 中山大学药学院,广东 广州 510006
2. School of Pharmaceutical Sciences, Sun Yat-sen University, Guangzhou 510006, China
受体相互作用蛋白140(receptor-interacting protein 140,RIP140)是一种重要的转录辅助因子,在调节组织能量代谢中扮演重要角色。研究报道[1],RIP140通过抑制脂肪组织甘油三酯的分解与合成,影响脂肪细胞的分化。RIP140也能抑制骨骼肌的葡萄糖和脂肪酸代谢[2]。外源性过表达RIP140基因促进心肌肥大、纤维化的发生[3],但其作用的机制仍不明确。因此,建立RIP140目的基因的过表达系统,研究其在各组织、细胞中的调节机制尤为重要。心脏的工作与能量代谢密切联系,而心肌细胞是高度分化的非增殖原代细胞,常用的质粒过表达体系转染心肌细胞存在转染率低、脂质体介导的转染细胞毒性大的弊端,而RIP140基因序列又长达3.5 kb,故亟需寻找一种能满足高包装容量、高转染效率以及低细胞毒性的过表达载体系统。
1 材料与方法 1.1 仪器和试剂腺病毒穿梭载体pAdTracker-CMV与骨架载体pAd Easy-1由中山大学生命科学院实验室提供,DNA提取试剂盒、逆转录试剂盒、LA Taq、BglⅡ、EcoRⅤ、T4 DNA Ligase酶、pMD18-T vector (日本TaKaRa公司);PmeⅠ、PacⅠ酶(美国NEB公司);IPTG、X-gal、卡那霉素、氨苄霉素、Ecoli DH5α感受态、Top 10感受态(天根公司);胶回收试剂盒、质粒DNA小提试剂盒、质粒DNA中提取纯化试剂盒(美国Omega公司);发光液、核蛋白提取试剂盒、蛋白定量试剂盒(美国Pierce公司);CO2细胞培养箱(美国Thermo公司);蛋白电泳仪、电转仪、GEL DOC 2000成像系统、蛋白定量酶标仪(美国BioRad公司);胎牛血清(美国Hyclone公司);DMEM培养基(美国Gibco公司)
1.2 RIP140基因扩增与鉴定RIP140基因的编码区由单一外显子构成,截取一小段大鼠鼠尾,提取基因组DNA并扩增目的基因模板。根据大鼠RIP140的基因序列设计引物序列,参考穿梭质粒pAd Tracker-CMV图谱上的酶切位点,在上游引物加入BglⅡ酶切位点和2个保护碱基,下游引物加入EcoRⅤ酶切位点和3个保护碱基。最终引物序列如下:上游:GAAGATCTATGACTCATGGAGAAGAG CTTG;下游:CCGGATATCTCACTCGCACTCTTTTTTTA。PCR扩增RIP140基因的条件为:94℃ 5 min, (94℃ 30s, 58.3℃ 30 s, 72℃ 4min)×32 cycles, 72℃ 10 min。
1.3 重组穿梭载体pTracker-RIP140的构建与鉴定 1.3.1 pT-RIP140载体的构建胶回收目的DNA片段,与T克隆载体连接过夜,转化Top 10感受态后铺在含氨苄霉素抗性的琼脂糖平板表面进行蓝白斑筛选。选取10个白色克隆,摇菌、提取质粒DNA用EcoRⅤ、BglⅡ进行双酶切鉴定。能切出3.5 kb处条带对应的克隆送去华大基因广州公司测序,碱基序列与GenBank中公布的大鼠源性RIP140基因一致的克隆命名为pT-RIP140。
1.3.2 RIP140克隆于穿梭载体pAdTracker-CMV切胶回收RIP140基因片段,与EcoRⅤ、BglⅡ双酶切后的pAdTracker-CMV质粒DNA连接过夜。连接产物转化Ecoli DH5α感受态细菌,再均匀涂布于含卡那霉素抗性的琼脂糖培养基平板进行筛选,挑取单克隆摇菌扩增、提取质粒DNA,再用EcoRⅤ和BglⅡ双酶切方法进行鉴定,将能切出3.5 kb左右的片段的阳性克隆命名为pTracker-RIP140。
1.4 重组腺病毒基因pAd-RIP140的构建与鉴定将含腺病毒骨架质粒pAdEasy-1的BJ5183菌株涂布在氨苄抗性的平板上进行筛选,挑取单克隆菌落摇菌并扩增,加入预冷的0.1mol·L-1 CaCl2-MgCl2溶液(80 mmol·L-1 MgCl2,20 mmol·L-1 CaCl2)制备含腺病毒骨架质粒pAdEasy-1的BJ5183感受态细菌。重组的穿梭载体pTracker-RIP140用PmeⅠ酶切线性化,转化上述制备好的BJ5183感受态细菌,与腺病毒骨架质粒在BJ5183中进行同源重组。挑取5个单克隆菌落摇菌、扩增,提取质粒DNA后经Pac I线性化酶切鉴定,能切出4.5或3kb左右位置的条带的为重组阳性克隆,命名为pAd-RIP140。
1.5 重组腺病毒包装、扩增与纯化重组的阳性克隆重新转化到Ecoli DH5a中进行稳定扩增,摇菌、大量抽提质粒DNA,经PacⅠ酶切、酚/氯仿抽提、乙醇沉淀后在无菌条件下溶于灭菌双蒸水中。将Pac I线性化的pAd-RIP140用lipofectamine2000脂质体转染AD293细胞,直至在荧光显微镜下观察到明显的细胞病变(cytopathic effect, CPE)。收集病毒上清液,以5%~10%的比率重新感染AD293细胞,重复以上扩增过程,直至病毒增殖到第4代的时候基本稳定时,收集上清、CsCl密度梯度离心法进行纯化、分装,于-80℃保存。纯化后的腺病毒命名Ad-RIP140,对照组为空白穿梭载体与腺病毒载体的同源重组,重组后的包装、扩增与纯化方案均与Ad-RIP140相同,空白对照病毒命名为Ad-GFP。
1.6 重组腺病毒的滴度测定采用半数组织培养感染剂量法(50% tissue culture infectious dose, TCID50)测定腺病毒滴度。准备细胞密度为108个·L-1的AD293细胞,96孔板中加入倍比稀释的病毒,以10-4~10-12稀释浓度感染细胞,96孔板每行留2孔作为阴性对照。于37℃培养10 d后荧光显微镜下观察,计算每一横排中出现CPE的孔数。当阴性对照中不出现CPE且细胞生长良好,最低稀释度100% CPE阳性而最高稀释度100% CPE阴性,则认为本测试即为有效。腺病毒滴度用KARBER统计法精确算出:对于100 μL的稀释液,滴度为T=101+d(s-0.5)
d=lg10 of dilution, s=the sum of ratios (包括最初的10-1稀释度);
T=a×10bTCID50/mL=a×10b-0.7 PFU/mL; MOI=PFU/cell numbers。
1.7 腺病毒介导的目的基因在乳鼠心肌细胞的鉴定原代乳鼠心肌细胞的培养参考文献[4],心肌细胞培养36 h后,分别加入重组腺病毒Ad-RIP140及对照Ad-GFP,直接覆盖心肌细胞表面,37℃孵箱中培养4h后补加适当体积的完全培养基,继续感染20 h,荧光显微镜下观察GFP情况,确定感染效率。病毒36 h后,抽提总蛋白,采用Western blot验证RIP140在心肌细胞过表达情况。以不同MOI的病毒滴度感染心肌细胞,加入20 μL的Counting Cell Kit-8(CCK-8),测定490nm处吸光度,观察腺病毒对心肌细胞活力的影响。
1.8 数据分析采用SPSS13.0统计软件对数据进行统计分析,结果用x±s表示。均数比较用单因素方差分析。
2 结果 2.1 pT-RIP140载体的构建PCR扩增的产物为单一条带,大小位于3 500 bp左右(Fig 1A)。重组质粒用Bgl Ⅱ和EcoR Ⅴ双酶切鉴定,分别切出3 500 bp位置条带及2 900 bp位置的条带,分别与RIP140基因和pMD18-T vector质粒载体大小位置一致(Fig 1B)。将酶切验证后的克隆进一步测序分析,序列比对后显示与Genebank发表的RIP140基因序列一致,将阳性克隆命名为pT-RIP140。
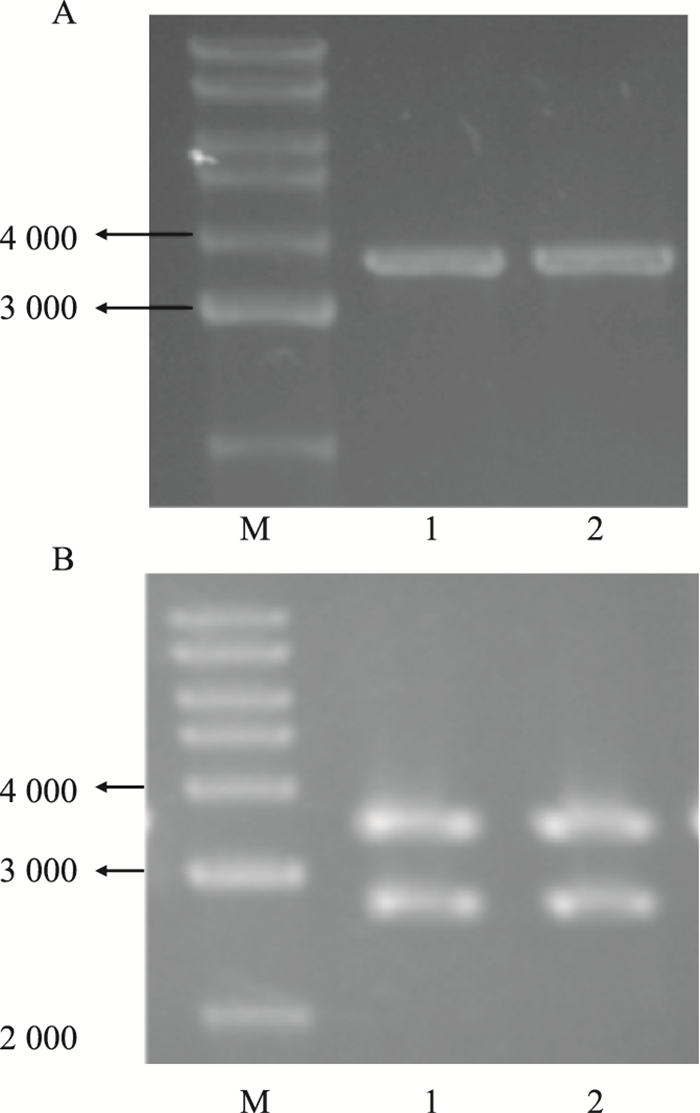
|
| Fig 1 Cloning RIP140 gene into a pMD18-T vector. M: 10kb Maker. (A), 1-2: RIP140 production by PCR. (B), 1-2: Recombinant plasmid digested by restriction enzymes Bgl Ⅱ and EcoR Ⅴ. |
胶回收T载体上的RIP140基因条带,与用Bgl Ⅱ和EcoR Ⅴ双酶切后的穿梭载体pAdTracker-CMV (9.2 Kbp左右) DNA连接过夜,转化后挑取12个单克隆摇菌,提取质粒DNA再用Bgl Ⅱ和EcoR Ⅴ双酶鉴定。如Fig 2所示,6号克隆能切出3500bp左右的小条带与9000bp左右的大条带,分别与预期的RIP140基因和pAdTracker-CMV基因大小一致,将6号重组阳性质粒命名为pTracker-RIP140。
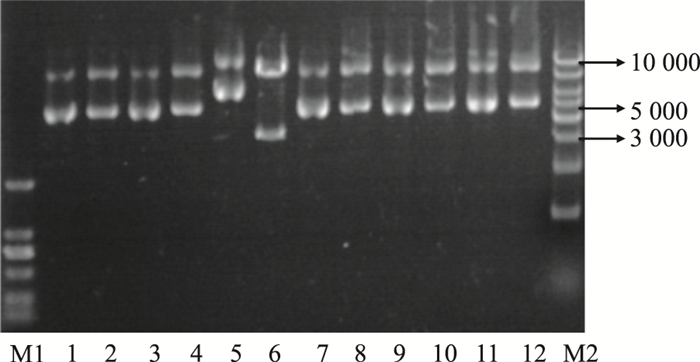
|
| Fig 2 The Cloning screen and characterization of recombinant plasmid pTrack-RIP140. M1: Maker, 2 000bp; M2: Maker, 10 000 bp. 1~12: Screening positive pTracker-RIP140 clone. |
Pme I线性化处理重组穿梭质粒pTracker-RIP140(Fig 3A),在BJ5183感受态细胞中与病毒骨架质粒pAdEasy-1进行同源重组。重组的腺病毒质粒通过卡那霉素初步筛选,最后再用Pac I进行酶切鉴定分析。挑取24个最小单克隆扩增,提取质粒DNA并进行琼脂糖电泳,初步估计大小在10kb以上单克隆为重组腺病毒阳性克隆。如Fig 3B所示,4号克隆为阴性克隆,其余克隆初步估计为阳性克隆,需进一步PacⅠ酶切验证。PacⅠ酶切重组腺病毒通常会得到约30kb的片段和一个3.0或4.5 kb的小片段,小片段的大小取决于重组位置。如Fig 3C所示,挑取的重组目的基因克隆与阴性对照克隆经PacⅠ酶切,均得到位于4.5 kb处的条带(Fig 3C),说明重组RIP140腺病毒质粒构建成功,且同源重组发生在复制起始位置与右臂之间。构建好的RIP140腺病毒重组质粒命名为pAd-RIP140,不含目的基因的同源重组为阴性对照,命名为pAd-GFP。
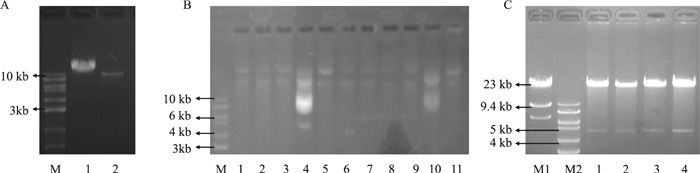
|
| Fig 3 Construction and screening of recombinant plasmid pAd-RIP140. (A), M: Maker; 1: p-Tracker-RIP140 digested by linear enzyme Pme I; 2: pAdTrack-CMV digested by linear enzyme Pme I. (B), M:Maker; 1-9: Clone 1~9; 10: pAdTrack-CMV control; 11: pAdEasy-1 control. (C), M1: 23 kb λ-Hing Ⅲ digest Maker; M2: 10kb Maker; 1~2: Positive clone digested by Pac I enzyme; 3~4: pAd-GFP control digested by Pac I enzyme. |
得到的重组腺病毒用Pac I线性化,转染AD293细胞后产生重组病毒颗粒。转染2 d后,GFP绿色荧光逐渐增多,15 d的时候局部细胞变圆、脱落,细胞拉伸成网状并出现荧光聚集现象(Fig 4A箭头所示),呈现典型的细胞病变效应(CPE)。扩增到第4代时候,细胞在感染病毒36h后明显变圆并脱落(Fig 4B),CPE现象明显,病毒增殖基本稳定,留少量作滴度测定,其余分装并冻存-80℃。采用TCID50测定腺病毒滴度,据测定并计算,Ad-RIP140和Ad-GFP的滴度T分别为1011.3和1011.7 PFU·mL-1。
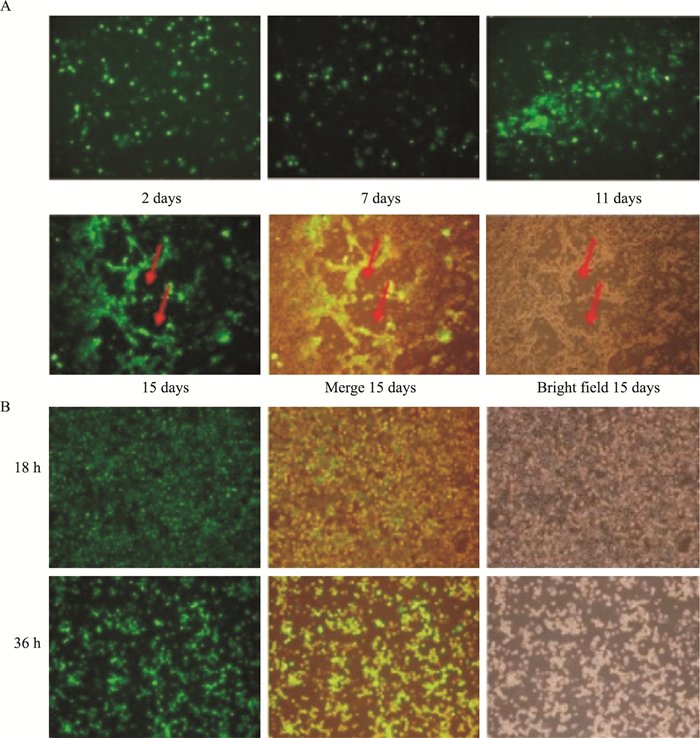
|
| Fig 4 Production of viral plaques and amplification of recombinant adenovirus. A: Tipical CPE in cardiomyocytes after RIP140 virus infection from 2 to 15days; B: The fourth generation of Ad-RIP140 infected cardiomyocytes for 18 and 36h. |
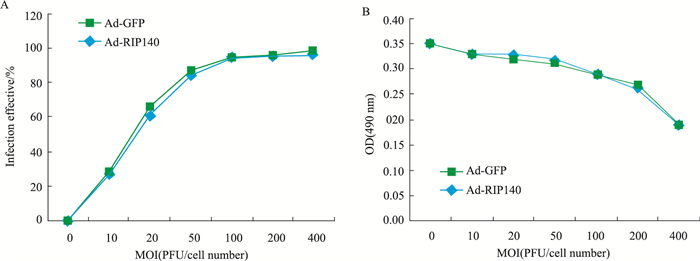
如Fig 5A所示,Ad-RIP140的MOI增加到100时,心肌细胞的病毒感染率达90%以上。相同MOI值情况下Ad-GFP对照组感染率比Ad-RIP140组略高。细胞活力测定结果显示(Fig 5B),Ad-RIP140的MOI值在200以下时,腺病毒本身对心肌细胞的活力并无影响,增高到400时,心肌细胞活力明显下降。结合感染效率和细胞毒性测定所得到的结果,我们认为Ad-RIP140感染心肌细胞合适的MOI为100。
|
| Fig 5 Infection effeciency and cell vitality detection for Ad-RIP140 and Ad-GFP control. Adenovirus infection effeciency (A) and cell vitality detection (B) for Ad-RIP140 and Ad-GFP control at 0 to 400 MOI. |
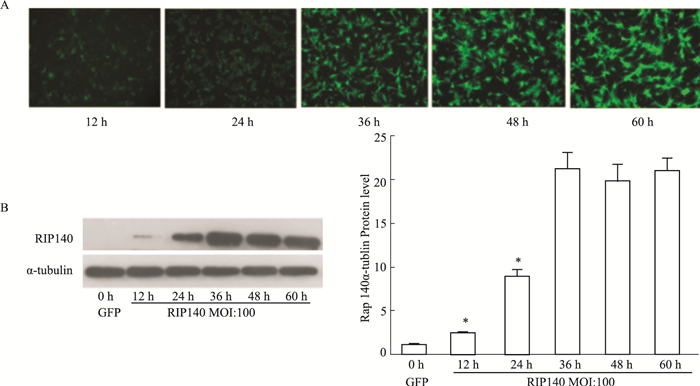
重组腺病毒转染细胞后能否合成外源性蛋白,是腺病毒载体构建成功与否的关键标志。通过荧光显微镜我们观察到病毒随感染滴度升高和感染时间的延长,心肌细胞内GFP荧光的强度逐渐增加(Fig 6A)。给予一定MOI (100)的Ad-RIP140感染心肌细胞,通过Western bolt分析我们观察到心肌细胞外源性RIP140蛋白在感染36h时达最高峰(P < 0.05),之后不再随感染时间的延长而变化(Fig 6B,P > 0.05)。故Ad-RIP140腺病毒病毒感染乳鼠心肌细胞的最佳感染时间为36 h。
|
| Fig 6 Best time of Ad-RIP140 in cardiomyocytes by fluorescence and Western bolt analysis. A:Fluorescence analysis; B: RIP140 protein level by Western bolt analysis in cardiomyocytes after infected Ad-RIP140 at 12 h, 24 h, 36 h, 48h and 60 h.*P < 0.05 vs 0 h. |
心肌细胞是一高度分化的非增殖原代细胞,常用的质粒过表达体系转染心肌细胞最大的问题在于转染率极低,且对于脂质体介导的质粒转染,随脂质体和基因载体用量加大,细胞毒性也明显增大。RIP140基因长达3.5 kb,与普通的质粒载体DNA连接起来有较大困难。重组腺病毒载体作为外源性DNA转入真核细胞的工具,具有高滴度、高感染率、宿主范围广、插入容量大等优点,是用作非增殖细胞过表达工具的最佳选择。
本研究参考He等[5]在1998年建立的腺病毒载体构建的方法,并按Luo等[6]方案加以改进。研究所用的AdEasyTM系统由穿梭质粒pAdTracker-CMV与骨架质粒pAdEasy-1构成。本研究中重组腺病毒构建方案改进主要体现在以下几方面:首先,RIP140目的基因序列过长,若将其直接与穿梭质粒连接,由于后者也接近10 kb,要成功连接并不容易,再者即使连接成功后测序验证也存在难度。所以我们首先将其插入T-载体进行蓝白斑筛选、经测序验证正确后再与穿梭质粒连接,这一改进并不增加实验的繁琐,反而提高了实验的成功率、节约了实验时间,此调整方案可供后续研究者参考。相比较其他重组腺病毒的构建,穿梭载体pAdTracker-CMV融合了巨细胞病毒启动子CMV启动子,并含有表达绿色荧光蛋白的GFP基团,可通过GFP的荧光强度与蛋白表达情况了解腺病毒的产生,省去了烦琐的空斑纯化过程,还能够直接观察感染效率。重组腺病毒基因组DNA的E1区被外源目的基因取代后,进入靶细胞后病毒虽不能复制,但可以表达目的蛋白,外源性蛋白在靶细胞中的表达丰度可通过改变病毒的滴度而变得可控,可为RIP140的后续研究提供可靠的量效分析。E3区的缺失不仅使得插入的外源基因容量扩大,还可以大大降低腺病毒对宿主细胞的免疫原性。早期研究中,腺病毒载体系统转染293A细胞大多采用磷酸钙共转化沉淀法,本研究中利用脂质体作为转染介质,亦得到满意结果,说明该方法可有效地用于腺病毒DNA的转染,可供后续研究者借鉴。
本研究中,利用这种新的腺病毒载体系统,在AD293细胞中成功包装出重组腺病毒Ad-RIP140,参考王爽等[7]选择SFDA和FDA推荐的TCID50方法,基于最高稀释度下AD293细胞中病变效应(CPE)的形成,测定病毒滴度,Ad-RIP140腺病毒最终滴度高达1011 PFU·mL-1。质粒载体转染乳鼠心肌细胞细胞毒性大,外源基因过表达率通常不足20%,而借助腺病毒载体系统,观察到MOI为100时,Ad-RIP140感染乳鼠心肌细胞就高达90%以上,Western blot也进一步验证了目的基因在心肌细胞的高效表达,且MOI在200以下对细胞活力均无影响。总之,Ad-RIP140感染乳鼠心肌细胞符合了高滴度、高感染率、高容量插入、低细胞毒性等优点。通过成功制备表达RIP140基因的重组腺病毒载体,并使其在原代乳鼠心肌细胞中获得高效、稳定、安全的表达,有利于进一步研究RIP140在心肌能量代谢中的调控作用。
( 致谢: 本研究内容的腺病毒穿梭载体pAdTracker-CMV与骨架载体pAdEasy-1由中山大学生命科学院实验室提供,在中山大学药学院药理毒理实验室完成。 )
| [1] | Docquier A, Augereau P, Lapierre M, et al. The RIP140 gene is a transcriptional target of E2F1[J]. PloS One, 2012, 7 (5): e35839. doi:10.1371/journal.pone.0035839 |
| [2] | Fritah A, Steel J H, Parker N, et al. Absence of RIP140 reveals a pathway regulating glut4-dependent glucose uptake in oxidative skeletal muscle through UCP1-mediated activation of AMPK[J]. PloS One, 2012, 7 (2): e32520. doi:10.1371/journal.pone.0032520 |
| [3] | Fritah A, Steel J H, Nichol D, et al. Elevated expression of the metabolic regulator receptor-interacting protein 140 Results in cardiac hypertrophy and impaired cardiac function[J]. Cardiovascular Res, 2010, 86 (3): 443-51. doi:10.1093/cvr/cvp418 |
| [4] | 陈艳芳, 刘培庆. RIP140/PGC-1a在AngII调节心肌能量代谢中的作用研究[J]. 中国药理学通报, 2015, 31 (2) : 194-8. Chen Y F, Liu P Q. The role of RIP140 and PGC-1α in the Angiotensin II mediated energy metabolism in cardiomyocytes[J]. Chin Pharmacol Bull, 2015, 31 (2): 194-8. |
| [5] | He T C, Zhou S, da Costa L T, et al. A simplified system for generating recombinant adenoviruses[J]. Proc Natl Acad Sci USA, 1998, 95 (5): 2509-14. doi:10.1073/pnas.95.5.2509 |
| [6] | Luo J, Deng Z L, Luo X, et al. A protocol for rapid generation of recombinant adenoviruses using the AdEasy system[J]. Nat Protoc, 2007, 2 (5): 1236-47. doi:10.1038/nprot.2007.135 |
| [7] | 王爽, 许坚吉, 刘晓霓, 陈德喜. 人ASPP2重组腺病毒质量控制研究[J]. 中国药理学通报, 2016, 32 (6) : 881-5. Wang S, Xu J J, Liu X N, Chen D X. Quality control of human ASPP2 recombinant adenovirus[J]. Chin Pharmacol Bull, 2016, 32 (6): 881-5. |

