


2. 重庆医科大学 基础医学院解剖学教研室 重庆 400016;
3. 重庆医科大学 神经科学研究中心, 重庆 400016;
4. 北京大学医学部基础医学院药理学系, 北京 100191
 ,
RAN Jian-hua2,3
,
RAN Jian-hua2,3
 ,
LI Jing1,
CHEN Di-long1,
YANG Bao-xue4,
HE Fei2,3,
XIONG Wei1,
SHI Xue-ping1,
LI Hai-xing1
,
LI Jing1,
CHEN Di-long1,
YANG Bao-xue4,
HE Fei2,3,
XIONG Wei1,
SHI Xue-ping1,
LI Hai-xing1
2. Dept of Anatomy, Chongqing 400016;
3. Neuroscience Research Center, Chongqing Medical University, Chongqing 400016;
4. Dept of Pharmacology, School of Basic Medical Science, Beijing 100191
白血病是以恶性克隆性白血病细胞增殖异常、分化障碍、凋亡受阻和正常造血受抑制为特点的造血系统恶性疾病,其发病机制非常复杂,与染色体断裂、易位所引起的癌基因激活、抑癌基因失活等多种因素有关[1]。临床上,白血病的分型复杂,发病机制尚未完全阐明。目前的治疗手段以化疗为主而疗效欠佳,需要寻找新的治疗药物。
注射用核糖核酸Ⅱ(商品名BP素)是从牛胰腺提取的高纯度、具有生物活性的核糖核酸,有抗肿瘤和提高免疫功能的作用[2]。临床上,采用注射用核糖核酸Ⅱ治疗肝癌、肺癌、乳腺癌、胰腺癌及宫颈癌等已有报道,而对白血病的治疗及机制研究极为有限。此前有研究发现注射用核糖核酸Ⅱ具有抑制白血病K562细胞增殖的作用,而对正常细胞无明显影响,其作用机制不清[3]。目前对注射用核糖核酸Ⅱ治疗机制的研究证实,其除了具有提高免疫功能的作用外,抑制肿瘤细胞DNA的复制也是其重要的抗肿瘤机制之一[4]。DNA损伤激活凋亡相关信号通路、诱导细胞凋亡是多种抗癌药物疗效的重要机制[5]。p53作为肿瘤抑制因子,在DNA损伤诱导细胞凋亡过程中具有关键作用[6]。注射用核糖核酸Ⅱ抑制K562细胞增殖的作用是否与诱导白血病细胞凋亡有关尚未见报道。因此我们的研究拟通过体外实验验证注射用核糖核酸Ⅱ对白血病细胞系K562和KG1a细胞的增殖抑制作用,以及对细胞凋亡的影响,并检测p53及凋亡相关蛋白的表达变化,探讨注射用核糖核酸Ⅱ治疗白血病的机制。
1 材料与方法 1.1 主要实验材料和试剂人白血病细胞株(K562细胞)来源于ATCC;人白血病细胞株(KG1a细胞)为重庆医科大学检验系血液学实验室惠赠;注射用核糖核酸Ⅱ(BP素,规格50mg)由吉林敖东药业集团延吉股份有限公司提供;胎牛血清、RPMI 1640培养基购自美国Gibco公司;Hochest 33258染液、青霉素-链霉素溶液(100 X)、BCA蛋白浓度测定试剂盒(增强型)、RIPA裂解液(强)、PMSF (100 nmol·L-1)、SDS-PAGE凝胶配制试剂盒购自碧云天生物技术有限公司;6孔板和96孔板购自Falcon Plastics公司;CCK-8试剂盒(cell counting Kit-8)购自日本株式会社同仁化学研究所;β-actin抗体、兔抗人IgG抗体购自巴傲得生物科技有限公司;p53、Bcl-2、Bax和cleaved caspase-3抗体购自沈阳万类科技有限公司;PVDF膜和ECL显色剂购自Miliproe公司。
1.2 方法 1.2.1 细胞培养人白血病K562和KG1a细胞培养基体系由90% RPMI 1640培养基加10%胎牛血清再加1%青霉素-链霉素溶液混合组成。所有细胞均置于37℃、5% CO2孵箱中培养,每隔24 h观察细胞状态,每2~3 d换液传代。
1.2.2 注射用核糖核酸Ⅱ的配制将500 μL高温消毒后的DEPC水加入50 mg的注射用核糖核酸Ⅱ粉末中使之充分溶解,配制成浓度为100 g·L-1的储存液,-20℃储存。实验前以100 mL·L-1的胎牛血清RPMI 1640培养基稀释至所需浓度。
1.2.3 CCK-8方法检测K562和KG1a细胞增殖抑制率取对数生长期的K562或KG1a细胞,调整细胞数为1×109·L-1,取1 mL稀释至25 mL接种于96孔板,每孔200 μL。设空白对照组:10%胎牛血清的RPMI 1640培养基;Control组:含有细胞10%胎牛血清的RPMI 1640培养基;注射用核糖核酸Ⅱ组:加入终浓度为100、150、200 mg·L-1的注射用核糖核酸Ⅱ;每组分别设5个复孔。培养12、24、48 h后,每孔加入10 μL CCK-8工作液,轻轻震荡使之混匀,于37℃、5% CO2饱和湿度下继续培养2 h。在450 nm波长处检测各孔吸光度值(A值),并计算细胞生长抑制率和各时间点的半数抑制浓度(half inhibitory concentration,IC50),以IC50为标准确定药物最适作用浓度和时间,实验重复3次。
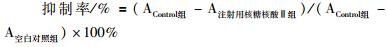
|
取对数生长期的K562或KG1a细胞,调整细胞数为1×109·L-1,取0.5 mL稀释至12.5 mL接种于6孔板,每孔3 mL。实验分组:Control组:含有细胞10%胎牛血清的RPMI 1640培养基;终浓度为100、150、200 mg·L-1的注射用核糖核酸Ⅱ,于37℃、5% CO2饱和湿度下继续培养24 h,收集各组细胞,用预冷的0.01 mol·L-1 PBS (pH 7.2)漂洗细胞2次,4℃,1 000×g,离心5 min。每组样本测定3×104个细胞上流式细胞仪检测采用CellQuest软件分析得出细胞凋亡率,实验重复3次。
1.2.5 Hoechst 33258染色实验取对数生长期的K562和KG1a细胞,调整细胞数为1×109·L-1,接种于6孔板,每孔3 mL。实验分组:Control组:含有细胞10%胎牛血清的RPMI 1640培养基;终浓度为100、150、200 mg·L-1的注射用核糖核酸Ⅱ,于37℃,5% CO2饱和湿度下继续培养24 h,收集各组细胞,用预冷的0.01 mol·L-1 PBS (pH7.2)漂洗细胞2次,4℃,1 000×g, 离心5 min。加甲醇:乙醇(3 :1)固定液固定15 min,离心去除固定液加Hoechst 33258染色液,避光室温染色30 min,PBS洗5次,再加上PBS制成细胞悬液滴在载玻片上,50%甘油封片,置于荧光显微镜下观察、采图,实验重复3次。
1.2.6 Western blot取对数生长期的K562或KG1a细胞,调整细胞数为1×109·L-1,取0.5 mL稀释至12.5 mL接种于6孔板,每孔3 mL。实验分组:Control组:含有细胞10%胎牛血清的RPMI 1640培养基;终浓度为100、150、200 mg·L-1的注射用核糖核酸Ⅱ,于37℃,5% CO2饱和湿度下继续培养24 h,收集各组细胞,用预冷的0.01 mol·L-1 PBS (pH7.2)漂洗细胞2次,4 ℃, 1 000×g, 离心5 min。将细胞裂解液、1% PMSF冰上混匀,加100 μL至细胞中,用枪吹打,置于冰上10 min,然后涡旋混匀,重复3次,4 ℃, 12 000×g, 离心15 min,取上清液即为所提细胞总蛋白,BCA法检测各组蛋白浓度。按每孔50 μg上样,80 V~120 V进行SDS-PAGE凝胶电泳,250 mA 30~60 min将蛋白转移到PVDF膜上,5% BSA溶液37℃封闭2 h,一抗孵育过夜(p53 1 :1 000, Bcl-2 1 :1 000, Bax 1 :500, cleaved caspase-3 1 :500, β-actin 1 :10 000),TBST洗膜3次,每次15 min,二抗37℃孵育30 min (1 :10 000),TBST洗膜3次,每次30 min,ECL发光液孵育30 s,ChemiDOC Touch imaging system (BIO-RAD)机器曝光,使用配套软件检测灰度值,p53、Bcl-2、Bax、cleaved caspase-3比β-actin灰度值。
1.3 统计学方法本实验采用SPSS 22.0版本统计软件包处理。进行独立样本t检验。
2 结果 2.1 注射用核糖核酸Ⅱ能有效抑制人白血病细胞K562和KG1a增殖运用CCK-8法检测注射用核糖核酸Ⅱ对K562和KG1a细胞增殖抑制率。分别用终浓度为100、150、200、250、300 mg·L-1的注射用核糖核酸Ⅱ作用于K562和KG1a细胞12、24、48 h,K562和KG1a细胞的增殖受到明显抑制,与空白对照组相比,差异有统计学意义(P < 0.05)。注射用核糖核酸Ⅱ作用于K562细胞12, 24, 48 h的半数致死浓度(IC50)分别为171.6、165.0、127.9 mg·L-1,注射用核糖核酸Ⅱ作用于KG1a细胞12、24、48 h的半数致死浓度(IC50)分别为172.6、156.0、120.7 mg·L-1。由Fig 1可见,注射用核糖核酸Ⅱ对K562和KG1a细胞的抑制率呈时间效应和剂量效应。
|
| Fig 1 Inhibitory effect of ribonucleic acid Ⅱon K562/KG1a by CCK-8 assay A:Inhibitory effect of ribonucleic acid Ⅱ on K562 after treatment for 12, 24, 48 h; B: Inhibitory effect of ribonucleic acid Ⅱ on KG1a after treatment for 12, 24, 48 h |
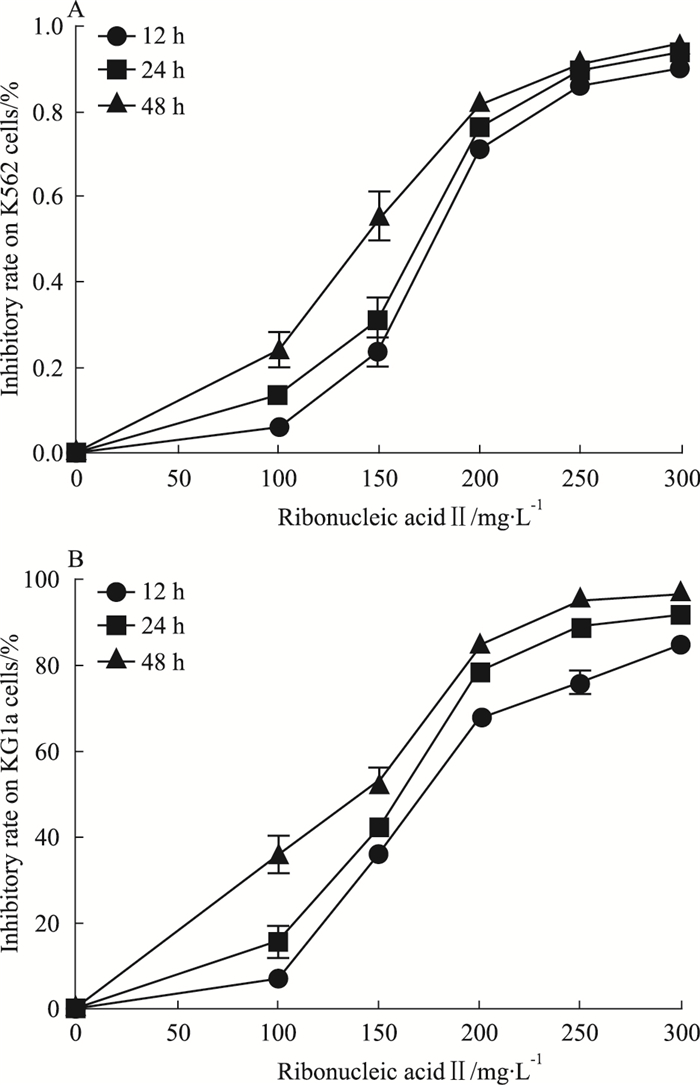
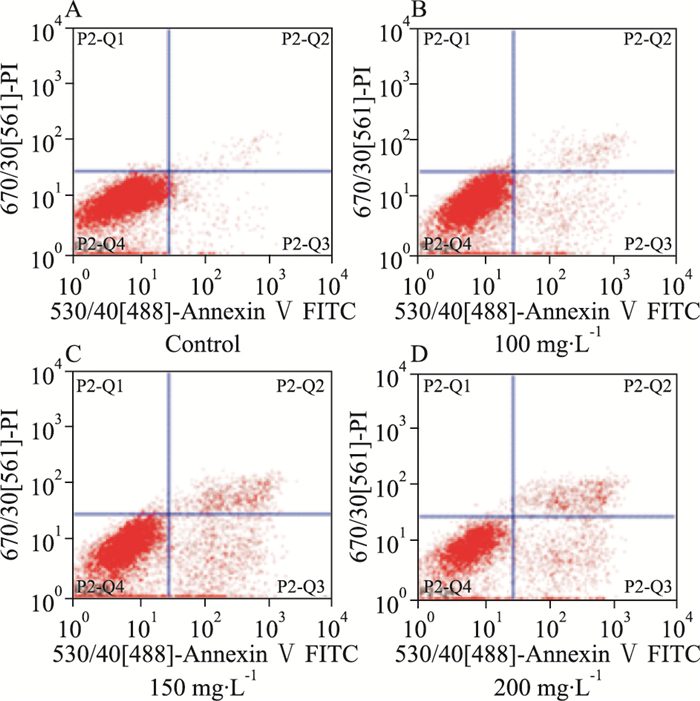
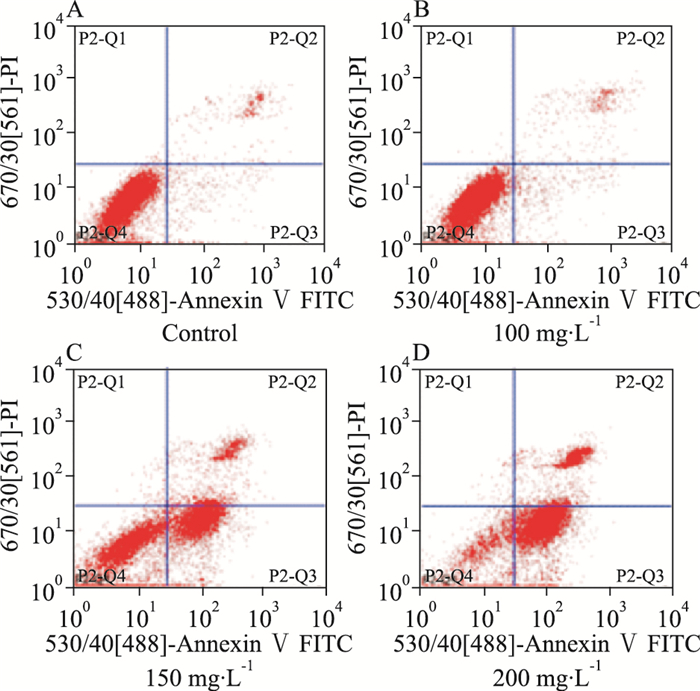
FCM检测结果显示,100、150、200 mg·L-1注射用核糖核酸Ⅱ能够诱导人白血病K562和KG1a细胞凋亡,其中K562细胞的凋亡率分别为9.21%、15.8%、29.36%, 与空白组4.75%相比,差异具有统计学意义(P < 0.05);KG1a细胞的凋亡率分别为10.06%、56.49%、77.24%,与空白组6.91%相比,差异具有统计学意义(P < 0.05)。由Tab 1、2可见,K562和KG1a细胞的凋亡率随药物作用浓度的增加而逐渐上升,提示注射用核糖核酸Ⅱ抑制人白血病K562和KG1a细胞的增殖活性与其诱导细胞凋亡有关。
| Ribonucleic acid Ⅱ/mg·L-1 | Apoptosis rate/% |
| 0 | 4.75±0.12 |
| 100 | 9.21±0.61* |
| 150 | 15.80±4.34* |
| 200 | 29.36±2.67* |
| *P < 0.05 vs control | |
| Ribonucleic acid Ⅱ/mg·L-1 | Apoptosis rate/% |
| 0 | 6.91±0.09 |
| 100 | 10.06±0.42* |
| 150 | 56.49±5.91* |
| 200 | 77.24±5.61* |
| *P < 0.05 vs control | |
K562和KG1a细胞经100、150、200 mg·L-1注射用核糖核酸Ⅱ诱导24 h后染色,在荧光显微镜下观察可见,空白对照组发出均匀、淡蓝色荧光,未见凋亡细胞;而注射用核糖核酸Ⅱ处理的各组均出现核染色质浓缩聚集、核碎裂、核边集及发出蓝白色荧光等典型的细胞凋亡特征,凋亡改变随药物作用浓度升高而更加明显。
2.4 注射用核糖核酸Ⅱ诱导人白血病细胞K562和KG1a调控细胞凋亡相关蛋白的表达K562和KG1a细胞经100、150、200 mg·L-1注射用核糖核酸Ⅱ诱导24 h后收集细胞提取总蛋白进行凝胶电泳分析。Western blot法检测结果显示,p53、Bax和cleaved caspase-3蛋白表达水平随注射用核糖核酸Ⅱ药物浓度的增高而表达上调,而Bcl-2蛋白表达水平逐渐降低,与空白对照组相比,差异具有统计学意义(P < 0.05)。提示注射用核糖核酸Ⅱ可能是通过上调p53调控Bcl-2/Bax的表达,激活caspase-3促进K562和KG1a细胞凋亡。
|
| Fig 2 Effect of ribonucleic acid Ⅱon cell apoptosis of K562 cells A: Control; B: 100 mg·L-1; C:150 mg·L-1; D: 200 mg·L-1 |
|
| Fig 3 Effect of ribonucleic acid Ⅱon cell apoptosis of KG1a cells A:Control; B: 100 mg·L-1; C: 150 mg·L-1; D: 200 mg·L-1 |
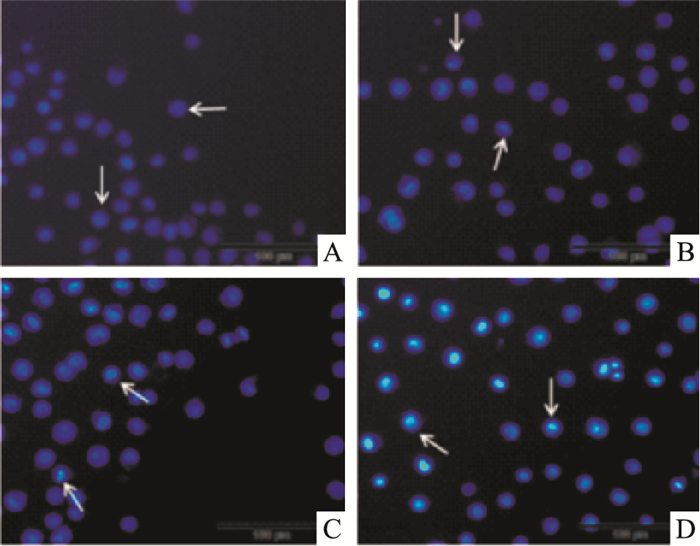
|
| Fig 4 Hoechst 33258 staining after ribonucleic acid Ⅱ induced K562 for 24 h (The arrow points to the apoptotic cell) A:Control; B:100 mg·L-1; C:150 mg·L-1; D:200 mg·L-1 |
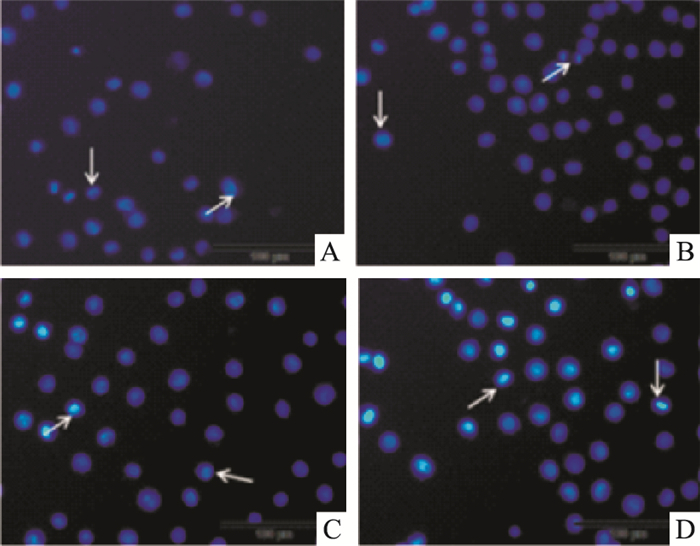
|
| Fig 5 Hoechst 33258 staining after ribonucleic acidⅡ induced KG1a for 24 h (The arrow points to the apoptotic cell) A:Control; B:100 mg·L-1; C:150 mg·L-1; D:200 mg·L-1 |
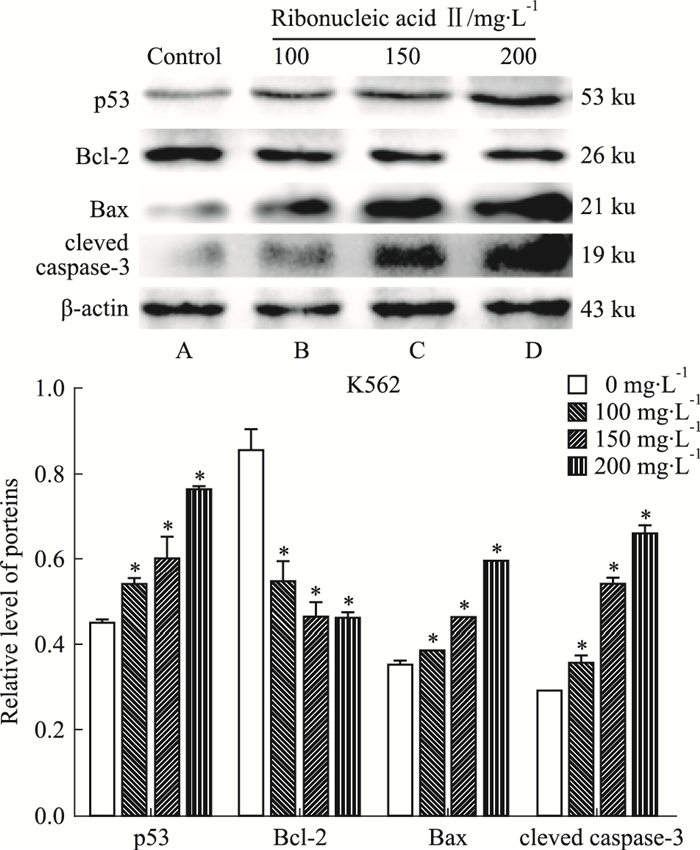
|
| Fig 6 Expression of proteins in K562 cellsafter ribonucleic acid Ⅱ treatment for 24 hours A:Control; B:100 mg·L-1; C:150 mg·L-1; D:200 mg·L-1. *P < 0.05 vs control |
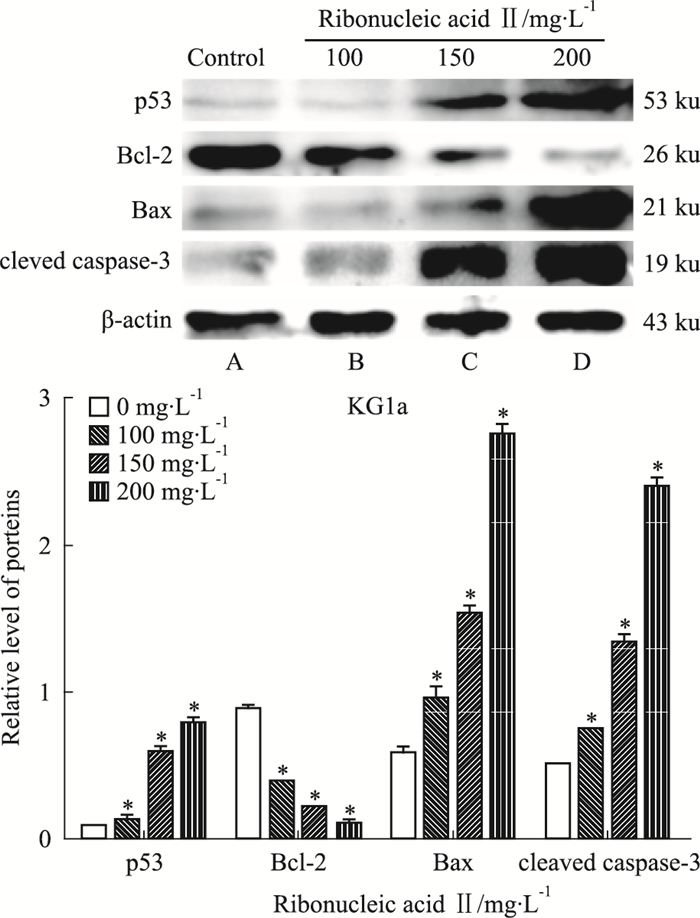
|
| Fig 7 Expression of proteins in KG1a cells afterribonucleic acid Ⅱ treatment for 24 hours A:Control; B:100 mg·L-1; C:150 mg·L-1; D:200 mg·L-1. *P < 0.05 vs control |
白血病在我国的发病率为十万分之六左右,居肿瘤发病率第6位,还因其在儿童恶性肿瘤发病率中居于前列,受到了众多学者的关注。虽然临床上对白血病的治疗进行了不懈的努力和尝试,采用了骨髓移植、化疗等方法,但因其治疗价格昂贵、配型困难、副作用多等不利因素影响了白血病的治疗效果,寻找价格低廉而疗效明显的药物迫在眉睫。注射用核糖核酸Ⅱ在抗癌及增强免疫功能方面的作用为其治疗白血病提供新的方向。
目前已有临床上采用注射用核糖核酸Ⅱ治疗肝癌、肺癌等肿瘤的报道,但对其抗癌作用的机制研究较少[7]。本研究运用CCK-8法检测注射用核糖核酸Ⅱ对慢性粒细胞白血病细胞K562和急性髓系白血病细胞KG1a的增殖抑制作用,结果提示,100~300 mg·L-1的药物在12、24、48 h均可明显抑制上述两种细胞的增殖,并且对急慢性白血病细胞的抑制率均呈时间和剂量依赖性。研究不仅证实了注射用核糖核酸Ⅱ对急慢性白血病细胞的增殖抑制作用,并且在不同时间点的药物较此前研究活性更好[3],这可能与药物的批次、作用时间和细胞状态不同等因素有关。有研究报道,注射用核糖核酸Ⅱ的抗肿瘤作用与DNA损伤有关,而DNA损伤与细胞凋亡关系密切;因此注射用核糖核酸Ⅱ对白血病细胞的增殖抑制作用是否与凋亡有关值得深入研究。
研究采用了FCM和Hoechst染色两种方法检测了注射用核糖核酸Ⅱ对白血病细胞凋亡的影响。FCM检测结果显示,100、150、200 mg·L-1注射用核糖核酸Ⅱ诱导K562细胞的凋亡率分别为9.21%、15.8%、29.36%;KG1a细胞的凋亡率分别为10.06%、56.49%、77.24%,提示注射用核糖核酸Ⅱ能有效诱导急慢性白血病细胞的凋亡。与此同时,采用相同浓度的注射用核糖核酸Ⅱ诱导急慢性白血病细胞,出现了核染色质浓缩聚集、核碎裂、核边集等典型的凋亡变化,凋亡形态变化的程度与凋亡率的改变一致;但注射用核糖核酸Ⅱ诱导白血病细胞凋亡的机制尚不清楚。
p53是人体抑癌基因,其失活对肿瘤的形成具有举足轻重的作用,因而成为药物治疗白血病机制研究中的关键靶点[8]。p53可在DNA受损后通过维持基因组稳定参与DNA的修复过程[9]。p53可通过影响Bcl-2/Bax和cleaved caspase-3等蛋白的表达和活性实现对细胞凋亡过程的调控作用[10]。Bcl-2基因是恶性肿瘤中最为重要的抗凋亡基因,Bax基因通过组成同源二聚体或与Bcl-2组成异源二聚体抑制Bcl-2的作用而发挥促进细胞凋亡的功能[11-12]。caspase-3是细胞凋亡过程中最主要的终末剪切酶, 是细胞凋亡蛋白酶级联反应的必经之路[13]。Bcl-2/Bax通过促进细胞色素C在内的多种促凋亡蛋白的释放,激活caspase家族,产生caspase级联反应导致细胞凋亡的发生[14]。本实验采用100、150、200 mg·L-1注射用核糖核酸Ⅱ分别诱导K562和KG1a细胞24h后的蛋白印迹结果显示,p53、Bax和cleaved caspase-3蛋白表达水平随注射用核糖核酸Ⅱ药物浓度的增高而表达上调,而Bcl-2蛋白表达水平降低,提示注射用核糖核酸Ⅱ可能是通过上调p53来调控Bcl-2/Bax的表达,激活caspase-3进而对K562和KG1a细胞的凋亡产生影响,而注射用核糖核酸Ⅱ又是通过何种机制上调p53表达调控细胞凋亡的发生还需要进一步的研究证实。
综上所述,注射用核糖核酸Ⅱ可通过诱导细胞凋亡发挥其抑制急慢性白血病细胞的增殖作用,而其凋亡的机制与上调p53,调控Bcl-2/Bax的表达,激活caspase-3有关,深入探讨p53上下游凋亡有关的信号分子改变可为注射用核糖核酸Ⅱ治疗白血病提供实验依据。
( 致谢: 此研究在重庆医科大学基础医学院组织细胞工程与干细胞研究室及解剖学教研室实验室完成,特此感谢! )
| [1] | Tabarestani S, Movafagh A. New developments in chronic myeloid leukemia: implications for therapy[J]. Iran J Cancer Prev, 2016, 9 (1): e3961. |
| [2] | 李学哲, 朴惠顺. BP素对中晚期肺癌、胃癌及肝癌的疗效观察[J]. 中国医药指南, 2013 (33) : 8-9. Li X Z, Piao H S. Clinlical study on median advanced lung cancer, stomach cancer and liver cancer treated by BP[J]. Guid China Med, 2013 (33): 8-9. |
| [3] | 王灿, 林上炎, 吴利红, 等. 注射用核糖核酸Ⅱ的抗肿瘤活性测定[J]. 中国医药工业杂志, 2015, 46 (04) . Wang C, Lin S Y, Wu L H, et al. Determinaion of anti-carcinoma activity of ribonucleic acid Ⅱ[J]. Chin J Pharm, 2015, 46 (04). |
| [4] | 胡和平, 王国英. 注射用核糖核酸Ⅱ配合放化疗治疗恶性肿瘤临床观察[J]. 临床医药实践, 2010, 19 (3) : 119. Hu H P, Wang G Y. Clinical observation on the treatment of malignant tumor with the use of RNA Ⅱ injection combined with radiotherapy[J]. Proce Clin Med, 2010, 19 (3): 119. |
| [5] | Yu Q. Restoring p53-mediated apoptosis in cancer cells: new opportunities for cancer therapy[J]. Drug Resist Updat, 2006, 9 (1-2): 19-25. doi:10.1016/j.drup.2006.03.001 |
| [6] | Talukder K A, Azmi I J, Ahmed K A, et al. Activation of p53/ATM-dependent DNA damage signaling pathway by shiga toxin in mammalian cells[J]. Microb Pathog, 2012, 52 (6): 311-7. doi:10.1016/j.micpath.2012.02.007 |
| [7] | 霍小位, 王灿红, 马晓玲, 等. 注射用免疫核糖核酸II的免疫调节及对顺铂的增效减毒作用[J]. 中国医药生物技术, 2016, 11 (1) : 32-7. Huo X W, Wang C H, Ma X L, et al. Immunomodulatory effects and Synergistic attenuated antitumor effect of RNA Ⅱ injection combined with cis-dichlorodamineplatinum[J]. Chin Med Biotechnol, 2016, 11 (1): 32-7. doi:10.1186/s13020-016-0101-1 |
| [8] | Chipuk J E, Green D R. Dissecting p53-dependent apoptosis[J]. Cell Death Differ, 2006, 13 (6): 994-1002. doi:10.1038/sj.cdd.4401908 |
| [9] | Cheung KJ, Mitchell D, Lin P, et al. The tumor suppressor candidate p33(ING1) mediates repair of UV-damaged DNA[J]. Cancer Res, 2001, 61 (13): 4974-7. |
| [10] | Tam C S, Seymour J F, Roberts A W. Progress in BCL2 inhibition for patients with chronic lymphocytic leukemia[J]. Semin Oncol, 2016, 43 (2): 274-9. doi:10.1053/j.seminoncol.2016.02.014 |
| [11] | 宋金莲, 马中良, 迟晓伟, 等. 天然活性分子isatin经p53介导的线粒体途径诱导乳腺癌细胞MCF-7凋亡[J]. 中国药理学通报, 2016, 32 (6) : 773-8. Song J L, Ma Z L, Chi X W., et al. The endogenous oxindole isatin induces apoptosis of MCF-7 breast cancer cells through a p53-mediated mitochondrial pathway[J]. Chin Pharmacol Bull, 2016, 32 (6): 773-8. |
| [12] | Gerber J M, Qin L, Kowalski J, et al. Characterization of chronic myeloid leukemia stem cells[J]. Am J Hematol, 2011, 86 (1): 31-7. doi:10.1002/ajh.v86.1 |
| [13] | Rosati A, Quaranta E, Ammirante M, et al. Quassinoids can induce mitochondrial membrane depolarisation and caspase 3 activation in human cells[J]. Cell Death Differ, 2004, 1112 (9): S216-8. |
| [14] | 连晓岚, 胡建达, 郑志宏, 等. 大黄素诱导白血病U937细胞凋亡及机制初探[J]. 中国药理学通报, 2007, 23 (10) : 1312-6. Lian X L, Hu J D, Zheng Z H, et al. The Effects and Mechanisms of Emodin on Inducing Leukemic U937 cells Apoptosis[J]. Chin Pharmacol Bull, 2007, 23 (10): 1312-6. |