


2. 重庆医科大学药理教研室,重庆 400016
 ,
SHAO Ying1,2,
LI Yang1,2,
CHEN Qian-zhao1,2,
REN Wen-yan1,2,
ZHOU Lin-yun1,2,
ZHOU Yi1,2,
LIU Rong-xing1,2,
HE Bai-cheng1,2
,
SHAO Ying1,2,
LI Yang1,2,
CHEN Qian-zhao1,2,
REN Wen-yan1,2,
ZHOU Lin-yun1,2,
ZHOU Yi1,2,
LIU Rong-xing1,2,
HE Bai-cheng1,2

2. Chongqing Key Laboratory of Biochemistry and Molecular Pharmacology, Chongqing 400016, China
结肠癌是临床常见的一种消化系统恶性肿瘤,每年约有近100万新增结肠癌患者,大约60万的患者死于结肠癌[1]。结肠癌的发生与多种因素有关,其中调节细胞增殖与分化的关键信号通路调节失控被认为是结肠癌的发生的主要原因之一,如TGF-β信号和Wnt/β-catenin信号等[2-3]。其中,TGF-β信号不仅参与调节胚胎的发育和个体内环境平衡,同时也参与调节细胞的增殖与分化。研究显示,TGF-β受体或Smad突变均能明显增加结肠癌的发生危险。近年来,随着对结肠癌发病机制认识的进一步深入和开展早期筛查,其临床治疗已有较大改善,5年生存率也有明显提高[1]。这种提高也与近年来一些靶向药物的成功应用有关,如贝伐单抗和西妥昔单抗等,但结肠癌的治疗效果及预后状况仍不十分理想[4]。因此,临床急需开发新型或高效的结肠癌治疗药物。化疗药物的毒性与癌细胞转移是结肠癌治疗所面临的最主要挑战。传统中药是抗癌药物的重要来源之一,如长春新碱等早已用于结肠癌的治疗[5]。白藜芦醇(resveratrol, Res)又名芪三酚,主要来源于虎杖、葡萄、花生、桑葚等植物[6]。作为一种多酚类物质,Res具有明显的抗氧作用,故可用于防治高血脂、动脉粥样硬化、冠心病以及缺血性心脏病等疾病[7-8]。除此之外,研究表明Res还具有明显的抗肿瘤作用,能有效地抑制多种肿瘤细胞增殖并促进细胞凋亡,如乳腺癌、结肠癌、肺癌和肝癌等[9-10]。到目前为止,Res抗肿瘤作用的机制仍不十分清楚。本研究将进一步分析Res抑制结肠癌细胞增殖的作用及可能的分子机制,为将Res开发成用于治疗和预防结肠癌的药物或辅助药物提供相应的实验基础。
1 材料与方法 1.1 试剂及细胞培养LoVo细胞购自American Type Culture Collection (ATCC)。白藜芦醇(resveratrol, Res)购自西安昊轩生物科技有限公司,所用一抗均购自Santa Cruz Biotechnology公司,ALK2和ALK3抑制剂(LDN-193189)购自赛力克公司(selleck)。LoVo细胞置于37 ℃,5%的CO2孵箱中,采用DMEM高糖培养基(含10%胎牛血清、青霉素100 U·ml-1和链霉素0.1 g·L-1)进行培养。
1.2 实验设计及分组按实验要求,设置对照组和实验组。采用DMSO溶解Res,实验组的细胞采用不同浓度的Res进行处理,对照组细胞则用相同体积的DMSO进行处理。
1.3 结晶紫染色实验将生长良好的LoVo细胞消化后种到24孔板中,等细胞贴壁后用不同浓度的Res (0、10、20、40、60和80 μmol·L-1)或同体积的DMSO进行处理。24 h、48 h或72 h后进行结晶紫染色,检测Res对LoVo细胞增殖能力的影响。具体方法简述如下:弃培养基后用PBS小心清洗24孔板2次,每孔加5%的结晶紫染液(用PBS缓冲的10%甲醛配制)0.5 mL,于室温下孵育20 min。弃结晶紫染液,然后用自来水将24孔板小心清洗干净并置于空气中自然风干,最后进行扫描或定量分析。每组实验重复3次。
1.4 流式细胞术周期和凋亡分析实验将生长状态良好的LoVo细胞均匀种于6孔板,等细胞贴壁以后采用不同浓度的Res (0、20、40和60 μmol·L-1)或同体积的DMSO进行处理。48 h后收集细胞并按试剂盒说明书操作,然后通过流式细胞仪进行周期分析;对细胞进行凋亡分析时,利用不含EDTA的胰酶消化并收集细胞,按试剂盒说明进行实验,最后通过流式细胞仪进行凋亡分析。每组实验重复3次。
1.5 RNA提取及RT-PCR实验将生长状态良好的LoVo细胞消化并种到T25培养瓶,等细胞贴壁后加入不同浓度的Res (0、20、40和60 μmol·L-1)或同体积DMSO进行处理。利用TRIzol法提取总RNA, 然后通过逆转录反应制备cDNA,最后通过PCR检测目的基因mRNA表达水平变化情况。所用引物如下:GAPDH上游引物5′-CAACGAATTTGGCTACAGCA -3′, 下游引物5′-AGGGGAGATTCAGTGTG GTG-3′;BMP9上游引物5′-CCTGGGCACAACAAGGAC-3′, 下游引物5′-CCTTCCCTGGCAGTTGAG-3′;ALK2上游引物5′-AGGGCTCATCACCACCAA-3′, 下游引物5′-TTCCGTTTCCCTGAACCA-3′;ALK3上游引物5′-TCAGATGGTCCGGCAAGT-3′, 下游引物5′-CATGGCGCATTAGCACAG-3′。每组实验重复3次。
1.6 Western blot实验将生长状态良好的LoVo细胞消化后均匀种于6孔板,用不同浓度Res (0、20、40和60 μmol·L-1)或同体积DMSO对细胞进行处理。于相应时间点提取各处理组的总蛋白,按常规方法进行Western blot实验,最后利用ECL试剂盒显影并采集图像。每组实验重复3次。
1.7 统计学分析利用Microsoft office Excel对实验结果进行统计分析,采用t-test进行组间比较,实验数据以x±s表示。
2 结果 2.1 Res对LoVo细胞增殖的影响Res对多种肿瘤细胞具有增殖抑制作用,但具体机制仍不十分清楚。为进一步分析Res抑制结肠癌细胞增殖的机制,本研究首先分析Res对LoVo细胞的增殖影响。结晶紫染色分析结果显示,Res对LoVo细胞的增殖抑制作用呈浓度和时间依赖性增强(Fig 1A)。周期分析结果显示,Res能明显诱导LoVo细胞发生S期阻滞(Fig 1B)。以上实验结果表明,Res对LoVo细胞的增殖具有明显抑制作用。
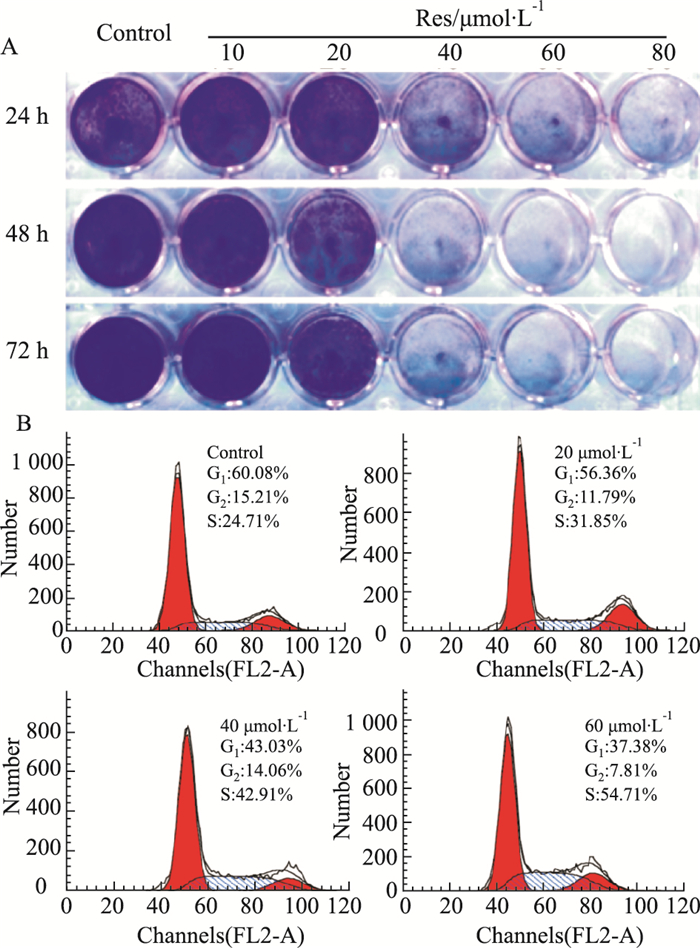
|
| Fig 1 Effects of Res on proliferation in LoVo cells A:Crystal violet staining results showed the effect of Res on proliferation in LoVo cells; B:Flow cytometery analysis results showed the effect of Res on cell cycle arrest in LoVo cells |
抗肿瘤药物多数都能诱导细胞凋亡,因此本研究进一步分析Res对LoVo细胞凋亡的影响。流式分析结果显示,经Res处理后,LoVo细胞凋亡比例明显随药物浓度升高而增加,当Res为20 μmol·L-1时LoVo就已明显出现凋亡(Fig 2)。结果提示, Res对LoVo细胞的凋亡具有促进作用。
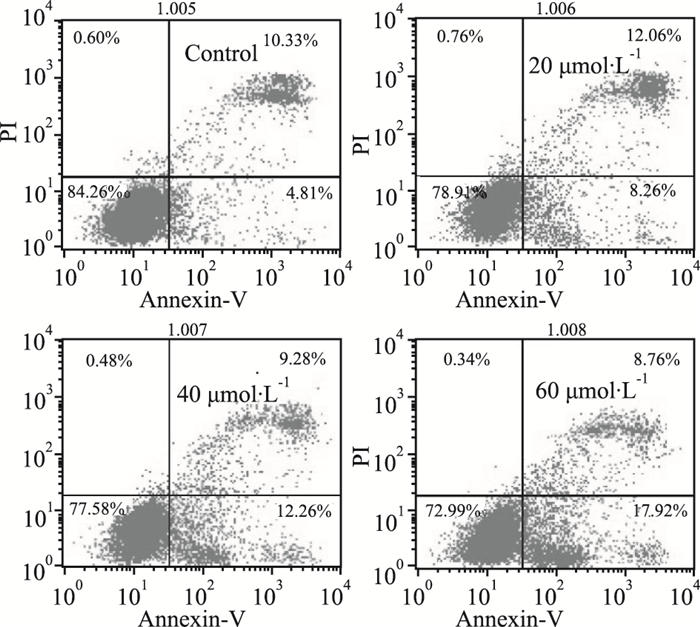
|
| Fig 2 Effects of Res on apoptosis in LoVo cells Flow cytometry analysis results showed the effect of Res on apoptosis in LoVo cells. |
以上实验结果再次证明Res对结肠癌细胞的增殖具有明显抑制作用,但具体机制仍不清楚。骨形态蛋白(bone morphogenetic proteins, BMPs)属于TGF-β超家簇成员,对细胞的增殖分化具有重要调节作用,同时BMPs信号的异常也与结肠癌的发生及发展密切相关。文献报道,BMP9能抑制胃癌细胞的迁移、侵袭和增殖,但目前尚不清楚BMP9是否对结肠癌细胞也有类似的作用。为此本研究首先分析Res在结肠癌细胞中对BMP9表达的影响。RT-PCR检测结果显示,Res能明显促进BMP9的mRNA表达(Fig 3A)。Western blot分析结果显示,经Res处理后LoVo细胞中BMP9蛋白水平也明显升高(Fig 3B)。进一步分析表明,在FHC和几种常见的结肠癌细胞中,BMP9均存在内源性表达;并且BMP9在FHC细胞中的水平明显高于结肠癌细胞(Fig 3C)。结果提示BMP9可能与Res抑制LoVo细胞增殖和诱导凋亡有关。
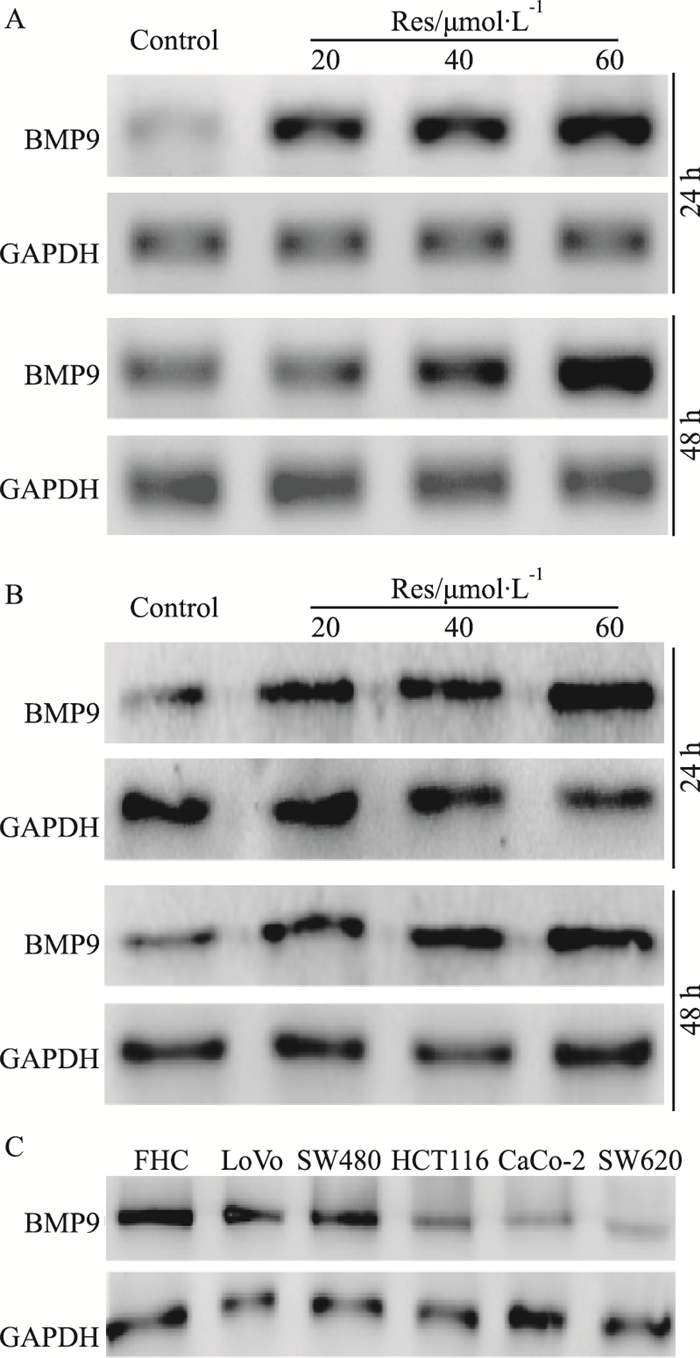
|
| Fig 3 Effects of Res on expression of BMP9 in LoVo cells A: RT-PCR assay results showed the effect of Res on mRNA expression of BMP9 in LoVo cells; B: Western blot analysis results showed the effect of Res on the level of BMP9 in LoVo cells; C: Western blot analysis results showed the endogenous expression of BMP9 in FHC cell and colon cancer cells. |
Res能促进BMP9表达,而BMP9本身对细胞的增殖与分化具有重要调节作用,因此本研究进一步分析BMP9对Res抑制LoVo细胞增殖作用的影响。结果显示,外源性过表达BMP9能明显抑制LoVo细胞增殖(Fig 4A),增强Res对LoVo细胞的S期阻滞作用(Fig 4B),以及增强Res诱导Bad表达和抑制Bcl-2表达的作用(Fig 4C);沉默BMP9虽然不能逆转Res对Bcl-2表达的抑制作用,但能明显减弱Res对Bad表达的诱导作用(Fig 4C)。结果提示,上调BMP9可能参与介导Res对LoVo细胞的增殖抑制和诱导凋亡作用。
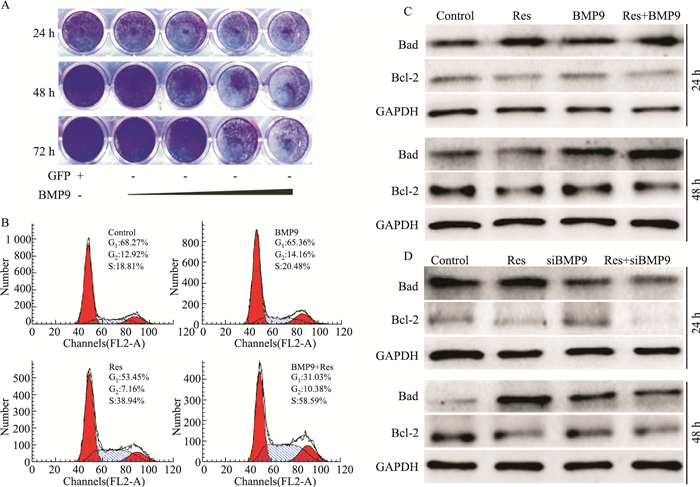
|
| Fig 4 Effects of BMP9 on anti-proliferation and apoptosis inducing effects of Res in LoVo cells A: Crystal violet staining results showed the effect of BMP9 on the proliferation of LoVo cells; B: Flow cytometry assay results showed the effect of BMP9 on Res induced cell cycle arrest in LoVo cells; C: Western blot analysis results showed the effect of exogenous BMP9 on Res-induced apoptosis in LoVo cells; D: Western blot analysis results showed the effect of knockdown BMP9 on Res-induced apoptosis in LoVo cells. |
BMP9与其受体ALK2和ALK3结合,通过经典或非经典BMPs/Smads信号通路发挥各种作用。RT-PCR分析结果显示,Res能明显促进BMP9的受体,即ALK2和ALK3的表达(Fig 5A)。Western blot实验结果显示,经Res处理后虽然BMP9表达明显升高,但并未明显增加Smad1/5/8的磷酸化水平,而是有一定程度降低。提示,BMP9在LoVo细胞中的作用可能与非经典BMPs/Smads信号有关(Fig 5B)。进一步分析表明,抑制ALK2/3能促进LoVo细胞增殖,并减弱Res对LoVo细胞的增殖抑制作用(Fig 5C)。以上结果提示,BMP9可能通过非经典BMPs/Smads信号介导Res对LoVo细胞的增殖抑制作用。
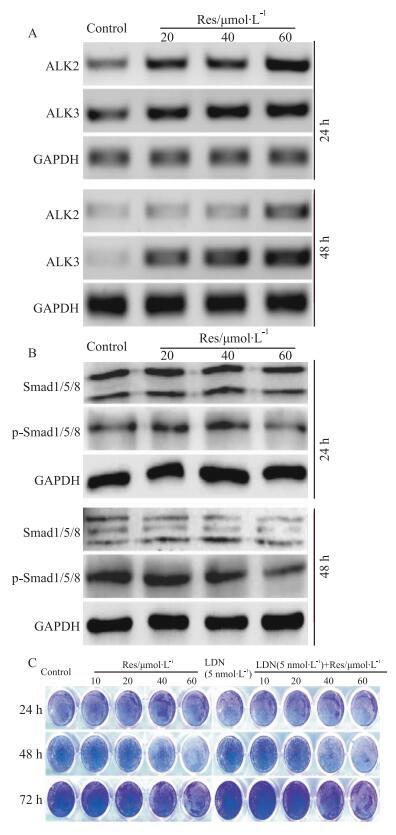
|
| Fig 5 Effects of ALK2/3 inhibitor on the anti-proliferation effect of Res in LoVo cells A: RT-PCR assay results show the effect of Res on the expression of ALK2 and ALK3 in LoVo cells; B: Western blot analysis results show the effect of Res on the phosphorylation of Smad1/5/8 in LoVo cells. (B) Crystal violet staining results show the effect of ALK2/3 inhibitor on the anti-proliferation effect of Res in LoVo cells (LDN: inhibitor for ALK2 and ALK3). |
结肠癌作为一种临床常见的恶性消化系统肿瘤,具有较高的发病率和死亡率,仅次于肝癌、肺癌和胃癌,每年全球约有近60万的患者因结肠癌而死亡[1]。目前治疗结肠癌所面临的主要挑战包括传统化疗药物的严重不良反应以及癌细胞的转移等。虽然对结肠癌的诊断和治疗水平都已有较大程度的提高,但其预后仍不十分乐观。因此,临床急需一些高效而低毒性的抗肿瘤药物。本研究结果显示,Res对人结肠癌LoVo细胞具有明显的增殖抑制和促进凋亡作用;Res的这种作用可能与其促进BMP9及其受体表达有关,但Res促进BMP9表达的详细机制尚不清楚。
结肠癌的发生与多种因素有关,包括生活方式、年龄和基因突变等。文献报道,TGF-β和Wnt/β-catenin等多种信号转导在结肠癌细胞中明显存在异常[2-3]。TGF-β信号在胚胎发育、个体稳态的维持以及调节细胞增殖分化等过程中扮演着重要的角色。BMPs作为TGF-β超家族的成员,与其受体结合后通过经典或非经典BMPs/Smads信号,调节细胞的增殖、分化与凋亡等过程。BMPs信号参与调节多种肿瘤细胞的生物学特性,BMP6能抑制乳腺癌细胞增殖,但促进前列腺癌骨转移并对雄激素耐药[11-12];卵巢癌癌旁间充质干细胞表达部分BMPs成员,其中BMP4和BMP6对肿瘤细胞生长具有促进作用,而BMP2则抑制癌细胞生长[13]。不同BMPs成员对癌细胞增殖的影响不一致,可能与细胞种类以及细胞突变类型及微环境有关。研究表明,在结肠癌细胞中正常的BMPs信号能抑制癌细胞生长,该信号异常与结肠癌发生有关;Samd4缺失明显促进结肠癌细胞转移[14],BMP4能诱导结肠癌细胞分化并增加其对化疗药物的敏感性[15]。BMP9是目前已发现的诱导干细胞成骨分化最强的因子之一,同时对多种肿瘤细胞的增殖也具有明显影响,如抑制乳腺癌细胞增殖和促进骨肉瘤细胞增殖[16-17]。到目前为止,BMP9对结肠癌细胞的影响还不清楚。
Res是一种天然的多酚类物质,主要来源于葡萄、虎杖、花生、桑葚等植物。因具有明显的抗氧化作用,所以Res可用于相关心血管疾病的防治,如动脉粥样硬化等。近来越来越多的研究表明,Res具有明显的抗肿瘤作用,能抑制多种肿瘤细胞的增殖并促进其凋亡,如肺癌、肝癌、乳腺癌和结肠癌细胞等[9-10]。Res的抗肿瘤作用机制可能与增强p53功能、抑制Wnt/β-catenin和促进PTEN表达等有关[18-19],但具体作用机制仍不清楚。
课题组前期研究已证实Res对结肠癌细胞的增殖具有抑制作用,机制可能与促进PTEN表达有关[20];由于BMP9在促进干细胞成骨分化的过程中,能明显抑制PTEN表达,所以课题组推测Res抑制结肠癌细胞增殖可能与抑制BMP9表达有关。结果显示,Res不仅不抑制BMP9表达,而且明显促进BMP9表达;BMP9在正常结肠上皮细胞FHC中的表达水平明显高于在结肠癌细胞中的表达水平(Fig 3)。提示BMP9可能对结肠上皮细胞的增殖具有重要调控作用并参与Res对结肠癌细胞的增殖抑制作用。进一步分析表明,外源性过表达BMP9能抑制LoVo细胞的增殖,并明显增强Res对结肠癌细胞的增殖抑制作用(Fig 4A,B);外源性过表达BMP9明显增强Res诱导LoVo凋亡的作用,而沉默BMP9则能部分逆转Res对LoVo细胞的这种作用(Fig 4C,D)。因此Res抑制LoVo细胞增殖可能与其促进BMP9表达有关。BMP9与其受体结合后可通过经典与非经典BMPs/Smads信号发挥作用。结果显示, Res能促进BMP9的受体(ALK2和ALK3)表达,但并不能增加Smad1/5/8的磷酸化水平;同时,抑制ALK2和ALK3明显减弱Res对LoVo细胞增殖的抑制作用(Fig 5)。提示,在LoVo细胞中,BMP9可能通过非经典的BMPs/Smads信号发挥对细胞增殖的抑制作用。
本研究结果证实Res能明显抑制结肠癌细胞的增殖,具有潜在治疗和预防结肠癌的作用;Res可能通过促进BMP9表达并激活非经典BMPs/Smads信号通路实现这种作用,但具体机制仍不清楚。课题组将进一步分析Res在结肠癌细胞中促进BMP9表达及抑制结肠癌细胞增殖的可能分子机制,研究结果将有利于促进Res的临床应用开发。
( 致谢: 本研究主要在重庆市生物化学与分子药理学重点实验室完成。课题组感谢芝加哥大学何通川(Tongchuan He)教授为本研究提供所需的重组腺病毒载体(BMP9和GFP) )
| [1] | Tárraga López P J, Albero J S, Rodriguez-Montes J A. Primary and secondary prevention of colorectal cancer[J]. Clin Med Insights Gastroenterol, 2014, 7 : 33-46. |
| [2] | Bellam N, Pasche B. Tgf-beta signaling alterations and colon cancer[J]. Cancer Treat Res, 2010, 155 : 85-103. doi:10.1007/978-1-4419-6033-7 |
| [3] | Sebio A, Kahn M, Lenz H J. The potential of targeting Wnt/β-catenin in colon cancer[J]. Expert Opin Ther Targets, 2014, 18 (6): 611-5. doi:10.1517/14728222.2014.906580 |
| [4] | Tol J, Punt C J. Monoclonal antibodies in the treatment of metastatic colorectal cancer:a review[J]. Clin Ther, 2010, 32 : 437-53. doi:10.1016/j.clinthera.2010.03.012 |
| [5] | Sun Q L, Zhao C P, Wang T Y, et al. Expression profile analysis of long non-coding RNA associated with vincristine resistance in colon cancer cells by next-generation sequencing[J]. Gene, 2015, 572 (1): 79-86. doi:10.1016/j.gene.2015.06.087 |
| [6] | Wang K H, Lai Y H, Chang J C, et al. Germination of peanut kernels to enhance resveratrol biosynthesis and prepare sprouts as a functional vegetable[J]. J Agric Food Chem, 2005, 53 (2): 242-6. doi:10.1021/jf048804b |
| [7] | Petrovski G, Gurusamy N, Das D K. Resveratrol in cardiovascular health and disease[J]. Ann N Y Acad Sci, 2011, 1215 : 22-33. doi:10.1111/j.1749-6632.2010.05843.x |
| [8] | 孙杰, 孙文佳, 陈北冬, 等. 白藜芦醇降低ox-LDL诱导血小板ROS产生和PECAM-1表达的分子机制研究[J]. 中国药理学通报, 2015, 31 (11) : 1608-14. Sun J, Sun W J, Chen B D, et al. Effect of resveratrol on ROS production and PECAM-1 expression in ox-LDL-stimulated platelets[J]. Chin Pharmacol Bull, 2015, 31 (11): 1608-14. |
| [9] | Singh C K, Ndiaye M A, Ahmad N. Resveratrol and cancer:Challenges for clinical translation[J]. Biochim Biophys Acta, 2015, 1852 (6): 1178-85. doi:10.1016/j.bbadis.2014.11.004 |
| [10] | 刘理静, 钱红, 张平, 等. 白藜芦醇对人胚肺成纤维细胞株MRC-5生长的抑制作用[J]. 中国药理学通报, 2015, 31 (5) : 673-9. Liu L J, Qian H, Zhang P, et al. Inhibitory effects of resveratrol on human pulmonary fibroblast line MRC-5 growth[J]. Chin Pharmacol Bull, 2015, 31 (5): 673-9. |
| [11] | Hu F, Meng X, Tong Q, et al. BMP-6 inhibits cell proliferation by targeting microRNA-192 in breast cancer[J]. Biochim Biophys Acta, 2013, 1832 (12): 2379-90. doi:10.1016/j.bbadis.2013.08.011 |
| [12] | Lee G T, Kang D I, Ha Y S, et al. Prostate cancer bone metastases acquire resistance to androgen deprivation via WNT5A-mediated BMP-6 induction[J]. Br J Cancer, 2014, 110 (6): 1634-44. doi:10.1038/bjc.2014.23 |
| [13] | Peng J, Yoshioka Y, Mandai M, et al. The BMP signaling pathway leads to enhanced proliferation in serous ovarian cancer-A potential therapeutic target[J]. Mol Carcinog, 2016, 55 (4): 335-45. doi:10.1002/mc.v55.4 |
| [14] | Itatani Y, Kawada K, Fujishita T, et al. Loss of SMAD4 from colorectal cancer cells promotes CCL15 expression to recruit CCR1+myeloid cells and facilitate liver metastasis[J]. Gastroenterology, 2013, 145 (5): 1064-75. doi:10.1053/j.gastro.2013.07.033 |
| [15] | Lombardo Y, Scopelliti A, Cammareri P, et al. Bone morphogenetic protein 4 induces differentiation of colorectal cancer stem cells and increases their response to chemotherapy in mice[J]. Gastroenterology, 2011, 140 (1): 297-309. doi:10.1053/j.gastro.2010.10.005 |
| [16] | 黄军, 刘映孜, 袁霜雪, 等. 环氧酶-2在骨形态蛋白9诱导间充质干细胞骨向分化中的作用研究[J]. 中国药理学通报, 2014, 30 (7) : 1006-11. Huang J, Liu Y Z, Yuan S X, et al. Study on the role of COX-2 in BMP9 induced osteogenic differentiation in mesenchymal stem cells[J]. Chin Pharmacol Bull, 2014, 30 (7): 1006-11. |
| [17] | Ren W, Liu Y, Wan S, et al. BMP9 inhibits proliferation and metastasis of HER2-positive SK-BR-3 breast cancer cells through ERK1/2 and PI3K/AKT pathways[J]. PLoS One, 2014, 9 (5): e96816. doi:10.1371/journal.pone.0096816 |
| [18] | Lin H Y, Tang H Y, Davis F B, et al. Resveratrol and apoptosis[J]. Ann N Y Acad Sci, 2011, 1215 : 79-88. doi:10.1111/j.1749-6632.2010.05846.x |
| [19] | 袁霜雪, 王东旭, 伍秋香, 等. 白藜芦醇抑制HCT116结肠癌细胞增殖与Wnt/β-catenin的关系研究[J]. 中国药理学通报, 2015, 31 (4) : 537-41. Yuan S X, Wang D X, Wu Q X, et al. Study on the relationship between the anti-proliferation effect of resveratrol on HCT116 colon cancer cells and Wnt/β-catenin[J]. Chin Pharmacol Bull, 2015, 31 (4): 537-41. |
| [20] | 胡培, 伍秋香, 袁霜雪, 等. 白藜芦醇抑制人结肠癌细胞增殖及其与PTEN的关系研究[J]. 第三军医大学学报, 2015, 37 (10) : 1006-11. Hu P, Wu Q X, Yuan S X, et al. Study on the relationship between the anti-proliferation effect of resveratrol and PTEN in colon cancer cells[J]. Chin Pharmacol Bull, 2015, 37 (10): 1006-11. |