


2. 广东天然药物研究与开发重点实验室,广东 湛江 524023
2. Guangdong Key Laboratory for Research and Development of Natural Drugs, Guangdong Medical University, Zhanjiang Guangdong 524023, China
结肠癌是常见的恶性消化道肿瘤之一,发病率和死亡率均位居恶性肿瘤前列,使人类健康面临严重挑战[1]。尽管结肠癌诊疗的技术和水平都有所提高,但患者的5年生存率仍不理想[2]。据统计,1940~2014年间,超过75%的抗肿瘤药物直接来源于天然物质[3]。因此,从天然药物中寻找新型抗癌药物,对改善结肠癌患者预后具有重要意义。研究表明[4],结肠癌的发生、发展与Wnt/β-catenin、EGFR、p53、MAPK、Notch、RhoA/ROCK等多种信号通路有关,其中Wnt/β-catenin信号通路的异常激活被认为是结肠癌的发生、发展的关键事件。Tan等[5]研究发现,通过抑制Wnt/β-catenin信号通路的激活,结肠癌细胞可发生增殖抑制和凋亡现象。紫穗槐(Amorpha Fruticosa),落叶灌木,系豆科紫穗槐属,其花和叶均可入药,具有清热、凉血、止血和祛湿消肿等药理作用,中医主要用于湿疹、痈肿和烧烫伤等病症[6]。dalbinol是从紫穗槐中分离纯化的一种鱼藤酮类化合物(结构见Fig 1A),本课题组的前期研究发现,该化合物在体外对HCT116细胞表现出显著的细胞毒性,但其作用机制尚不明确。因此,本研究进一步观察dalbinol对人结肠癌HCT116细胞周期及凋亡的影响,并分析dalbinol对Wnt/β-catenin信号通路的影响,探讨dalbinol调控Wnt/β-catenin信号通路的可能机制,为其后续开发与利用提供科学依据。
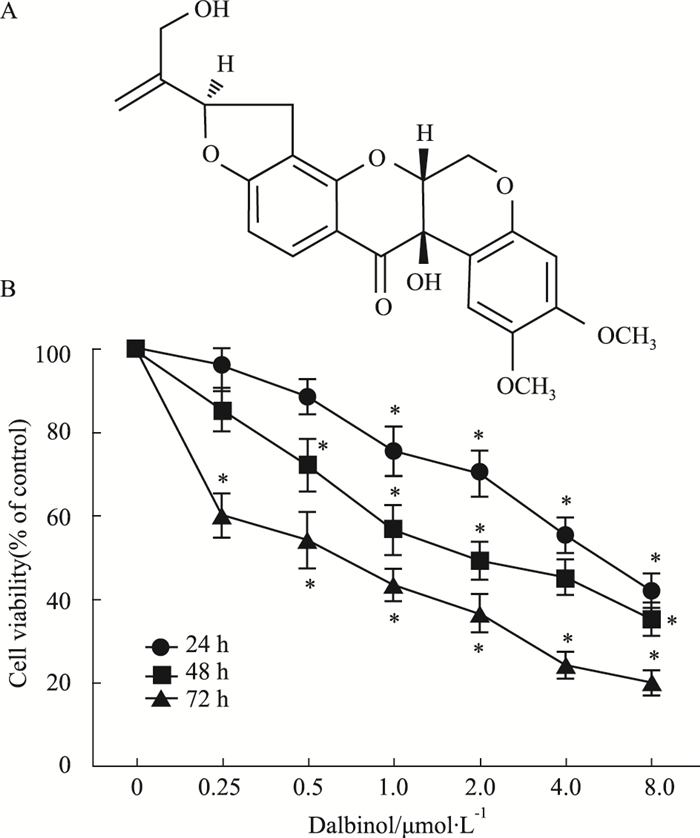
|
| Fig 1 Structure of dalbinol and anti-proliferative effect of dalbinol on HCT116 cells A:The Structure of dalbinol; B:Anti-proliferative effect of by dalbinol on HCT116 cells.P < 0.05 vs control. |
人结肠癌HCT116细胞由本实验室保存。
1.1.2 主要试剂dalbinol由本课题组提取纯化并鉴定所得[7]。胰蛋白酶、DMEM培养基(高糖型)、胎牛血清均购于美国Hyclone公司;青霉素-链霉素购自广州威佳科技有限公司;Hoechst 33342染色液、活性氧检测试剂盒、全蛋白提取试剂盒、BCA蛋白浓度测定试剂盒、ECL化学发光液、细胞周期与细胞凋亡检测试剂盒、细胞核蛋白与细胞质蛋白抽提试剂盒均购于碧云天生物技术研究所;β-actin抗体购自北京义翘神州生物技术有限公司;β-catenin抗体购自英国ABC公司;PARP抗体购自美国Biolegend公司;caspase-3抗体购自美国Proteintech公司;Dvl-2购于美国Santa Cruz Biotechnology公司。GSK-3β和c-Myc抗体均购于美国BD公司;GSK-3β(pS9)、Survivin、Bcl-2、Bax、Bim、Mcl-1和Histone3抗体均购于美国CST公司;羊抗兔IgG-HRP和羊抗鼠IgG-HRP均购于北京中杉金桥生物技术有限公司。
1.2 方法 1.2.1 细胞培养用含10%胎牛血清和1%(V/V)青-链霉素的高糖型DMEM培养基,于37 ℃、5% CO2条件下培养HCT116细胞,按1 :4隔天传代,取对数生长期细胞进行实验。
1.2.2 MTT法检测细胞增殖抑制作用取对数生长期细胞接种于96孔板,不同浓度的dalbinol (0、0.25、0.5、1.0、2.0、4.0、8.0 μmol·L-1)分别作用24、48、72 h后,每组设置3个复孔,每孔加入5 g·L-1 MTT 10 μL,置孵箱继续培养4 h,弃上清,加入200 μL DMSO溶液,使用酶标仪在570 nm波长处检测各孔吸光度值,计算细胞存活率。
1.2.3 Hoechst 33342荧光染色观察细胞凋亡的形态学变化取对数生长期细胞接种于6孔板,将dalbinol稀释成不同终浓度(0.5、1.0、2.0 μmol·L-1)进行加药,每组设置3个复孔,同时设置阴性对照组。孵育24 h后,PBS洗3遍后每孔各加入2.5 mg·L-1 Hoechst 33342染色液,在37 ℃条件下孵育染色5 min,用PBS洗3次。倒置荧光显微镜观察细胞形态学变化。
1.2.4 Annexin V-FITC/PI双染法测定细胞凋亡率取对数生长期细胞接种于6孔板,质量浓度、加药方式同“1.2.3”项,加药24 h后收集细胞,PBS洗涤2次,将细胞重悬于195 μL的Annexin V-FITC结合液中,室温避光孵育15 min后加入5 μL Annexin V-FITC和5 μL PI,混匀。流式细胞仪检测细胞凋亡率。
1.2.5 细胞内ROS含量的检测取对数生长期细胞接种于6孔板,质量浓度、加药方式同“1.2.3”项,dalbinol处理12 h后收集细胞,将DCFH-DA荧光探针按1 :1 000用无血清培养液稀释,置10 μmol·L-1 DCFH-DA于培养箱中孵育30 min,用无血清培养液洗涤细胞3次。流式细胞仪测定细胞内活性氧含量。
1.2.6 Western blot检测相关蛋白的表达将对数生长期细胞接种于6孔板中,质量浓度、加药方式同“1.2.3”项,加药24 h后收集细胞,提取各实验组细胞总蛋白、核蛋白。BCA法蛋白定量,用SDS-PAGE凝胶电泳分离蛋白质,将分离后的蛋白质转移至NC膜上,用5%脱脂奶粉室温封闭2 h,TBST洗涤10 min,一抗4℃摇床过夜,TBST洗涤3次,每次15 min,HRP标记二抗室温孵育2 h,TBST洗涤3次,每次15 min,最后在暗室进行化学发光显色和曝光。
1.3 统计学分析所有实验结果均源自3次独立实验,数据采用x±s表示,采用GraphPad Prism 5.0软件进行数据处理和分析;应用SPSS 19.0软件中的ANOVA分析进行统计分析。
2 结果 2.1 dalbinol对HCT116细胞增殖的影响MTT结果显示(Fig 1B),与对照组相比,作用24、48和72 h时,dalbinol可抑制HCT116细胞的增殖,呈剂量和时间依赖性(P < 0.05),IC50分别为(4.8±0.53)、(2.5±0.43)和(0.6±0.22) μmol·L-1。
2.2 dalbinol对HCT116细胞凋亡的影响将dalbinol按不同终浓度(0.5、1.0、2.0 μmol·L-1)处理HCT116细胞24 h后,Hoechst33342染色后可观察到部分细胞出现细胞皱缩、核固缩、核破碎等典型凋亡的形态学变化(Fig 2)。同时Annexin V-FITC/PI双染结果表明(Fig 3),与阴性对照组相比,dalbinol可浓度依赖性地增加HCT116细胞凋亡率(P < 0.05)。
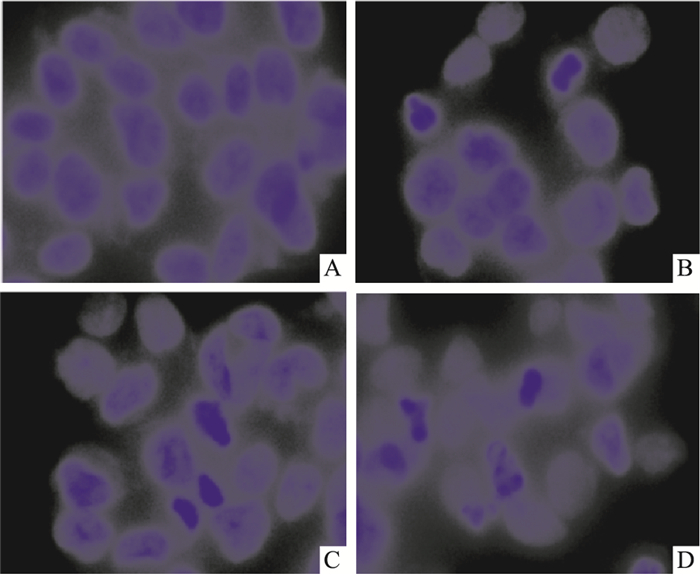
|
| Fig 2 Morphological changes of apoptosis by dalbinol in HCT116 cells A:0 μmol·L-1; B:0.5 μmol·L-1; C:1.0 μmol·L-1; D:2.0 μmol·L-1 |
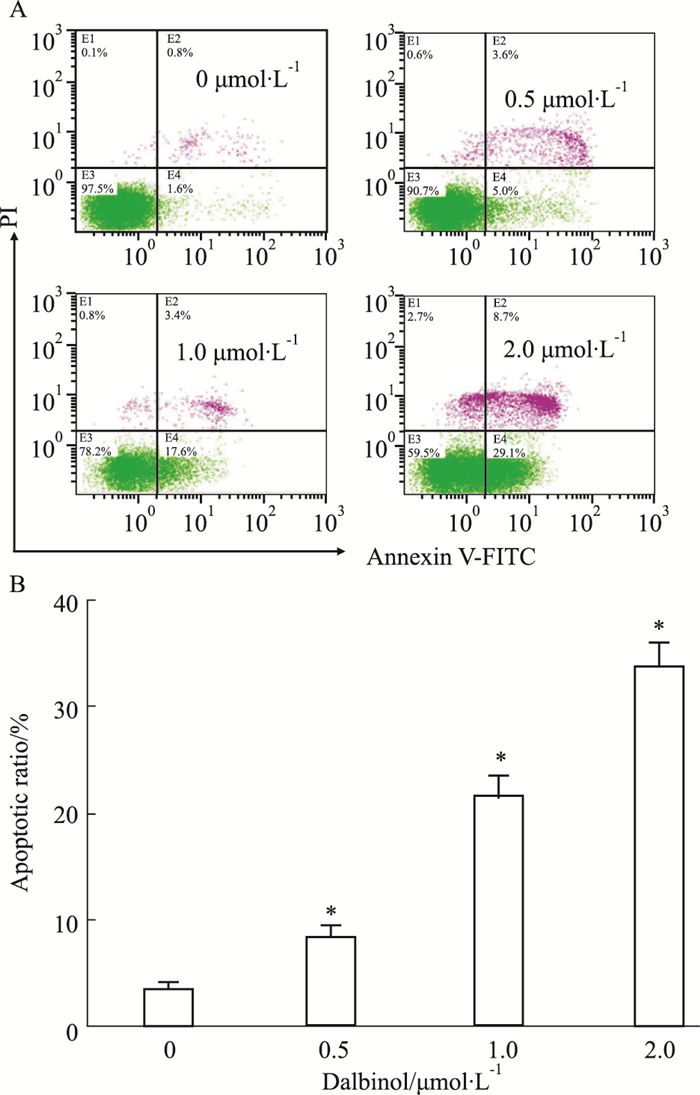
|
| Fig 3 Effect of dalbinol on apoptosis of HCT116 cells A:Flow cytometry analysis results; B:The apoptotic ratio was measured by flow cytometric analysis staining with PI. P < 0.05 vs control |
DCFH-DA检测结果表明(Fig 4),dalbinol按不同终浓度(0.5、1.0、2.0 μmol·L-1)作用12 h时,与对照组相比,dalbinol可使HCT116细胞内ROS水平升高,2.0 μmol·L-1 dalbinol作用时细胞内ROS水平最高达55.3%,并呈浓度依赖性。

|
| Fig 4 Intracellular ROS generation of HCT116 cells treated with dalbinol |
初步的作用机制表明(Fig 5),不同终浓度(0.5、1.0和2.0 μmol·L-1)的dalbinol处理HCT116细胞24 h后,促凋亡蛋白Bax和Bim的表达升高,抗凋亡蛋白Bcl-2和Mcl-1的表达水平下降,导致cleaved caspase-3和cleaved PARP同时过度活化,而总的caspase-3和PARP变化趋势不明显。
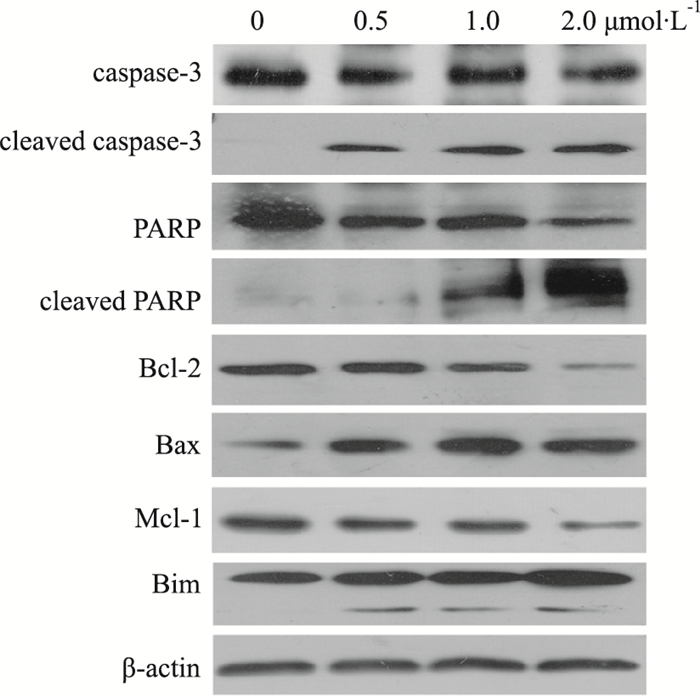
|
| Fig 5 Expression of apoptosis-associated proteins by dalbinol in HCT116 cells |
进一步的作用机制研究表明(Fig 6),dalbinol可降低HCT116细胞内总的和胞核β-catenin蛋白表达,尤以胞核β-catenin的下降为甚,但对胞质β-catenin的表达无明显影响。此外,dalbinol可降低Dvl-2、GSK-3β(pS9)、c-Myc和Survivin的蛋白表达,总的GSK-3β蛋白表达无明显变化。
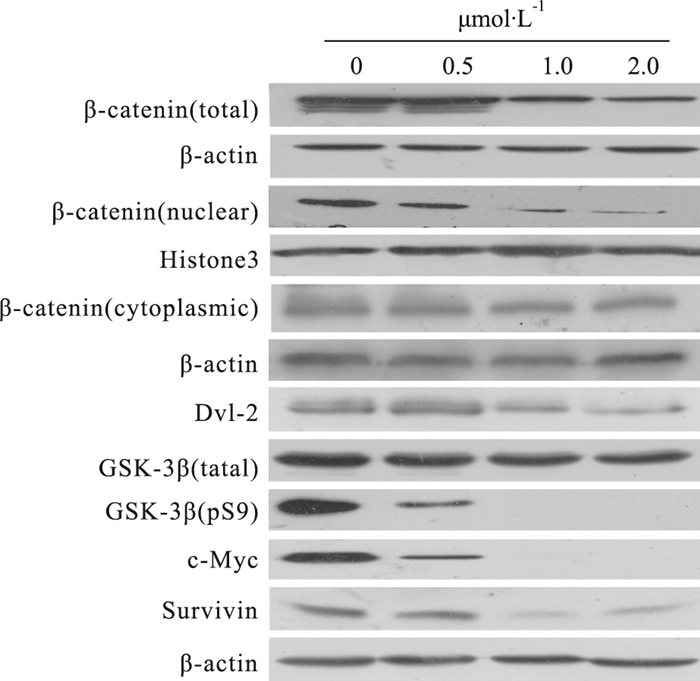
|
| Fig 6 Expression of related proteins in Wnt/β-catenin pathway by dalbinol in HCT116 cells |
随着社会经济的发展,尤其是饮食结构的改变,目前结肠癌已上升为全球发病率最高的恶性肿瘤之一[1]。在过去几十年,外科手术一直是结肠癌的主要治疗手段之一,但在原发肿瘤出现明显症状之前,患者可能己经发生播散或远处转移,另外约50%病例术后2年会出现复发和转移,因此大多数结肠癌患者都需要接受化疗。由于外科手术治疗的局限性、放射治疗的剂量限制、化疗药物的毒副作用以及耐药性等因素影响,结肠癌患者的预后仍不理想[2]。从天然药物资源中寻找具有抗肿瘤活性的药物,是近年来抗结肠癌药物研究的热点之一[3]。
Wnt/β-catenin信号通路的异常激活与许多癌症的发生、发展有着不可分割的联系,其与结肠癌的关系更是密不可分。据报道,90%的结肠癌都存在Wnt/β-catenin信号通路中一个关键调控基因的突变[8]。因此抑制Wnt/β-catenin信号是抑制结肠癌细胞生长的重要靶点之一[9],开发针对Wnt/β-catenin信号通路的抗癌药物已成为研究的热点[10]。大量研究表明,经典模式下,Wnt/β-catenin信号通路中LRP5/6、APC、Dvl、GSK3β、Axin或者β-catenin等基因的突变,会抑制降解复合体(Axin/APC/GSK-3β)的生成,使β-catenin无法降解并在胞质内堆积后转入细胞核,引起核的β-catenin与转录因子TCF/LEF形成复合物,从而激活相应的下游靶基因c-Myc、Cyclin D1和Survivin等,最终导致结肠癌的发生和发展[4]。
本实验Western blot结果发现,dalbinol作用24 h后,HCT 116细胞中总的和胞核β-catenin的表达均下降,尤以胞核β-catenin下降最为明显,但胞质β-catenin水平无明显变化,这结果表明dalbinol可调控关键蛋白β-catenin的表达。因此,我们推测dalbinol可能通过下调Wnt/β-catenin信号通路来抑制HCT 116细胞的增殖。另外,Wnt/β-catenin通路的下游靶蛋白c-Myc和Survivin表达均降低,这结果也进一步证实我们的推测。为明确dalbinol调控Wnt/β-catenin通路的具体机制,我们还检测了影响降解复合体生成的相关蛋白Dvl-2、GSK-3β和GSK-3β(pS9)。结果发现,Dvl-2和GSK-3β(pS9)的表达下降明显,而GSK-3β的蛋白水平未见明显变化。上述结果表明,dalbinol可能通过抑制Dvl-2的表达,从而使失活型GSK-3β(pS9)的表达下降,β-catenin磷酸化降解增多,最终导致Wnt/β-catenin通路的下游靶蛋白c-Myc和Survivin表达下降。
总之,dalbinol能明显抑制人结肠癌HCT116细胞增殖,并诱导其凋亡,其作用机制可能与细胞内ROS水平提高和抑制Dvl/GSK-3β/β-catenin信号通路有关。本实验仅探讨dalbinol对HCT116细胞的作用,尚未在其它结肠癌细胞系中予以证实,下一步本课题组将继续研究dalbinol对多种结肠癌细胞系中Wnt/β-catenin通路的影响,为其进一步开发提供科学依据。
( 致谢: 本实验在广东医科大学广东天然药物研究与开发重点实验室完成,感谢吴华教授和巫鑫博士以及各位老师的指导和帮助。 )
| [1] | Favoriti P, Carbone G, Greco M, et al. Worldwide burden of colorectal cancer:a review[J]. Updates Surg, 2016, 68 (1): 7-11. doi:10.1007/s13304-016-0359-y |
| [2] | Merla A, Goel S. Novel drugs targeting the epidermal growth factor receptor and its downstream pathways in the treatment of colorectal cancer:a systematic review[J]. Chemother Res Pract, 2012, 2012 : 387172. |
| [3] | Newman D J, Cragg G M. Natural products as sources of new drugs from 1981 to 2014[J]. J Nat Prod, 2016, 79 (3): 629-61. doi:10.1021/acs.jnatprod.5b01055 |
| [4] | Perkins G, Laurent-Puig P. Colorectal cancer biology[J]. Rev Prat, 2015, 65 (6): 802-6. |
| [5] | Tan B L, Esa N M, Rahman H S, et al. Brewers'rice induces apoptosis in azoxymethane-induced colon carcinogenesis in rats via suppression of cell proliferation and the Wnt signaling pathway[J]. BMC Complement Altern Med, 2014, 14 : 304. doi:10.1186/1472-6882-14-304 |
| [6] | 国家中医药管理局中华本草编委会. 中华本草[M]. 第10卷. 上海: 上海科学技术出版社, 2004 : 328 . Chinese herbalism editorial board of state administration of TCM. Chinese herbalism[M]. Volume 10. Shanghai: Shanghai Scientific and Technical Publishers, 2004 : 328 . |
| [7] | Wu X, Liao H B, Li G Q, et al. Cytotoxic rotenoid glycosides from the seeds of Amorpha fruticosa[J]. Fitoterapia, 2015, 100 : 75-80. doi:10.1016/j.fitote.2014.11.015 |
| [8] | Weng W, Feng J, Qin H, et al. Molecular therapy of colorectal cancer:progress and future directions[J]. Int J Cancer, 2015, 136 (3): 493-502. |
| [9] | 袁霜雪, 王东旭, 伍秋香, 等. 白藜芦醇抑制HCT116结肠癌细胞增殖与Wnt/β-catenin的关系研究[J]. 中国药理学通报, 2015, 31 (4) : 537-41. Yuan S X, Wang D X, Wu Q X, et al. Study on the relationship between anti-proliferation effect of resveratrol on HCT116 colon cancer cells and Wnt/β-catenin[J]. Chin Pharmacol Bull, 2015, 31 (4): 537-41. |
| [10] | Zhang X, Hao J. Development of anticancer agents targeting the Wnt/beta-catenin signaling[J]. Am J Cancer Res, 2015, 5 (8): 2344-60. |

