


2. 南京中医药大学江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023
 ,
LIU Yu-ping1,
WANG Xu1,
SHEN Pei-liang1,
ZHU Ping-ting1,
CHEN Wen-xing1,2,
WANG Ai-yun1,2,
LU Yin1,2
,
LIU Yu-ping1,
WANG Xu1,
SHEN Pei-liang1,
ZHU Ping-ting1,
CHEN Wen-xing1,2,
WANG Ai-yun1,2,
LU Yin1,2

2. Jiangsu Collaborative Innovation Center of Traditional Chinese Medicine Prevention and Treatment of Tumor, Nanjing University of Chinese Medicine, Nanjing 210023, China
炎症在肿瘤的发生、发展中起到了至关重要的作用。国内外研究学者的报道多数集中于炎症和肿瘤之间的关系,具体研究包括炎性细胞、炎性介质及肿瘤相关的信号通路等[1-3]。血小板激活因子(platelet-activating factor,PAF)是一种活性磷脂,目前认为是一种第二信使,由内皮细胞、巨噬细胞、血小板等产生,能够参与细胞活化、信号转导以及炎症反应的磷脂介质[4]。PAF是一种对磷脂酶A2较为敏感,与花生四烯酸(arachidonic acid,AA)代谢密切相关的磷脂,是过敏反应和炎症反应中起非常重要作用的炎症因子[5]。
有研究显示,肿瘤相关的细胞因子,如血管内皮生长因子(vascular endothelial growth factor, VEGF)、肿瘤坏死因子α(tumor necrosis factor-alpha, TNF-α)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)及抗凋亡的因子(Bcl-2和Bcl-xL)参与了肿瘤的生长及肿瘤转移,是肿瘤的发生、发展过程中的关键因子。研究指出,PAF能够促进黑色素瘤细胞、乳腺癌细胞等多种肿瘤细胞的增殖和转移,且作用的机制与其激活核转录因子NF-κB有关,可能促进了NF-κB依赖性的血管生成因子VEGF等上述因子的表达[6-7]。提示PAF所介导的炎症在促进肿瘤方面具有关键作用。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)是丝氨酸-苏氨酸蛋白激酶,其信号通路包括三级激酶模式,是真核细胞最广泛的调控信号,含有ERK、p38、JNK和ERK5 4个亚族。大量的文献研究显示,MAPKs促进细胞的迁移、增强促存活基因以及增殖基因的表达,能够促进基质金属降解酶的表达,MAPKs信号通路在多种人类肿瘤中都能检测到,包括结直肠癌、乳腺癌、肾癌、肺癌等。肿瘤细胞的迁移与肿瘤细胞的运动能力密切相关,肿瘤细胞在运动的过程中往往需要伸出片状伪足,而在此过程中最重要的调控蛋白被认为是局部黏着斑激酶(focal adhesion kinase, FAK),其调控的下游分子桩蛋白(paxillin)起到了锚定的作用。大量研究表明,MAPK、FAK等信号能够受到很多细胞膜表面的生长信号受体所调控,其中包括PAFR[8]。
大蒜二烯丙基三硫化物(DATS)是大蒜的有机硫化物成分中最有效的抗癌成分。DATS也具有良好的抗炎活性。研究报道明确了大蒜素能够有效地抑制皮肤癌,但其具体的机制尚不明确。近年来,国内外学者在DATS对肿瘤的治疗方面进行了深入的研究和探索,并且报道DATS不但具有癌化学预防的作用,而且能够抑制肿瘤细胞的增殖,诱导肿瘤细胞凋亡。这些效应与其干扰了MAPKs信号,如p38和JNK等有关[9-10]。因此,本研究旨在证明MAPKs在PAF诱导的肿瘤转移中的重要作用及DATS能够抑制PAF诱导的肿瘤转移,为中医临床防治肿瘤转移提供重要指导。
1 材料与方法 1.1 细胞株小鼠的黑色素瘤高转移细胞株B16F10及A375购于中国科学院上海细胞生物研究所细胞库。本实验采用37℃、5%的CO2孵箱条件孵育,用含有10% FBS的RPMI 1640完全培养基进行细胞培养。
1.2 实验动物SPF级C57BL/6小鼠,由南京中医药大学动物实验中心提供,鼠龄为4~5周,体质量为18~22 g。
1.3 试剂与材料RPMI 1640培养液:Gibco产品;胎牛血清(FBS)购自以色列Biological Industries公司(货号:1418110);Matrigel购自美国B&D公司(货号:356234);胰蛋白酶:美国Gibco公司;二甲基亚砜(DMSO):美国Sigma公司;细胞培养板:美国BD公司;Transwell小室购自美国Costar公司(货号:3422);兔源性GAPDH多克隆抗体购自美国Bioworld公司(货号:BSAP0063);兔源性MMP-2单克隆抗体购自美国CST公司(货号:4022S);兔源性Paxillin单克隆抗体购自SAB公司(货号:21107);兔源性Akt单克隆抗体购自SAB公司(货号:11054);兔源性p38单克隆抗体购自CST公司(货号:8690p);兔源性FAK单克隆抗体购自SAB公司(货号:21076);兔源性JNK单克隆抗体购自美国Bioworld公司(货号:AP0370);兔源性ERK单克隆抗体购自美国CST公司(货号:4695p)。
1.4 MTT法取处在对数生长期的B16F10和A375细胞,常温下1 000 r·min-1离心3 min,倒去上清液,接着用含10%FBS的RPMI l640完全培养基将细胞配制成相应的悬液备用,浓度调整为4×108·L-1,接种于96孔板,放入CO2细胞培养箱,细胞贴壁之后加药。给予不同浓度的DATS (0~200 μmol·L-1)作用,加药后,将96孔板放于细胞培养箱中培养。24 h后,用1 mL注射器的针头小心吸去上清液,换入新鲜的培养基200 μL,并在每孔加20 μL MTT溶液,避光孵育4 h后,用注射器小心吸走上清液,每孔加入200 μL的DMSO,避光震荡10 min,酶标仪于490 nm下测定每孔吸光度(OD值),计算出相对增殖率。
1.5 划痕愈合实验取处在对数生长期B16F10、A375细胞,用不含EDTA的胰酶消化细胞,调整细胞的浓度为5.0×108·L-1,接种于6孔板中,将6孔板置于培养箱中进行培养。待到细胞长到融合率达到80%~90%后,加入终浓度25 μg的丝裂霉素C作用2 h后,撤去培养基,并用10 μL的无菌枪头在每个孔的中央垂直划入一条直线,划完后用PBS洗2次,尽量将细胞碎片洗干净,每孔加入2 mL用含5% FBS的完全培养基配制的不同浓度的药物,于给药0 h时置于显微镜下拍照,后置于CO2培养箱培养24 h后,取出,于倒置显微镜下拍照。
1.6 Transwell垂直迁移实验将B16F10、A375细胞用不含EDTA的胰酶进行消化(之前用无血清的培养基饥饿过夜),并用无血清的RPMI 1640进行重悬,调整密度为1×109·L-1,备用。取出Transwell小室,在上室中加入无血清的细胞悬液100 μL,并加入100 nmol·L-1的PAF及不同浓度的DATS,设空白对照组;在下室中加入含有20%的FBS的完全培养基,置于CO2培养箱中培养24 h后,取出小室,用棉签小心擦去上室没有迁移的细胞,用95%的乙醇固定30 min,用结晶紫进行染色,置于超净台风干,于200倍的倒置显微镜下拍照穿膜细胞,随机选5个视野,计算平均数。
1.7 Western blot实验常规培养B16F10细胞,消化后离心,接种细胞于10 cm培养皿中(接种细胞密度为106个/皿),置于37℃、5% CO2培养箱进行培养,待细胞贴壁后换液,用PBS洗涤3次,加入100 nmol·L-1的PAF及含DATS 1、5、10、25 μmol·L-1的RPMI 1640完全培养基作用细胞24 h。用体积比为100 :1的RIPA细胞裂解液裂解后,提取蛋白样品,-80 ℃冻存12 h,13 000×g、4 ℃离心,上清液则为蛋白样品。蛋白浓度测定采用二喹啉甲酸(bicinchoninic acid,BCA)测定法。100 ℃水浴使蛋白样品变性10 min。SDS-PAGE分离蛋白,根据目的蛋白的相对分子质量配制相应的分离胶浓度(8%和10%)。分离蛋白采用横流电泳,恒压进行分离蛋白转膜。5%脱脂奶粉的封闭液室温封闭2 h后,分别加入一抗、二抗及GAPDH多克隆抗体(内参)(稀释倍数参见各抗体的操作说明书),一抗孵育4 ℃过夜。TBST洗膜5次,每次10 min;依据一抗的种属选择相应的二抗(羊抗兔或羊抗鼠IgG,用含5% BSA的封闭液稀释二抗,体积稀释比例为1:10 000)室温反应2 h。采用凝胶成像系统(美国Bio-Rad公司凝胶成像系统ChemiDocTMXRS+)及Image Lab 4.1软件检测目的蛋白的表达情况[11]。
1.8 体内移植瘤实验体外培养B16F10细胞,并将细胞消化,PBS混悬,制成细胞悬液,调整细胞浓度,每只小鼠尾静脉注射200 μL细胞悬液。100 nmol·L-1 PAF尾静脉注射给予,DATS灌胃给予,21 d后处死小鼠,取出肺脏进行分析。
1.9 统计学分析采用Graphpad 5统计学软件对实验结果进行统计学分析。所有实验均独立重复3次,计量资料以x±s表示,各组分别与对照组进行单因素方差分析。
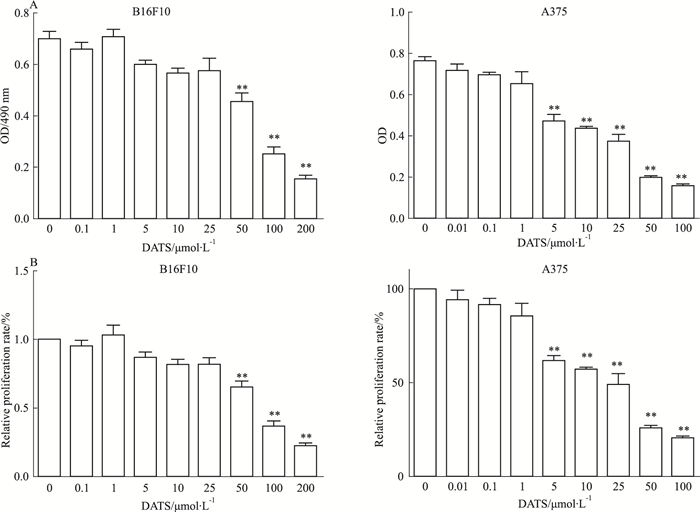
2 结果 2.1 DATS对鼠黑色素瘤B16F10和人黑色素瘤细胞A375生长数目的影响MTT检测结果显示(Fig 1A),DATS作用24 h后,可以剂量依赖性地抑制B16F10和A375黑色素瘤细胞的增殖。与相同时间内的对照组比较,当DATS剂量达到50 μmol·L-1时有明显差异(P < 0.01)。同时,DATS浓度达50、100 μmol·L-1时,B16F10细胞的相对生长率
|
| Fig 1 Effect of DATS on the proliferation of melanoma cells A: Effect of different concentrations of DATS on B16F10 and A375 melanoma cell growth number; B: Effect of DATS on B16F10 and A375 melanoma cell relative proliferation. **P < 0.01 vs control |
分别降至73.21%、48.78%。而对于A375细胞的增殖,DATS展现出了更好的抑制作用。DATS对B16F10细胞及A375细胞的IC50分别为76.54、21.61 μmol·L-1。见Fig 1B。
2.2 DATS对黑色素瘤细胞运动迁移的影响 2.2.1 DATS对PAF诱导的黑色素瘤B16F10细胞水平迁移的影响(划痕愈合实验)观察不同浓度的DATS作用不同时间点对PAF (100 nmol·L-1)诱导的黑色素瘤B16F10(Fig 2A)和A375(Fig 2B)细胞划痕愈合能力的影响,结果发现,PAF (100 nmol·L-1)刺激24 h后,能够有效诱导细胞迁移,而给予DATS后,随着DATS浓度的提高,细胞划痕的愈合程度呈递减趋势。Fig 2结果以0 h和24 h两个时间点为例,呈现对照组和DATS作用不同时间点黑色素瘤细胞的划痕愈合情况,发现24 h时,对照组划痕区域的黑色素瘤细胞发生明显迁移,而随着DATS给药浓度的增加,划痕区域细胞迁移的数目呈降低趋势。

|
| Fig 2 Effect of different concentrations of DATS on PAF-induced migration of B16F10 (A) and A375 (B) cells |
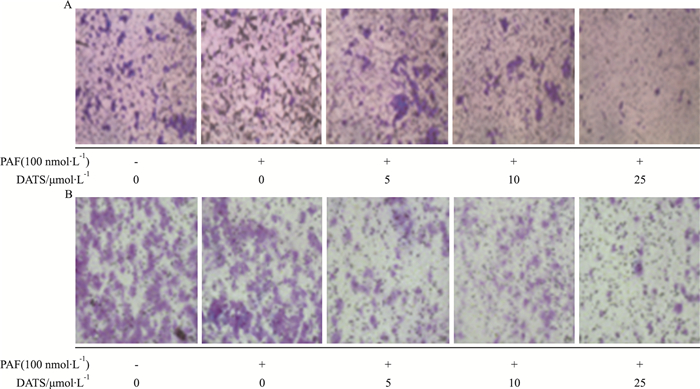
不同浓度DATS对PAF诱导的B16F10(Fig 3A)和A375(Fig 3B)黑色素瘤细胞Transwell小室迁移能力的影响发现,随着DATS浓度的提高,细胞侵袭能力呈递减趋势。100×显微镜观察B16F10和A375细胞迁移情况,由Fig 3可见对照组细胞迁移数目较多,DATS各浓度组处理24 h后,细胞迁移数目与对照组比较呈降低趋势。
|
| Fig 3 Effect of different concentrations of DATS on PAF-induced vertical migration of B16F10 (A) and A375 (B) cells |
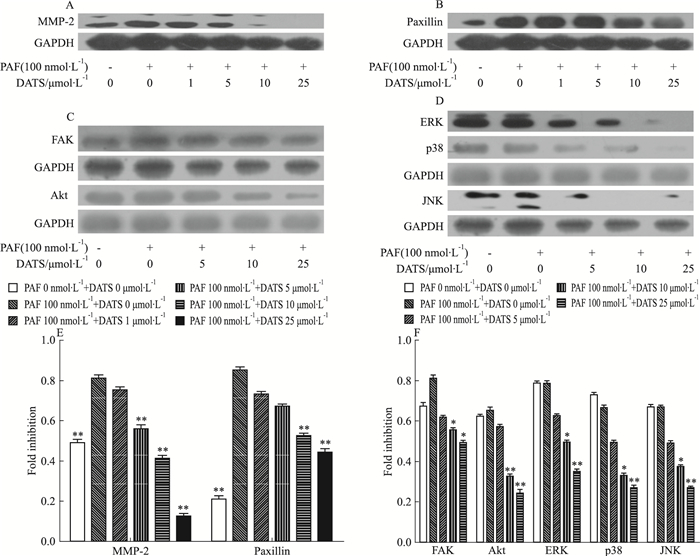
因为观察到了DATS能够有效地抑制100 nmol·L-1的PAF诱导的黑色素瘤细胞的迁移和运动,而研究显示,DATS能抑制NF-κB及VEGF蛋白的表达[12],同时研究发现PAF诱导黑色素瘤的转移可能通过增加了基质金属蛋白酶、激活MAPK信号传导等方式增强了黑色素瘤的转移。因此,我们考察了DATS对PAF介导的黑色素瘤细胞MMP-2的表达,ERK、p38等相关转移蛋白的影响。结果显示,100 nmol·L-1的PAF能够激活MMP-2、桩蛋白、FAK;而DATS能够剂量依赖性的降低这些蛋白的表达。见Fig 4。
|
| Fig 4 Effects of DATS on the expression of metastasis-related proteins MMP-2(A), Paxillin (B), FAK, Akt (C) and ERK, p38, JNK (D) Glyceraldehyde-3-phosphate dehydrogenase (GAPDH) was used as the internal control. P < 0.05, **P < 0.01 vs PAF 100 nmol· L-1 alone |
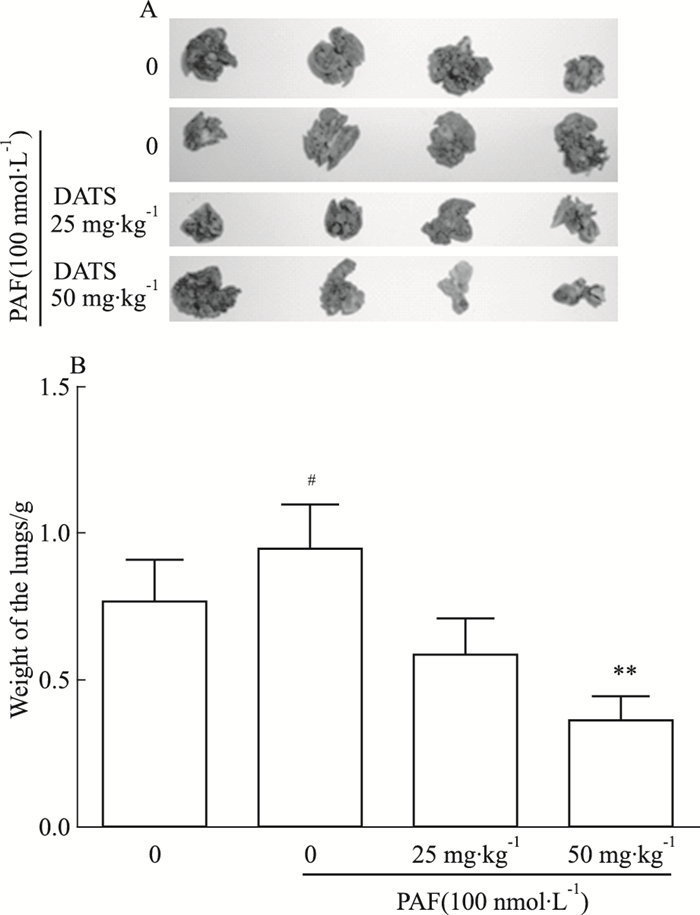
为了考察DATS对PAF诱导的B16F10黑色素瘤体内转移情况,我们构建了黑色素瘤实验性转移模型。通过尾静脉注射B16F10细胞,同时给予PAF和25、50 mg·kg-1的DATS,21 d后小鼠处死,取出肺脏,进行拍照及称量肺重。Fig 5结果显示,100 nmol·L-1的PAF能够促进B16F10的转移,而灌胃给予50 mg·kg-1的DATS能有效减少肺转移结节,并降低肺重。
|
| Fig 5 Effect of DATS on PAF-induced B16F10 cell lung metastasis in vivo A: The lung size; B: The lung weight. #P < 0.05 vs control; **P < 0.01 vsPAF 100 nmol· L-1 group |
肿瘤转移是恶性肿瘤最明显的生物学特性之一。具有浸润性的肿瘤,不仅可以在原发部位生长和蔓延,还能够通过各种途径扩散到身体其他部位,称之为肿瘤转移,是临床肿瘤病人的主要死因。肿瘤细胞的迁移和侵袭是贯穿了肿瘤转移整个过程的关键步骤。而黑色素瘤在发病早期转移率高,致死性强[13]。在微环境中,有很多促进肿瘤转移的因子,主要来源于机体宿主细胞如血小板、内皮细胞等等。其中,PAF能够内源性地激活血小板,使得血小板活化。目前,对PAF的研究发现,PAF在炎症、心脑血管疾病、肿瘤中起着很重要的作用[14]。本文将PAF作为诱导剂,选取皮肤癌为研究对象,因众多文献报道PAF能够诱导皮肤癌、黑色素瘤的转移。PAF发挥其作用主要通过与其受体PAFR结合,激活了下游的信号传导,活化多种核转录因子如NF-κB、CREB等,从而调控了肿瘤细胞的恶性生物学行为。我们的研究发现100 nmol·L-1 PAF能够促进肿瘤细胞的迁移、运动能力,而动物实验也表明给予PAF之后,小鼠B10F10黑色素瘤实验性转移模型中肺转移灶明显高于不给予PAF组。因此,研究PAF介导的肿瘤转移能够探寻有效的治疗转移的药物。
目前尚无有效的治疗肿瘤转移的药物,研究表明,具有药食同源的食材药物大蒜是最有潜力的抗癌药物,其是百合科的葱属植物的鳞茎,大蒜的有机硫化物是大蒜中活性成分。临床上广泛用于治疗深部真菌、霉菌感染[15],而近年来的研究发现,它不仅具有抗炎、抗病毒、心血管保护等多种生物学功能,而且能够抗肿瘤。DATS是目前发现的大蒜素中活性最强、也是研究最热的成分,化学名为三硫化二丙烯(二烯丙基三硫),分子质量是178.33。前期的研究发现,DATS对多种肿瘤包括乳腺癌、皮肤癌等具有抑制作用,但是,其具体的机制尚不明确[16]。B16黑色素瘤细胞是1954年在C57BL/6小鼠耳根皮肤上发现的自发性黑色素瘤,B16F10实验性转移模型是目前较常用的转移实验模型。我们的研究发现,DATS浓度达50、100 μmol·L-1时,可以明显抑制B16F10细胞的生长。同时,DATS对PAF诱导的黑色素瘤B16F10细胞的水平迁移和垂直迁移也有明显的抑制作用。
细胞外基质的降解,可以降低细胞与细胞之间的黏连,促进肿瘤的迁移。其中,发挥关键作用的是MMP-2及MMP-9等蛋白。研究显示,MMP-2等的蛋白表达增加,可以促进乳腺癌等多种肿瘤的转移[17]。本文通过划痕实验及Transwell实验初步证明了DATS是可以抑制PAF诱导的黑色素瘤细胞B16F10、A375的迁移,这是否与MMP-2等蛋白的表达有关呢?有研究报道指出,PAF诱导黑色素瘤的转移可能通过增加基质金属蛋白酶、激活MAPK信号传导等方式,增强了黑色素瘤的转移。因此,我们进一步研究了DATS对PAF介导的黑色素瘤细胞MMP-2的表达,ERK、p38等相关转移蛋白的影响。Western blot结果表明,DATS抑制PAF诱导的B16F10细胞的迁移可能与MMP-2、桩蛋白、FAK等蛋白的降低有关。DATS能够剂量依赖性地降低这些蛋白的表达,其机制有待于我们进一步研究。
( 致谢: 本实验在南京中医药大学江苏省中药药效与安全性评价重点实验室完成,感谢实验参与者对实验的帮助指导! )
| [1] | Gomes M, Teixeira A L, Coelho A, et al. The role of inflammation in lung cancer[J]. Adv Exp Med Biol, 2014, 816 : 1-23. doi:10.1007/978-3-0348-0837-8 |
| [2] | Jia Q, Dong Q, Qin L. CCN:core regulatory proteins in the microenvironment that affect the metastasis of hepatocellular carcinoma[J]. Oncotarget, 2016, 7 (2): 1203-14. |
| [3] | 李影, 陈镜宇, 张玲玲, 等. 肿瘤坏死因子受体相关因子参与炎症免疫调节的研究进展[J]. 中国药理学通报, 2015, 31 (9) : 1206-11. Li Y, Chen J Y, Zhang L L, et al. Research advance of tumor necrosis factor receptor-associated factors in inflammatory immune regulation[J]. Chin Pharmacol Bull, 2015, 31 (9): 1206-11. |
| [4] | Reznichenko A, Korstanje R. The role of platelet-activating factor in mesangial pathophysiology[J]. Am J Pathol, 2015, 185 (4): 888-96. doi:10.1016/j.ajpath.2014.11.025 |
| [5] | Spinas E, Kritas S K, Saggini A, et al. Role of mast cells in atherosclerosis:a classical inflammatory disease[J]. Int J Immunopathol Pharmacol, 2014, 27 (4): 517-21. |
| [6] | Anandi V L, Ashiq K A, Nitheesh K, et al. Platelet-activating factor promotes motility in breast cancer cells and disrupts non-transformed breast acinar structures[J]. Oncol Rep, 2016, 35 (1): 179-88. |
| [7] | Sahu R P. Expression of the platelet-activating factor receptor enhances benzyl isothiocyanate-induced apoptosis in murine and human melanoma cells[J]. Mol Med Rep, 2015, 12 (1): 394-400. |
| [8] | Haakenson J, Wu J Y, Xiang S, et al. HDAC6-dependent functions in tumor cells:crossroad with the MAPK pathways[J]. Crit Rev Oncog, 2015, 20 (1-2): 65-81. doi:10.1615/CritRevOncog.v20.i1-2 |
| [9] | Wang H C, Pao J, Lin S Y, et al. Molecular mechanisms of garlic-derived allyl sulfides in the inhibition of skin cancer progression[J]. Ann N Y Acad Sci, 2012, 1271 : 44-52. doi:10.1111/j.1749-6632.2012.06743.x |
| [10] | Panza E, De Cicco P, Armogida C, et al. Role of the cystathionine γ lyase/hydrogen sulfide pathway in human melanoma progression[J]. Pigment Cell Melanoma Res, 2015, 28 (1): 61-72. doi:10.1111/pcmr.12312 |
| [11] | 单云龙, 韦忠红, 陶丽, 等. 川芎嗪抑制缺氧诱导的乳腺癌MDA-MB-435S细胞的侵袭及迁移[J]. 肿瘤, 2015, 35 (6) : 621-9. Shan Y L, Wei Z H, Tao L, et al. Tetramethylpyrazine inhibits hypoxia-induced migration and invasion of breast cancer cell line MDA-MB-435S in vitro[J]. Tumor, 2015, 35 (6): 621-9. |
| [12] | Li Y, Zhang J, Zhang L, et al. Diallyltrisulfide inhibits proliferation, invasion and angiogenesis of osteosarcoma cells by switching on suppressor microRNAs and inactivating of Notch-1 signaling[J]. Carcinogenesis, 2013, 34 (7): 1601-10. doi:10.1093/carcin/bgt065 |
| [13] | 刘兆国, 范方田, 韦忠红, 等. BRAF突变的黑色素瘤耐药机制研究进展[J]. 中国药理学通报, 2013, 29 (10) : 1349-51. Liu Z G, Fan F T, Wei Z H, et al. Research progress of the mechanisms for drug resistance in melanoma with BRAF-mutation[J]. Chin Pharmacol Bull, 2013, 29 (10): 1349-51. |
| [14] | 曹玉珠, 刘兆国, 单云龙, 等. 血小板介导肿瘤血行转移的作用及其机制研究进展[J]. 中国药理学通报, 2015, 31 (2) : 166-9. Cao Y Z, Liu Z G, Shan Y L, et al. Research progress on the role of platelet in mediating tumor metastasis by hematogenous spread and its mechanisms[J]. Chin Pharmacol Bull, 2015, 31 (2): 166-9. |
| [15] | 郑燕华, 林求诚, 吕联煌. 大蒜素对白血病细胞增殖和凋亡的影响[J]. 中国药理学通报, 2009, 25 (6) : 790-3. Zheng Y H, Lin Q C, Lyu L H. Inhibitory effects of allicin on HL-60 cell proliferation and its induction of apoptosis[J]. Chin Pharmacol Bull, 2009, 25 (6): 790-3. |
| [16] | Yi L, Su Q. Molecular mechanisms for the anti-cancer effects of diallyldisulfide[J]. Food Chem Toxicol, 2013, 57 : 362-70. doi:10.1016/j.fct.2013.04.001 |
| [17] | Jacob A, Prekeris R. The regulation of MMP targeting to invadopodia during cancer metastasis[J]. Front Cell Dev Biol, 2015, 3 : 4. |