


2. 甘肃省中医院重症医学科,甘肃 兰州 730050
2. Intensive Care Unit, Gansu Provincial Hospital of TCM, Lanzhou 730050, China
酒精性脂肪肝(alcoholic fatty liver disease,AFLD)是指由于长期摄入过量酒精而导致的肝脏损害病变。慢性嗜酒者约有60%导致AFLD,其中30%可发展为肝纤维化和肝硬化[1]。在肝脏疾病中,AFLD死亡率仅次于肝癌,居第2位,并且酒精性肝病的发病率呈现明显上升趋势[2-3]。因此,对AFLD及其临床药物的研发工作具有十分重要的意义。
药材狗肝菜是爵床科华九头狮子草属狗肝菜Dicliptera chinensis(L.) Nees.的全草,其化学成分主要为多糖、有机酸、氨基酸等物质[4]。近年来,本课题组已证实狗肝菜多糖(Dicliptera chinensis polysaccharide,DCP)对化学性肝损伤、肝纤维化呈现出良好的保护作用[5-6]。但检索国内外相关文献,尚未发现DCP抗AFLD的研究报道。因此,本实验采用灌胃酒精联合喂养高脂饲料的方法建立大鼠AFLD模型,并经DCP干预,拟从抗炎、抗氧化方面探讨DCP对AFLD的药效及机制,为DCP的临床应用和进一步开发利用提供科学依据。
1 材料 1.1 动物SPF级SD大鼠60只,体质量180 g~220 g,♀♂各半,由桂林医学院SPF实验动物中心提供(许可证号SCXK2007-0001)。
1.2 药品与试剂DCP制备方法参见文献[7]。ALT、AST、AKP、MDA、SOD、GSH试剂盒购于南京建成生物工程研究所;TG、TC、LDL-C、HDL-C试剂盒购于北京北华康泰临床试剂有限公司;TNF-α、IL-6试剂盒购于Elabscience公司;TGF-β1购于武汉伊莱瑞特生物科技有限公司;NF-κB抗体购于Abcam公司;水飞蓟宾胶囊为天津天士力制药有限公司产品,批号20140224;红星牌二锅头白酒,北京酿酒总厂出品,酒精度55%。
1.3 仪器TGL-16K台式高速冷冻离心机,湖南湘仪离心机厂;AU600全自动生化检测仪,奥林巴斯生产;Olympus BX51显微镜,奥林巴斯生产;BS1105电子天平、AUW220D电子天平,德国Sartorius公司;Tanon电泳仪,上海天能科技有限公司。
2 方法 2.1 分组及给药将60只大鼠随机分为6组,即正常对照组、模型组、水飞蓟宾组(100 mg·kg-1)及DCP高、中、低剂量组(300、200、100 mg·kg-1)。正常组喂普通饲料,其余各组以高糖高脂饲料(基础饲料68.8%、10%蔗糖、10%蛋黄、10%猪油、胆固醇1%、胆盐0.2%)喂养,并每天从5%酒精开始以5 mL·kg-1灌胃,浓度每周递增5%,于第7周末造成大鼠AFLD模型;继续35%酒精和高糖高脂饲料处理,并受试药物干预5周后,眼球取血和收集肝组织[8]。
2.2 指标的检测实验于第12周末结束,禁食、不禁水18 h后,眼球取血和收集肝组织。参照试剂盒的说明,生物化学法检测血清中ALT、AST、AKP、TG、TC、LDL-C、HDL-C水平;测定肝组织中MDA、SOD、GSH水平或活性;ELISA法检测肝组织中TNF-α、IL-6和TGF-β1含量;Western blot法检测肝组织NF-κB蛋白表达情况[9-10]。
2.3 肝脏病理学检查取大鼠肝左叶,固定于4%多聚甲醛溶液中,石蜡包埋、切片、HE染色,在光学显微镜下观察肝组织病理学变化。
2.4 统计学分析应用SPSS 13.0软件进行统计分析,数据均以x±s表示,组间比较应用F检验。
3 结果 3.1 DCP对AFLD大鼠血清中ALT、AST和AKP水平的影响由Tab 1结果可见,模型组与正常组相比较,ALT、AST和AKP差异有显著性(P < 0.01);与模型组比较,水飞蓟宾和DCP均能明显抑制ALT、AST和AKP活性(P < 0.01,P < 0.05),且成量效关系。因此,可判断DCP对受损的肝细胞具有保护作用。
| Group | Dose /mg·kg-1 |
ALT /U·L-1 |
AST /U·L-1 |
AKP /U·L-1 |
| Normal | - | 40±5 | 49±4 | 50±6 |
| Model | - | 198±12** | 221±15** | 123±13** |
| Silybin | 100 | 80±8## | 110±12## | 69±7## |
| DCP | 300 | 73±6## | 108±10## | 71±7## |
| 200 | 83±8## | 123±11# | 78±8## | |
| 100 | 124±10# | 136±14# | 87±9# | |
| **P < 0.01 vs normal; #P < 0.05, ##P < 0.01 vs model | ||||
模型对照组TG、TC和LDL-C含量升高,HDL-C水平降低(P < 0.01),水飞蓟宾对TC含量无明显影响(P>0.05);DCP能明显提高模型鼠HDL-C含量, 降低TG、TC、LDL-C含量(P < 0.05或0.01),可判断DCP对AFLD大鼠的血清血脂具有明显的调节作用,见Tab 2。
| Group | Dose/mg·kg-1 | LDL-C/mmol·L-1 | HDL-C/mmol·L-1 | TG/mmol·L-1 | TC/mmol·L-1 |
| Normal | - | 0.36±0.04 | 1.31±0.12 | 0.31±0.04 | 2.67±0.23 |
| Model | - | 0.77±0.08** | 0.76±0.07** | 0.57±0.06** | 3.89±0.30** |
| Silybin | 100 | 0.57±0.05## | 0.91±0.08## | 0.41±0.05## | 3.51±0.19 |
| DCP | 300 | 0.52±0.05## | 1.01±0.10## | 0.39±0.03## | 2.99±0.23## |
| 200 | 0.55±0.07## | 0.95±0.07## | 0.41±0.03## | 3.20±0.19## | |
| 100 | 0.56±0.08## | 0.88±0.06# | 0.44±0.05# | 3.48±0.32# | |
| **P < 0.01 vs normal; #P < 0.05, ##P < 0.01 vs model | |||||
与正常组比较,模型组大鼠肝中MDA含量明显升高,SOD活性降低且GSH含量减少(P < 0.01);DCP能明显降低AFLD大鼠肝组织中的MDA含量,提高SOD活性及GSH含量(P < 0.05或0.01),表明DCP具有良好的抗氧化能力,见Tab 3。
| Group | Dose /mg·kg-1 |
MDA /nmol·g-1 Pro |
GSH /mg·g-1 Pro |
SOD /IU·g-1 Pro |
| Normal | - | 1.89±0.14 | 2.25±0.12 | 2.12±0.17 |
| Model | - | 4.65±0.37** | 1.01±0.09** | 1.30±0.14** |
| Silybin | 100 | 3.31±0.21## | 1.37±0.13# | 1.75±0.19# |
| DCP | 300 | 2.99±0.31## | 1.59±0.18## | 1.85±0.19## |
| 200 | 3.28±0.28## | 1.42±0.14## | 1.74±0.15# | |
| 100 | 3.69±0.38# | 1.33±0.11# | 1.71±0.09# | |
| **P < 0.01 vs normal; #P < 0.05, ##P < 0.01 vs model | ||||
Tab 4中ELISA结果表明,与正常组比较,模型组肝组织中TNF-α、IL-6和TGF-β1水平明显增加(P < 0.01)。经受试药物治疗后,各组肝组织中TNF-α、IL-6和TGF-β1的水平逐渐减少,与模型组比较,差异有统计学意义(P < 0.05或0.01),表明DCP可通过抑制肝组织内的炎症反应和细胞毒性来实现保肝作用。
| Group | Dose /mg·kg-1 |
TNF-α /ng·g-1 |
IL-6 /ng·g-1 |
TGF-β1 /ng·g-1 |
| Normal | - | 18.99±2.34 | 23.89±4.31 | 10.20±1.12 |
| Model | - | 67.52±6.98** | 68.39±6.37** | 30.27±2.87** |
| Silybin | 100 | 47.61±5.66## | 55.38±5.92## | 15.57±1.88## |
| DCP | 300 | 41.30±4.81## | 50.27±6.33## | 14.37±1.15## |
| 200 | 44.39±4.60## | 54.99±5.12## | 16.38±1.88## | |
| 100 | 49.86±5.87# | 58.31±5.45# | 19.91±2.51# | |
| **P < 0.01 vs normal; #P < 0.05, ##P < 0.01 vs model | ||||
由Fig 1数据可见,DCP能明显下调NF-κB蛋白的表达(P < 0.01)。提示DCP对AFLD大鼠肝脏的保护作用与调节NF-κB蛋白表达密切相关。
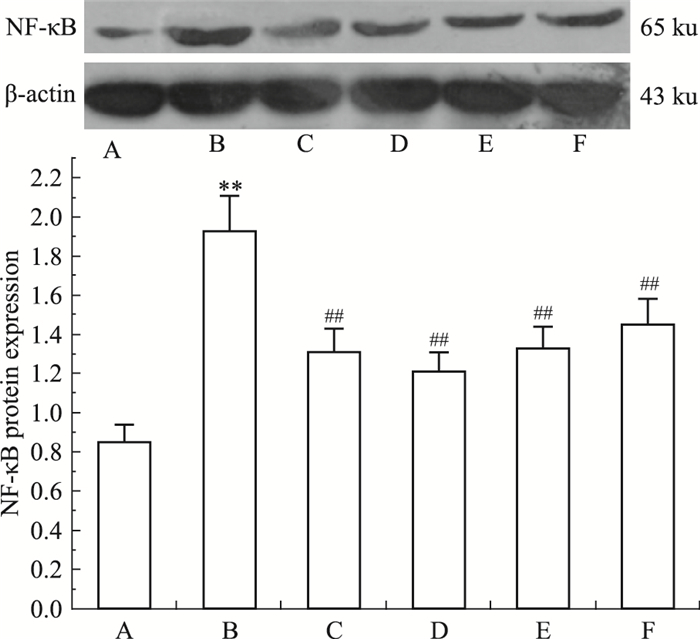
|
| Fig 1 Effect of DCP on expression of NF-κB in rats with AFLD (x±s, n=5) A:Normal group; B:Model group; C: Silybin group (100 mg·kg-1); D: DCP (300 mg·kg-1) group; E: DCP (200 mg·kg-1) group; F: DCP (100 mg·kg-1) group.**P < 0.01 vs normal; ##P < 0.01 vs model |
经HE染色,在光镜下观察,正常大鼠肝细胞均匀整齐,胞质丰富,未见脂肪病变,汇管区未发现炎症细胞浸润,肝小叶结构完整,肝索和肝窦均清晰可辨。模型组肝组织肝细胞数量明显减少,出现明显脂肪变性,出现不同程度的水肿,中央静脉出现明显点灶状坏死和淤血现象。而经受试药物DCP和水飞蓟宾干预后,与模型组比较,炎症反应明显减轻,细胞索状排列较整齐,肝内淤血和点灶状坏死明显减少,肝细胞数量增加,脂肪变性细胞减少。HE组织病理学检查提示DCP能够有效改善AFLD大鼠的肝组织的病变,见Fig 2。
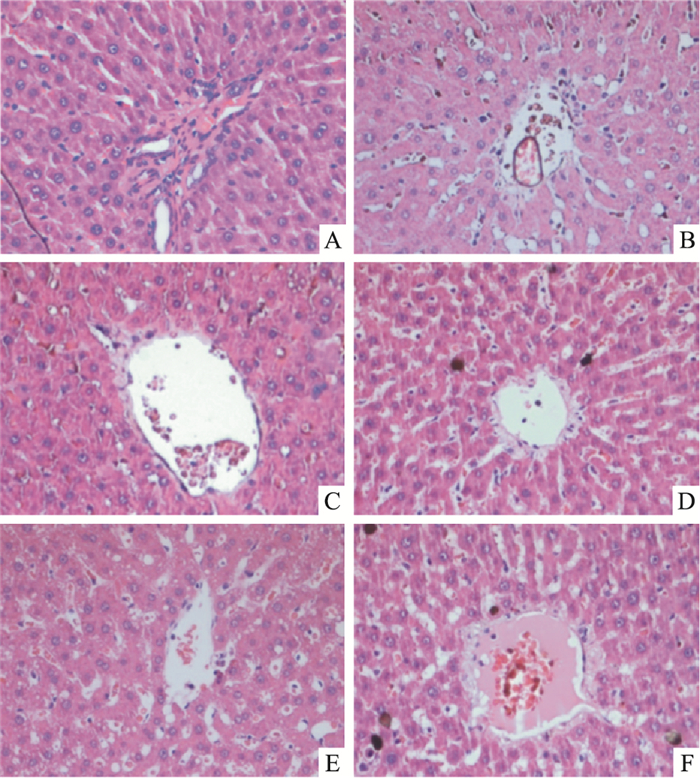
|
| Fig 2 Effect of DCP on hepatic histopathology in rats with NAFLD (HE×200) A:Normal group; B: Model group; C: Silybin group (100 mg·kg-1); D: DCP (300 mg·kg-1) group; E: DCP (200 mg·kg-1) group; F:DCP (100 mg·kg-1) group |
酒精性肝损伤的代谢产物引发的肝脏氧化应激与肝细胞凋亡密切相关,表现为SOD活性降低、MDA过量产生、GSH系统功能紊乱和凋亡阳性细胞增多等[11-12]。本实验结果显示,经DCP干预后,MDA、SOD和GSH生化指标明显改善,提示DCP对大鼠AFLD保护作用与其抑制脂质过氧化反应、清除自由基的作用相关,具有较好的抗氧化应激作用。此外,DCP能降低大鼠AFLD血脂,减少脂肪在肝脏的沉积,抑制脂肪肝的形成。同时,DCP能下调AFLD大鼠TGF-β1的表达,体现其有助于抑制肝细胞凋亡和肝星状细胞的激活,从而延缓或阻止向肝纤维化的发生、发展。
NF-κB是多种炎症介质的上游信号分子,可促进多种炎症介质的产生,处于炎症反应的中心环节[13]。NF-κB通过调控各种急性反应蛋白、细胞因子和细胞黏附分子的转录过程,直接参与肝脏的急、慢性炎症[14]。NF-κB激活后可刺激TNF-α、IL-1等的产生,而这些物质又作为激动剂进一步作用于NF-κB,形成NF-κB活化的正反馈[15]。TNF-α作为引起急、慢性肝损伤的重要因子之一,可直接或间接引起肝细胞的免疫损伤,进而诱导TNF-α本身、IL-1、IL-6和IL-8等细胞炎症因子的持续大量分泌,加重肝脏损伤[16-17]。氧化应激在NF-κB的活化过程中也起着重要的作用,机体受到氧化应激刺激时,便通过一个或多个信号转导途径,进而活化NF-κB[18]。本实验结果显示,模型组NF-κB蛋白表达及TNF-α、IL-6水平明显高于正常组,经DCP干预后,NF-κB蛋白表达、TNF-α、IL-6水平明显降低,提示DCP对大鼠AFLD的保护作用可能是通过抑制NF-κB信号通路的活化,阻止炎症反应。此外,DCP是否直接抑制NF-κB活性或通过抑制氧化应激,进而减少NF-κB的产生,其交互关系有待于进一步研究。
( 致谢: 本实验在桂林医学院药物研究所和广西自治区生药学重点实验室完成的,感谢实验室全体老师对本实验的大力支持和帮助。 )
| [1] | 周恒, 李俊, 王华. 酒精性肝病动物模型研究进展[J]. 中国药理学通报, 2016, 32 (4) : 468-72. Zhou H, Li J, Wang H. Animal models of alcohol liver diseases[J]. Chin Pharmacol Bull, 2016, 32 (4): 468-72. |
| [2] | Niemela O, Parkkila S, Juvonen R O, et al. Cytochromes P4502A6, 2E1, and 3A and production of protein-aldehyde adducts in the liver of patients with alcoholic and non-alcoholic liver diseases[J]. J Hepatol, 2000, 33 (6): 893-901. doi:10.1016/S0168-8278(00)80120-8 |
| [3] | Waluga M, Hartleb M. Alcoholic liver disease[J]. Wiad Lek, 2003, 56 (1-2): 61-70. |
| [4] | 高雅, 钟明利, 钟家良, 等. 狗肝菜多糖对抗结核药物治肝损伤的研究[J]. 广州中医药大学学报, 2014, 31 (6) : 953-6. Gao Y, Zhong M L, Zhong J L, et al. Study of Dicliptera chinensis polysaccharide in counteracting liver injury induced by antituberculosis drugs[J]. J Guangzhou Univ Tradit Chin Med, 2014, 31 (6): 953-6. |
| [5] | Zhang K F, Gao Y, Zhong M L, et al. Hepatoprotective effects of Dicliptera chinensis polysaccharides on dimethylnitrosamine-induced hepatic fibrosis rats and its underlying mechanism[J]. J Ethnopharmacol, 2016, 179 : 38-44. doi:10.1016/j.jep.2015.12.053 |
| [6] | 张可锋, 高雅, 钟明利, 等. 狗肝菜多糖对二甲基亚硝胺诱导的肝纤维化大鼠的影响[J]. 中药药理与临床, 2014, 30 (6) : 71-4. Zhagn K F, Gao Y, Zhong M L, et al. Study on the antagonistic effects and mechanism of Dicliptera chinensis polysaccharide on liver fibrosis in rats induced by dimethylnitrosamin[J]. Pharmacol Clin Chin Mater Med, 2014, 30 (6): 71-4. |
| [7] | 韦日明, 高雅, 钟明利, 等. 狗肝菜多糖对大鼠酒精性肝损伤的影响[J]. 中药药理与临床, 2015, 31 (4) : 97-100. Wei R M, Gao Y, Zhong M L, et al. Study on the protective effect of Dicliptera chinensis polysaccharide on rats liver induced by alcohol[J]. Pharmacol Clin Chin Mater Med, 2015, 31 (4): 97-100. |
| [8] | 陈熙, 张程, 赵卉, 等. 4-苯基丁酸对果糖所致非酒精性脂肪肝的保护效应[J]. 中国药理学通报, 2011, 27 (5) : 661-5. Chen X, Zhang C, Zhao H, et al. The protective effect of 4-phenyl butyrate acid on fructose-evoked nonalcoholic fatty liver disease in mice[J]. Chin Pharmacol Bull, 2011, 27 (5): 661-5. |
| [9] | 谭海荣, 吴谦, 潘竞锵, 等. 水飞蓟宾对抗大鼠酒精性脂肪肝作用及机制[J]. 中国临床药理学与治疗学, 2004, 9 (7) : 803-6. Tan H R, Wu Q, Pan J Q, et al. Effects ant mechanism of silibinin on antagonizing alcoholic fatty liver in rats[J]. Chin J Clin Pharmacol Ther, 2004, 9 (7): 803-6. |
| [10] | 宋芳, 谢梅林, 朱路佳, 等. 蛇床子素调节酒精性脂肪肝大鼠脂代谢机制的研究[J]. 中国药理学通报, 2008, 24 (7) : 979-80. Song F, Xie M L, Zhu L J, et al. Regulatory mechanism of osthole on lipid metabolism in alcohol-induced fatty liver rat[J]. Chin Pharmacol Bull, 2008, 24 (7): 979-80. |
| [11] | 许文萱, 张自力, 赵士峰, 等. 法尼酯衍生物X受体在慢性肝病中的作用及机制研究进展[J]. 中国药理学通报, 2016, 32 (3) : 314-9. Xu W X, Zhang Z L, Zhao S F, et al. Progress on roles and mechanisms of farnesoid X receptor (FXR) in chronic liver diseases[J]. Chin Pharmacol Bull, 2016, 32 (3): 314-9. |
| [12] | Darwish H A, Abd Raboh N R, Mahdy A. Camel′s milk alleviates alcohol-induced liver injury in rats[J]. Food Chem Toxicol, 2012, 50 (5): 1377-83. doi:10.1016/j.fct.2012.01.016 |
| [13] | 胡泽华, 王琳琳, 唐清, 等. 内毒素血症肝损伤幼年大鼠肝NF-κB的变化[J]. 中国当代儿科杂志, 2010, 12 (10) : 804-8. Hu Z H, Wang L L, Tang Q, et al. NF-κB levels in the liver of young rats with endotoxemic liver injury[J]. Chin J Contemp Pediatr, 2010, 12 (10): 804-8. |
| [14] | 尤红, 王宝恩. 核因子-κB在肝脏疾病中研究进展[J]. 临床肝胆杂志, 2000, 16 (1) : 11-2. You H, Wang B E. Investigative advancement of nuclear factor-κB in liver disease[J]. J Clin Hepatol, 2000, 16 (1): 11-2. |
| [15] | 程津新, 毛用敏. NF-κB的分子生物学活性及其在疾病中的作用[J]. 天津医药, 2004, 32 (3) : 189-91. Cheng J X, Mao Y M. Biological functions of nuclear factor-κB and its roles in diseases[J]. Tianjin Med J, 2004, 32 (3): 189-91. |
| [16] | Upham J W, Lundahl J, Liang H, et al. Simplified quantitation of myeloid dendritic cells in peripheral blood using flow cytometry[J]. Cytomentry, 2000, 40 (1): 50-9. doi:10.1002/(ISSN)1097-0320 |
| [17] | 王文平, 王佑民, 王丽萍. 肥胖大鼠非酒精性脂肪肝与血清脂联素和肿瘤坏死因子α的关系及吡格列酮干预[J]. 中国药理学通报, 2008, 24 (2) : 265-8. Wang W P, Wang Y M, Wang L P. Relationship between nonalcoholic fatty liver disease and levels of serum adiponectin and tumor necrosis factor-α in obese rats and pioglitazone intervention[J]. Chin Pharmacol Bull, 2008, 24 (2): 265-8. |
| [18] | Garg A, Aggawal B B. Nuclear transcription factor-κB as a target for cancer drug development[J]. Leukemia, 2002, 16 (6): 1053-68. doi:10.1038/sj.leu.2402482 |

