


2. 广州市番禺区中心医院心血管内科;
3. 广州市番禺区心血管疾病研究所,广东 广州 511400;
4. 中山大学附属第一医院东院心血管内科CCU,广东 广州 510700;
5. 东莞市第三人民医院心血管内科;
6. 东莞市心血管疾病研究所,广东 东莞 523326;
7. 中山大学附属第一医院心血管内科,广东 广州 510080
 ,
LIANG Wei-jie2,3,
LI Jian-hao2,3,
ZHENG Dong-dan4,
LAN Jun5,6,
CHEN Jing-fu4,
LIAO Xin-xue7
,
LIANG Wei-jie2,3,
LI Jian-hao2,3,
ZHENG Dong-dan4,
LAN Jun5,6,
CHEN Jing-fu4,
LIAO Xin-xue7

2. Dept of Cardiology, Central Hospital of Panyu District;
3. Cardiovascular Institute of Panyu District, Guangzhou 511400, China;
4. Cardiac Care Unit of Dept of Cardiology, Huangpu Division, the First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510700, China;
5. Dept of Cardiology, the Third People's Hospital of Dongguan City;
6. Cardiovascular Institute of Dongguan City, Dongguan Guangdong 523326, China;
7. Dept of Cardiology, the First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510080, China
高血糖不仅是糖尿病的一个重要指征,其所诱导的心肌损伤及炎症反应在糖尿病心血管并发症如糖尿病心肌病(diabetic cardiomyopathy,DCM)的发生和发展过程中起重要的作用[1]。研究表明,在DCM患者或糖尿病动物及离体细胞模型中,持续存在的炎症反应伴随大量的炎症细胞因子如白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的分泌及与炎症相关的信号分子如Toll样受体4(Toll-like receptor 4,TLR4)、核因子-κB (nuclear factor κB,NF-κB)、环氧化酶-2(cyclooxygenase-2,COX-2)等的激活,最终导致心肌损害发生[2-5]。因此,积极研发及寻找对抗炎症反应的药物,有望成为防治糖尿病心血管并发症的一个突破口。尼可地尔(nicorandil,Nic)是ATP敏感性钾通道(ATP-sensitive K+ channel,KATP通道)的开放剂,同时还具有类硝酸酯的作用,是一种广泛应用于临床的抗心绞痛药物[6]。研究表明,Nic具有抗炎作用,能抑制TLR4[7]、NF-κB[8]等炎症信号分子的活动从而实现器官保护。近年来,Nic在对抗糖尿病相关的心血管并发症中的作用得到了极大的关注[9-11]。例如:Nic不仅能减轻球囊导管机械损伤动脉导致的糖尿病大鼠血管内皮增生,而且能抑制HG诱导的血管内皮细胞增殖和迁移[9];应用Nic可减轻链脲霉素(streptozotocin,STZ)诱导的糖尿病大鼠的氧化应激及血管细胞粘附因子-1(vascular cell adhesion molecule-1,VCAM-1)的分泌[10];择期进行经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的糖尿病患者,口服Nic可减轻PCI相关的心肌损伤,改善心脏功能[11]。Nic的心血管保护作用与其开放KATP通道有关。最近,我们研究证实,开放KATP通道能对抗高糖引起的心肌细胞损伤[12-13]。然而,在高糖状态下,Nic能否保护心肌细胞对抗高糖诱导的损伤和炎症,其心肌保护作用能否通过抑制NF-κB、COX-2等炎症信号分子的活动而实现,目前尚未完全清楚。
为此本研究在高糖损伤H9c2心肌细胞模型[14]中探讨:(1) Nic能否对抗高糖引起的心肌细胞损伤和炎症;(2) Nic的心肌保护作用是否与抑制NF-κB/COX-2通路有关。
1 材料与方法 1.1 材料抗磷酸化(p)-NF-κB p65和抗总(t)-NF-κB p65抗体、抗COX-2抗体、抗cleaved caspase-3抗体来源于Cell Signaling (美国);二硫代氨基甲酸吡咯烷(Pyrrolidine dithiocarbamate,PDTC,NF-κB抑制剂)、Nic、罗丹明123(Rhodamine 123,Rh 123)、双氯荧光素(2′,7′-dichlorfluorescein-diacetate,DCFH-DA)、NS-398(COX-2抑制剂)、Hoechst 33258、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒购自Sigma-Aldrich公司(美国);特级胎牛血清(fetal bovine serum,FBS)购自Gibco BRL (美国);细胞计数试剂盒8(cell counter kit-8, CCK-8)购自Dojindo Lab (日本);DMEM培养基(其葡萄糖浓度为5.5 mmol·L-1)由Hyclone公司(美国)供应;IL-1β和TNF-α ELISA试剂盒由武汉华美生物工程有限公司提供。H9c2心肌细胞来源于胚胎期大鼠心脏组织的亚克隆细胞系,由中山大学实验动物中心细胞库供应。
1.2 细胞培养及实验分组H9c2心肌细胞置于含10% FBS的DMEM培养基中,于5% CO2、37 ℃的条件下传代培养,待细胞生长至约80%的融合状态可用于实验。实验分为8组:(1)对照(Control)组:DMEM培养基作用心肌细胞24 h;(2)高糖(high glucose, HG)组:35 mmol·L-1葡萄糖处理心肌细胞24 h;(3) Nic+HG组:50 μmol·L-1 Nic作用心肌细胞60 min,PBS液洗2次,然后HG处理24 h;(4) PDTC+HG组:100 μmol·L-1 PDTC与HG共处理心肌细胞24 h;(5) NS-398+HG组:10 μmol·L-1 NS-398与HG共处理心肌细胞24 h;(6) Nic组:50 μmol·L-1 Nic作用心肌细胞60 min,PBS液洗2次,然后DMEM处理24 h;(7) PDTC组:100 μmol·L-1 PDTC与DMEM共处理心肌细胞24 h;(8) NS-398组:10 μmol·L-1 NS-398与DMEM共处理心肌细胞24 h。
1.3 蛋白质免疫印迹法检测NF-κB、COX-2和cleaved caspase-3的表达水平H9c2心肌细胞在60 mm培养皿中生长至融合度约80%时,根据分组给予相应处理后,加入细胞裂解液,4 ℃摇床上处理30 min,11 400×g高速离心10 min,BCA法测定蛋白质含量。等量的蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳分离后,转移至PVDF膜上,5%脱脂奶粉封闭1 h,加入I抗,即兔抗鼠p-NF-κB p65、t-NF-κB p65、COX-2、cleaved caspase-3或GAPDH (浓度均为1 :1 000),4 ℃作用过夜后加入浓度为1 :2 500的Ⅱ抗稀释液,室温下孵育1.5 h。ECL法使PVDF膜显色,暗室中曝光到X线片上,凝胶成像扫描系统分析结果。实验重复5次。
1.4 CCK-8法测定心肌细胞存活率H9c2心肌细胞在96孔板中生长至融合度约80%时,按照设定的分组处理后,每孔加入DMEM 90 μL和CCK-8溶液10 μL,培养箱内孵育2.5 h,酶标仪上读取450 nm处的吸光度值(A)。细胞存活率按照以下公式计算:细胞存活率/%=处理组A/对照组A×100%。实验重复5次。
1.5 LDH试剂盒检测细胞培养液中LDH活性H9c2心肌细胞在96孔板中生长至融合度约80%时,按照设定的分组分别处理后,严格按照LDH试剂盒说明书介绍的步骤,检测并计算出培养液中LDH的活性。实验重复5次。
1.6 DCFH-DA染色荧光显微镜照相法测定胞内活性氧(reactive oxygen species, ROS)水平H9c2心肌细胞在24孔板中生长至融合度约80%时,按照分组给予相应处理后,加入DCFH-DA染液,在细胞培养箱中孵育30 min,荧光显微镜(TE-2000 Nikon,日本)下随机照片记录5个高倍镜视野,应用图像分析软件(Image J 1.47i)计算出绿色荧光强度的平均值,平均荧光强度(mean fluorescent intensity,MFI),其数值大小能间接反映ROS水平的高低,再对每组数据进行统计分析。实验重复5次。
1.7 Hoechst 33258核染色荧光显微镜照相检测凋亡细胞数量H9c2心肌细胞在24孔板中生长至约80%的融合度时,按分组给予相应处理后,多聚甲醛固定10 min,随后Hoechst 33258染料作用30 min,在荧光显微镜下可观察到:正常心肌细胞核呈弥散均匀低密度荧光,凋亡细胞则表现为细胞核呈浓缩致密的颗粒块状荧光。随机照片记录5个高倍镜视野,应用Image J 1.47i计算出蓝色荧光的MFI,并进行数据分析统计。实验重复5次。
1.8 Rh 123染色荧光显微镜照相法检测线粒体膜电位(mitochondrial membrane potential,MMP)H9c2心肌细胞在24孔板中生长至约80%的融合度时,按照分组给予相应的处理后,加入Rh 123缓冲液,细胞培养箱中孵育45 min,荧光显微镜下随机照片记录5个高倍镜视野,应用图像分析软件计算出绿色荧光的MFI (数值大小可反映MMP的高低),再对每组数据进行统计分析。实验重复5次。
1.9 ELISA法检测细胞培养液中IL-1β和TNF-α的水平H9c2心肌细胞在96孔板中生长至融合度约80%时,按照分组给予不同处理后,收集培养基作待测标本,按照ELISA试剂盒说明书进行操作,测定出细胞培养液中IL-1β和TNF-α的水平。实验重复5次。
1.10 统计学处理应用SPSS 19.0软件进行统计数据处理和分析,计量资料采用均数±标准误(x±s)表示,单因素方差分析用于多个样本均数间的比较,SNK-q检验用于多个样本均数间的两两比较。
2 结果 2.1 Nic抑制HG诱导的心肌细胞存活率下降为选择Nic的最佳作用浓度及预处理时间,本研究首先选择Nic的不同浓度及预处理时间在HG处理的心肌细胞模型中进行实验。Fig 1A结果显示,高糖作用心肌细胞24 h可明显降低心肌细胞存活率。20~100 μmol·L-1 Nic预处理心肌细胞60 min均可明显升高细胞存活率,与HG处理组比较,差异均有统计学意义(P < 0.01),其中浓度在50 μmol·L-1时,Nic升高细胞存活率作用最明显,因此本研究观察50 μmol·L-1 Nic在不同预处理时间的心肌细胞保护作用。Fig 1B显示,从预处理30 min开始,Nic可对抗HG对心肌细胞存活率的抑制作用,使细胞存活率升高,其中预处理60 min时的作用最明显,预处理90和120 min,升高细胞存活率的作用虽有所降低,但仍具有统计学意义(P < 0.01)。根据上述两项实验结果,本研究选用50 μmol·L-1和预处理60 min作为Nic后续实验的作用浓度及预处理时间。
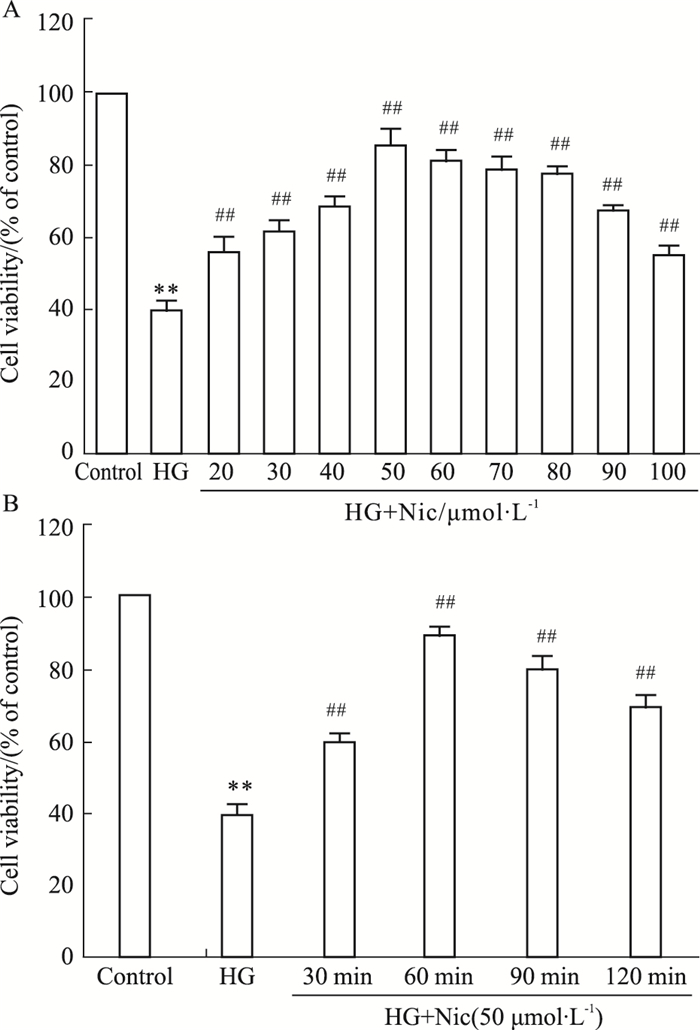
|
| Fig 1 Nicorandil (Nic) attenuates high glucose (HG)-induced decrease in cell viability in H9c2 cardiac cells (n=5) H9c2 cardiac cells were pre-treated with Nic at different concentrations and different time before exposure to HG for 24 h.**P < 0.01 vs control group; ##P < 0.01 vs the HG-treated group. |
Fig 2显示,HG作用心肌细胞24 h可使心肌细胞磷酸化(p)-NF-κB p65和COX-2的表达水平明显上升;在HG作用前,应用50 μmol·L-1 Nic预处理心肌细胞60 min,p-NF-κB p65和COX-2的表达水平均有所下降,与HG组分别比较,差异均具有统计学意义(P < 0.01)。50 μmol·L-1 Nic本身对心肌细胞p-NF-κB p65和COX-2的基础表达无明显的影响。
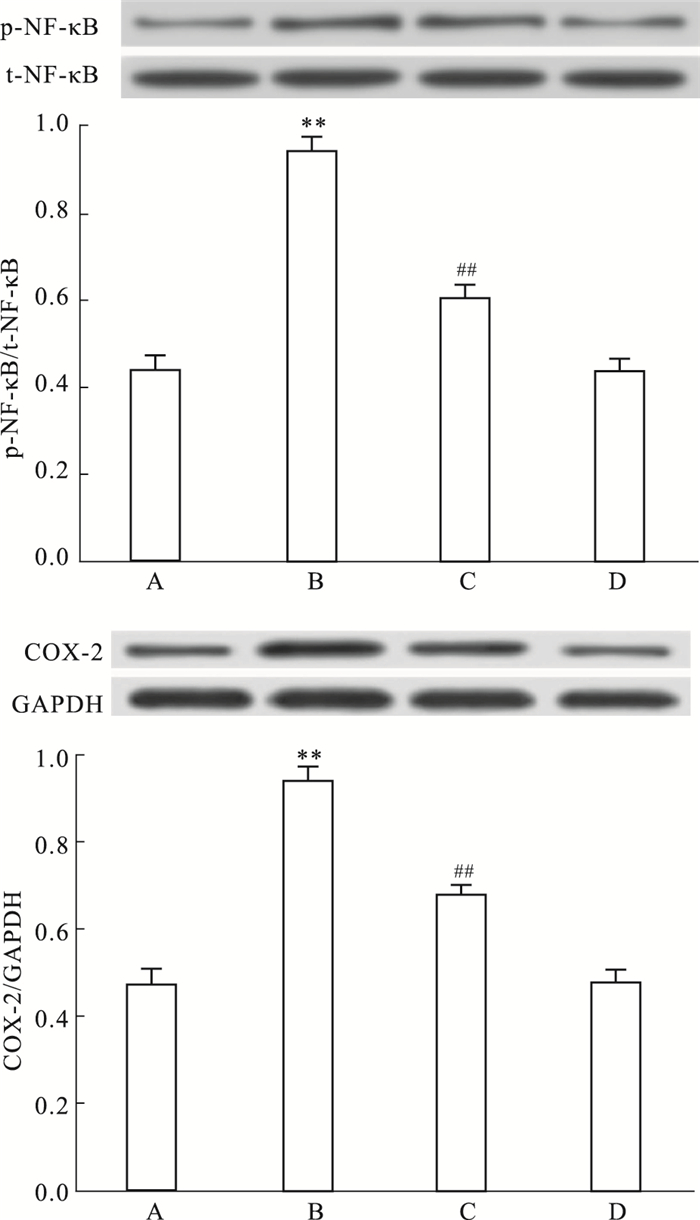
|
| Fig 2 Nic attenuates HG-induced up-regulation of phosphorated (p)-NF-κB p65 and COX-2 protein expression in H9c2 cardiac cells (n=5) A: Control; B: Glucose 35 mmol·L-1; C: Nic 50 μmol·L-1+Glucose 35 mmol·L-1; D: Nic 50 μmol·L-1. **P < 0.01 vs control group; ##P < 0.01 vs the HG-treated group |
HG作用心肌细胞24 h,培养液中的LDH活性明显增加,与Control组比较,差异具有统计学意义(P < 0.01,Fig 3)。在HG作用前,应用50 μmol·L-1 Nic预处理心肌细胞60 min可减少LDH的活性,与HG组比较,差异具有统计学意义(P < 0.01)。与Nic的作用相类似,100 μmol·L-1 PDTC (NF-κB抑制剂)或10 μmol·L-1 NS-398(COX-2抑制剂)和HG共处理心肌细胞24 h也可减少LDH的活性,与HG组分别比较,差异均具有统计学意义(P < 0.01)。50 μmol·L-1 Nic、100 μmol·L-1 PDTC或10 μmol·L-1 NS-398本身对LDH的活性无明显的影响。
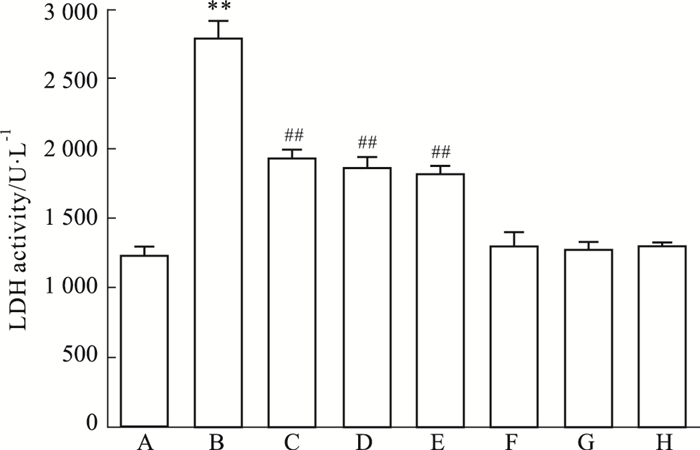
|
| Fig 3 Nic, inhibitors of NF-κB and COX-2 attenuate HG-induced increase in activity of lactate dehydrogenase (LDH) in H9c2 cardiac cells (n=5) A: Control; B: Glucose 35 mmol·L-1; C: Nic 50 μmol·L-1+Glucose 35 mmol·L-1; D: PDTC 100 μmol·L-1+Glucose 35 mmol·L-1; E: NS-398 10 μmol·L-1 +Glucose 35 mmol·L-1; F: Nic 50 μmol·L-1; G: PDTC 100 μmol·L-1; H: NS-398 10 μmol·L-1. **P < 0.01 vs control group; ##P < 0.01 vs the HG-treated group |
Fig 4B显示,HG作用H9c2心肌细胞24 h可使胞内DCFH-DA的MFI明显增强,与Control组(Fig 4A)相比,差异具有统计学意义(P < 0.01)。然而,在HG作用前,50 μmol·L-1 Nic预处理心肌细胞60 min,可使MFI明显降低(Fig 4C),与HG组比较,差异具有统计学意义(P < 0.01)。与Nic作用相类似,100 μmol·L-1 PDTC或10 μmol·L-1 NS-398和HG共处理心肌细胞24 h也能使DCFH-DA的MFI明显降低,分别与HG组比较,差异均具有统计学意义(P < 0.01)。50 μmol·L-1 Nic、100 μmol·L-1 PDTC或10 μmol·L-1 NS-398本身对心肌细胞ROS的基础生成无明显的影响(P>0.05)。
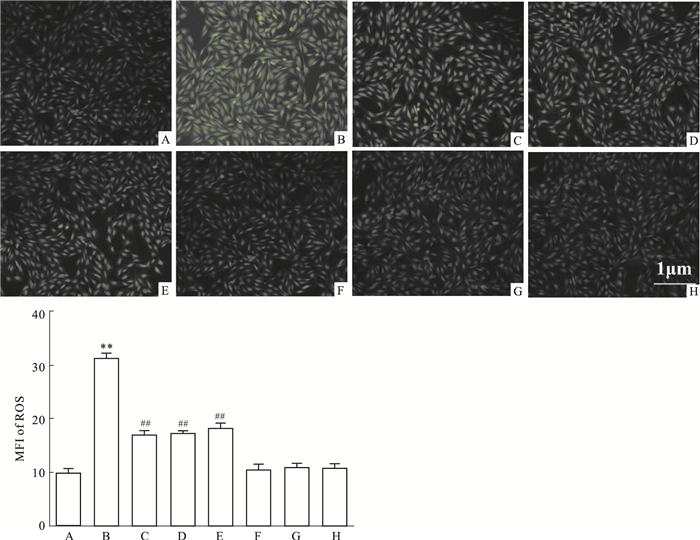
|
| Fig 4 Nic, inhibitors of NF-κB and COX-2 attenuate HG-induced increase in intracellular ROS generation in H9c2 cardiac cells (n=5) A: Control; B: Glucose 35 mmol·L-1; C: Nic 50 μmol·L-1+Glucose 35 mmol·L-1; D: PDTC 100 μmol·L-1+Glucose 35 mmol·L-1; E: NS-398 10 μmol·L-1 +Glucose 35 mmol·L-1; F: Nic 50 μmol·L-1; G: PDTC 100 μmol·L-1; H: NS-398 10 μmol·L-1. **P < 0.01 vs control group; ##P < 0.01 vs the HG-treated group |
HG作用心肌细胞24 h后,经Hoechst 33258核染色,在荧光显微镜下可观察到典型凋亡特征的细胞数量明显增多(Fig 5B),与Control组(Fig 5A)比较,差异具有统计学意义(P < 0.01)。然而50 μmol·L-1 Nic预处理心肌细胞60 min再予HG作用心肌细胞24 h,凋亡细胞数量明显减少,与HG处理组比较,差异具有统计学意义(P < 0.01,Fig 5C)。与Nic作用相类似,100 μmol·L-1 PDTC或10 μmol·L-1 NS-398和HG共处理心肌细胞24 h也能减少凋亡细胞的数量,与HG组分别比较,差异均具有统计学意义(P < 0.01)。Nic、PDTC或NS-398本身对细胞凋亡数量无明显的影响。
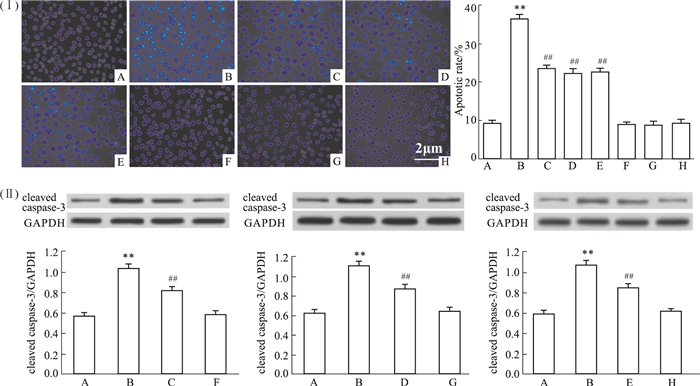
|
| Fig 5 Nic, Inhibitors of NF-κB and COX-2 attenuate HG-induced apoptosis in H9c2 cardiac cells (n=5) (Ⅰ) The changes of apoptotic cells were detected by Hoechst 33258 nuclear staining. (Ⅱ) The levels of cleaved caspase-3 were measured by Western blot. A: Control; B: Glucose 35 mmol·L-1; C: Nic 50 μmol·L-1+Glucose 35 mmol·L-1; D: PDTC 100 μmol·L-1+ Glucose 35 mmol·L-1; E: NS-398 10 μmol·L-1 +Glucose 35 mmol·L-1; F: Nic 50 μmol·L-1; G: PDTC 100 μmol· L-1; H: NS-398 10 μmol·L-1. **P < 0.01 vs control group; ##P < 0.01 vs the HG-treated group. |
另一方面,HG可导致细胞凋亡的终末效应器cleaved caspase-3的表达明显增多;应用50 μmol·L-1 Nic预处理心肌细胞60 min然后再予HG作用24 h,或应用100 μmol·L-1 PDTC或10 μmol·L-1 NS-398和HG共处理心肌细胞24 h均可减轻HG对cleaved caspase-3表达的上调,分别与HG组比较,差异均具有统计学意义(P < 0.01)。50 μmol·L-1 Nic、100 μmol·L-1 PDTC或10 μmol·L-1 NS-398本身对心肌细胞cleaved caspase-3的基础表达无明显的影响(P>0.05)。
2.6 Nic、NF-κB和COX-2的抑制剂减轻HG引起的心肌细胞MMP丢失HG作用心肌细胞24 h,可使心肌细胞内Rh 123的MFI从(29.6±1.36)%(Control组,Fig 6A)降低至(8.7±0.90)% (HG组,Fig 6B),两者比较差异有统计学意义(P < 0.01)。在HG作用前,采用50 μmol·L-1 Nic预处理心肌细胞60 min,可使MFI升高至(19.8±1.24)%(Fig 6C),与HG组比较,差异有统计学意义(P < 0.01)。与Nic作用相类似,100 μmol·L-1 PDTC或10 μmol·L-1 NS-398和HG共处理心肌细胞24 h,MFI也可明显升高,分别为(20.6±0.77)%和(21.3±0.83)%,与HG组比较,差异均具有统计学意义(P均 < 0.01)。50 μmol·L-1 Nic、100 μmol·L-1 PDTC或10 μmol·L-1 NS-398本身对心肌细胞MMP无明显的影响(P>0.05)。
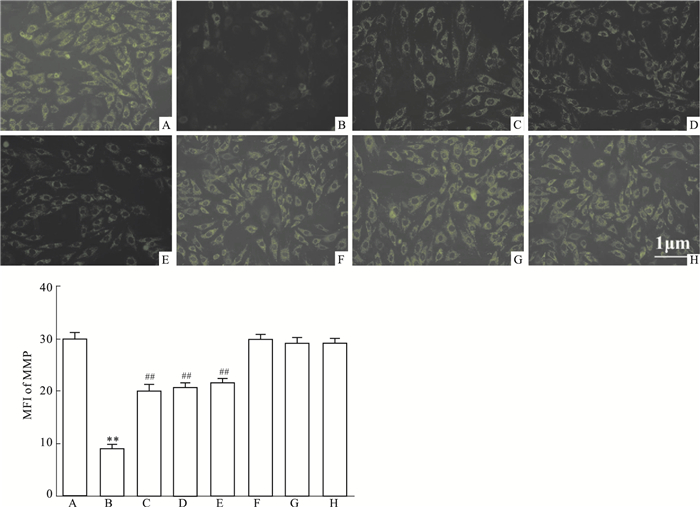
|
| Fig 6 Nic, nhibitors of NF-κB and COX-2 attenuate HG-induced dissipation of mitochondrial membrane potential (MMP) in H9c2 cardiac cells (n=5) A: Control; B: Glucose 35 mmol·L-1; C: Nic 50 μmol·L-1+Glucose 35 mmol·L-1; D: PDTC 100 μmol·L-1+Glucose 35 mmol·L-1; E: NS-398 10 μmol·L-1 +Glucose 35 mmol·L-1; F: Nic 50 μmol·L-1; G: PDTC 100 μmol·L-1; H: NS-398 10 μmol·L-1. **P < 0.01 vs control group; ##P < 0.01 vs the HG-treated group. |
如Fig 7所示,HG处理心肌细胞24 h可使炎症因子IL-1β(Fig 7A)和TNF-α(Fig 7B)的分泌水平明显升高,与Control组比较,差异具有统计学意义(P < 0.01)。在HG作用前,采用50 μmol·L-1 Nic预处理心肌细胞60 min可使IL-1β和TNF-α的分泌水平明显降低,与HG组比较,差异均具有统计学意义(P < 0.01)。与Nic的作用相类似,100 μmol·L-1 PDTC或10 μmol·L-1 NS-398和HG共处理心肌细胞24 h也能使IL-1β和TNF-α的分泌水平降低,分别与HG组比较,差异均具有统计学意义(P < 0.01)。50 μmol·L-1 Nic、100 μmol·L-1 PDTC或10 μmol·L-1 NS-398本身不影响炎症因子的基础分泌水平。
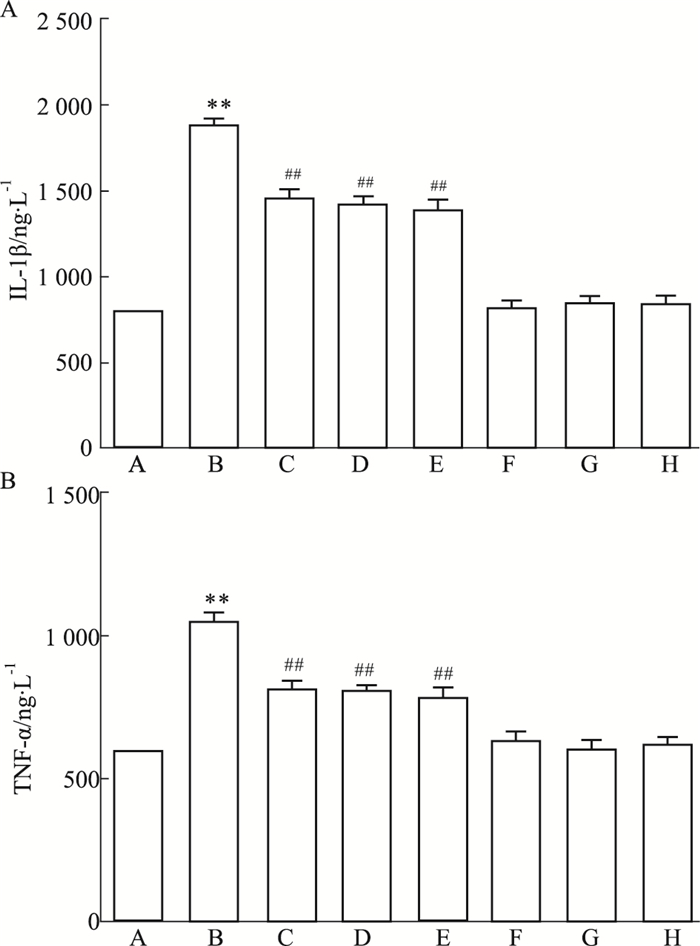
|
| Fig 7 Nic, inhibitors of NF-κB and COX-2 attenuate HG-induced secretion of inflammatory cytokines in H9c2 cardiac cells (n=5) A: Control; B: Glucose 35 mmol·L-1; C: Nic 50 μmol·L-1+Glucose 35 mmol·L-1; D: PDTC 100 μmol·L-1+Glucose 35 mmol·L-1; E: NS-398 10 μmol·L-1 +Glucose 35 mmol·L-1; F: Nic 50 μmol·L-1; G: PDTC 100 μmol·L-1; H: NS-398 10 μmol·L-1. **P < 0.01 vs control group; ##P < 0.01 vs the HG-treated group. |
Nic不仅是一种临床上广泛应用的抗心绞痛药物,更因为其能通过开放KATP通道从而保护心脏对抗缺血引起的损伤[6, 15-16]而得到了国内外学者的重视。最近Nic因其能对抗糖尿病相关的心血管并发症[9-11]引起了广泛的关注。我们研究证实,开放KATP通道能保护H9c2心肌细胞对抗高糖引起的损伤[12-13],因此我们推测Nic也可能有对抗HG损伤心肌细胞的作用。为此我们观察了Nic对HG诱导心肌细胞损伤和炎症的影响。结果显示,20~100 μmol·L-1 Nic预处理心肌细胞均可对抗HG诱导的心肌细胞毒性,升高心肌细胞存活率,其中浓度在50 μmol·L-1时Nic对抗HG致细胞毒性作用最明显。此外Nic能减轻HG诱导的多种损伤,使LDH活性降低,ROS生成、凋亡细胞数量、cleaved caspase-3表达、MMP丢失及炎症因子(IL-1β和TNF-α)的分泌均减少。上述结果清晰地提示:Nic能保护H9c2心肌细胞对抗HG引起的损伤和炎症,这为临床上应用Nic防治糖尿病心血管并发症的发生发展提供了实验依据并扩宽了思路,具有重要的理论和临床意义。
重要的是,我们进一步探讨了Nic保护心肌细胞对抗HG引起的损伤和炎症的作用机制。炎症反应是高血糖引起心肌损伤的重要的病理生理机制之一。在炎症反应发生过程中,NF-κB和COX-2等信号分子发挥重要的作用。NF-κB是炎症级联反应的重要始动因素,能够调节多种参与炎症反应的细胞因子和炎症介质的基因转录,其下游的一个重要信号之一是COX-2[17]。COX-2在生理状态下鲜有表达,在炎症、缺血/缺氧、高血糖等病理状态下则表达明显增多,并诱导炎症反应发生。我们已证实,HG可激活NF-κB和COX-2通路,抑制NF-κB和COX-2的活性可减轻HG引起的心肌细胞损伤[4, 18]。然而,尼可地尔能否通过抑制NF-κB/COX-2通路从而保护心肌细胞对抗HG引起的损伤和炎症目前尚未见报道。Kawamura等[8]指出,Nic可通过抑制冠状动脉搭桥术后患者NF-κB的活动,从而减少炎症细胞因子的分泌、减轻心肌再灌注损伤,因此我们推测Nic可能对NF-κB及其下游的COX-2通路有调控作用。为此我们首先探讨了Nic对HG上调p-NF-κB p65和COX-2表达的影响。研究结果表明,Nic能抑制HG对心肌细胞p-NF-κB p65和COX-2表达的上调作用;此外,应用PDTC抑制NF-κB和应用NS-398抑制COX-2的活动均能产生类似Nic的心肌保护作用,使LDH活性、ROS生成、凋亡细胞数量、cleaved caspase-3表达、MMP丢失及炎症因子的分泌均减少。上述结果提示,抑制NF-κB/COX-2通路的活动可能是Nic保护心肌细胞对抗HG引起的损伤和炎症的重要机制之一。有趣的是,Tang等[19]报道,在心肌梗死的兔模型中,Nic通过上调COX-2表达产生延迟相心肌保护作用。我们的结果和Tang等[19]的结果不一致,可能与COX-2在不同的疾病模型中发挥不同的作用有关。
综上所述,本研究在HG损伤H9c2心肌细胞的模型中,证实Nic可保护心肌细胞对抗HG诱导的损伤和炎症反应;抑制NF-κB/COX-2通路可能是Nic发挥心肌保护作用的重要机制之一。
( 致谢: 本实验在中山大学中山医学院科技楼开展,全体作者均参与了实验。在此非常感谢实验室各位老师和同学在实验中提供的帮助,尤其感谢冯鉴强教授对本实验设计、文章书写给予的悉心指导! )
| [1] | Pan Y, Wang Y, Zhao Y, et al. Inhibition of JNK phosphorylation by a novel curcumin analog prevents high glucose-induced inflammation and apoptosis in cardiomyocytes and the development of diabetic cardiomyopathy[J]. Diabetes, 2014, 63 (10): 3497-511. doi:10.2337/db13-1577 |
| [2] | Wen H L, Liang Z S, Zhang R, et al. Anti-inflammatory effects of triptolide improve left ventricular function in a rat model of diabetic cardiomyopathy[J]. Cardiovasc Diabetol, 2013, 12 : 50. doi:10.1186/1475-2840-12-50 |
| [3] | grawa N K, Kant S. Targeting inflammation in diabetes:Newer therapeutic options[J]. World J Diabetes, 2014, 5 (5): 697-710. doi:10.4239/wjd.v5.i5.697 |
| [4] | Xu W, Chen J, Lin J, et al. Exogenous H2S protects H9c2 cardiac cells against high glucose-induced injury and inflammation by inhibiting the activation of the NF-κB and IL-1β pathways[J]. Int J Mol Med, 2015, 35 (1): 177-86. |
| [5] | Fang Q, Wang J, Wang L, et al. Attenuation of inflammatory response by a novel chalcone protects kidney and heart from hyperglycemia-induced injuries in type 1 diabetic mice[J]. Toxicol Appl Pharmacol, 2015, 288 (2): 179-91. doi:10.1016/j.taap.2015.07.009 |
| [6] | Sato T, Sasaki N, O′Rourke B, et al. Nicorandil, a potent cardioprotective agent, acts by opening mitochondrial ATP-dependent potassium channels[J]. Am Heart J, 2001, 141 (6): 940-3. doi:10.1067/mhj.2001.114369 |
| [7] | Zhao A P, Dong Y F, Liu W, et al. Nicorandil inhibits inflammasome activation and Toll-like receptor-4 signal transduction to protect against oxygen-glucose deprivation-induced inflammation in BV-2 cells[J]. CNS Neurosci Ther, 2014, 20 (2): 147-53. doi:10.1111/cns.2014.20.issue-2 |
| [8] | Kawamura T, Kadosaki M, Nara N, et al. Nicorandil attenuates NF-kappaB activation, adhesion molecule expression, and cytokine production in patients with coronary artery bypass surgery[J]. Shock, 2005, 24 (2): 103-8. doi:10.1097/01.shk.0000168874.83401.3f |
| [9] | Zhang Y Q, Tian F, Zhou Y, et al. Nicorandil attenuates carotid intimal hyperplasia after balloon catheter injury in diabetic rats[J]. Cardiovasc Diabetol, 2016, 15 (1): 62. doi:10.1186/s12933-016-0377-6 |
| [10] | Liu L, Liu Y, Qi B, et al. Nicorandil attenuates endothelial VCAM-1 expression via thioredoxin production in diabetic rats induced by streptozotocin[J]. Mol Med Rep, 2014, 9 (6): 2227-32. |
| [11] | Shehata M. Cardioprotective effects of oral nicorandil use in diabetic patients undergoing elective percutaneous coronary intervention[J]. J Interv Cardiol, 2014, 27 (5): 472-81. doi:10.1111/joic.v27.5 |
| [12] | Liang W, Chen J, Mo L, et al. ATP-sensitive K+ channels contribute to the protective effects of exogenous hydrogen sulfide against high glucose-induced injury in H9c2 cardiac cells[J]. Int J Mol Med, 2016, 37 (3): 763-72. |
| [13] | 梁伟杰, 陈景福, 何洁仪, 等. ATP敏感性钾通道-Akt通路在硫化氢对抗高糖损伤H9c2心肌细胞中的作用[J]. 中国药理学通报, 2016, 32 (4) : 530-6. Liang W J, Chen J F, He J Y, et al. Role of ATP-sensitive potassium channels-Akt pathway in the inhibitory effect of hydrogen sulfide on the high glucose-induced injury in H9c2 cardiac cells[J]. Chin Pharmacol Bull, 2016, 32 (4): 530-6. |
| [14] | Xu W, Wu W, Chen J, et al. Exogenous hydrogen sulfide protects H9c2 cardiac cells against high glucose-induced injury by inhibiting the activities of the p38 MAPK and ERK1/2 pathways[J]. Int J Mol Med, 2013, 32 (4): 917-25. |
| [15] | Li W, Wu N, Shu W, et al. Pharmacological preconditioning and postconditioning with nicorandil attenuates ischemia/reperfusion-induced myocardial necrosis and apoptosis in hypercholesterolemic rats[J]. Exp Ther Med, 2015, 10 (6): 2197-205. |
| [16] | Matsushita N, Hirose M. Roles of ATP-sensitive K+ channels in the prevention of ischemia-induced cardiac tachyarrhythmia[J]. Nihon Yakurigaku Zasshi, 2015, 146 (1): 5-9. doi:10.1254/fpj.146.5 |
| [17] | 丁伟斌, 梁统, 周克元, 等. 原花青素二聚体B2对大鼠滑膜细胞NF-κB核转运及炎症因子表达的影响[J]. 中国药理学通报, 2012, 28 (6) : 803-6. Ding W B, Liang T, Zhou K Y, et al. Effect of procyanidin dimer B2 on NF-κB nucleus transfer and expression of inflammatory cytokines in rat synovial cells[J]. Chin Pharmacol Bull, 2012, 28 (6): 803-6. |
| [18] | 谭其平, 陈景福, 梁鉴文, 等. 血管紧张素-(1-7)通过抑制活性氧激活的环氧合酶-2通路保护心肌细胞对抗高糖引起的损伤[J]. 解剖学研究, 2015, 37 (3) : 161-6. Tan Q P, Chen J F, Liang J W, et al. Angiotensin-(1-7) protects cardiomyocytes against the high glucose-induced injury by inhibiting ROS-activated COX-2 pathway[J]. Anat Res, 2015, 37 (3): 161-6. |
| [19] | Tang X L, Xuan Y T, Zhu Y, et al. Nicorandil induces late preconditioning against myocardial infarction in conscious rabbits[J]. Am J Physiol Heart Circ Physiol, 2004, 286 (4): H1273-80. |