


肿瘤干细胞(cancer stem cells,CSCs) 是构成肿瘤实体的异质细胞群中含有的一些拥有自我更新能力以及分化能力的细胞群体[1]。目前,临床主要通过肿瘤细胞减少的数量以及肿瘤体积缩小的程度来评价手术或者化疗和化疗对肿瘤的治疗作用[2]。但是根据肿瘤干细胞理论,目前这种评价方法不能代表脑肿瘤能否完全清除。采用临床手段治疗后,如果肿瘤干细胞继续增殖,脑肿瘤有继续复发的可能。所以,如果能完全清除肿瘤组织中的肿瘤干细胞,脑肿瘤就有被根治的可能。因此,本实验拟采用C6胶质瘤干细胞建立小鼠胶质瘤模型,考察肿瘤干细胞在脑胶质瘤形成过程中的生长情况与病理学特征,为后续研究脑肿瘤模型建立基础。
1 材料与方法 1.1 材料C6胶质瘤细胞购自中国科学院上海细胞库;ICR(imprinting control region)♂小鼠,购自新疆医科大学;基本成纤维细胞生长因子(bFGF)与表皮生长因子(EGF)(中科迈晨科技有限公司); DMEM/F12(美国Gibco公司);Nestin巢蛋白抗体(美国R&D公司);胎牛血清(杭州四季青公司);0.25% 胰酶(美国Gibco公司); FACScan流式细胞仪(美国BD公司);山羊抗兔抗体(中杉金桥生物科技有限公司);B27因子(美国Gibco公司);CD133抗体(武汉三鹰生物技术有限公司)。
1.2 方法 1.2.1 C6胶质瘤干细胞的培养将C6细胞系接种于10%胎牛血清的培养基中,在CO2饱和湿度培养箱中培养48 h后,用PBS清洗,0.25%胰酶消化,吹打成单细胞悬液,重悬于由DMEM/F12、10 μg·L-1bFGF、20 μg·L-1 EGF、体积分数为0.02的B27因子组成的无血清培养基中,待脑肿瘤干细胞增殖形成肿瘤干细胞球。
1.2.2 C6胶质瘤干细胞的鉴定收集C6胶质瘤干细胞球,采用胰酶消化,PBS 清洗细胞,4%的多聚甲醛固定10 min。体积分数为0.001的皂苷破膜,与Nestin巢蛋白抗体以及其同型对照一起避光孵化30 min,洗涤3次后用PBS重悬,使用FACScan流式细胞仪分析。
1.2.3 小鼠肿瘤模型的建立取肿瘤干细胞球,用PBS重悬吹打至肿瘤球分散均匀,用计数板调整干细胞浓度为5×1010·L-1,将分散均匀的干细胞置于37℃水浴锅中备用。取体质量在18~20 g的ICR ♂小鼠,用体积分数为0.2的氨基甲酸乙酯1 g·kg-1麻醉,将小鼠固定于脑立体定位仪上。头顶备毛,分离暴露颅骨。根据小鼠头部解剖图谱确定冠状缝前0.4 mm,矢状缝向右2 mm,牙科钻钻孔。用微量注射器抽吸3 μL含有5×1010·L-1干细胞混悬液,沿骨孔缓慢垂直进针至硬脑膜下3.0 mm,固定。缓慢注射1μL干细胞混悬液(1 min),留针1 min,缓慢拔针,骨蜡封闭骨窗。肌注青霉素,常规单笼饲养。
1.2.4 肿瘤模型的评价① 观察小鼠术后的生存状态;② 测量肿瘤体积变化:小鼠接种肿瘤干细胞后,分别将接种成功后的d 7、14、21的小鼠,用10%的多聚甲醛固定肿瘤标本,沿小鼠脑表面接种点做冠状切口,测量肿瘤体积的大小,肿瘤体积=a2bπ/6(a为肿瘤的短径,b为肿瘤的长径);③ 组织学检查:取脑胶质瘤标本经过石蜡包埋切片后,分别进行HE染色及CD133免疫组化染色。
1.2.5 统计学方法本实验数据以x±s表示,采用SPSS 17.0统计软件ANOVA进行方差分析。
2 结果 2.1 C6干细胞的鉴定C6细胞接种于无血清干细胞培养基,培养14 d后,可形成干细胞肿瘤球体,且肿瘤球折光性强,干细胞肿瘤球生长过程较为缓慢,6~7 d可以进行传代培养。通过FACScan流式细胞仪分析,由Fig 1可知,与同型对照相比,C6胶质瘤干细胞中Nestin表达量占96%。从结果中可以看出Nestin在所培养的C6胶质瘤干细胞球中高表达,说明上述培养条件适合干细胞的生长和增殖。
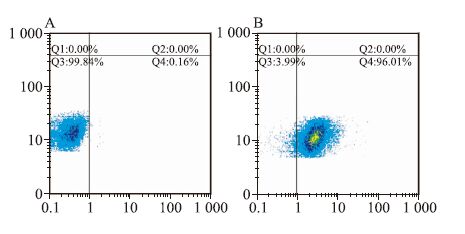
|
| Fig 1 Identification of glioma stem cells(GSCs) A: GSCs treated as isotype controls; B: GSCs stained with anti-mouse/rat nestin-phycoerythrin antibodies. |
接种C6胶质瘤干细胞1周后,发现小鼠食欲不振,体质量偏轻,一些小鼠有不自觉的逆时针转圈习惯,体格较弱,喜缩成一团,且行为缓慢,反应呆滞,眼睛半眯,无神,卷缩近不动,且体温低于正常组小鼠。接种干细胞后,小鼠的中位生存期为19 d,最长生存时间为26 d。
2.3 肿瘤体积变化接种干细胞d 7、14、21时,测定肿瘤的体积分别为(0.51±8.67) mm3、(4.88±5.90) mm3、(9.77±6.58) mm3。由结果可知,肿瘤体积随着天数的增加逐渐增大。当建模d 21时,肿瘤体积与建模d 7和d 14相比差异有显著性(P<0.05)。
2.4 组织学检查由Fig 2可知,肿瘤组织边缘无明显边界,呈浸润性生长状态,肿瘤细胞核皱缩,排列紊乱。在肿瘤组织中,有大面积的坏死和出血区域,并分布有丰富的微血管。由Fig 3可知,免疫组化CD133染色显示肿瘤细胞有棕色阳性显色,且为胞质着色,说明肿瘤组织中存在有大量的脑胶质瘤干细胞。
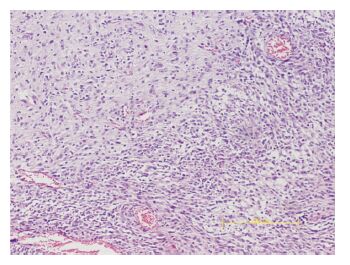
|
| Fig 2 HE staining of tumor tissue(×100) |
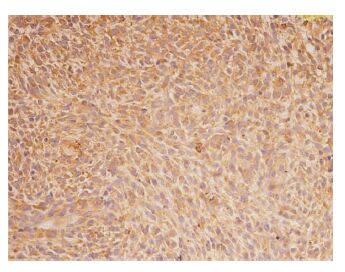
|
| Fig 3 Tumor immunohistochemical staining CD133 positive(×200) |
脑胶质瘤是人类死亡率最高的肿瘤之一,其具有浸润性生长的特点,且脑肿瘤边缘无明显边界。尽管接受手术、放疗、化疗等手段,胶质母细胞瘤患者的预后仍然很差,而且神经胶质瘤对放疗和化疗药物的敏感性较差。由于脑肿瘤干细胞的存在,脑肿瘤的复发率也较高,因此脑肿瘤的预后也不理想[3-4]。因此,本实验建立了将脑肿瘤干细胞接种到小鼠脑内的胶质瘤模型,为后续胶质瘤实验的研究奠定基础。
ICR小鼠[5]是Hauschka用Swiss小鼠群以多产为目标,进行选育的小鼠。ICR小鼠具有较强的适应性,且生长速度较快,具有较好的实验重复性。ICR小鼠是进行免疫药物筛选,复制病理模型较常用的实验动物,已广泛用于药理、毒理、肿瘤等的研究[6-7]。因此,本研究中选用ICR小鼠造模,相比较于使用大鼠造模,模型成功率高,且便于操作。将C6干细胞接种到小鼠组织中,相比较用C6细胞构建肿瘤模型,C6干细胞较C6细胞具有更强的浸润性以及促进肿瘤细胞生长的能力,可以更好地研究肿瘤干细胞在肿瘤生长过程中的生物学特性,为后续肿瘤复发的研究提供依据。
如何从肿瘤细胞中分离纯化肿瘤干细胞,也是目前的主要研究内容之一。针对脑肿瘤干细胞的分离及纯化主要有以下几种方法,即CD133免疫磁珠法、悬浮生长法、SP细胞鉴定法[8]。CD133免疫磁珠法或者SP细胞操作方法复杂,成本较高,且在获得过程中细胞数量的损耗较多,只能较少地反映干细胞的特性,而悬浮生长法可以在短时期内获得较多以及符合建模要求的干细胞,因此本研究中选用悬浮生长法来培养单克隆C6胶质瘤干细胞球。在本实验中,采用流式细胞仪用Nestin巢蛋白抗体对C6干细胞进行了鉴别。由鉴别结果可知,C6干细胞的表达量较多,达到了实验的要求。
在造模过程中,分离暴露颅骨以后,应注意保持伤口的润湿性,防止伤口干燥,影响小鼠后期的恢复。在注射C6干细胞的过程中,缓慢注射1 μL,留针1 min,防止干细胞在迅速拔针的过程中遗失,使细胞可以在靶部位充分沉积,延长肿瘤干细胞与靶点脑组织的接触时间,从而提高成瘤率[3]。
CD133是人类造血干细胞上的一种跨膜糖蛋白。近年来研究发现,CD133在白血病细胞、脑胶质瘤、结肠癌、前列腺癌、肝癌和胰腺癌中均有表达[9-11],表明呈CD133阳性的肿瘤细胞具有很强的增殖、分化以及自我更新的能力,是研究肿瘤干细胞表面标记物的重要指标之一。在本研究中,免疫组化选用CD133作为一抗(1 ∶50),山羊抗兔作为二抗,结合HE染色可知,肿瘤组织边缘呈浸润性生长,且肿瘤组织中有大面积的坏死和出血区域,CD133在细胞质中大量表达。说明采用此方法建立的肿瘤模型成功。
综上所述,本研究中使用C6悬浮生长法提取了C6干细胞,利用C6胶质瘤干细胞建造了小鼠肿瘤模型,此方法成瘤周期短且具有较高的成瘤性。通过建立肿瘤干细胞脑胶质瘤模型,将对研究脑肿瘤产生的原因、肿瘤干细胞在成瘤过程中的作用机制、脑胶质瘤的发病原因和预防产生较大的影响。同时,本研究可为胶质瘤干细胞在胶质瘤中的分子机制以及作用机制研究提供理想的模型。
| [1] | Bensalma S, Chadeneau C, Legigan T, et al. Evaluation of cytotoxic properties of a cyclopamine glucuronide prodrug in rat glioblastoma cells and tumors[J]. J Mol Neurosci, 2015, 55 (1): 51-61. doi:10.1007/s12031-014-0395-3 |
| [2] | Ceresa C, Nicolini G, Semperboni S, et al. Synchrotron-based photon activation therapy effect on cisplatin pre-treated human glioma stem cells[J]. Anticancer Res, 2014, 34 (10): 5351-5. |
| [3] | Doblas S, Saunders D, Kshirsagar P, et al. Phenyl- tert -butylnitrone induces tumor regression and decreases angiogenesis in a C6 rat glioma model[J]. Free Radic Biol Med, 2008, 44 (1): 63-72. doi:10.1016/j.freeradbiomed.2007.09.006 |
| [4] | Zhang C G, Huang J C, Liu T, Li X Y. Anticancer effects of bishydroxycoumarin are mediated through apoptosis induction, cell migration inhibition and cell cycle arrest in human glioma cells[J]. J BUON, 2015, 20 (6): 1592-600. |
| [5] | Kim J, Ekram M B, Kim H, et al. Imprinting control region(ICR) of the Peg3 domain[J]. Hum Mol Genet, 2012, 21 (12): 2677-87. doi:10.1093/hmg/dds092 |
| [6] | Kim J. Multiple YY1 and CTCF binding sites in imprinting control regions[J]. Epigenetics, 2008, 3 (3): 115-8. doi:10.4161/epi.3.3.6176 |
| [7] | Li X Y, Zhao Y, Sun M G, et al. Multifunctional liposomes loaded with paclitaxel and artemether for treatment of invasive brain glioma[J]. Biomaterials, 2014, 35 (21): 5591-604. doi:10.1016/j.biomaterials.2014.03.049 |
| [8] | Li X T, Ju R J, Li X Y, et al. Multifunctional targeting daunorubicin plus quinacrine liposomes, modified by wheat germ agglutinin and tamoxifen, for treating brain glioma and glioma stem cells[J]. Oncotarget, 2014, 5 (15): 6497-511. doi:10.18632/oncotarget |
| [9] | 宣自学, 张琦, 李琳娜, 等. 干细胞样U87胶质瘤细胞向内皮细胞转分化及VEGFR2人源化单克隆抗体的干预作用[J]. 中国药理学通报, 2015, 31 (3) : 339-45. Xuan Z X, Zhang Q, Li L N, et al. Stem cell-like U87 cells trans-differentiating into endothelial cells and inhibition of anti-VEGFR2 human monoclonal antibody[J]. Chin Pharmacol Bull, 2015, 31 (3): 339-45. |
| [10] | Srinivasan T, Walters J, Bu P, et al. NOTCH signaling regulates asymmetric cell fate of fast- and slow-cycling colon cancer initiating cells[J]. Cancer Res, 2016, 76 (11): 3411-21. doi:10.1158/0008-5472.CAN-15-3198 |
| [11] | 刘静, 笪祖科, 李振, 等. 紫草素对脑胶质瘤干细胞干性维持的相关研究[J]. 中国药理学通报, 2016, 32 (1) : 49-54. Liu J, Da Z K, Li Z, et al. Effects of shikonin on stemness maintance of glioma stem cells[J]. Chin Pharmacol Bull, 2016, 32 (1): 49-54. |

