


糖尿病已成为一种具有严重危害的流行病,它是心血管疾病的危险因素之一。无论在发达国家或是发展中国家,糖尿病都是导致人口死亡率增加的原因之一[1]。糖尿病最主要危害在于其并发症,其中糖尿病血管并发症包括主动脉、冠状动脉等病变,这类是以动脉粥样硬化为主要特征的大血管病变,还有一类是视网膜病变、肾脏病变等微血管病变。血管内皮细胞是人体各种主要器官的保护屏障,糖尿病情况下,内皮细胞损伤会导致一些特定的细胞因子生产过剩,从而引起炎症样症状[2]。前期的基因芯片结果显示慢性高糖会导致人脐静脉血管内皮细胞(HUVEC)趋化因子CX3CL1 (fractalkine)明显升高[3]。CX3CL1是趋化因子CX3C家族唯一的成员,具有趋化作用和黏附分子的性质。大血管内皮细胞CX3CL1上调会导致白细胞附着力的增加。CX3CL1在血管炎性病症如动脉损伤、动脉粥样硬化和新内膜形成的发病机制中具有重要作用[4]。Fractalkine还可以激活血管活性氧簇,使NO生物利用度降低而诱导血管功能异常,这表明CX3CL1可能与血管功能异常或心血管疾病有关[5]。了解引起内皮炎症的分子机制,将有助于防止糖尿病患者血管内皮细胞损而最终导致的器官损伤。柚皮苷(naringin,Nar)是从柚子和相关柑桔类提取出来的黄酮苷,具有抗氧化、清除自由基以及抗细胞凋亡的活性,对2型糖尿病有抗炎、降血糖的作用[6-7]。在1型糖尿病大鼠模型中,柚皮苷通过其抗氧化作用调节p38和PKC-β蛋白的表达,使心肌纤维化得以改善,这对于延缓糖尿病心肌纤维化的进展来说是有益的[8]。本文主要研究柚皮苷对血管内皮损伤的保护作用是否与其降低CX3CL1的表达和抗氧化作用有关。
1 材料与方法 1.1 试剂与药品HUVEC购自ATCC公司(美国);RPMI 1640培养基(货号SH30809,含有11.1 mmol·L-1葡萄糖) 和胎牛血清购自Hyclone公司(南非);柚皮苷(标准品) 购自中国食品药品检定研究院;CX3CL1抗体购自Abcam公司 (货号ab25088);CellTiter 96©AQueous One Solution Cell Proliferation Assay (MTS) 购自Promega 公司(美国);ROS检测试剂盒购自江苏碧云天生物技术研究所;NO试剂盒购自南京建成生物工程研究所;β-actin抗体(sc-47778) 购自Santa Cruz公司;羊抗兔IgG-HRP购自北京华美生物工程公司;引物由Invitrogen公司合成;用于RNA提取的TRIzol Reagent购自CW BIO公司;RevertAid First Strand cDNA逆转录试剂盒购自Thermo公司;购自SinoBio公司的2×Taq Master Mix(E005)。
1.2 HUVEC的培养HUVEC培养于含有10%胎牛血清和2%双抗的RPMI 1640培养基,待培养瓶中细胞生长至80%~90%左右时,弃去培养基,用无菌的PBS清洗3次,加入胰蛋白酶消化1~2 min,显微镜下观察,等细胞之间的连接不再紧密,加入2~3 mL完全培养基终止消化,转移到15 mL离心管,1 500 r·min-1离心5 min,弃去上清,加入1 mL培养基吹打,根据需求按不同比例进行传代,所用细胞控制在30代以内。
1.3 MTS法确定高糖、柚皮苷浓度HUVEC按每孔5 000个细胞接种96孔培养板内,柚皮苷浓度设置为0、12.5、25、50、100、200 μmol·L-1共6组,每组各做3个复孔。培养基中含有11.1 mmol·L-1的葡萄糖,以此为对照组,高糖浓度设置为22.2、33.3、44.4 mmol·L-1,共4组,每组各做3个复孔。5% CO2、37℃条件下培养12 h后,按分组加入不同浓度的柚皮苷或葡萄糖,培养5 d后换成无血清培养液,每孔加入10%的MTS,培养2~4 h后,将培养板置于多功能酶标仪内,测定490 nm波长处的吸光度(OD) 值,实验重复3次。
1.4 NO的测定每组细胞各设3组复孔,使用24孔板,种板12 h后,加入葡萄糖或柚皮苷处理5 d,用硝酸还原酶法测定细胞上清液中NO的含量,具体操作过程严格按照NO试剂盒检测说明书进行。
1.5 细胞内ROS的测定细胞接种于24孔板,每组设置3个复孔,种板12 h后加入葡萄糖或柚皮苷,试剂盒中荧光探针DCFH-DA用无血清培养液按1 ∶1 000的比例释稀为10 μmol·L-1,培养5 d后,换成1 mL已稀释的DCFH-DA培养液培养20 min,每隔3~5 min振荡1次,用无血清培养液洗去未进入细胞的荧光探针,洗涤重复3次,加入200 μL胰酶消化细胞,终止消化后,吹打成细胞悬液,使用多功能酶标仪在激发波长485 nm,发射波长535 nm条件下测定各组细胞荧光强度。
1.6 RT-PCR检测细胞内CX3CL1 mRNA的表达各组细胞处理5 d后,采用TRIzol RNA提取法提取各组细胞总RNA,再按逆转录试剂盒说明书将RNA逆转录为cDNA,以β-actin作为内参对cDNA进行PCR扩增,琼脂糖凝胶电泳跑胶,Bio-Rad琼脂糖凝胶成像系统拍照,Image-Pro Plus 6.0软件分析光密度值。引物序列如下:β-actin (400 bp):上游:5′- TTTTTTGGCTTGACTCAGGAT-3′,下游:5′-GGGAGACCAAAAGCCTTCAT-3′;CX3CL1 (119 bp):上游: 5′-CCTTGGTTAGGCATTGTGGG-3′,下游:5′-TTGGTGGCTTGATGGTGGAA-3′。
1.7 Western blot检测CX3CL1蛋白的表达各组细胞于6孔板培养5 d后,去除细胞培养液,PBS洗3次,10 mmol·L-1的PMSF加入到RIPA细胞裂解液提取细胞总蛋白,进行SDS-PAGE电泳,转膜、封闭后加入一抗 (兔多克隆抗体) CX3CL1(1 ∶800) 室温孵育2 h,TBST洗3次,每次10 min,羊抗兔IgG-HRP二抗反应液(1 ∶2 000) 室温孵育1 h,TBST洗3次,每次10 min,放入成像系统(Bio-Rad),加入化学发光试剂曝光显影。IPP软件分析光密度值。
1.8 统计学方法统计软件采用SPSS 21,实验结果以x±s表示,各组数据间的统计采用方差分析,组间比较采用LSD法。
2 结果 2.1 细胞活力确定柚皮苷和葡萄糖浓度用不同浓度的柚皮苷处理HUVEC 5 d后,MTS作用2 h检测细胞活力,结果显示柚皮苷浓度在0~50 μmol·L-1之间时对细胞活力并无明显影响;但柚皮苷浓度在100~200 μmol·L-1时明显减弱了细胞活力(P<0.01),故选取柚皮苷浓度为50 μmol·L-1用于后续研究 (Fig 1)。HUVEC用不同浓度的葡萄糖处理5 d,结果显示,22.2 mmol·L-1葡萄糖与对照组(11.1 mmol·L-1)相比,差异无统计学意义(P>0.05)。之后,随着糖浓度增加对细胞活力的影响越来越大,故选择44.4 mmol·L-1用于后续研究 (Fig 2)。
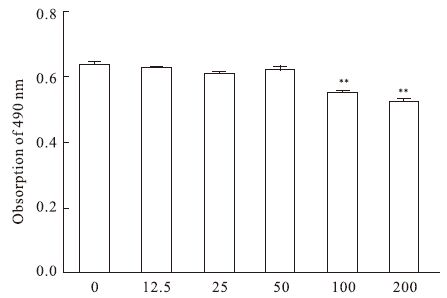
|
| Fig 1 Effect of different concentrations of naringin on cell viability in HUVEC **P<0.01 vs control group (0 μmol·L-1 naringin) |
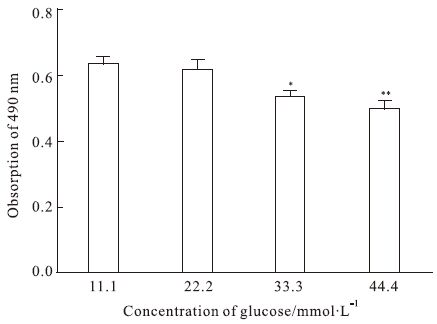
|
| Fig 2 Effect of high glucose on cell viability in HUVEC *P<0.05,**P<0.01 vs control group (11.1 mmol·L-1 glucose) |
细胞处理5 d后,硝酸还原酶法检测细胞培养液中NO浓度,结果显示高糖组细胞培养液中NO含量较对照组明显减少(P<0.01);与高糖组相比,高糖加柚皮苷组随着柚皮苷浓度增加,NO含量逐渐增加,高糖加50 μmol·L-1柚皮苷组与高糖组比较,NO含量增加更明显(P<0.01);不同浓度柚皮苷组与对照组相比无明显差异(P>0.05,Fig 3)。
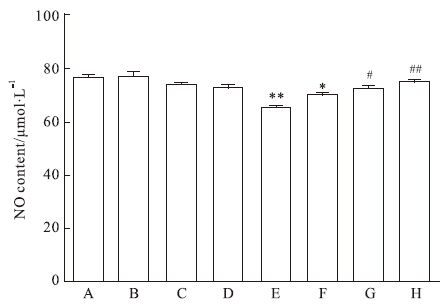
|
| Fig 3 Effect of naringin on nitric oxide (NO) content in high glucose-injured HUVEC A: Control; B: Nar 12.5 μmol·L-1; C: Nar 25 μmol·L-1; D: Nar 50 μmol·L-1; E: HG; F: HG+Nar 12.5 μmol·L-1; G: HG+Nar 25 μmol·L-1; H: HG+Nar 50 μmol·L-1. *P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs HG group |
DCFH-DA探针本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成DCFH。而DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF,检测DCF的荧光就可以知道细胞内活性氧的水平。结果显示高糖组细胞内ROS含量较对照组明显增加(P<0.01);与高糖组相比,高糖加柚皮苷组随着柚皮苷浓度增加,细胞内ROS含量逐渐降低,高糖加50 μmol·L-1柚皮苷组ROS含量减少最明显(P<0.01);不同浓度柚皮苷组与对照组之间差异无统计学意义(P>0.05,Fig 4)。
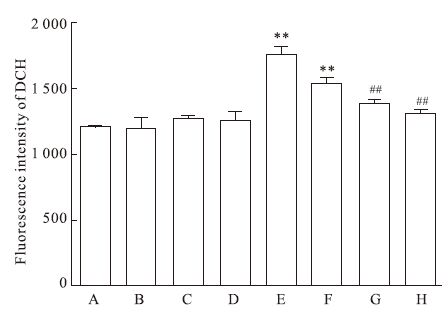
|
| Fig 4 Effect of naringin on intercellular ROS in high glucose-injured HUVEC A: Control; B: Nar 12.5 μmol·L-1; C: Nar 25 μmol·L-1; D: Nar 50 μmol·L-1; E: HG; F: HG+Nar 12.5 μmol·L-1; G: HG+Nar 25 μmol·L-1; H: HG+Nar 50 μmol·L-1. **P<0.01 vs control group;##P<0.01 vs HG group |
RT-PCR结果显示,高糖组HUVEC中CX3CL1 mRNA的表达量较对照组明显增加(P<0.01),高糖加不同浓度柚皮苷处理后CX3CL1 mRNA的表达量随柚皮苷浓度的增加而降低 (P<0.01);对照组HUVEC中CX3CL1 mRNA的表达量与不同浓度柚皮苷组之间无明显变化(P>0.05,Fig 5)。
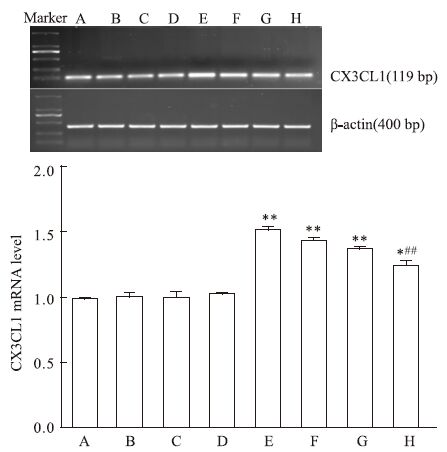
|
| Fig 5 Effect of naringin on expression of CX3CL1 mRNA in high glucose-injured HUVEC A: Control; B: Nar 12.5 μmol·L-1; C: Nar 25 μmol·L-1; D: Nar 50 μmol·L-1; E: HG; F: HG+Nar 12.5 μmol·L-1; G: HG+Nar 25 μmol·L-1; H: HG+Nar 50 μmol·L-1. *P<0.05,**P<0.01 vs control group;##P<0.01 vs HG group. |
CX3CL1蛋白印迹结果经各组相应β-actin标化后显示,高糖组的CX3CL1蛋白表达量较对照组明显增加(P<0.01),高糖加柚皮苷组CX3CL1蛋白表达量较高糖组明显下调(P<0.01),对照组与柚皮苷组、高糖加柚皮苷组之间差异无显著性(P>0.05,Fig 6)。
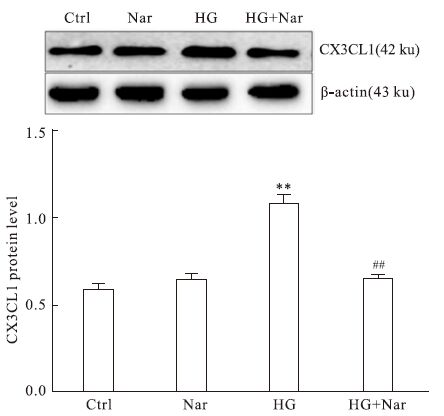
|
| Fig 6 Effect of naringin on expression of CX3CL1 protein in high glucose-injured HUVEC **P<0.01 vs control group;##P<0.01 vs HG group |
糖尿病引起的心血管病变累及身体各脏器,并导致各种并发症。血管内皮细胞损伤是糖尿病微血管和大血管病变的初始原因。因此,保护内皮细胞防止高血糖损伤可作为糖尿病血管并发症的治疗靶点[9]。慢性高血糖症是血管内皮的激活源,正常情况下,血管内皮细胞具有合成并释放血管活性物质的功能,长期高浓度葡萄糖会导致血管内皮细胞的损伤,导致血管内皮功能障碍,引起血管扩张因子和血管收缩因子释放的不平衡。一氧化氮(NO)是血管内皮细胞释放的最主要、最有效的内皮源性舒张因子。除此之外,NO还可以抑制内皮细胞凋亡,刺激内皮细胞的增殖[10]。正常条件下,内皮细胞的损伤与修复过程达到平衡。而高糖条件下,内皮细胞合成和释放NO减少,导致血管收缩,血流速度减慢,易导致血栓形成并增加白细胞黏附。此外,糖尿病高血糖症,影响内皮细胞多种代谢途径,诱导内皮细胞死亡和抑制内皮细胞迁移和增殖,从而破坏内皮细胞损伤和修复之间的平衡,进而促进动脉粥样硬化病变[11]。实验结果表明高糖明显减少细胞上清液中NO的含量,同时抑制内皮细胞的增殖,说明高糖已造成血管内皮细胞损伤。
柚皮苷是从芸香科植物柚果实中提取的一种双氢黄酮类化合物。柚皮苷具有抗炎、抗病毒、抗癌、抗突变、抗过敏、抗溃疡、镇痛、降血压活性,能降低血胆固醇,减少血栓的形成,改善局部微循环和营养供给,抗凋亡和心血管保护作用[12]。柚皮苷能够利用抗氧化成分清除活性氧,防止ROS积累和氧化损伤,发挥抗炎、抗动脉粥样硬化的作用。在促进内皮细胞迁移或增强内皮祖细胞再生能力、内皮组织修复、内皮功能恢复、减少心血管疾病风险上具有重要的作用[13]。实验观察到柚皮苷能明显逆转高糖诱导的脐静脉内皮细胞NO产生的减少,同时降低高糖时升高的ROS,表明柚皮苷可能通过影响NO和ROS的产生发挥保护血管的作用。
糖尿病是一种慢性低度炎症反应,趋化因子与糖尿病并发症关系密切[14]。CX3CL1是一种以与膜结合形式或可溶性形式存在的趋化因子,具有跨膜结构域和趋化因子结构域的膜结合趋化因子。在炎症、血管疾病条件下CX3CL1的表达增加。CX3CL1在人动脉粥样硬化的冠状动脉内皮细胞表达上调[15],并促进粥样硬化的发展[4]。本实验结果显示,高糖组HUVEC细胞内CX3CL1 mRNA与蛋白水平均上调,表明高浓度的葡萄糖可增加内皮细胞CX3CL1的表达。
氧化应激主要由氧自由基介导,许多刺激因素,如高血糖,可通过激活内皮细胞NADPH氧化酶的活性,增加细胞内活性氧(ROS)的产生[16]。产生的ROS可通过抑制磷酸化酪氨酸磷酸酶 (PTPS) 的活性,从而启动下游氧化还原反应,调控内皮细胞活力、迁移、凋亡和血管生成过程。ROS能够增加胞质内钙离子浓度,减少NO的生成,使血管舒张作用减弱。而钙离子内流消耗ATP,使ATP减少。NO和ATP共同减少导致血管内皮进一步受损[17]。在2型糖尿病(T2DM)和代谢综合症中,氧化应激增加,氧化应激是导致胰岛素抵抗、血脂异常、β细胞功能障碍、糖耐量受损,并最终导致2型糖尿病的有害因素。慢性氧化应激、高血糖、高血脂异常对抗氧化能力最低同时又具有高氧化能量需求的β细胞是极度危险的,可通过降低关键基因的表达诱导β细胞死亡[18]。本实验观察在正常和慢性高糖状态下,HUVEC中CX3CL1的mRNA和蛋白表达及柚皮苷对其影响,结果显示慢性高糖可导致HUVEC中CX3CL1的mRNA和蛋白表达明显增加,而柚皮苷可以明显降低慢性高糖诱导的细胞内CX3CL1的mRNA和蛋白的表达。高糖培养可引起HUVEC 细胞培养上清液中NO含量降低,而柚皮苷能明显逆转高糖诱导的细胞上清液中NO浓度降低的情况。高糖组细胞内ROS明显升高,而柚皮苷可以明显地降低高糖组细胞内ROS含量。因此,柚皮苷可能能够通过下调趋化因子CX3CL1的表达、降低细胞内ROS的产生并增加NO的释放,从而改善糖尿病的慢性炎症病症,并在一定程度逆转慢性高糖诱导的血管内皮损伤。
综上所述,柚皮苷对慢性高糖诱导的内皮细胞损伤具有一定的保护作用,且CX3CL1参与到这种保护作用过程中,其保护作用可能与柚皮苷的抗氧化应激及抗炎作用有关。
( 致谢: 感谢实验过程中南昌大学江西医学院神经生理实验室老师和同学的帮助。 )
| [1] | Goralczyk K, Szymanska J, Szot K, et al. Low-level laser irradiation effect on endothelial cells under conditions of hyperglycemia[J]. Lasers Med Sci, 2016, 31 (5): 825-31. doi:10.1007/s10103-016-1880-4 |
| [2] | Tabit C E, Chung W B, Hamburg N M, et al. Endothelial dysfunction in diabetes mellitus: molecular mechanisms and clinical implications[J]. Rev Endocr Metab Disord, 2010, 11 (1): 61-74. doi:10.1007/s11154-010-9134-4 |
| [3] | Li G, Zhu G, Gao Y, et al. Neferine inhibits the upregulation of CCL5 and CCR5 in vascular endothelial cells during chronic high glucose treatment[J]. Inflammation, 2013, 36 (2): 300-8. doi:10.1007/s10753-012-9547-1 |
| [4] | Greene J A, Portillo J A, Lopez Corcino Y, et al. CD40-TRAF signaling upregulates CX3CL1 and TNF-alpha in human aortic endothelial cells but not in retinal endothelial cells[J]. PLoS One, 2015, 10 (12): e0144133. doi:10.1371/journal.pone.0144133 |
| [5] | Schafer A, Schulz C, Fraccarollo D, et al. The CX3C chemokine fractalkine induces vascular dysfunction by generation of superoxide anions[J]. Arterioscler Thromb Vasc Biol, 2007, 27 (1): 55-62. doi:10.1161/01.ATV.0000251535.30191.60 |
| [6] | Mahmoud A M, Ashour M B, Abdel-Moneim A, et al. Hesperidin and naringin attenuate hyperglycemia-mediated oxidative stress and proinflammatory cytokine production in high fat fed/streptozotocin-induced type 2 diabetic rats[J]. J Diabetes Complications, 2012, 26 (6): 483-90. doi:10.1016/j.jdiacomp.2012.06.001 |
| [7] | 吴铿, 游琼, 黄瑞娜, 等. 柚皮苷调控心肌PPARγ表达对实验性2型糖尿病心肌病大鼠模型心肌损伤的防治作用[J]. 中国药理学通报, 2012, 28 (4) : 526-30. Wu J, You Q, Huang R N. Naringin regulates the expression of PPARγ in myocardial preventive myocardial injury on experimental rat model of type 2 diabetes with heart disease[J]. Chin Pharmacol Bull, 2012, 28 (4): 526-30. |
| [8] | Adebiyi O A, Adebiyi O O, Owira P M. Naringin reduces hyperglycemia-induced cardiac fibrosis by relieving oxidative stress[J]. PLoS One, 2016, 11 (3): e0149890. doi:10.1371/journal.pone.0149890 |
| [9] | Ishibashi Y, Matsui T, Matsumoto T, et al. Ranirestat has a stronger inhibitory activity on aldose reductase and suppresses inflammatory reactions in high glucose-exposed endothelial cells[J]. Diab Vasc Dis Res, 2016, 13 (4): 312-5. doi:10.1177/1479164116640220 |
| [10] | Sena C M, Pereira A M, Seica R. Endothelial dysfunction-a major mediator of diabetic vascular disease[J]. Biochim Biophys Acta, 2013, 1832 (12): 2216-31. doi:10.1016/j.bbadis.2013.08.006 |
| [11] | Zaitseva, I I, Berggren P O, Zaitsev S V. Insulinotropic compounds decrease endothelial cell survival[J]. Toxicol In Vitro, 2016, 33 : 1-8. doi:10.1016/j.tiv.2016.02.004 |
| [12] | Raza S S, Khan M M, Ahmad A, et al. Neuroprotective effect of naringenin is mediated through suppression of NF-kappaB signaling pathway in experimental stroke[J]. Neuroscience, 2013, 230 : 157-71. doi:10.1016/j.neuroscience.2012.10.041 |
| [13] | Buachan P, Chularojmontri L, Wattanapitayakul S K. Selected activities of Citrus maxima Merr. fruits on human endothelial cells: enhancing cell migration and delaying cellular aging[J]. Nutrients, 2014, 6 (4): 1618-34. doi:10.3390/nu6041618 |
| [14] | 李桂林, 梁尚栋. 趋化因子5 及其受体CCR5 与糖尿病并发症[J]. 中国药理学通报, 2011, 27 (10) : 1333-7. Li G L, Liang S D. Chemokine 5 and CCR5 and diabetic complications[J]. Chin Pharmacol Bull,, 2011, 27 (10): 1333-7. |
| [15] | Flierl U, Bauersachs J, Schafer A. Modulation of platelet and monocyte function by the chemokine fractalkine (CX3 CL1) in cardiovascular disease[J]. Eur J Clin Invest, 2015, 45 (6): 624-33. doi:10.1111/eci.2015.45.issue-6 |
| [16] | Watanabe H, Miyamoto Y, Enoki Y, et al. p-Cresyl sulfate, a uremic toxin, causes vascular endothelial and smooth muscle cell damages by inducing oxidative stress[J]. Pharmacol Res Perspect, 2015, 3 (1): e00092. doi:10.1002/prp2.92 |
| [17] | Tseng C Y, Wang J S, Chao M W. Causation by Diesel exhaust particles of endothelial dysfunctions in cytotoxicity, pro-inflammation, permeability, and apoptosis induced by ROS generation[J]. Cardiovasc Toxicol, 2016 . |
| [18] | Tangvarasittichai S. Oxidative stress, insulin resistance, dyslipidemia and type 2 diabetes mellitus[J]. World J Diabetes, 2015, 6 (3): 456-80. doi:10.4239/wjd.v6.i3.456 |

