


2. 针灸推拿学院,湖南 长沙 410208
2. College of Acupuncture & Moxibustion and Tui-na, Hunan University of Chinese Medicine, Changsha 410208,China
能量代谢(energy metabolism)是机体生命活动的基本特征,是指生物体内物质代谢过程中所伴随的能量释放、转移和利用等。当能量代谢发生障碍的时候,机体细胞的活性降低,存活、分化、发育和稳态都将受到强烈的影响[1]。有研究表明[2],高血糖症或血糖升高所引起机体的能量代谢障碍,是糖尿病不加控制的一种通常结果。长期高糖会对人体的多个系统带来严重损害,尤其神经和血管[3]。高血糖等因素对血管的损伤通常会导致糖尿病患者产生心血管和脑血管并发症,与非糖尿病患者相比,糖尿病人群患动脉粥样硬化的比例更高且发病年龄更低[4]。血管内皮细胞构成血液循环的基本,在维持血脑屏障以及保证各组织营养供应中发挥至关重要的作用,血管内皮细胞能量代谢障碍是引发动脉粥样硬化的主要原因,也是凝血反应启动至血栓形成过程中一个重要特征[5]。在高糖损伤干预下,血管内皮细胞会发生能量代谢障碍,如存活率降低、生长缓慢、活性降低等症状[6]。
大量研究表明,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)不仅仅具有多向分化能力、低免疫原性、可以调节代谢以及可用来自体移植治疗等优势被作为细胞治疗的重要来源,而且可以提供营养支持,促进血管再生、调节炎症反应,重构免疫网络等从而促进组织再生等能力,是应用于糖尿病治疗的新生力量[7]。小檗碱是中药黄连的主要有效成分之一,故盐酸小檗碱又称黄连素,应用于糖尿病及其并发症的治疗已经超过20年,但其作用机制、疗效仍不明确[8]。BM-MSCs以及小檗碱的治疗作用是否是通过改善血管内皮细胞能量代谢而实现,其相互作用是表现为协同还是相加,需要进一步研究。因此,本研究探讨了在高糖损伤下,血管内皮细胞发生了怎样的能量代谢障碍,然后再在此基础上进行小檗碱、BM-MSCs以及联合使用抗高糖损伤下能量代谢障碍的实验研究,为其进一步地研究和临床的合理应用提供实验依据。
1 材料 1.1 试剂葡萄糖(C6H12O6)(批号:G7528-250G);甘露醇(C6H14O6)(批号:M8140);小檗碱(berberine)(批号:SB8130);胎牛血清(批号:1347477);RPMI 1640培养液(批号:8114020);胰蛋白酶(批号:1552993);7 sea-cell counting试剂盒(批号:20151226);Reverse Transcription逆转录试剂盒(批号:A3500);无机试剂均为国产分析纯试剂;Transwell板(批号:08909028)。
1.2 仪器培养箱(Galaxy 170R);离心机(Centrifuge 5804 R);显微镜(ZEISS,1777-614);超净工作台(1305011);高效液相分析仪(Waters,2498/Waters,1525)。
1.3 细胞骨髓间充质干细胞(BM-MSCs)购自于上海中科院细胞库;脐静脉内皮细胞(HUVEC)购自于湘雅细胞中心。
2 方法 2.1 细胞培养以及高糖等因素干预HUVEC、BM-MSC细胞均以含10%胎牛血清的RPMI 1640培养基(含葡萄糖5.5 mmol·L-1、体积分数为0.10的胎牛血清和1%青、链霉素)于37℃、5 mol·L-1 CO2及饱和湿度的培养箱中培养,2 d换液1次,待细胞生长融合后传代培养。细胞以1×107 ·L-1接种于12孔Transwell培养板,每孔0.5 mL,培养24 h待细胞贴壁后,再加入无血清培养基培养24 h,使细胞同步化到G0期,弃培养液,用以下干预方式处理细胞,2 d换液1次,待测。具体分组及干预方式见Tab 1。
| Group | Intervention |
| NC | 5.5 mmol·L-1glucose×6 d |
| MA | 5.5 mmol·L-1glucose+24.5 mannitol×16 h+5.5 mmol·L-1glucose×6 d |
| HG | 30 mmol·L-1glucose×16 h→5.5 mmol·L-1glucose×6 d |
| XBJ | 30 mmol·L-1glucose×16 h→5.5 mmol·L-1glucose+berberine 100 mg·L-1×6 d |
| BM-MSCs | 30 mmol·L-1glucose×16 h→5.5 mmol·L-1glucose+BM-MSCs×6 d |
| XBJ+BM-MSCs | 30 mmol·L-1glucose×16 h BM→5.5 mmol·L-1glucose+(BM-MSCs+berberine 100 mg·L-1)×6 d |
将干预后的细胞每孔加入7 sea-cell counting试剂盒中工作液10 μL,继续培养2 h之后,用酶标仪检测450 nm处的吸光值(OD),细胞增殖抑制率/%=[1-(实验组OD值/空白组OD值)]×100%)。
2.3 流式细胞术检测细胞周期离心收集各组细胞,弃上清,用预冷PBS洗细胞2次,收集1×105~5×105细胞;加入500 μL的Binding Buffer至悬浮细胞;加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide(PI),混匀;室温、避光、反应5~15 min;在1 h之内进行流式细胞仪的观察和检测。
2.4 彗星实验法检测细胞损伤情况离心收集各组细胞进行彗尾实验检测:① 取100 μL于45 ℃水浴中保温的7.5 g·L-1 NMA,铺于磨沙载玻片上,形成底胶。4 ℃凝固5~8 min;② 水平取下盖片,取100 μL于37 ℃水浴中保温的5 g·L-1 LMA与20 μL细胞悬液(约400个细胞)混匀,4 ℃凝固5~8 min;③ 将制备好的胶板去掉盖玻片后,在4 ℃下裂解2.5~3 h,解旋20 min;④ 玻片水平放置阳极端附近,4 ℃电泳20~25 min(25 V,300 mA);⑤ 电泳结束,中和10 min×3次,最后晾干;⑥ 取出胶板,在2 mg·L-1的EB染色液中,暗处染色5~10 min;⑦ 蒸馏水漂洗5 min×2次。晾干,在荧光显微镜下观察。
2.5 高效液相色谱法检测能量代谢指标将各组细胞经高氯酸裂解后,用反向HPLC法检测细胞中ATP、ADP和AMP的含量。HPLC系统采用Ecosil C18反相柱(4.6×250 mm,5 μm,pH 2~8),流动相:体积分数为0.90的15 mmol·L-1磷酸二氢钾缓冲液和体积分数为0.10的甲醇,流速0.5 mL·min-1,紫外检测波长为254 nm;检测温度为25℃,进样量20 μL。以标准曲线法计算ATP、ADP和AMP含量,并计算腺苷酸能荷值(EC)。
标准曲线的建立和样本测定:分别吸取1、2、3、4、5 μL标准品进样,根据标准品浓度和HPLC的峰面积得到标准曲线分别为:ATP:Y=0.117X-0.077(r=0.9996);ADP:Y=0.104X+0.695(r=0.9999);AMP:Y=0.128X-0.606(r=0.9998)。其中Y为浓度,X为峰面积。再将样品进行HPLC测定,得到的峰面积由标准曲线推算样本各待测物的含量,EC=(ATP+0.5 ADP)/(ATP+ADP+AMP)。
2.6 RT-PCR法检测COX、CCR的mRNA表达收集细胞,进行如下操作:① TRIzol法提取各组细胞的总RNA,超微量紫外分光光度计检测浓度;② 运用逆转录试剂盒将RNA逆转录合成cDNA;③ PCR扩增目的基因和内参基因,反应条件:94℃ 4 min,94℃ 30 s,60℃ 30 s,72℃ 45 s,×30个循环,72℃延伸10 min,4℃保存。引物设计:参照参考文献[7],由上海生工合成,见Tab 2。
| Gene | Sequences(5′-3′) | |
| COX | Sense | ATGATTTTGGGCTCTGGAAC |
| Antisense | GTTTGATGCCTGGGTA | |
| CCR | Sense | CAGAAGGGAAGCGTGAACA |
| Antisense | GAAACATCCTGGTGGTCCTG | |
| GAPDH | Sense | TATGACTTAGTTGCGTTACACC |
| Antisense | CCTTCACCGTTCAGTTT |
细胞培养及处理同前,收集细胞,进行如下操作:① 细胞蛋白质的提取:吸去上清,PBS洗涤,刮下细胞,1 000 r·min-1离心5 min后弃去上清,加入100 μL的蛋白裂解液和1 μL的蛋白酶抑制剂,冰上充分混匀后静置20 min,12 000 r·min-1离心10 min,取上清,BCA试剂盒测定总蛋白含量。取30 μg蛋白100℃水浴10 min变性;② Westrn blot:60 V恒压电泳3 h后,105 mA转膜2 h,质量浓度为50 g·L-1脱脂牛奶封闭1 h,再分别与COX兔源IgG(1 ∶1 000)、CCR兔源IgG(1 ∶1 000)和β-actin鼠源IgG(1 ∶1 000)溶液混合,4℃摇床过夜,TBS洗10 min×3次;然后分别加羊抗兔二抗(1 ∶2 000)或羊抗鼠二抗(1 ∶2 000),37℃孵育1 h,TBS洗10 min×3次,暗室中加ECL化学发光剂,X胶片压片、显影及定影;③ 图片分析:Image Pro-Plug 6.0图像分析软件测定目的条带的累积光密度值(IOD),以目的条带的IOD与β-actin条带的IOD的比值作为该目的蛋白的相对表达量。
2.8 统计学方法计量资料以x±s表示,对样本先进行方差齐性检验,方差齐时,用One-Way ANOVA检验,并运用LSD检验进行组间的多重比较;方差不齐时,用Dunnett T3检验。所有数据使用SPSS17.0统计软件进行处理。
3 结果 3.1 各组细胞增殖与活性的比较MTT实验结果显示:血管内皮细胞经高糖干预损伤后活性明显降低、增殖能力减弱,与正常组和甘露醇组比较,差异有显著性(P<0.01);而小檗碱、BM-MSCs及其联合使用均能提高细胞活性和增殖能力,与高糖组比较,差异有显著性(P<0.01),其中BM-MSCs联合小檗碱组的作用优于单用组(P<0.01),见Tab 3。
| Group | Proliferation rate/% |
| NC | - |
| MA | - |
| HG | 0.16±0.03** |
| XBJ | 10.95±1.14##△△ |
| BM-MSCs | 21.46±3.68##△△ |
| XBJ+BM-MSCs | 49.85±5.07## |
| **P<0.01 vs NC;##P<0.01 vs HG;△△P<0.01 vs XBJ+BM-MSCs | |
流式细胞术结果显示:血管内皮细胞经高糖干预损伤后处于S期(DNA合成期)+G2(DNA合成后期)的细胞明显减少,说明细胞分裂减慢,与正常组比较,差异有显著性(P<0.01);而小檗碱、BM-MSCs及其联合使用组S+G2期的细胞均有不同程度增加,与高糖组比较,差异有显著性(P<0.01),其中小檗碱联合BM-MSCs组作用优于单用组(P<0.01),见Fig 1。
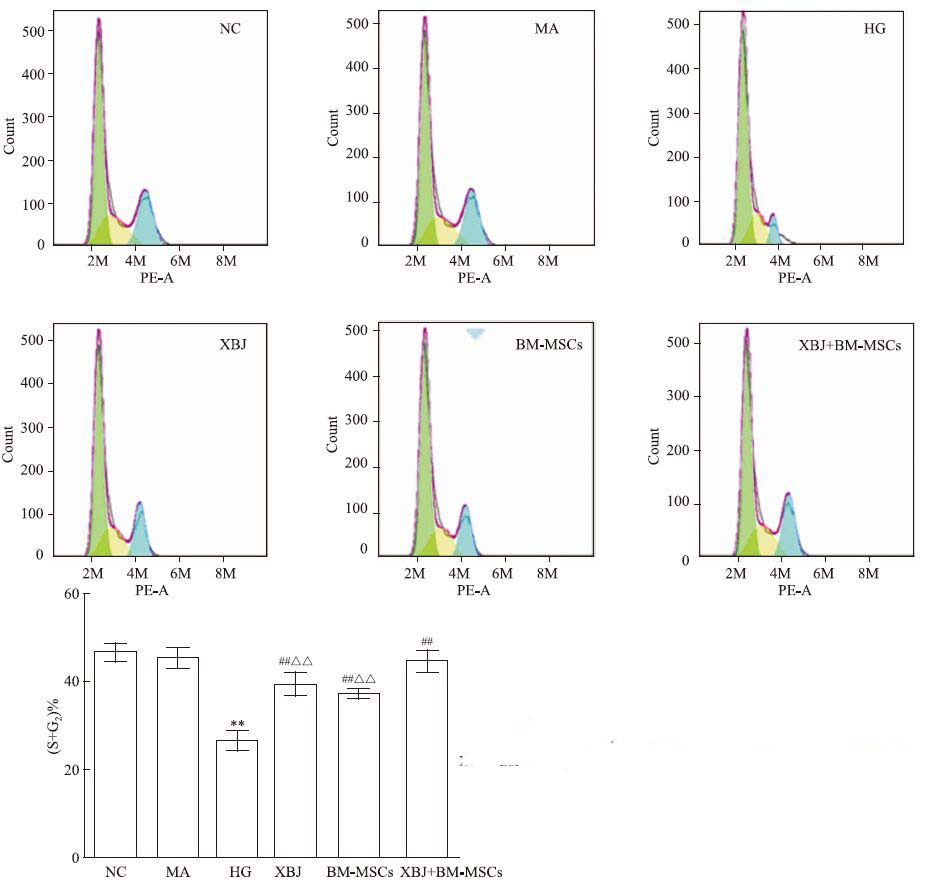
|
| Fig 1 Cell cycle detected by flow cytometry **P<0.01 vs NC group;##P<0.01 vs HG group;△△P<0.01 vs XBJ+BM-MSCs group |
彗尾实验结果显示:血管内皮细胞经高糖干预损伤后,细胞DNA出现了明显的损伤,产生脱尾现象,与正常组比较,差异有显著性(P<0.01);而小檗碱、BM-MSCs及其联合使用均能改善细胞DNA的损伤情况,与高糖组比较,差异有显著性(P<0.01),其中小檗碱联合BM-MSCs组的作用优于单用组(P<0.01或P<0.05),见Fig 2。
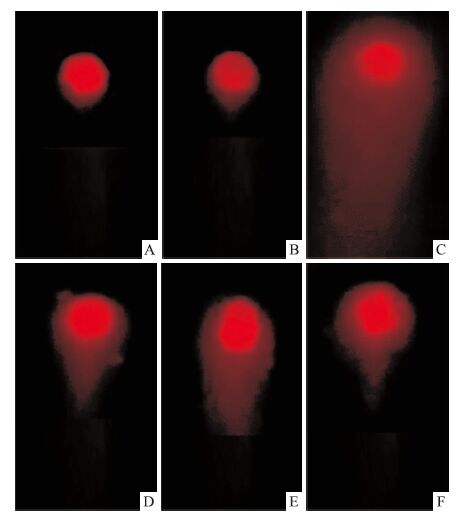
|
| Fig 2 Cell damage detected by comet assay A:NC;B:MA;C:HG;D:XBJ;E:BM-MSCs;F:XBJ+BM-MSCs |
HPLC结果显示:血管内皮细胞经高糖干预损伤后,细胞ATP、ADP以及EC值明显降低,AMP升高,AMP与正常组比较,差异有显著性(P<0.01);而小檗碱、BM-MSCs及其联合使用均能上调ATP、ADP含量以及EC值,下调AMP,与高糖组比较,差异有显著性(P<0.01或P<0.05),其中小檗碱联合BM-MSCs组的作用优于单用组(P<0.01或P<0.05),见Tab 4。
| Group | ATP/μg·L-1 | ADP/μg·L-1 | AMP/μg·L-1 | EC |
| NC | 208.52±3.33 | 140.40±7.99 | 154.497±7.94 | 0.554±0.01 |
| MA | 207.93±14.72 | 130.75±7.50 | 159.780±7.01 | 0.548±0.02 |
| HG | 76.41±13.12** | 103.75±5.66** | 220.318±10.43* | 0.320±0.01** |
| XBJ | 98.51±1.46##△△ | 91.80±6.44#△△ | 176.401±12.76#△ | 0.394±0.01##△△ |
| BM-MSCs | 104.45±1.00##△△ | 121.10±11.53# | 195.332±4.98##△△ | 0.392±0.02#△△ |
| XBJ+BM-MSCs | 183.91±5.46## | 123.05±5.23## | 150.755±7.01# | 0.536±0.02## |
| *P<0.05,**P<0.01 vs NC group;#P<0.05,##P<0.01 vs HG group;△P<0.05,△△P<0.01 vs XBJ+BM-MSCs group | ||||
RT-PCR结果显示:血管内皮细胞经高糖干预损伤后,细胞COX、CCR mRNA表达量明显降低,与正常组比较,差异有显著性(P<0.01);而小檗碱、BM-MSCs及其联合使用均能上调COX、CCR mRNA表达,与高糖组比较,差异有显著性(P<0.01或P<0.05),其中小檗碱联合BM-MSCs组的作用优于单用组(P<0.05),见Fig 3。
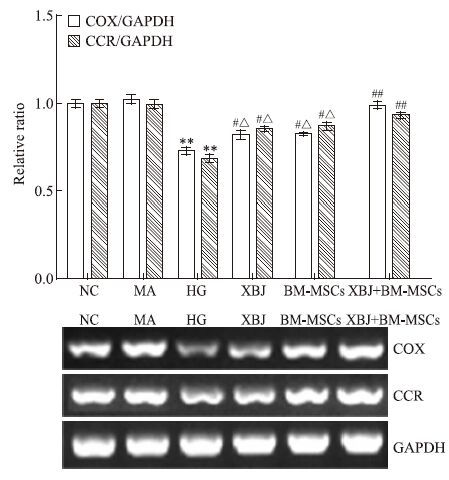
|
| Fig 3 mRNA expression of COX and CCR by RT-PCR **P<0.01 vs NC group;#P<0.05,##P<0.01 vs HG group;△P<0.05 vs XBJ+BM-MSCs group |
Western blot结果显示:血管内皮细胞经高糖干预损伤后,细胞COX、CCR蛋白表达量明显降低,与正常组比较,差异有显著性(P<0.01);而小檗碱、BM-MSCs及其联合使用均能上调COX、CCR蛋白表达,与高糖组比较,差异有显著性(P<0.01),其中小檗碱联合BM-MSCs组的作用优于单用组(P<0.05)。见Fig 4。
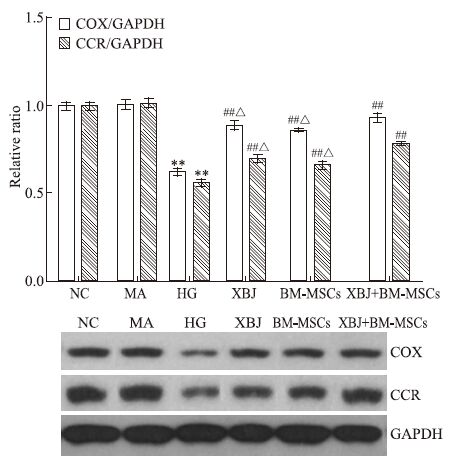
|
| Fig 4 Protein expression of COX and CCR by Western blot **P<0.01 vs NC group;##P<0.01 vs HG group;△P<0.05 vs XBJ+BM-MSCs |
近年来,大量研究发现糖尿病中胰岛素抵抗的发生与线粒体功能障碍密切相关。胰岛素抵抗的小鼠、2型糖尿病动物和患者均伴有机体中线粒体氧化磷酸化活性下降、ATP生成减少、线粒体功能障碍[9]。ATP作为组织细胞的主要能量来源,对于维持细胞的生理功能,如主动转运、蛋白质合成与加工、离子内环境稳定、细胞膜完整性等发挥着重要作用[10]。EC是动态反映细胞能量平衡的一个参数,可有效评估组织细胞的能量储备状态。能荷值高,说明细胞内ATP生成活跃,反之则表明ATP生成不足或利用增加。高糖损伤下的血管内皮细胞会出现有氧氧化障碍,代谢紊乱,ATP含量下降,ATP分解产物ADP、AMP含量增加,随后ADP、AMP相继分解,最终导致EC值明显下降,血管损伤。细胞色素C还原酶(cytochrome c reductase,CCR)和细胞色素C氧化酶(cytochrome C oxidase,COX)是氧化磷酸化过程中呼吸链的重要组分,在体内ATP 生成起着关键作用。本研究结果显示,高糖损伤血管内皮细胞之后,血管内皮细胞的COX与CCR mRNA和蛋白表达均降低,呼吸链过程受阻,导致整个ATP合成量下降。
小檗碱是黄连中含量最为丰富的单体成份,中药黄连是中医用于治疗糖尿病的常用药物,中医记载黄连具有清热、解毒、泻火以及治疗消渴症的作用[11]。BM-MSCs是一类具有多向分化潜能、造血支持和促进干细胞植入、免疫调控和自我复制等特点的细胞,在细胞替代治疗中有极其重要的作用[12]。BM-MSCs在体内或体外特定的诱导条件下,可分化为脂肪、骨、软骨、肌肉、肌腱、韧带、神经、肝、心肌、内皮等多种组织细胞,连续传代培养和冷冻保存后仍具有多向分化潜能,可作为理想的种子细胞用于衰老和病变引起的组织器官损伤修复[13]。在治疗糖尿病的难题上提供了新思路。
本文结果显示,小檗碱、干细胞和小檗碱联合干细胞使用均能明显改善高糖损伤后血管内皮细胞的活性与增殖情况,并且可以加快细胞的分裂生长,以及改善细胞的DNA损伤情况。与此同时,在提高ATP的含量,增加EC值上也发挥了不可估量的作用,改善了血管内皮细胞的能量代谢,且小檗碱联合干细胞组的作用强于单用组。在COX与CCR mRNA和蛋白表达的干预上,小檗碱、干细胞和小檗碱联合干细胞使用均能明显上调,且联合使用的作用强于单用组,这可能与上调COX与CCR mRNA和蛋白表达,促进细胞中氧化物的氧化,减轻细胞的负担,从而调节血管内皮细胞能量代谢有关。
综上所述,将小檗碱和BM-MSCs合理配伍,将可能对糖尿病的治疗发挥增效作用,这种作用与其配伍后增强改善血管内皮细胞能量代谢有关,为治疗糖尿病提供了新思路和一定的实验依据,但是其具体的作用通路及其机制还有待我们进一步研究。
( 致谢: 感谢团队成员为该项目付出的辛勤劳动,感谢湖南中医药大学医学基础教学实验中心提供实验场地,感谢中西医结合心脑疾病防治湖南省重点实验室和中医方证研究转化医学湖南省高校重点实验室提供指标检测仪器! )
| [1] | 陆静金, 刘圣. 小檗碱对糖尿病及其并发症作用的研究进展[J]. 安徽医药, 2012, 16 (11) : 1566-9. Lu J J, Liu S. Research progress on the effects of berberine on diabetes mellitus and its complications[J]. Anhui Med Pharm J, 2012, 16 (11): 1566-9. |
| [2] | 丁海华, 邱原野, 王盈盈, 等. 小檗碱对糖尿病肾病大鼠nephrin、podocin和α3β1整合素表达的影响[J]. 中国药理学通报, 2015, 31 (10) : 1414-20. Ding H H, Qiu Y Y, Wang Y Y, et al. The effect of berberine on expression of nephrin, podocin and α3β1integrin in diabetic nephropathy rats[J]. Chin J Pharmacol Bull, 2015, 31 (10): 1414-20. |
| [3] | 倪伟建, 丁海华, 唐丽琴, 等. 小檗碱对糖尿病肾病大鼠肾组织VEGF表达的影响[J]. 中国药理学通报, 2015, 31 (6) : 795-800. Ni W J, Ding H H, Tang L Q, et al. Effects of berberine on the expression of VEGF in renal tissue of diabetic nephropathy rats[J]. Chin Pharmacol Bull, 2015, 31 (6): 795-800. |
| [4] | 严国强, 陈春香, 陈芳辉, 等. PPARγ介导卡托普利改善高糖诱导血管内皮细胞胰岛素抵抗的作用[J]. 中国药理学通报, 2015, 31 (4) : 532-7. Yan G Q, Chen C X, Chen F H, et al. PPARγ with captopril to improve insulin resistance in vascular endothelial cells induced by high glucose[J]. Chin Pharmacol Bull, 2015, 31 (4): 532-7. |
| [5] | 李劲松. COX-2信号通路参与高糖高胰岛素诱导的心肌细胞肥大研究[J]. 重庆医学, 2011, 40 (25) : 2537-40. Li J S. COX-2 signaling pathway involved in the study of cardiac hypertrophy induced by high glucose and high insulin[J]. Chongqing J Med, 2011, 40 (25): 2537-40. |
| [6] | 王宁丁, 刘晓秋, 伍军军, 等. 补中益气丸对糖尿病大鼠胃黏膜诱导型一氧化氮合酶及环氧化酶2表达的影响[J]. 吉林中医药, 2015, 35 (3) : 279-82. Wang N D, Liu X Q, Wu J J, et al. Buzhong Yiqi Pill on gastric mucosa of rats with diabetes induced nitric oxide synthase and cyclooxygenase 2 expression in mice[J]. Jilin Tradit Chin Med, 2015, 35 (3): 279-82. |
| [7] | 李颖, 李健琳, 范晨, 等. 小檗碱片对2型糖尿病患者胰岛素分泌及抵抗的影响[J]. 现代诊断与治疗, 2015, 26 (7) : 1450-1. Li Y, Li J L, Fan C, et al. Effects of berberine on insulin secretion and resistance in patients with type 2 diabetes[J]. Mod Diagn Treat, 2015, 26 (7): 1450-1. |
| [8] | 徐静钰, 林原, 李华, 等. 小檗碱多靶点抗糖尿病作用的研究进展[J]. 中国糖尿病杂志, 2011, 19 (3) : 231-2. Xu J Y, Lin Y, Li H, et al. Research progress on anti-diabetic effects of berberine hydrochloride[J]. Chin J Diabetes, 2011, 19 (3): 231-2. |
| [9] | 于丁, 于永燕, 马千里, 等. 盐酸小檗碱对糖尿病大鼠心肌缺血再灌注损伤的保护作用[J]. 河北医科大学学报, 2011, 32 (5) : 505-8. Yu D, Yu Y Y, Ma Q L, et al. Protective effects of berberine hydrochloride on diabetic rats myocardial ischemia reperfusion injury[J]. J Hebei Med Univ, 2011, 32 (5): 505-8. |
| [10] | 李彩虹, 周克元. 黄连活性成分的作用及机制研究进展[J]. 时珍国医国药, 2010, 21 (2) : 466-8. Li C H, Zhou K Y. Study on the effect and mechanism of active components of Huanglian[J]. Lishizhen Med Mater Med Res, 2010, 21 (2): 466-8. |
| [11] | 贾晓利. 糖尿病合并心衰患者的能量代谢支持治疗[J]. 实用医院临床杂志, 2010, 7 (5) : 150-2. Jia X L. Energy metabolism support in patients with diabetes mellitus complicated with heart failure[J]. Pract J Clin Med, 2010, 7 (5): 150-2. |
| [12] | 马航, 胡慭然, 邹宗尧, 等. 黄连生物碱降糖作用研究及构效关系初探[J]. 中国药理学通报, 2015, 31 (11) : 1575-9. Ma H, Hu Y R, Zou Z Y, et al. Hypoglycemic effect of the relationship of Rhizoma Coptidis alkaloids and structure activity[J]. Chin Pharmacol Bull, 2015, 31 (11): 1575-9. |
| [13] | 姚金铭, 宋秀玲, 王焕君, 等. 黄连素(小檗碱)治疗糖尿病肾病疗效和安全性的系统评价[J]. 中华临床医师杂志(电子版), 2015, 9 (23) : 110-4. Yao J M, Song X L, Wang H J, et al. Berberine in the treatment of diabetic nephropathy efficacy and safety evaluation[J]. Clin J Clin (Electron Edi), 2015, 9 (23): 110-4. |

