


2. 成都中医药大学,成都 610075;
3. 北京中医药大学东方医院,北京 100078;
4. 中国中医科学院,北京 100700
2. Chengdu University of TCM, Chengdu 610075, China ;
3. Dongfang Hospital Affiliated to Beijing University of Chinese Medicine,Beijing 100078,China ;
4. China Academy of Chinese Medical Sciences,Beijing 100700,China
β-淀粉样蛋白(amyloid β-protein,Aβ)沉积形成的老年斑是阿尔茨海默病(Alzheimer's disease,AD)的典型病理特征[1]。脑内Aβ代谢异常是Aβ沉积的关键,Aβ代谢异常与其生成和清除失衡密切相关[2]。Aβ生成主要取决于α-分泌酶、β-分泌酶和γ-分泌酶对APP不同剪切作用[3],而剪切后可溶性α-APP(sAPPα)、可溶性β-APP(sAPPβ)和C99等相关片段水平的高低可以间接反映相应分泌酶的活性;中性内肽酶(neprilysin,NEP)和胰岛素降解酶(insulin-degrading enzyme,IDE)是脑内Aβ的主要降解酶,因此IDE和NEP的活性水平可以间接反映脑内Aβ的清除水平[4]。已知Aβ1-40和Aβ1-42是APP错误酶切后的毒性片段,其寡聚化后沉积在神经细胞形成老年斑,损害神经元后导致神经突触缺失,参与了AD的发生和发展。课题组前期研究发现,通络醒脑泡腾片(Tongluoxingnao effervescent tablet,TLXNET)对Aβ注射AD大鼠 [5]、东莨菪碱致拟痴呆小鼠[6]、双侧颈总动脉永久结扎大鼠[7]等多种痴呆模型均有良好的抗痴呆效应,为进一步探索TLXNET抗AD作用机制,本研究拟从Aβ生成和清除角度进行了研究。
1 材料 1.1 药物通络醒脑泡腾片(每片1.2 g,4.5 g原生药/片),四川同道堂药业集团股份有限公司提供,批号:20140215。
1.2 动物与细胞株SD大鼠(血清供体),♂,体质量280 g~320 g,由成都达硕实验动物有限公司提供,实验动物合格证SCXK(川)2013-24;SH-SY5Y、SH-SY5Y-APP和 SH-SY5Y-C99均由北京中医药大学东方医院马涛老师惠赠。
1.3 试剂Aβ25-35购自Sigma公司;LDH试剂盒购自Biovision公司;Human Aβ1-40 Colorimetric ELISA Kit和Human Aβ1-42 Colorimetric ELISA Kit购自Invitrogen公司;β-分泌酶酶活测定试剂盒购自Biovision公司;RNA提取试剂TRIzol购自天根生化科技有限公司;PrimeSTAR HS(Premix)购自TaKaRa公司(大连);RevertAidTM M-MuLV逆转录酶及RT-PCR中其他试剂购自Fermentas公司;抗IDE抗体、抗NEP抗体购自Abcam公司;抗β-actin单克隆抗体C4购自Santa Cruz公司;抗APP抗体购自IBL公司;Calbiochem® BACE1抗体购自Merck公司;Amersham ECL plus显色试剂购于GE公司;细胞培养试剂均购自Invitrogen公司。
1.4 仪器BioRad Mini-Protean小型垂直电泳系统(BioRad公司),ELX800酶标仪(BIO-TEK公司),GeneGnome ECL成像仪(Syngene公司),5810R台式多功能冷冻离心机(Eppendorf公司),7300实时荧光PCR仪(ABI公司)。
2 方法 2.1 含药血清的制备大鼠按临床成人用药量5倍灌胃给药,每天1次,连续6 d,d 7重复给药2次,间隔时间2 h。在末次给药1 h后,从眼眶静脉取血,室温静置1 h以上,待血凝固后,1 500 r·min-1,10 min,分离血清,置于56℃水浴中30 min灭活处理,-20℃保存。使用前,0.2 μm滤膜过滤除菌。
2.2 通络醒脑泡腾片含药血清无毒浓度的确定及其对细胞活性的影响SH-SY5Y-APP和SH-SY5Y-C99细胞均用含10%胎牛血清、100 kU·L-1青霉素、100 mg·L-1链霉素、500 mg·L-1 G418(用于维持外源基因的表达)的DMEM/F12完全培养基置于37 ℃、5% CO2、相对湿度90%的CO2培养箱中孵育。取对数生长期的SH-SY5Y-APP和SH-SY5Y-C99细胞,用0.25%胰酶消化后,分别以2.5×107·L-1接种于96孔板培养,每孔100 μL,待融合度达75%以上,弃去旧的培养基,对照孔加含10%普通大鼠血清,给药孔分别加含1.25%、2.5%、5%、10%、20%、40%含药血清(不足10%的以普通大鼠血清补足至终浓度10%)的DMEM/F12培养液孵育48 h。采用MTT法确定含药血清无毒浓度和LDH-Cytotoxicity Assay Kit检测细胞活性,结果以空白对照组(0%)光吸收值的百分数表示。
2.3 通络醒脑泡腾片对细胞的Aβ1-40和Aβ1-42分泌量的影响SH-SY5Y-APP细胞和SH-SY5Y-C99细胞分别以2.5×107·L-1接种于24孔板,相应浓度含药血清孵育48 h,收集细胞培养液,采用Human Aβ1-40 Colorimetric ELISA Kit和Human Aβ1-42 Colorimetric ELISA Kit测定培养液中Aβ浓度,具体操作参照试剂盒说明书。
2.4 通络醒脑泡腾片对APP基因和蛋白表达水平的影响SH-SY5Y-APP细胞以1×108·L-1接种于6孔板,用相应浓度含药血清孵育48 h,采用RT-PCR法检测细胞APP基因水平,TRIzol提取细胞总RNA,紫外分光光度计测定其浓度和纯度,采用RevertAidTM M-MuLV逆转录酶进行反转录,扩增得到的cDNA,以PrimeSTAR HS(Premix) PCR扩增30个循环,以β-actin为内参;APP引物为:上游5′-GGAAGTGGGATTCAGATCC-3′,下游5′-GCATAGTCTGTGTCTGCTC-3′。采用Western blot法检测细胞中APP蛋白表达量,以RIPA裂解液裂解细胞,提取细胞总蛋白,以BCA法测定样品蛋白浓度,160 V电泳1.5 h,295 mA转膜1.5 h,封闭1~2 h,加入抗体4 ℃孵育过夜,PBST清洗膜4次,5 min每次,加入抗体(辣根过氧化物酶标记羊抗鼠和羊抗兔IgG),室温反应1.5~2 h,进行ECL显色。采用X光片曝光,扫描后图像用Image J软件(NIH image,MD)分析。
2.5 通络醒脑泡腾片对sAPPα和sAPPβ蛋白水平的影响SH-SY5Y-APP细胞以1×108·L-1接种于6孔板,含相应浓度含药血清孵育48 h,采用Western blot法确定细胞中sAPPα和sAPPβ蛋白,步骤同“2.4”。
2.6 通络醒脑泡腾片对β-分泌酶基因、蛋白和酶活性的影响 2.6.1 通络醒脑泡腾片对β-分泌酶基因表达的影响SH-SY5Y-APP细胞以1×108·L-1接种于6孔板,含相应浓度含药血清孵育48 h。采用qRT-PCR法检测细胞中BACE1基因水平,TRIzol提取细胞总RNA,紫外分光光度计测定其浓度和纯度。采用RevertAidTM First Strand cDNA Synthesis Kit进行反转录,扩增得到的cDNA以SYBR® Green Real-Time PCR Master Mixes在ABI 7300 real time PCR system上扩增35个循环,以β-actin为内参。BACE1引物为:上游5′-TGATCATTGTGCGGGTGGAGA-3′,下游5′-AGCTGCTCTCCTAGCCAGAAA -3′。
2.6.2 通络醒脑泡腾片对β-分泌酶蛋白表达及酶活性的影响SH-SY5Y-APP细胞以1×108·L-1接种于6孔板,采用Western blot法检测细胞中BACE1的蛋白表达量,步骤同“2.4”。β-分泌酶活性测定方法参考试剂盒说明书。
2.7 通络醒脑泡腾片对Aβ降解酶蛋白水平的影响SH-SY5Y-APP细胞以1×108·L-1接种于6孔板,相应浓度含药血清孵育48 h,采用Western blot法检测细胞中IDE和NEP蛋白水平,步骤同“2.4”。
2.8 通络醒脑泡腾片对Aβ神经细胞毒性的保护作用Aβ25-35以1 mmol·L-1浓度溶解于PBS缓冲液中,0.22 μm滤膜过滤除菌,37℃孵育48 h,制备寡聚化的Aβ蛋白。SH-SY5Y细胞按“2.1”方法接种于96孔板,待融合至75%以上后,加入老化好的Aβ25-35至终浓度为35 μmol·L-1,同时加入相应浓度的含药血清,37℃孵育48 h。MTT检测细胞活性,步骤同“2.1”。
2.9 统计学方法qRT-PCR的数据采用2-ΔΔCT方法进行分析,其余实验数据以x±s表示,组间数据比较采用t检验,采用Origin 8.5做统计分析及绘图。
3 结果 3.1 通络醒脑泡腾片对SH-SY5Y-APP和SH-SY5Y-C99细胞活性影响MTT法检测结果显示,与对照组(0%)比较,0%~40%含药无血清培养液孵育48 h,各浓度的吸光值无显著性差异(P>0.05),见Fig 1A,即0%~40%浓度范围内,通络醒脑泡腾片含药血清对SH-SY5Y-APP和SH-SY5Y-C99细胞无毒性。LDH法检测细胞活性结果显示,与对照组(0%)比较,1.25%~40% 药物浓度范围内,吸光度无显著性变化(P>0.05),见Fig 1B,药物对细胞分泌乳酸脱氢酶的活性无影响。提示0%~40%浓度范围内,通络醒脑泡腾片含药血清对SH-SY5Y-APP和SH-SY5Y-C99细胞无明显毒性。
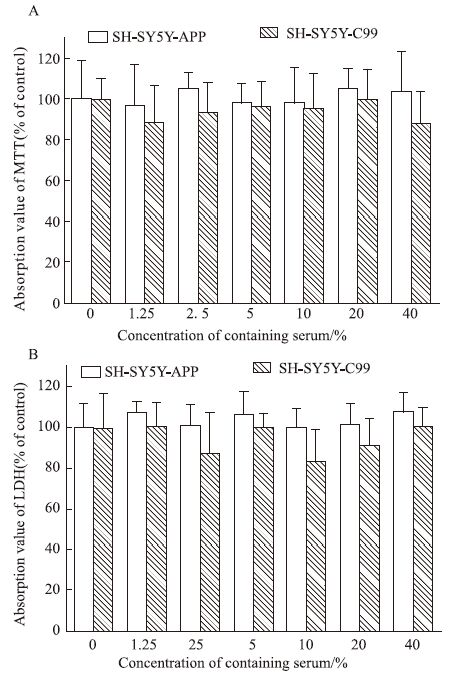
|
| Fig 1 Effect of TLXNET on cell viability of SH-SY5Y-APP and SH-SY5Y-C99 A:MTT assay;B:LDH assay |
与对照组(0%)比较,2.5%~20%药物浓度范围内,TLXNET含药血清可明显抑制SH-SY5Y-APP细胞的Aβ分泌(P<0.05),且存在浓度依赖性,见Fig 2。与对照组(0%)比较,1.25%~10%药物浓度范围内,SH-SY5Y-C99细胞的Aβ含量无明显变化(P>0.05),说明TLXNET对SH-SY5Y-C99细胞中Aβ的分泌无抑制作用,见Fig 3。提示TLXNET不是通过γ-分泌酶调控,可能是通过α-分泌酶或β-分泌酶影响Aβ的生成。
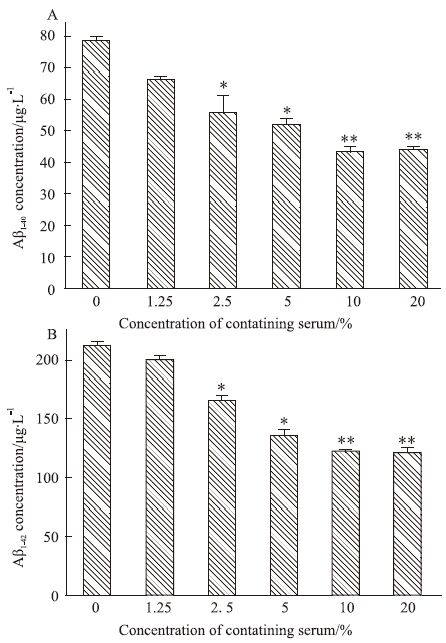
|
| Fig 2 Effect of TLXNET on level of Aβ1-40 (A) and Aβ1-42 (B) in SH-SY5Y-APP cell *P<0.05,**P<0.01 vs control |
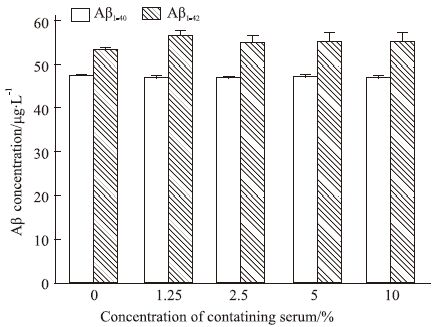
|
| Fig 3 Effect of TLXNET on levels of Aβ1-40 and Aβ1-42 in SH-SY5Y-C99 cell |
qRT-PCR结果显示,与对照组(0%)比较,1.25%~20%药物浓度范围内,APP基因和蛋白表达均无明显变化(P>0.05),见Fig 4、5,提示TLXNET对APP基因和蛋白表达均无明显影响。
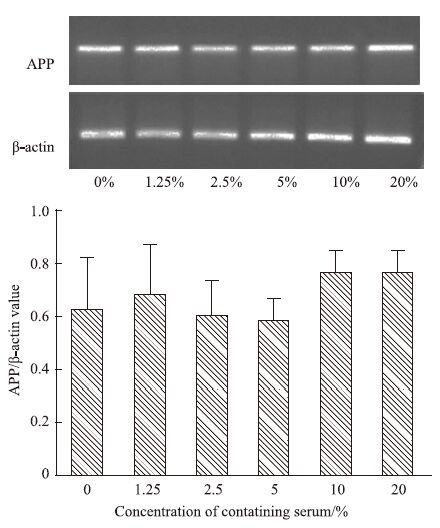
|
| Fig 4 Effect of TLXNET on transcription of APP mRNA |
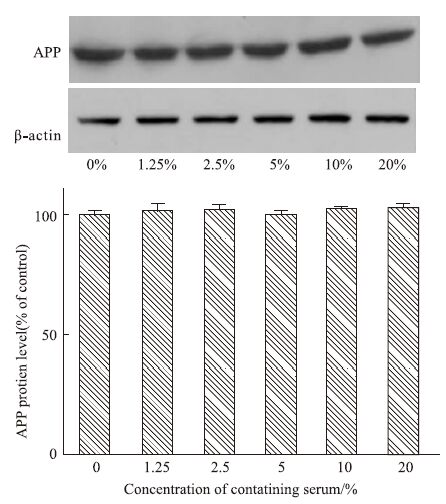
|
| Fig 5 Effect of TLXNET on the protein expression of APP |
sAPPα和sAPPβ是APP分别经α-分泌酶与β-分泌酶剪切后的产物。Western blot结果显示,与对照组(0%)比较,1.25%~5%药物浓度范围内,sAPPα蛋白表达差异无显著性(P>0.05),而sAPPβ蛋白含量明显减少(P<0.05),并呈药物浓度依赖性,见Fig 6。提示TLXNET抑制Aβ生成与调控β-分泌酶有关,但与α-分泌酶关系不大。

|
| Fig 6 Effect of TLXNET on expression of shearing fragment of APP **P<0.01 vs control |
采用2-ΔΔCT方法对qRT-PCR的数据进行分析,结果见Tab 1,与对照组(0%)比较,2.5%~10% TLXNET含药血清可以以剂量依赖方式下调BACE1基因表达。
| The concentrations of medicated serum/% | ΔCT | 2-ΔΔCT |
| 2.5 | 0.77 | 0.585 |
| 5 | 1.15 | 0.451 |
| 10 | 1.35 | 0.393 |
Fig 7 Western blot结果显示,与对照组(0%)比较,1.25%~5%药物浓度范围内,TLXNET以剂量依赖方式明显抑制BACE1蛋白表达(P<0.01)。
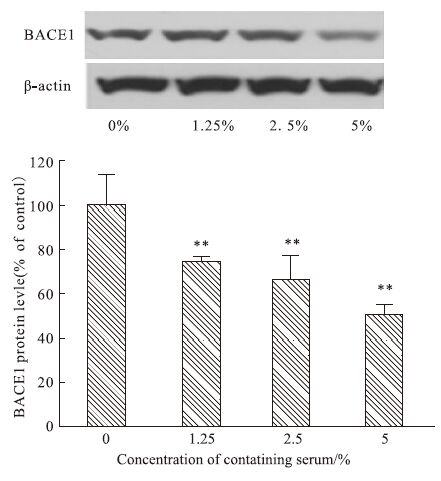
|
| Fig 7 Effect of TLXNET on expression of BACE1 protein in SH-SY5Y-APP cells **P<0.01 vs control |
酶活性测定结果见Fig 8,与对照组(0%)比较,1.25%~5%药物浓度范围内,TLXNET以剂量依赖方式明显抑制BACE1酶活性(P<0.01)。

|
| Fig 8 Effect of TLXNET on enzyme activity of BACE1 in SH-SY5Y-APP cells **P<0.01 vs control |
Fig 9 Western blot检测结果显示,与对照组(0%)比较,1.25%~5%药物浓度范围内,TLXNET对IDE和NEP蛋白表达水平无明显影响(P>0.05)。
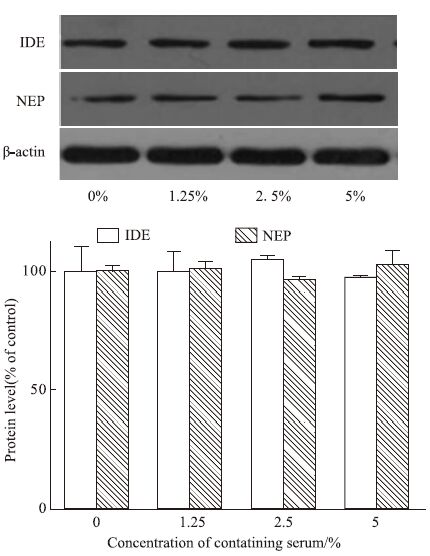
|
| Fig 9 Effect of TLXNET on expression of Aβ degrading enzyme protein |
与对照组比,Aβ25-35孵育48 h后,SH-SY5Y细胞存活率明显下降(P<0.01);在2.5%~10%药物浓度范围内,TLXNET明显提高SH-SY5Y细胞存活率(P<0.01),并呈剂量依赖方式,见Fig 10。提示TLXNET具有拮抗Aβ神经细胞毒性的作用。
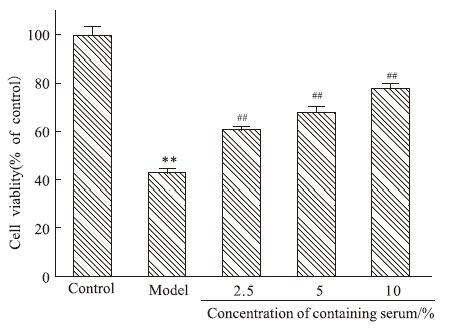
|
| Fig 10 Effect of TLXNET on neurotoxicity induced by Aβ25-35 **P<0.01 vs control;##P<0.01 vs model |
Aβ异常沉积具有神经毒性,可引起Tau蛋白磷酸化、突触的变化、递质丢失、神经胶质增生和炎症反应等病理反应,导致老年斑块形成、神经原纤维缠结和神经突触缺失,进而可导致神经元的变性或死亡,最终导致AD的发生[8]。可见Aβ异常沉积及其神经毒性是AD的早期核心事件,神经细胞的损伤是导致AD发生的关键,而有学者提出对抗 Aβ神经毒性是“对因治疗” AD 的主要目标[9],TLXNET是否具有该作用呢?课题组采用Aβ25-35致SH-SY5Y细胞损伤模型考察了其神经保护作用,结果显示TLXNET明显提高SH-SY5Y细胞存活率,提示其能够拮抗Aβ的神经细胞毒性,保护神经细胞。
Aβ生成和清除失衡是导致Aβ异常沉积的关键因素[10],而Aβ生成与APP剪切途径密切相关。APP可经α-分泌酶或β-分泌酶剪切作用分别生成sAPPα、C83和sAPPβ、C99,C99再经γ-分泌酶剪切产生Aβ[11-12]。本实验采用的SH-SY5Y-APP和SH-SY5Y-C99转基因细胞可自主分泌过量的Aβ,是AD研究中较为理想的细胞模型[13]。课题组首先检测了无毒浓度下TLXNET含药血清对SH-SY5Y-APP和SH-SY5Y-C99细胞Aβ分泌的影响,结果显示TLXNET可明显抑制SH-SY5Y-APP细胞的Aβ分泌,而对SH-SY5Y-C99细胞Aβ分泌无影响。TLXNET导致Aβ分泌量下降究竟是通过抑制其生成还是促进其降解,亦或是二者兼而有之呢?为回答这一问题,课题组先从Aβ生成途径进行了研究。研究发现TLXNET对SH-SY5Y-C99细胞的Aβ分泌量无明显影响,提示抑制Aβ的分泌不是通过抑制γ-分泌酶作用而实现,同时发现其对sAPPα蛋白表达水平亦无影响,提示该作用亦不是通过抑制α-分泌酶产生;但TLXNET可以明显下调sAPPβ蛋白水平,说明抑制Aβ的分泌与β-分泌酶密切相关。为了进一步确认TLXNET对β-分泌酶的抑制作用,我们检测了BACE1基因、蛋白表达及酶活性。结果发现TLXNET对β-分泌酶的基因、蛋白和酶活性均有剂量依赖性的抑制作用,提示其通过抑制β-分泌酶抑制了Aβ的分泌。
TLXNET导致Aβ分泌量的减少是否与促进其降解亦有关系呢?正常生理条件下,机体自身存在有效的清除机制,Aβ的产生和清除能保持动态平衡,但随着机体逐渐衰老,Aβ清除降解机能下降,进而导致Aβ过量沉积[11]。NEP和IDE是清除Aβ重要的降解酶,可由神经元或神经胶质细胞产生或在脑血管上分泌,将Aβ降解为小分子肽类从体内清除[14],当Aβ清除受抑制,Aβ可大量聚集进而加剧神经原纤维的缠结导致细胞死亡,促使AD的形成发展[15]。研究结果发现,通络醒脑泡腾片对Aβ降解酶NEP和IDE的蛋白水平无影响,提示其降低Aβ分泌与促进降解无关,但这与我们前期在体研究的结果不一致。前期发现药物可提高Aβ25-35海马注射痴呆大鼠的NEP水平[16],但药物对IDE的影响并没有研究。而出现药物调控NEP水平结果不一的可能原因:一是药物在体内代谢过程十分复杂,通络醒脑泡腾片在体给药是否产生了某种内源性的活性物质产生了作用;二是体内实验和体外实验因为内环境不同,导致产生了不一致的结果;三是两个研究的检测方法不同,前者采用了免疫组化技术,本次采用Western blot技术,前者是否出现了假阳性的结果等,具体原因有待进一步深入研究分析。
综上所述,在本实验条件下,研究发现通络醒脑泡腾片通过抑制β-分泌酶进而抑制Aβ生成,并通过拮抗Aβ神经细胞毒性保护神经元是其发挥抗AD的主要作用机制之一。
( 致谢: 本项工作主要在四川省中药资源系统研究与开发利用国家重点实验室培育基地和北京中医药大学东方医院国家中医药管理局细胞分子技术三级实验室共同完成,在此感谢陈欢、任香怡、付昆等同学在实验中的帮助。 )
| [1] | Clippingdale A B, Wade J D, Barrow C J. The amyloid-β peptide and its role in Alzheimer’s disease[J]. J Peptid Sci, 2001, 7 (5): 227-49. doi:10.1002/(ISSN)1099-1387 |
| [2] | Mawuenyega K G, Sigurdson W, Ovod V, et al. Decreased clearance of CNS β-amyloid in Alzheimer’s disease[J]. Science, 2010, 330 (6012): 1774. doi:10.1126/science.1197623 |
| [3] | Blennow K, Mattsson N, Schll M, et al. Amyloid biomarkers in Alzheimer’s disease[J]. Trends Pharmacol Sci, 2015, 36 (5): 297-309. doi:10.1016/j.tips.2015.03.002 |
| [4] | Dorfman V B, Pasquini L, Riudavets M, et al. Differential cerebral deposition of IDE and NEP in sporadic and familial Alzheimer’s disease[J]. Neurobiol Aging, 2010, 31 (10): 1743-57. doi:10.1016/j.neurobiolaging.2008.09.016 |
| [5] | 徐世军, 代渊, 张荫杰, 等. 通络醒脑泡腾片对 Aβ 海马注射痴呆大鼠 tau 蛋白磷酸化关键调控蛋白 CDK5 和 GSK-3 表达的影响[J]. 华西药学杂志, 2013, 28 (2) : 140-3. Xu S J, Dai Y, Zhang Y J, et al. Effects of Tongluo Xingnao effervescent tablet on expression of CKD5 and GSK-3 in rat model of hippocampus with Aβ injection[J]. West China J Pharm Sci, 2013, 28 (2): 140-3. |
| [6] | 张荫杰, 巨少华, 胡勇, 等. 通络醒脑泡腾片对拟痴呆小鼠中枢胆碱能神经功能的影响[J]. 中药新药与临床药理, 2014, 25 (3) : 272-6. Zhang Y J, Ju S H, Hu Y, et al. Effect of Tongluo Xingnao effervescent tablets on cerebral cholinergic function of mice dementia model induced by scopolamine[J]. Tradit Chin Drug Res Clin Pharmacol, 2014, 25 (3): 272-6. |
| [7] | 胡勇, 巨少华, 张荫杰, 等. 通络醒脑泡腾片对大鼠慢性脑缺血致学习记忆功能损伤的影响[J]. 中国中药杂志, 2014, 39 (10) : 1908-12. Hu Y, Ju S H, Zhang Y J, et al. Effect of Tongluo Xingnao effervescent tablets on learning and memory dysfunction in rats with chronic cerebral ischemia[J]. China J Chin Mater Med, 2014, 39 (10): 1908-12. |
| [8] | Mehta P D. Amyloid beta protein as a marker or risk factor of Alzheimer’s disease[J]. Curr Alzheimer Res, 2007, 4 (4): 359-63. doi:10.2174/156720507781788891 |
| [9] | 苏玮, 朱龙军, 许大平, 等. 新型益脑双联体防治阿尔茨海默病作用及机制研究进展[J]. 中国药理学通报, 2014, 30 (9) : 1201-5. Su W, Zhu L J, Xu D P, et al. Research progress in characterizing multiple-target mechanisms of novel anti-Alzheimer’s dimers[J]. Chin Pharmacol Bull, 2014, 30 (9): 1201-5. |
| [10] | Hardy J, Selkoe D J. The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics[J]. Science, 2002, 297 (5580): 353-6. doi:10.1126/science.1072994 |
| [11] | Pimplikar S W. Reassessing the amyloid cascade hypothesis of Alzheimer’s disease[J]. Int J Biochem Cell Biol,, 2009, 41 (6): 1261-8. doi:10.1016/j.biocel.2008.12.015 |
| [12] | 李守业, 朱妍, 焦悦, 等. 阿尔茨海默病APP分泌酶及其靶向干预研究进展[J]. 中国药理学通报, 2011, 27 (10) : 1349-53. Li S Y, Zhu Y, Jiao Y, et al. Progress of APP secretase and targeted intervention on Alzheimer’s disease[J]. Chin Pharmacol Bull, 2011, 27 (10): 1349-53. |
| [13] | Grimm M O, Stahlmann C P, Mett J, et al. Vitamin E: curse or benefit in Alzheimer’s disease? A systematic investigation of the impact of α-, γ-and δ-tocopherol on Aβ generation and degradation in neuroblastomacells[J]. J Nutr Health Aging, 2015, 19 (6): 646-56. doi:10.1007/s12603-015-0506-z |
| [14] | 杨红旗, 陈生弟. Aβ降解酶在阿尔茨海默病发病机制及治疗中的作用[J]. 上海交通大学学报, 2007, 27 (6) : 739-41. Yang H Q, Chen S D. Role of Aβ-degrading enzymes in pathogenesis and treatment of Alzheimer’s disease[J]. J Shanghai Jiaotong Univ Med Sci, 2007, 27 (6): 739-41. |
| [15] | Wang D S, Dickson D W, Malter J S. β-Amyloid degradation and Alzheimer’s disease[J]. J Biomed Biotechnol, 2006, 2006 (3): 58406. |
| [16] | 张荫杰, 代渊, 胡勇, 等. 通络醒脑泡腾片对AD大鼠学习记忆和海马胰岛素降解酶表达的影响[J]. 中国中药杂志, 2013, 38 (17) : 2863. Zhang Y J, Dai Y, Hu Y, et al. Effect of Tongluo Xingnao effervescent tablet on learning and memory of AD rats and expression of insulin-degrading enzyme in hippocampus[J]. China J Chin Mater Med, 2013, 38 (17): 2863. |

