


2. 军事医学科学院放射与辐射医学研究所,北京 100850
 ,
HU Chao2,
XU Long-long2,
MA Zeng-chun2,
LIANG Qian-de2,
TANG Xiang-lin2,
WANG Yu-guang2,
TAN Hong-ling2,
XIAO Cheng-rong2,
GAO Yue1,2
,
HU Chao2,
XU Long-long2,
MA Zeng-chun2,
LIANG Qian-de2,
TANG Xiang-lin2,
WANG Yu-guang2,
TAN Hong-ling2,
XIAO Cheng-rong2,
GAO Yue1,2

2. Institute of Radiation Medicine, Academy of Military Medical Sciences, Beijing 100850, China
参麦方由人参和麦冬两味中药组成,源于《症因脉治》的参脉饮,具有益气固脱、养阴补心等功效。临床上将其用于心血管疾病的治疗,具有抗氧化、抗心肌缺血、减少心肌耗氧量、强心升压等药理学功能[1-2]。阿霉素(doxorubicin,DOX)具有广谱的抗肿瘤活性,临床上广泛用于乳腺癌、卵巢癌、多发性骨髓瘤以及淋巴瘤等恶性肿瘤的治疗,然而,其固有的剂量依赖性及累积性的心脏毒性对患者产生了极大的副作用,使其应用受到限制[3-5]。有研究表明[6],参麦方可以有效减轻由阿霉素所引起的心肌损伤效应,为临床寻找有效的阿霉素所致心肌损伤保护药物提供了参考。本文从代谢组学角度[7]研究这种心肌损伤保护作用的物质基础,为探讨参麦配伍减毒增效、两药在体内的作用机制及临床合理用药提供依据。
1 材料与方法 1.1 药液的制备麦冬Ophiopogon japonicus(批号20110917),产地浙江慈溪;人参Panax ginseng(批号20110901),产地吉林。麦冬、人参药材由天津中医药大学提供。分别称取人参、麦冬500 g,粉碎成粗颗粒后浸泡0.5 h,8倍量水煎煮提取2次,每次1 h,提取液减压浓缩至500 mL,制成浓度为1 kg·L-1的人参药液和麦冬药液。参麦药液为两单药等比例煎煮药液,制备方法与单药制备方法相同。
1.2 试剂甲酸为分析纯,购自国药集团化学试剂有限公司;乙腈为色谱纯,购自Fisher Scientific公司;超纯水由Millipore制备;超氧化物歧化酶(SOD)测试盒、乳酸脱氢酶(LDH)测定试剂盒、丙二醛(MDA)测试盒购自南京建成生物工程研究所;注射用盐酸多柔比星(DOX)购自浙江海正药业股份有限公司(产品批号15006911)。
1.3 仪器Acquity UPLC-Synapt MS超高效液相色谱-质谱联用仪(Waters公司),包含MassLynx V4.1质谱工作站(Waters公司)、Acquity HSS T3 色谱柱(2.1 mm×100 mm,1.8 μm,Waters公司);冷冻离心机(Heraeus Labofuge 400R);纯水仪(Millipore Simplicity)。
1.4 动物与分组SD大鼠,♂,30只,清洁级,体质量(200±20)g,购自北京维通利华实验动物技术有限公司,动物品种合格证编号SCXK(京)2012-0001。饲养于军事医学科学院动物中心,给予标准饲料和饮用水,12 h日夜节律,室内温度为(22±1)℃,相对湿度为40%~50%。
将大鼠随机分为对照组、模型组、人参组、麦冬组和参麦组,每组6只。麦冬组灌胃麦冬水煎液,剂量为12 g·kg-1,人参组灌胃人参水煎液,参麦组灌胃参麦方,剂量为10 g·kg-1(均相当于人临床最大给药剂量的4倍),每日1次,连续给药14 d,对照组和模型组给予等体积的纯净水,每日1次,连续14 d。除对照组外,各组于灌胃给药3 d后开始注射DOX,隔天给药,每次3 mg·kg-1,累积剂量15 mg·kg-1[8],对照组注射等体积生理盐水。
1.5 样本的收集与制备将给药d 14的大鼠置于代谢笼中收集24 h尿液,尿样在4℃下3 000 r·min-1离心5 min,取上清进行分装,-80 ℃保存。分析前,取解冻后尿样100 μL,加入甲醇400 μL,涡旋2 min,过0.22 μm滤膜,置于进样小瓶中,用于UPLC/TOF-MS分析。
尿液收集完成后,腹股动脉取血,血样在4℃下3 000 r·min-1离心5 min得到血清样品,-80 ℃保存,用于血生化分析。同时,取心脏组织置于10%福尔马林溶液用于病理分析。
1.6 UPLC/TOF-MS条件采用Acquity HSS T3(2.1 mm×100 mm,1.8 μm)色谱柱,柱温30 ℃,样品室温度4 ℃,流速0.5 mL·min-1,进样量5 μL;流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈溶液;梯度洗脱条件:0~2 min,25%B;2~3 min,25%~30%B;3~17 min,30%~35%B;17~19 min,35%~25%B;19~20 min,25%B。
采用电喷雾电离离子源(ESI),正离子V模式检测:毛细管电压3 kV,锥孔电压3 kV,m/z范围50~1 500,脱溶剂气体流速900 L·h-1,锥孔气流量50 L·h-1,离子源温度100 ℃,脱溶剂温度450 ℃,质量校正质核比m/z 556.277 1;负离子V模式检测:毛细管电压2.9 kV,锥孔电压4 kV,m/z范围50~1 500,脱溶剂气体流速900 L·h-1,锥孔气流量50 L·h-1,离子源温度100 ℃,脱溶剂温度450 ℃,质量校正质核比m/z 554.261 5。
1.7 统计学分析质谱数据采用MassLynx 4.1软件(Waters公司)进行处理。消除背景噪音后,进行数据读取、色谱峰自动识别、峰对齐和归一化等处理,利用MakerLynx XS对色谱图分析,得到物质的保留时间、相对分子质量等信息。利用偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)和正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)对不同组之间的数据进行模式识别,通过散点图S-plot及VIP-plot结果,从VIP(变量投射重要性)>1且统计学差异P<0.05的变量中找出潜在的内源性标志物,结合本实验室质谱数据库、KEGG数据库(kyoto encyclopedia of genes and genomes)、HMDB数据库(human metabolome database),对标志物及涉及的相关代谢通路进行初步探讨,利用GraphPad软件进行绘图和数据统计学处理。
2 结果 2.1 尿液代谢轮廓分析采用UPLC/TOF-MS进行样本的分离以及数据的采集,Fig 1为大鼠尿液正、负离子模式下,各组总离子流基峰强度色谱图(base peak intensity chromatogram ,BPI)。由图可以看出,组与组之间的大鼠尿液代谢轮廓略有不同,而具体差异情况还需进行进一步的比较分析。
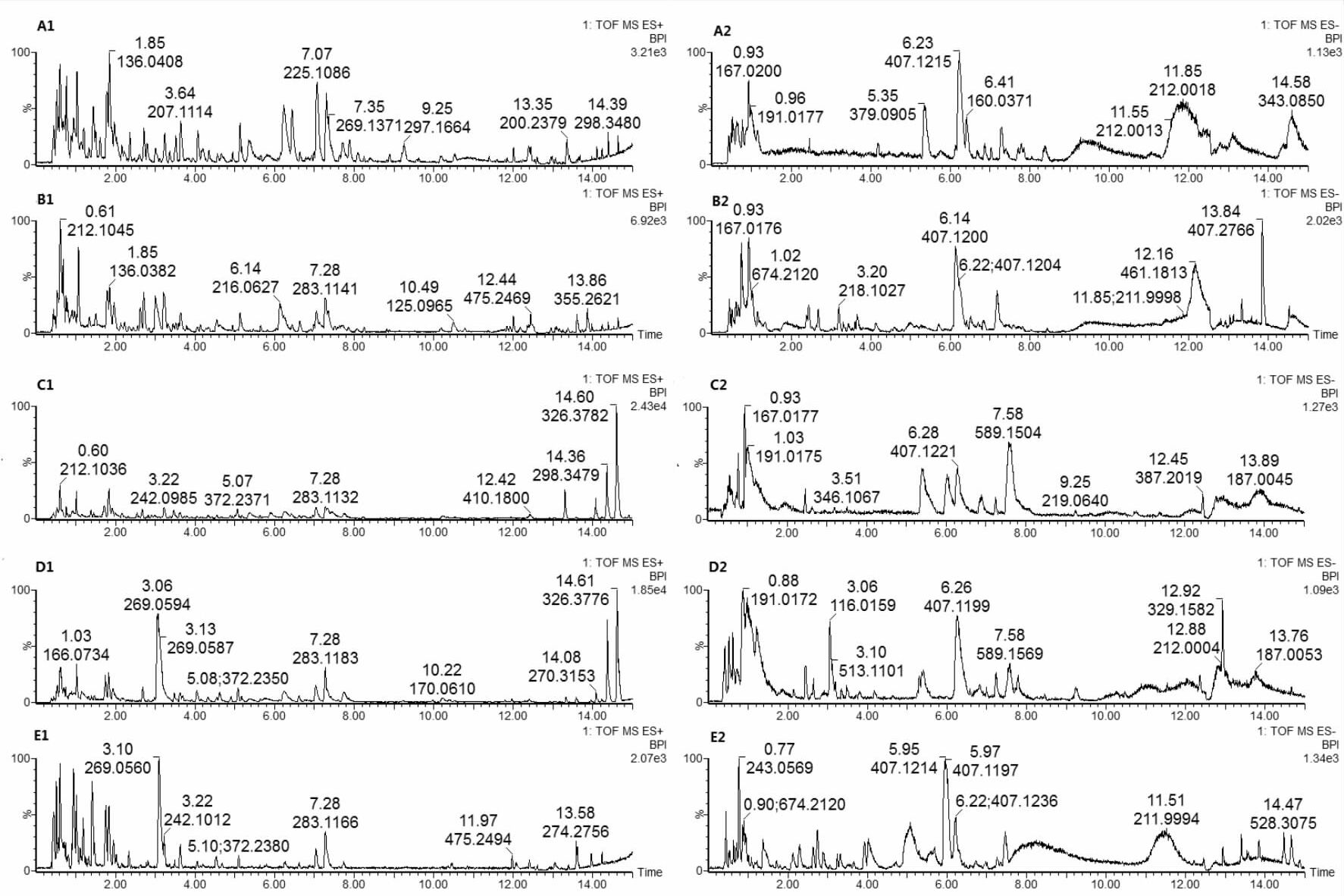
|
| Fig 1 Base peak intensity chromatograms in positive ion mode and negative ion mode in each group A:Control group; B:Model group; C:Ginseng group; D:Ophiopogon japonicus group; E:Shen-Mai group |
为研究给予参麦方后大鼠内源性物质代谢影响的大小,采用MakerLynx XS软件对数据进行组间PLS-DA分析,样品的分析结果如Fig 2和Fig 3所示。在PLS-DA图中,每1个点代表 1个样本,不同颜色代表不同的组别,从图中可以看出,对照组与其他各组在正、负离子模式下均得到了明显的区分,其他各组之间可以看出有所区别,说明各组之间存在差异。
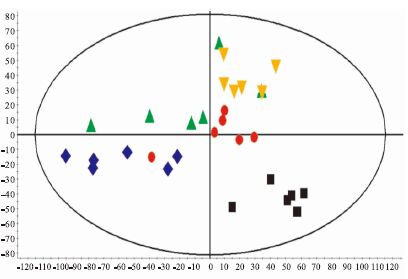
|
| Fig 2 PLS-DA score plot in positive ion mode from urine of rats ■ Control group;● Model group;▲ Ophiopogon japonicus group;♦ Ginseng group;▼ Shen-Mai group |
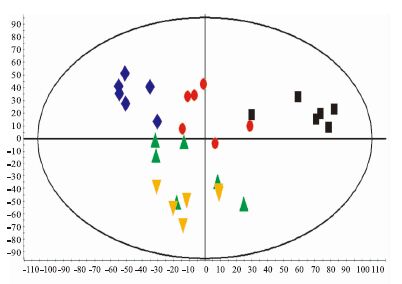
|
| Fig 3 PLS-DA score plot in negative ion mode from urine of rats ■ Control group;● Model group;▲ Ophiopogon japonicus group;♦ Ginseng group;▼ Shen-Mai group |
将对照组和模型组尿样数据进行正交偏最小二乘法判别分析(OPLS-DA),从中得出其S-plot及VIP-plot。选取S-plot两端具有明显差异,同时满足VIP > 1的变量,再用t检验对筛选到的差异变量进行验证,符合P<0.05的被认为是具有明显差异的化合物。结果在各组中找到14种具有明显差异的潜在标志物,结合本实验室质谱数据库、二级质谱、KEGG数据库、HMDB数据库作为辅助工具,鉴定出其中的14个化合物(Tab 1),各组中标志物含量相对变化情况见Fig 4。
| NO. | Mode | Retention time/min | m/z | VIP | Trend | Molecular formula | Chemical identity |
| 1 | ES+ | 10.55 | 269.1381 | 2.67 | ↓** | C10H13N5O3 | Deoxyadenosine |
| 2 | ES+ | 3.67 | 384.1147 | 3.52 | ↑** | C14H17N5O8 | Succinyladenosine |
| 3 | ES+ | 2.43 | 330.0602 | 3.01 | ↑** | C10H12N5O6P | Adenosine 2',3'-cyclic phosphate |
| 4 | ES- | 2.47 | 328.0443 | 2.99 | ↑** | C10H12N5O6P | Adenosine 2',3'-cyclic phosphate |
| 5 | ES- | 3.68 | 382.1002 | 2.79 | ↑** | C14H17N5O8 | Succinyladenosine |
| 6 | ES+ | 0.83 | 314.1234 | 3.38 | ↑** | C13H25NO2S2 | S-(3-methylbutanoyl)-dihydrolipoamide-E |
| 7 | ES- | 7.80 | 157.0860 | 2.40 | ↓** | C8H14O3 | cis-4-Hydroxycyclohexylacetic acid |
| 8 | ES- | 7.26 | 283.0803 | 4.68 | ↑** | C15H20N2O4 | Phenylbutyrylglutamine |
| 9 | ES+ | 3.49 | 297.1442 | 7.76 | ↓** | C14H26O4 | Tetradecanedioic acid |
| 10 | ES+ | 9.23 | 297.1674 | 5.30 | ↓** | C14H26O5 | 3-Hydroxytetradecanedioic acid |
| 11 | ES- | 7.41 | 113.0236 | 3.87 | ↑** | C4H4O | 3-Butyn-1-al |
| 12 | ES+ | 6.32 | 225.1114 | 4.23 | ↓** | C8H17NOS2 | Dihydrolipoamide |
| 13 | ES- | 7.40 | 175.0241 | 2.47 | ↑** | C3H4O3 | Pyruvic acid |
| 14 | ES+ | 1.40 | 271.1401 | 4.22 | ↓** | C12H11N7 | Triamterene |
| 15 | ES+ | 7.84 | 241.1055 | 4.65 | ↑** | C8H18N4O2 | Asymmetric dimethylarginine |
| 16 | ES- | 13.40 | 247.1331 | 2.52 | ↑** | C15H20O3 | Gamma-CEHC |
| **P<0.01 vs control group | |||||||
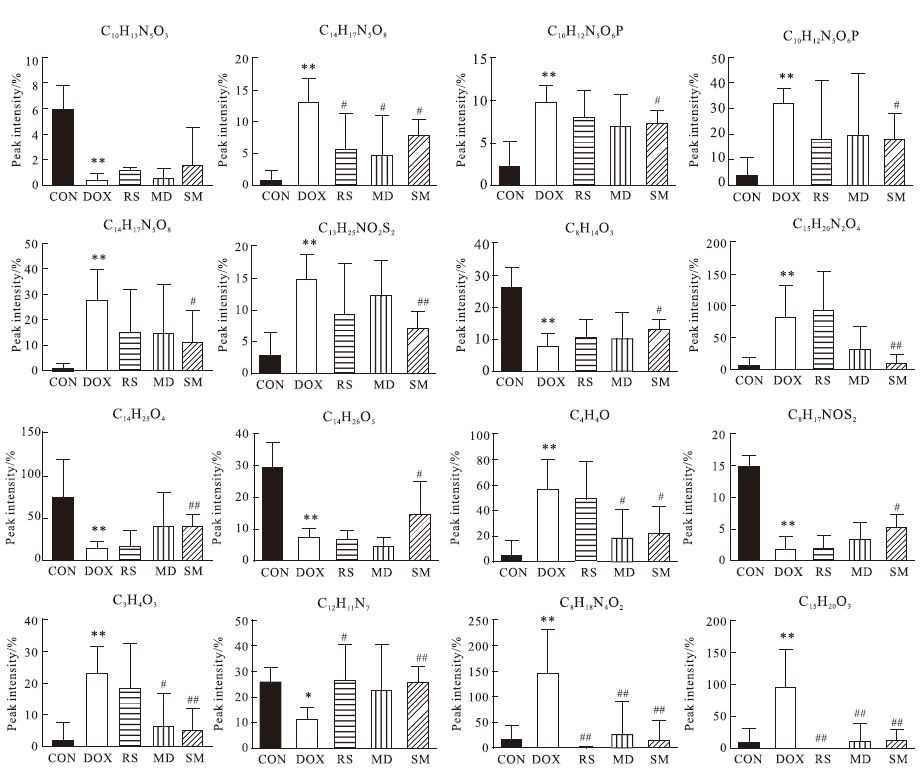
|
| Fig 4 The content changes of endogenous metabolites CON: Control group; DOX: Model group; RS: Ginseng group; MD: Ophiopogon japonicus group; SM: Shen-Mai group. *P<0.05,**P<0.01 vs control group; #P<0.05,##P<0.01 vs model group |
为验证阿霉素是否对心肌造成损伤以及参麦方复方和单方对心肌损伤的保护作用,测量大鼠各组血清的SOD、MDA及LDH含量。Tab 2结果显示,与对照组相比,模型组MDA及LDH含量明显增加(P<0.01),SOD活性明显降低(P<0.01)。人参组能够明显降低MDA与LDH含量,增加SOD的活性,而人参与麦冬合用后,效果更加明显,间接证明麦冬的加入刺激了人参中有效成分的溶出,两药合用起到增效作用。
| Group | SOD/kU·L-1 | MDA/μmol·L-1 | LDH/U·L-1 |
| Control | 262.9±17.4 | 3.83±0.15 | 147±52 |
| Model | 225.2±13.3** | 5.5±0.42** | 413±49** |
| RS | 235.6±14.7 | 4.28±1.03# | 245±87## |
| SM | 257.6±17.6## | 4.07±0.51## | 235±125## |
| MD | 228.1±12.1 | 4.38±1.29 | 277±122# |
| **P<0.01 vs control group;#P<0.05,##P<0.01 vs model group | |||
为验证阿霉素是否对心肌组织造成损伤,以及参麦方复方和单方对心肌损伤的保护作用,取大鼠心脏作病理切片,得到结果如Fig 5所示。结果显示,单独给予阿霉素后,出现部分区域带状心肌肥大,肌束变粗,心肌横纹不清,肌浆均质淡染,心肌间出血等病变(Fig 5B)。麦冬组(Fig 5D)与模型组差别并不明显,人参组(Fig 5C)较模型组心肌损伤略有减轻,而参麦组(Fig 5E)的心肌损伤明显改善。
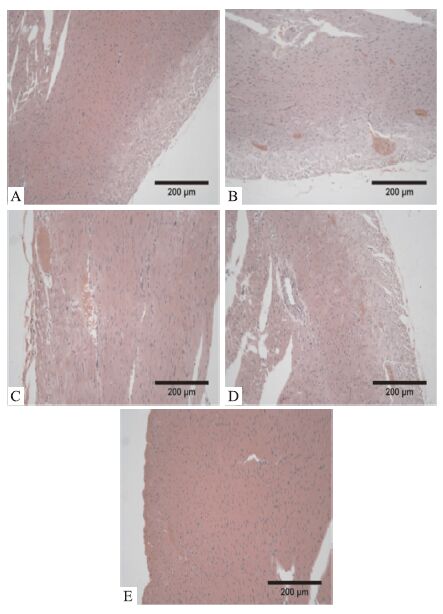
|
| Fig 5 Pathological variation of heart in rat after the treatment (HE×20) A:Control group; B:Model group; C:Ginseng group; D:Ophiopogon japonicus group; E:Shen-Mai group |
本研究采用UPLC/TOF-MS检测灌服参麦方的心肌损伤大鼠的尿液内源性代谢物变化,对参麦方在体内的物质基础、作用机制及两药配伍增效研究进行了初步探讨,经PLS-DA和OPLS-DA分析,共鉴定了14种相关的内源性标志物,涉及嘌呤代谢、缬氨酸、酪氨酸等氨基酸代谢、脂肪代谢、三羧酸循环等途径。
脱氧腺苷(deoxyadenosine)、环磷酸腺苷(adenosine 2′,3′-cyclic phosphate)和琥珀酰腺苷(succi-nyladenosine)是参与嘌呤合成与分解的重要物质,与其他分子共同调节着嘌呤代谢的正常运转[9]。模型组两物质含量明显改变,说明阿霉素引起了嘌呤代谢的紊乱,而其他给药组使得这种变化得以缓解,对嘌呤代谢起调节、稳定作用。
S-三甲基丁酰基二氢硫辛酰胺[S-(3-methylbutanoyl)-dihydrolipoamide-E]是合成缬氨酸、亮氨酸和异亮氨酸的中间体,这3种氨基酸可刺激骨骼肌蛋白质合成,促进骨骼肌葡萄糖的摄取,间接调节糖酵解中的丙酮酸脱氢酶,控制丙酮酸进入三羧酸循环[10]。阿霉素间接影响了这3种氨基酸的代谢与合成,而参麦方对这种改变起到了很好的调节作用。4-羟基环氧乙酸(cis-4-hydroxycyclohexylacetic acid)参与体内酪氨酸代谢,酪氨酸代谢的紊乱可能诱发酪氨酸血症,引起白化病、苯丙酮酸尿症、神经系统损害等多种疾病[11],参麦方有效地维持了由阿霉素引起的酪氨酸代谢异常,使机体保持稳定状态。
苯丁酰谷氨酰胺(phenylbutyrylglutamine)是苯基丁酸的次生代谢产物,苯基丁酸用于消除一些先天性疾病因子[12]。阿霉素诱发机体细胞凋亡,产生炎症,使得苯丁酰谷氨酰胺增多,参麦方提高了机体免疫力,有效抑制阿霉素所带来的细胞毒性,保护、修复了心肌细胞。丁酸甲酯(3-butyn-1-al)为丁酸代谢的中间产物,与十四烷二酸(tetradecanedioic acid)、3-羟基十四烯二酸(3-hydroxytetradecanedioic acid)共属于脂肪酸代谢范畴,心肌所需能量一部分来自游离的脂肪酸,另一部分能量由碳水化合物代谢提供[13],其含量的变化说明了参麦方对于心肌能量代谢起到调节作用。
丙酮酸(pyruvic acid)是糖类、蛋白质和脂肪三大代谢的中间体,其在线粒体内氧化脱羧生成乙酰CoA,进而进入三羧酸循环供机体利用。阿霉素破坏了细胞内线粒体功能,使线粒体损伤,进而造成丙酮酸堆积,影响机体正常代谢[14],参麦方对这种应激损伤起到了很好的保护作用。二氢硫辛酰胺(dihydrolipoamide)参与调节体内的糖酵解、糖异生、三羧酸循环、丙氨酸和天冬氨酸代谢等众多代谢通路的代谢,具有重要的生理意义。阿霉素对二氢硫辛酰胺的生成产生了较为明显的抑制,而参麦方也明显改善了这种抑制作用,对机体代谢的部分通路起到保护作用。
氨苯蝶啶(triamterene)给药后的上调对于促进尿液排放有积极作用[15],对于由心力衰竭、慢性肾炎引起的水肿有很好的治疗作用。二甲基精氨酸(asymmetric dimethylarginine)是内源性一氧化氮合酶抑制剂,可以通过多种机制导致内皮功能障碍,诱发疾病[16],模型组含量明显升高,对于机体产生不利影响,而参麦组将这种影响趋于正常水平。γ-生育酚(gamma-CEHC)是维生素E的代谢物,维生素E是体内重要的抗氧化剂,阿霉素的毒性作用使得机体产生大量自由基[17],参麦方通过协助机体清除自由基而发挥保护作用。
以上生物标志物以及相关代谢通路从体内代谢角度综合解释了参麦方保护由阿霉素所引起的心肌损伤的作用机制,验证了参麦方对于保护、修复心肌细胞,减少心肌耗氧量,增强细胞免疫力等方面的作用效果,同时也证明了人参与麦冬合用增效的配伍规律,为临床寻找有效的阿霉素所致心肌损伤保护药物提供了依据。
( 致谢: 本实验在军事医学科学院动物中心和军事医学科学院放射与辐射医学研究所完成,在此特别感谢参与本实验的所有老师和同学。 )
| [1] | 冯金红, 史强, 王毅, 等. 参麦方对缺血心肌组织蛋白S-亚硝基化的影响[J]. 中国中药杂志, 2008, 33 (15) : 1894-7. Feng J H, Shi Q, Wang Y, et al. Effects of Radix Ginseng and Radix Ophiopogonis extract (SMF) on protein S-nitrosylation in ischemic myocardial tissue[J]. Chin J Chin Mater Med, 2008, 33 (15): 1894-7. |
| [2] | 张红曦, 王宇光, 马增春, 等. 参麦注射液对大鼠心脏细胞色素P450酶的调节作用[J]. 中国药理学通报, 2014, 30 (4) : 484-90. Zhang H X, Wang Y G, Ma Z C, et al. Effect of Shenmai injection on the regulation of heart CYP450 isozymes in rats[J]. Chin Pharmacol Bull, 2014, 30 (4): 484-90. |
| [3] | Dolinsky V W, Roqan K J, Sung M M, et al. Both aerobic exercise and resveratrol supplementation attenuate doxorubicin-induced cardiac injury in mice[J]. Am J Physiol Endocrinol Metab,, 2013, 305 (2): 243-53. doi:10.1152/ajpendo.00044.2013 |
| [4] | Perez E A, Suman V J, Davidson N E, et al. Effect of doxorubicin plus cyclophosphamide on left ventricular ejection fraction in patients with breast cancer in the North Central Cancer Treatment Group N9831 Intergroup Adjuvant Trial[J]. J Clin Oncol, 2004, 22 (18): 3700-4. doi:10.1200/JCO.2004.03.516 |
| [5] | Akolkar G, Bhullar N, Bews H, et al. The role of renin angiotensin system antagonists in the prevention of doxorubicin and trastuzumab induced cardiotoxicity[J]. Cardiovasc Ultrasound, 2015, 13 : 18. doi:10.1186/s12947-015-0011-x |
| [6] | 陈丽, 马琍, 卢致辉, 等. 参麦注射液对阿霉素所致大鼠心肌损伤保护作用的实验研究[J]. 实用癌症杂志, 2003, 18 (2) : 129-31. Chen L, Ma L, Lu Z H, et al. Protection effect of Shenmai injection on the myocardium injury induced by adriamycin in rats[J]. Pract J Cancer, 2003, 18 (2): 129-31. |
| [7] | 周红光, 陈海彬, 王瑞平, 等. 代谢组学在中药复方研究中的应用[J]. 中国药理学通报, 2013, 29 (2) : 161-5. Zhou H G, Chen H B, Wang R P, et al. Metabonomics and its application in TCM formula study[J]. Chin Pharmacol Bull, 2013, 29 (2): 161-5. |
| [8] | You J S, Huang H F, Chang Y L, et al. Sheng-Mai-San reduces adriamycin-induced cardiomyopathy in rats[J]. Am J Chin Med, 2006, 34 (2): 295-305. doi:10.1142/S0192415X06003849 |
| [9] | Jiang H, Liu J, Wang T, et al. Mechanism of Xinfeng capsule on adjuvant-induced arthritis via analysis of urinary metabolomic profiles[J]. Autoimmune Dis, 2016, 1 : 1-10. |
| [10] | Li S J, Lin H, Qu C, et al. Urine and plasma metabonomics coupled with UHPLC-QTOF/MS and multivariate data analysis on potential biomarkers in anemia and hematinic effects of herb pair Gui-Hong[J]. J Ethnopharmacol, 2015, 21 (170): 175-83. |
| [11] | Xu T, Liu S, Zhao J, et al. A study on the effective substance of the Wu-tou formula based on the metabonomic method using UPLC-Q-TOF-HDMS[J]. Mol Biosyst, 2015, 11 (11): 3081-91. doi:10.1039/C5MB00454C |
| [12] | Kasumov T, Brunenqraber L L, Comte B, et al. New secondary metabolites of phenylbutyrate in humans and rats[J]. Drug Metab Dispos, 2004, 32 (1): 10-9. doi:10.1124/dmd.32.1.10 |
| [13] | Stanley W C, Lopaschuk G D, Hal J L, et al. Regulation of myocardial carbohydrate metabolism under normal and ischaemic conditions[J]. Cardiovasc Res, 1997, 33 (2): 243-57. doi:10.1016/S0008-6363(96)00245-3 |
| [14] | Zhang Y W, Shi J J, Li Y J, et al. Cardiomyocyte death in doxorubicin-induced cardiotoxicity[J]. Arch Immunol Ther Exp, 2009, 57 (6): 435-45. doi:10.1007/s00005-009-0051-8 |
| [15] | Tu W, Decker B S, He Z, et al. Triamterene enhances the blood pressure lowering effect of hydrochlorothiazide in patients with hypertension[J]. J Gen Intern Med, 2016, 31 (1): 30-6. doi:10.1007/s11606-015-3469-1 |
| [16] | Barber B E, William T, Grigg M J, et al. Asymmetric dimethylarginine in adult falciparum malaria: relationships with disease severity, antimalarial treatment, hemolysis, and inflammation[J]. Open Forum Infect Dis, 2016, 3 (1): 1-9. |
| [17] | Freiser H, Jing Q. Optimization of the enzymatic hydrolysis and analysis of plasma conjugated gamma-CEHC and sulfated long-chain carboxychromanols, metabolites of vitamin E[J]. Anal Biochem, 2009, 388 (2): 260-5. doi:10.1016/j.ab.2009.02.027 |