


2. 临床医学院,广西 南宁 530021
2. School of Clinical Medicine,Guangxi Medical University,Nanning 530021,China
吉非替尼(易瑞沙)是目前临床最常用的一种选择性表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs),适用于既往接受过化疗或不适于手术的晚期或转移性的非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者,但几乎所有对吉非替尼治疗有效的患者在一定时间的缓解期后会出现耐药、复发的现象[1],其机制尚不明确。
缝隙连接蛋白(connexins,Cxs)是一个多基因家族表达的保守蛋白,其组成的缝隙连接通信 (gap junction intercellular communication,GJIC)能连接沟通相邻细胞胞质直接传递电、化学及代谢物质,调控同步细胞活动、细胞增殖与凋亡、器官发育等[2],尤其与肿瘤化疗耐药密切相关。近年来发现,Cxs能独立于GJIC在肿瘤发生、发展中发挥重要作用[3]。目前已知,Cxs有21个亚型,它们的表达具有一定的组织特异性,正常肺组织主要表达Cx26、Cx43[4]。最近我们的研究发现[5],Cx26在吉非替尼耐药细胞HCC827 GR中明显升高,并且不依赖于GJIC,Cx26可与PI3K/Akt相互激活,从而诱导了NSCLC细胞EMT的发生,进而促进NSCLC对吉非替尼的耐药性。非常有趣的是,另一个在肺部分布的重要Cx亚型Cx43,在HCC827 GR中的表达明显降低,表现出与Cx26相反的变化。故本研究拟探索Cx43对NSCLC吉非替尼获得性耐药的影响,以阐明Cx43在NSCLC中吉非替尼获得性耐药的作用及可能的分子机制。
1 材料与方法 1.1 材料NSCLC细胞系HCC827购自美国ATCC;RPMI 1640培养基、胎牛血清和胰酶购自美国Gibco公司;吉非替尼(易瑞沙)购自英国AstraZeneca公司;MTT、嘌呤霉素、蛋白质提取试剂及鼠抗人Cx43多克隆抗体购自美国Sigma公司;BCA蛋白定量试剂盒购自Tiangen公司;兔抗人Cx43单克隆抗体购自Santa Cruz公司;兔抗人β-actin多克隆抗体、羊抗兔二抗、驴抗兔荧光二抗购自英国Abcam公司;兔抗人单克隆抗体Akt、兔抗人单克隆抗体 p-Akt(Ser473)购自美国CST公司;羊抗鼠二抗购自美国KPL公司。
1.2 方法 1.2.1 人NSCLC细胞HCC827培养、构建吉非替尼诱导耐药株HCC827GR 人NSCLC细胞HCC827、HCC827 GR用含10%胎牛血清、100 kU·L-1青霉素及100 mg·L-1链霉素的RPMI 1640培养基于37 ℃、5% CO2培养箱中常规培养、传代。在人NSCLC吉非替尼敏感细胞株HCC827的培养基中,按0.01、0.05、0.10、0.50、1.0 μmol·L-1浓度梯度逐步增加吉非替尼浓度,使用浓度为1.0 μmol·L-1的吉非替尼维持细胞耐药性,以构建吉非替尼诱导耐药株HCC827 GR。
1.2.2 MTT法检测吉非替尼对细胞的半数抑制浓度(IC50)取对数生长期的细胞以1×108·L-1的密度接种于96孔板,每孔100 μL,每组设3个复孔。吉非替尼以0.01、0.10、1.00、10.0、100.0 μmol·L-1浓度作用细胞,细胞培养96 h后,每孔加入0.5 mg·L-1的噻唑蓝20 μL,4 h后吸弃培养液,每孔加入150 μL DMSO,置摇床振荡10 min后,用酶标仪在波长570 nm处检测各孔吸光值(OD),以吉非替尼浓度为横坐标,OD570 nm为纵坐标,绘制曲线,求出IC50。
1.2.3 RT-PCR检测细胞系中Cx43的表达情况按照试剂说明书,从HCC827、HCC827 GR细胞提取总RNA并反转录成cDNA,RT-PCR检测Cx43的mRNA表达水平。扩增Cx43及GAPDH的上游引物和下游引物分别为:5′-AGGAGTTCAATCACTTGGCG-3′(sense)和5′-GCAGGATTCGGAAAATGAAA-3′ (antisense)、5′-AGCCACATCGCTCAGACA-3′(sense)和5′-GCCCAATACGACCAAATCC-3′ (antisense)。反应条件为:95 ℃ 5 min; 94 ℃ 45 s,58 ℃ 30 s,72 ℃ 45 s,30个循环;72 ℃ 5 min。用2-ΔΔCt法计算各组的mRNA相对表达量。
1.2.4 Western blot检测细胞系中Cx43和p-Akt的表达水平根据我们之前报道过的方法[6],收集各组细胞,加入1 mL预冷的RIPA裂解液(含1%PMSF)冰上裂解5 min,4 ℃、12 000×g离心30 min,取蛋白上清,用BCA蛋白定量试剂盒按照说明书严格操作,测定各组细胞株蛋白样品浓度。将蛋白样品20 μg经10%SDS-PAGE分离后转移到NC膜上,经5%脱脂牛奶(TBST稀释)室温封闭1 h后,分别加入鼠抗人Cx43多克隆抗体(1 ∶500)、兔抗人Akt单克隆抗体(1 ∶1 000)、兔抗人p-Akt单克隆抗体(1 ∶1 000),4 ℃过夜,兔抗人β-actin (1 ∶10 000)室温孵育1 h,TBST洗涤后,分别加入羊抗鼠二抗(1 ∶7 500)、羊抗兔二抗(1 ∶10 000),PBST洗涤后,Bio Rad凝胶成像系统采集图像,并以β-actin为内参对各细胞株Cx43及以Akt为内参对p-Akt条带进行灰度分析。
1.2.5 Parachute荧光示踪法检测细胞GJIC根据我们之前报道的方法[7],将各组细胞分别与荧光指示剂calcine-AM共同孵育,使calcine-AM进入细胞,该细胞称为“供体细胞”(donor cells)。再将donor cells接种到已生长融合至80%的相应组HCC827、HCC827 GR细胞(接受细胞,receiver cells)上,培养4 h。用GJ功能增强剂RA 10 μmol·L-1处理[8]相应组HCC827、HCC827 GR细胞,24 h后用PBS洗涤3次,将细胞分别与荧光指示剂calcine-AM共同孵育,并接种到相应的细胞上。待形成稳定的GJ后,小分子的calcine(发绿色荧光)就能通过GJ进入相邻的receiver cells。用荧光显微镜观察、计数1个donor cell周围含有calcine的receiver cell数目,作为GJ功能的指标。
1.2.6 免疫荧光法检测Cx43在细胞中的蛋白定位根据我们之前报道的方法[5],将细胞接种在盖玻片上24 h后,冰甲醇固定10 min,2%牛血清白蛋白室温封闭30 min,经兔抗人Cx43多克隆抗体(1 ∶50,PBS稀释)4 ℃孵育过夜后,用驴抗兔荧光二抗(1 ∶200,PBS稀释)于室温孵育1 h,接着用4′,6-二脒基-2-苯基吲哚(DAPI)复染。激光共聚焦扫描荧光显微镜(Nikon A1,Tokyo,Japan)采集成像,并用NIS-Elements软件进行分析。
1.2.7 统计学方法所有数据以x±s表示,采用SPSS 20.0统计软件进行统计学处理,组间差异比较采用单因素方差分析,多组间两两比较采用LSD检验。
2 结果 2.1 构建人NSCLC吉非替尼诱导耐药细胞株HCC827 GR从细胞株的表型特点可以看出,通过吉非替尼诱导,HCC827细胞失去上皮细胞特性而获得间质细胞特性,表现为由典型的上皮鹅卵石样变成散在的、细长的成纤维细胞样外形。MTT实验结果显示,HCC827的IC50值为(0.07±0.019) μmol·L-1(<1.0 μmol·L-1),HCC827 GR的IC50值为(10.84±0.021) μmol·L-1(>10 μmol·L-1)。上述结果表明,吉非替尼诱导耐药细胞株HCC827 GR已成功构建(Fig 1)。
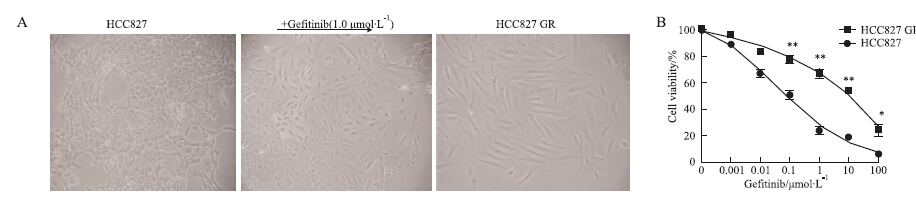
|
| Fig 1 Construction of gefitinib induced resistant HCC827 GR cells (x±s,n=5) A: The morphology of HCC827 and HCC827 GR cells; B: The gefitinib cytotoxicity in HCC827 and HCC827 GR cells.*P<0.05,**P<0.01 vs parental group |
RT-PCR琼脂糖凝胶电泳结果显示,HCC827 GR细胞中Cx43的mRNA表达量明显低于HCC827细胞(P<0.05),并且Western blot结果显示,HCC827 GR细胞中的Cx43蛋白表达量也较HCC827细胞明显降低(P<0.05)(Fig 2)。
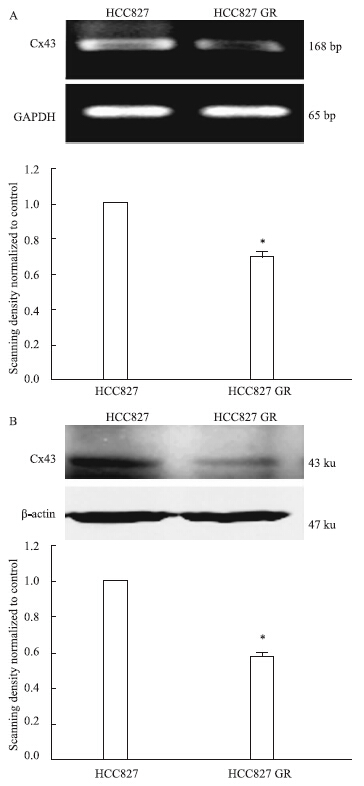
|
| Fig 2 mRNA and protein expression of Cx43 in HCC827 and HCC827 GR cells detected by RT-PCR and Western blot (x±s,n=3) A: The expression of Cx43 was detected in HCC827 and HCC827 GR cells through RT-PCR; B: The expression of Cx43 was detected in HCC827 and HCC827 GR cells through Western blot. *P<0.05 vs parental group |
Western blot结果显示,与亲本细胞HCC827相比,HCC827 GR细胞中的p-Akt蛋白表达量明显升高(P<0.05)。在HCC827 GR细胞上加PI3K的特异性抑制剂LY294002(25 μmol·L-1,24 h)后,p-Akt蛋白水平明显下降(P<0.01),且Cx43的蛋白水平明显升高(P<0.01)(Fig 3)。
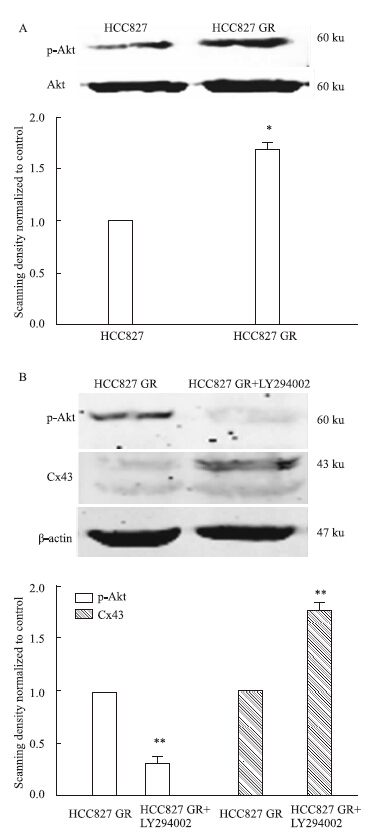
|
| Fig 3 The protein expressions of p-Akt (A) and Cx43 (B) detected by Western blot(x±s,n=3) *P<0.05,**P<0.01 vs parental group |
为研究NSCLC细胞中Cx43组成的GJIC是否与吉非替尼获得性耐药有关,我们用parachute法检测了HCC827、HCC827 GR的GJ功能。如Fig 4所示,以肺癌细胞NCI-H460作为阳性对照,在HCC827及HCC827 GR细胞中均未检测到荧光传递。为排除是否有难以检测到的GJIC存在,我们进一步用GJIC增强剂RA处理(10 μmol·L-1,24 h)上述细胞,亦未检测到荧光传递。这些结果表明,HCC827、HCC827 GR细胞中GJIC均缺失。
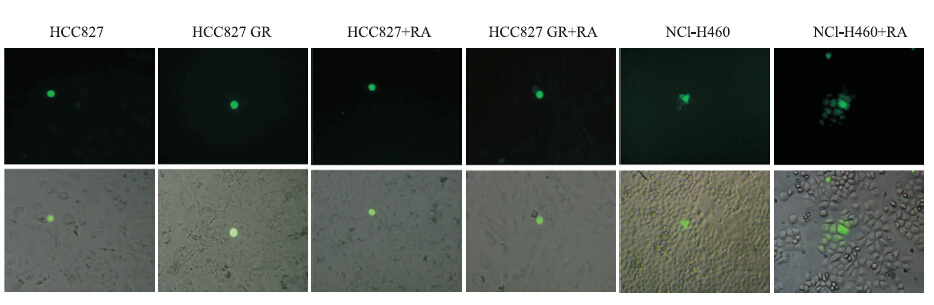
|
| Fig 4 GJIC in NCI-H460 as positive control was confirmed Functional GJIC was detected by parachute assay and no detectable GJIC was found in HCC827 and HCC827 GR cells. No enhancement of GJIC in these cells incubated with 10 μmol·L-1 of RA (a well-defined GJIC enhancer) for 24 h. Top: fluorescence images. Bottom: overlaid the corresponding phase-contrast images.Original magnification,×200 |
如Fig 5所示,绿色荧光为Cx43蛋白,蓝色荧光为DAPI染色的细胞核,Cx43在HCC827及HCC827 GR细胞中均主要表达在胞质,用GJIC增强剂RA处理(10 μmol·L-1,24 h)后,Cx43仍主要表达在2种细胞的胞质。
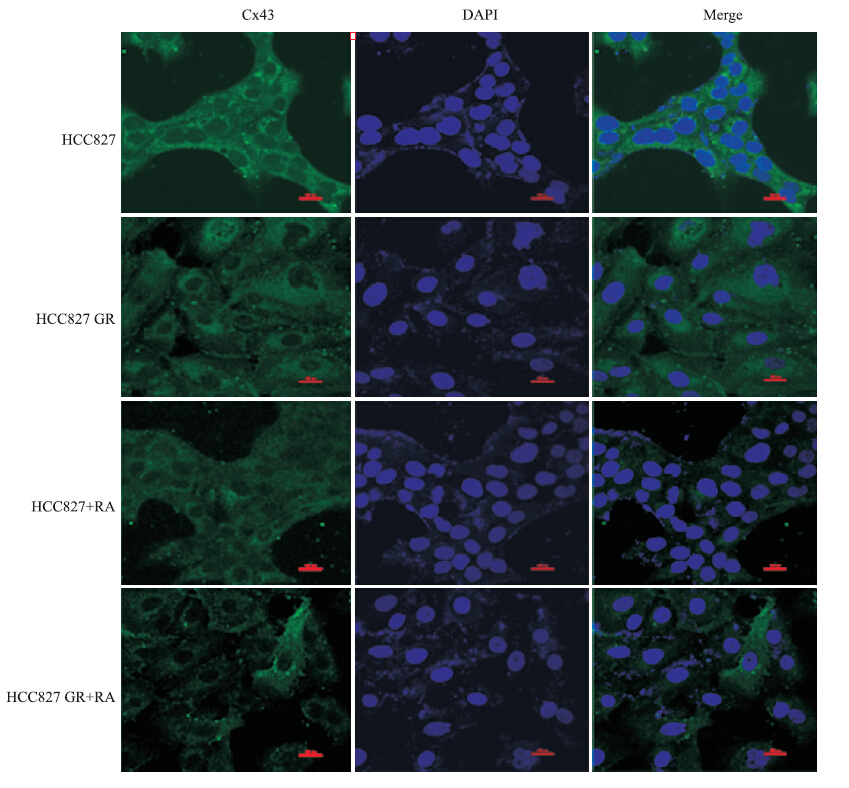
|
| Fig 5 Immunofluorescence staining of cellular localization of Cx43 with or without RA treatment All scale bars represent 50 μm |
肺癌是发病率、死亡率均居全球及我国第一位的恶性肿瘤。肺癌绝大多数起源于支气管黏膜上皮,80%为NSCLC。NSCLC早期诊断率极低,大多数患者确诊时已属晚期或发生转移,失去手术治疗的机会,需要化学药物治疗[9]。目前,临床常用于NSCLC的药物吉非替尼是第一个用于NSCLC治疗的分子靶向药物。目前已知,NSCLC患者对吉非替尼获得性耐药的主要机制有EGFR T790M突变(50%)[10]和MET扩增(20%)[11],但仍有约30%的NSCLC患者获得性耐药机制未知。因此,探索NSCLC对吉非替尼获得性耐药的机制对提高EGFR-TKIs临床疗效,改善NSCLC患者预后有重要意义。
大量研究表明,Cx及其组成的GJ在肿瘤发生发展中有密切的关系,大多数肿瘤发生发展过程中,常伴随着Cx表达及GJ功能的降低或缺失[12],如Cx32、Cx43蛋白在肝癌细胞中的表达水平及GJIC的明显降低可能与肝癌的发生密切相关[13]。长期以来,Cxs被认为是通过建立GJIC来增强肿瘤药物的敏感性。例如,Cx26蛋白的上调可以增强吉西他滨抗胰腺癌的疗效,且依赖于GJIC的功能[14];另一方面,GJIC功能的增强能够增强顺铂的细胞毒性作用[15]。然而,近年来一些研究表明,Cxs能够不依赖GJIC促进肿瘤化疗耐药。例如,Cx43可独立于GJIC,促进神经胶质瘤细胞对替莫唑胺的耐药性[16];Cx43可促进恶性间皮瘤对顺铂的耐药性,而与其GJIC无关[17]。我们最近的研究也发现,Cx26可独立于GJIC,与PI3K/Akt相互激活,从而诱导EMT,促进NSCLC吉非替尼耐药[5]。在本研究中,我们发现与亲本细胞HCC827相比,Cx43在HCC827 GR中的mRNA和蛋白表达明显降低,并且在亲本细胞HCC827和耐药细胞HCC827 GR中GJIC均缺失,Cx43蛋白均主要定位在胞质。这提示HCC827 GR细胞胞质中Cx43表达的下调可能与促进NSCLC吉非替尼的获得性耐药有关,并且GJIC不参与该过程。
最近研究发现,PI3K/Akt信号通路在EGFR-TKIs产生耐药性中也发挥重要作用[18]。PI3K/Akt通路的激活和HCC细胞发生EMT,从而对顺铂产生耐药有关[19];在头颈部鳞状细胞癌中,PI3K/Akt通路的激活能够使细胞对吉非替尼产生抗性[20]。在本研究中,我们发现,在HCC827 GR中Cx43蛋白减少的同时,p-Akt蛋白表达明显升高。进一步的研究发现,在HCC827 GR细胞上加PI3K特异性抑制剂后,能够明显抑制p-Akt蛋白的表达,且能够明显升高Cx43蛋白的表达。结合上述文献报道,我们推测,Cx43本身可能独立于GJIC,与PI3K/Akt之间形成负性调控,从而促进NSCLC细胞对吉非替尼的获得性耐药。但胞质中Cx43与PI3K/Akt之间的相互调控,还需进一步的深入研究。
综上所述,我们初步发现了Cx43在NSCLC吉非替尼获得性耐药中的作用及可能的分子机制,即Cx43是抑制NSCLC吉非替尼耐药的一个重要因素。这一发现将为深入了解Cx家族在肿瘤化疗耐药中的作用,以及寻找克服NSCLC分子靶向药物耐药的靶点,提供新的理论依据。
( 致谢: 感谢广西医科大学医学科学实验中心提供的实验条件和技术支持! )
| [1] | Engelman J A, Zejnullahu K, Mitsudomi T, et al. MET amplification leads to gefitinib resistance in lung cancer by activating ERBB3 signaling[J]. Science, 2007, 316 (5827): 1039-43. doi:10.1126/science.1141478 |
| [2] | Elias L A, Wang D D, Kriegstein A R, et al. Gap junction adhesion is necessary for radial migration in the neocortex[J]. Nature, 2007, 448 (7156): 901-7. doi:10.1038/nature06063 |
| [3] | 李艳燕, 张博, 韩峰, 等. 缝隙连接蛋白43研究进展[J]. 现代生物医学进展, 2012, 12 (19) : 3731-3. Li Y Y, Zhang B, Han F, et al. Progress on connexin 43[J]. Prog Mod Biomed, 2012, 12 (19): 3731-3. |
| [4] | Leithe E, Sirnes S, Omori Y, et al. Downregulation of gap junctions in cancer cells[J]. Crit Rev Oncog, 2006, 12 (3-4): 225-56. doi:10.1615/CritRevOncog.v12.i3-4 |
| [5] | Yang J, Qin G, Luo M, et al. Reciprocal positive regulation between Cx26 and PI3K/Akt pathway confers acquired gefitinib resistance in NSCLC cells via GJIC-independent induction of EMT[J]. Cell Death Dis, 2015, 6 (7): e1829. doi:10.1038/cddis.2015.197 |
| [6] | 阳洁, 覃贵慧, 陈军泽, 等. 慢病毒靶向干扰Cx26抑制人高转移性肝癌HCCLM3细胞增殖及迁移[J]. 中国药理学通报, 2014, 30 (7) : 937-41. Yang J, Qin G H, Chen J Z, et al. Inhibitory effect of lentivirus targeting interference Cx26 on proliferation and migration of human highly metastatic hepatocellular carcinoma HCCLM3 cells[J]. Chin Pharmacol Bull, 2014, 30 (7): 937-41. |
| [7] | 郑素平, 洪晓婷, 王琴, 等. 以siRNA表达载体稳定抑制缝隙连接蛋白43表达的睾丸间质细胞和睾丸支持细胞系的建立[J]. 中国药理学通报, 2010, 26 (10) : 1285-9. Zheng S P, Hong X T, Wang Q, et al. Establishment of Cx43-stably-downregulated leydig cell line and sertoli cell line by si RNA expression vector[J]. Chin Pharmacol Bull, 2010, 26 (10): 1285-9. |
| [8] | 蒋国君, 童旭辉, 祝晓光, 等. 在Hs578T乳腺癌细胞由Cx43组成的细胞缝隙连接对阿霉素细胞毒性的影响[J]. 中国药理学通报, 2012, 28 (5) : 641-7. Jiang G J, Tong X H, Zhu X G, et al. Influence of expression of Cx43 in breast cancer cells Hs578T on the cytotoxicity of adriamycin[J]. Chin Pharmacol Bull, 2012, 28 (5): 641-7. |
| [9] | Pao W, Chmielecki J. Biologically based treatment of EGFR-mutant non-small-cell lung cancer[J]. Nat Rev Cancer, 2010, 10 (11): 760-74. doi:10.1038/nrc2947 |
| [10] | Balak M N, Gong Y. Novel D761Y and common secondary T790M mutations in epidermal growth factor receptor–mutant lung adenocarcinomas with acquired resistance to kinase inhibitors[J]. Clin Cancer Res, 2006, 12 (21): 6494-501. doi:10.1158/1078-0432.CCR-06-1570 |
| [11] | Bean J, Brennan C, Shih J Y, et al. MET amplification occurs with or without T790M mutations in EGFR mutant lung tumors with acquired resistance to gefitinib or erlotinib[J]. Proc Natl Acad Sci USA, 2007, 104 (52): 20932-7. doi:10.1073/pnas.0710370104 |
| [12] | Mesnil M, Crespin S, Avanzo J L, et al. Defective gap junctional intercellular communication in the carcinogenic process[J]. Biochim Biophys Acta, 2005, 1719 (1): 125-45. |
| [13] | 马向东, 马兴, 隋延仿, 等. 肝癌细胞中connexin 32,connexin 43的表达及其与间隙连接通讯功能的相关性[J]. 临床与实验病理学杂志, 2002, 18 (2) : 189-92. Ma X D, Ma X, Sui Y F, et al. Expressions of connexin 32 and connexin 43 in human hepatocellular carcinoma cell lines and their effects on gap junctional intercellular communication[J]. J Clin Exp Pathol, 2002, 18 (2): 189-92. |
| [14] | Garcia-Rodríguez L, Pérez-Torras S, Carrió M, et al. Connexin-26 is a key factor mediating gemcitabine bystander effect[J]. Mol Cancer Ther, 2011, 10 (3): 505-17. doi:10.1158/1535-7163.MCT-10-0693 |
| [15] | Hong X, Wang Q, Yang Y, et al. Gap junctions propagate opposite effects in normal and tumor testicular cells in response to cisplatin[J]. Cancer Lett, 2012, 317 (2): 165-71. doi:10.1016/j.canlet.2011.11.019 |
| [16] | Gielen P R, Aftab Q, Ma N, et al. Connexin 43 confers temozolomide resistance in human glioma cells by modulating the mitochondrial apoptosis pathway[J]. Neuropharmacology, 2013, 75 (1): 539-48. |
| [17] | Sato H, Iwata H, Takano Y, et al. Enhanced effect of connexin 43 on cisplatin-induced cytotoxicity in mesothelioma cells[J]. J Pharmacol Sci, 2009, 110 (4): 466-75. doi:10.1254/jphs.08327FP |
| [18] | 刘姣, 李明春. P13K/Akt通路与表皮生长因子受体酪氨酸激酶抑制剂产生耐药性的关系研究进展[J]. 中国药理学通报, 2013, 29 (12) : 1648-50. Liu J, Li M C. PI3K/Akt signaling pathway and resistance to epithelial growth factor receptor tyrosine kinase inhibitors[J]. Chin Pharmacol Bull, 2013, 29 (12): 1648-50. |
| [19] | Jiao M, Nan K J. Activation of PI3 kinase/Akt/HIF-1alpha pathway contributes to hypoxia induced epithelial-mesenchymal transition and chemoresistance in hepatocellular carcinoma[J]. Int J Oncol, 2012, 40 (2): 461-8. |
| [20] | Maseki S, Ijichi K, Tanaka H, et al. Acquisition of EMT phenotype in the gefitinib-resistant cells of a head and neck squamous cell carcinoma cell line through Akt/GSK-3beta/snail signalling pathway[J]. Br J Cancer, 2012, 106 (6): 1196-204. doi:10.1038/bjc.2012.24 |

