


2. 福建医科大学基础医学院 生理学与病理生理学系,福建 福州 350108
2. Dept of Physiology and Pathophysiology,School of Basic Medical Sciences,Fujian Medical University,Fuzhou 350108,China
瞬时感受器电位(transient receptor potential,TRP) 超家族成员是机体内一类广泛分布的非选择性阳离子通道,以四聚体的形式发挥功能,每个亚基包含6个跨膜螺旋和胞内的N端和C端。根据序列同源性,这些通道可分为TRPC(Canonical)、TRPV(Vanilloid)、TRPM(Melastatin)、TRPP(Polycystin)、TRPA (Ankyrin)、TRPML(Muco-lipin)及TRPN(NOMP-C)7个亚家族,不同亚家族胞内区包含不同的保守结构域。TRP通道主要功能是使细胞感知周围环境变化,如在肿瘤细胞中是感受其微环境中多种物理(温度、渗透压或机械应力)或化学(pH、活性氧、氧分压、生长因子和细胞因子)刺激的关键因素。
Ca2+是细胞内广泛存在的第二信使,根据其所具有空间特异性和时间依赖性瞬时增加进而触发特定的细胞反应。激活细胞膜上 TRP超家族成员可引起胞质游离Ca2+浓度持续升高。肿瘤的发生和发展与细胞增殖、迁移和转移密切相关。细胞分裂增殖功能依赖于细胞外Ca2+,在G1期的开始、G1/S和G2/M两期转换间通过基础游离Ca2+升高或Ca2+瞬变增加参与细胞增殖和细胞周期进程[1]。细胞迁移是肿瘤细胞离开原发肿瘤侵袭其他组织的过程,是肿瘤转移的关键步骤。细胞转移包括细胞的变形、侵袭、迁移和黏附等过程,肿瘤细胞运动迁移行为发生改变是由于其骨架发育缺陷和黏附分子表达异常。已证明Ca2+参与转移的各个过程,包括细胞骨架和黏着斑(FA)组织,牵引力和方向感。
研究表明[2],前列腺癌发生与TRPV1、TRPV2、TRPV6、TRPM8、TRPM2和TRPC6有关,乳腺癌发生涉及TRPC1、TRPC3、TRPC6、TRPM7、TRPM8和TRPV6。在肺癌发生中TRPC1、TRPC3、TRPC6、TRPC4和TRPM8等发生变化。本文综述TRPC、TRPV和TRPM通道在肿瘤发生和发展中的作用,以及作为肿瘤诊断和预后标记的可能性。
1 TPRC与肿瘤TRPC亚家族的研究较多,包含TRPC1-7,其中人类TRPC2是假基因。TPRC可分为2组:① TRPC1/TRPC4/TRPC5是构成Ca2+池操纵性Ca2+通道(store-operated calcium channels,SOCC)的分子基础;② TRPC3/TRPC6/TRPC7是构成受体操纵性Ca2+通道(receptor-operated calcium channels,ROCC)的分子基础。ROCC和SOCC具有不同的激活机制。细胞因子或活性物质作用于胞膜上相应的受体,引起G蛋白偶联的磷脂酶C(PLC)激活,PLC可将磷酯酰肌醇二磷酸(PIP2)分解为三磷酸肌醇(IP3)和二酰甘油(DAG)。DAG诱发开放的非选择性阳离子通道被命名为ROCC,其介导的Ca2+内流称为ROCE(receptor-operated calcium entry)。IP3可触发胞内Ca2+池的耗竭,开放的另一种非选择性阳离子通道被命名为SOCC,其介导的Ca2+内流称为SOCE(store-operated calcium entry)[3]。SOCE的启动与内质网上的基质相互作用分子1(stromal interacting molecule,STIM1)和胞膜上的Orai蛋白(第一种被发现介导SOCC的蛋白)密切相关,过程如下:肌浆网/内质网上的STIM1可以感受IP3等引起的Ca2+池耗竭的信号而活化,活化的STIM1在肌浆网/内质网膜上移位、聚集,通过静电作用与胞膜上Orai通道耦合形成高分子复合体通道,介导SOCE;此外,TRPC1/TRPC4/TRPC5等也参与介导SOCE[4],它们与STIM、Orai蛋白一起被称为Ca2+池操纵Ca2+内流复合体(store-operated calcium influx complex)[5]。
1.1 STIM/Orai和TRPC1/TRPC4/TRPC5SOCE分子组成(如STIM、Orai和TRPC1/TRPC4/TRPC5)的表达水平在不同类型肿瘤上存在差异,大量证据支持SOCE参与肿瘤细胞的细胞周期进程、增殖、迁移、转移和逃避细胞凋亡,以及STIM和SOCC可作为肿瘤预后或治疗策略合适的候选目标。
1.1.1 STIM/Orai研究发现,耐药卵巢癌细胞中Orai1、STIM1和SOCE表达增强[6]。此外,相比结直肠癌、宫颈癌、肝癌、肺癌和肾透明细胞癌患者的癌前病变组织,也发现肿瘤组织中STIM1或Orai1过表达[7]。敲除或用药物抑制STIM1-Orai1能有效地抑制乳腺癌、结直肠癌、宫颈癌、肝癌、鼻咽癌、表皮样囊肿、胶质瘤、 黑色素瘤和肾透明细胞癌细胞的增殖和转移[8]。提示STIM/Orai1介导的SOCE通路的靶向治疗有潜在的抗癌和治疗价值。
SOCE调控肿瘤细胞增殖和迁移的分子机制[9]可以概括如下:① 敲低STIM1抑制SOCE将导致p21上调,细胞周期因子Cdc25C、cyclin E、cyclin D、CDCK2和CDCK4等下调,引起细胞周期阻滞;② 敲低STIM1或Orai1,抑制SOCE会损伤黏着斑翻转,导致细胞迁移。其可能的调节过程:钙调节蛋白酶、胞质激酶Pyk2、小GTP酶Ras和Rac都是黏着斑调节剂,SOCE表达异常导致钙调节蛋白酶和胞质激酶Pyk2激活,调节迁移性宫颈癌细胞的黏着斑动态。Ras和Rac组成性表达激活可以挽救黏着斑翻转以及由于抑制SOCE而导致乳腺癌细胞迁移的缺陷;③ 增强环氧合酶-2(COX-2)的表达和前列腺素E2(PGE2)的分泌,会使STIM1过表达,导致SOCE增强,进而促进结肠癌细胞迁移。钙依赖性转录因子NFAT在这一过程中也发挥重要作用。
1.1.2 TRPC1/TRPC4/TRPC5TRPC1介导的Ca2+内流可明显增强依赖表皮生长因子(EGF)的细胞增殖,调节过程如下:刺激表皮生长因子受体(EGFR)可引起TRPC1依赖的Ca2+内流,而TRPC1介导的Ca2+内流又能反过来增强EGFR自身磷酸化和活性。TRPC1通过EGFR磷酸化和EGF激活所诱导的磷脂酰肌醇-3-激酶 (phosphoinositide 3-kinases,PI3K)/Akt和MAPK下游信号通路来调控增殖。敲低TRPC1,使内皮祖细胞停滞在G0/G1期或使胶质瘤细胞中产生不完全分裂,引起细胞生长抑制[10]。
TRPC1和TRPC4的表达与非小细胞肺癌(NSCLC)的分化程度相关,NSCLC中RNAi耗竭TRPC1可诱导细胞阻滞在G0/G1期,明显减缓细胞生长[11]。Englerin A是一种从植物中分离得到倍半萜,对肾癌细胞表现出很高的活性抑制和选择性。研究发现,englerin A激活钙离子内流和膜去极化都需依赖TRPC4 或TRPC5的表达,而TRPC4和TRPC5作为englerin A细胞效能目标可以导致癌细胞生长抑制[12]。TRPC1也有引起肿瘤细胞迁移的作用,TRPC1在几种人脑胶质瘤细胞系中表达,通过EGF介导定向迁移,TRPC1药理抑制剂和RNAi耗竭TRPC1表达,会影响EGF介导的趋化迁移[13]。肺癌细胞系A-549细胞中TRPC1静默明显降低毒胡萝卜素诱导的SOCE,提示在A-549细胞中TRPC1介导SOCE。恶性脑胶质瘤中,中断脂筏会损害TRPC1电流,减少SOCE并抑制肿瘤细胞趋化性迁移[14]。在长期化疗的乳腺癌中可以观察到TRPC5高表达,其介导下游低氧诱导因子1α(HIF-1α)在核内累积,激活促进肿瘤血管生成的血管内皮生长因子的转录,导致肿瘤迁移增加,降低化疗效果[15]。
1.2 TRPC3/TRPC6TRPC3和TRPC6是ROCE的分子基础,而ROCE是胞外激动剂和PLC通路激活过程中非常重要的效应器。多不饱和脂肪酸(PUFA)调节TRPC3的活性,是乳腺癌细胞中调节Ca2+通道的新方法[14]。研究表明,卵巢上皮性肿瘤中TRPC3表达升高,而其沉默将降低卵巢癌细胞株体外增殖和减缓肿瘤在体内形成[16]。与良性前列腺增生相比,前列腺癌组织中介导ROCE的TRPC6 蛋白和mRNA表达明显增加,而α1-肾上腺素受体(AR)通过TRPC6依赖性Ca2+内流激活NFAT通路,可促进原发性前列腺癌上皮增殖,反义TRPC6沉默可以降低上述作用,表明TRPC6可以调控细胞增殖和NFAT通路。TRPC6还参与儿茶酚胺的促有丝分裂作用。TRPC6在肝癌、胃癌、食道癌和脑胶质瘤中表达升高,TRPC6 siRNA将肿瘤细胞阻滞在G2/M期,明显抑制胶质瘤细胞系、食管癌和乳腺癌的增殖[17-18]。
乳腺癌上皮细胞系MDA-MB-231 中,TRPC3和TRPC6通道形成异源多聚体被激活,可以应答PIP2水解激动剂并调节细胞增殖。TRPC3和TRPC6的表达也与NSCLC的分化程度相关[11]。乳腺癌细胞MCF-7上也发现TRPC1和TRPC6 形成的异源多聚体阳离子通道。此外,人类乳腺导管癌(HBDA)组织中TRPC1和TRPC6高水平表达[18],与Scarff-Bloom-Richardson(SBR)分级、Ki-67增殖指数和肿瘤的大小相关。TRPC1介导的胞质游离Ca2+浓度升高激活钙依赖钙调蛋白(CAMK),CAMK引起ERK的磷酸化,并通过细胞周期蛋白D1(cyclin D1)调节MCF-7细胞增殖[19]。利用T1E3和T367E3抗体封闭A549细胞孔隙,能特异性抑制 TRPC1和TRPC6以降低细胞的有丝分裂,进而抑制A549细胞增殖,反之TRPC1和TRPC6过表达可增加细胞增殖。
2 TRPV和肿瘤TRPV通道蛋白由6个成员组成,可分为3组:① TRPV1/TRPV2/TRPV4。TRPV1 是一种感觉效应器通道;TRPV2可以被热、机械应力和生长因子激活;TRPV4是具有一定离子选择性的外向整流阳离子通道,能感受胞外渗透压的变化,当胞外渗透压降低时,TRPV4 通道开放;② TRPV3。TRPV3是一种温度感受器通道,当温度从22 ℃升高到40 ℃时开放,对Ca2+的通透性较高;③ TRPV5/6。TRPV5和TRPV6通道具有高度的Ca2+选择性,通道电流具有很强的内向整流特性。
2.1 TRPV2/TRPV4Akt信号通路在维持细胞存活和增殖过程中具有关键作用,PI3K介导的信号通路调节细胞的增殖、分化、凋亡等活动,都与人类多种恶性肿瘤密切相关。TRPV4通过调控Akt蛋白磷酸化来抑制肝星状细胞(HSC)的活化增殖,在肝纤维化和肝癌的进展中发挥作用[20]。溶血磷脂、溶血磷脂酰胆碱(LPC)、溶血磷脂酰肌醇(LPI)和肾上腺髓质素(AM)可以激活PI3K信号通路,使TRPV2易位到胞膜,升高胞质Ca2+浓度,通过黏着斑激酶(FAK)磷酸化,导致黏附松动或减少,反过来促进了前列腺癌PC3细胞迁移或侵袭[21-22](Fig 1)。
转移性前列腺癌肿瘤样本中的TRPV2表达水平高于非转移的肿瘤样本和原发肿瘤,体外实验中雄激素剥夺诱导TRPV2表达,细胞静息Ca2+增加,迁移作用增强,表明TRPV2在迁移和侵袭中发挥作用。此外,抑制TRPV2降低了肿瘤的大小和许多入侵标志物的表达。提示TRPV2可能是雄激素非依赖性的侵略型前列腺癌的靶点[22]。
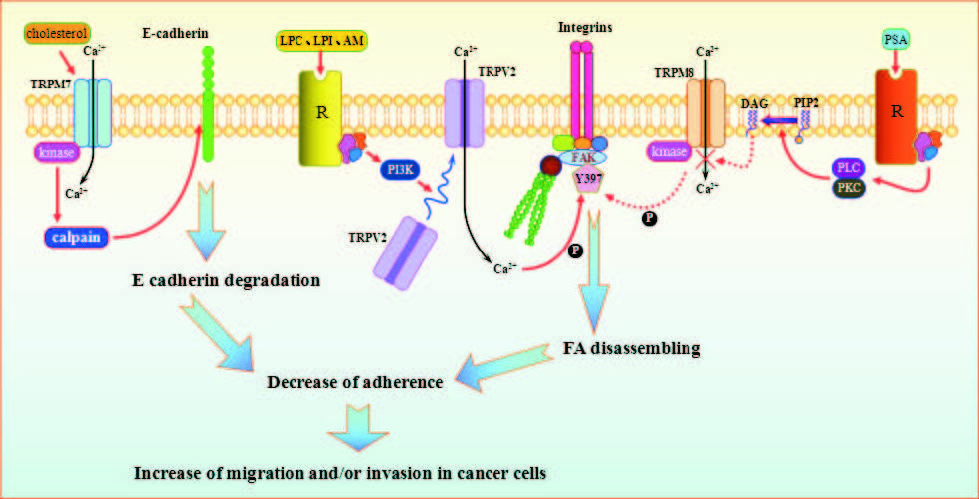
|
| Fig 1 TRPV2,TRPM7 and TRPM8 involved in intracellular calcium increase link to migration in cancer cells(plotted by reference 2) Lysophosphatidylcholine(LPC) and lysophosphatidylinositol(LPI),adrenomedullin(AM),focal adhesion kinase(FAK),phosphorylation of FAK(Y397),focal adhesion(FA),prostate specific antigen(PSA),phosphoinositide 3-kinases(PI3K),diacylglycerol(DAG),protein kinase C(PKC),phospholipase C(PLC),phosphatidylinositol(4,5)bisphosphate(PIP2). |
TRPV4作为乳腺癌血管生成的一个重要组成部分,在乳腺癌来源的内皮细胞中的表达明显高于人微血管内皮细胞,高表达的TRPV4可以促进钙离子内流和细胞迁移。研究发现[23],TRPV4特异性激动剂GSK1016790A与化疗药物顺铂联合应用,通过TRPV4活化促使肿瘤血管形成与成熟,可明显抑制肺癌的生长。TRPV4还可以通过调节细胞骨架结构以控制肝癌细胞的侵袭转移。此外研究还发现TRPV4在胰腺癌、结直肠癌和胃癌中表达上调,在食管癌、前列腺癌中表达下调[24]。
2.2 TRPV6前列腺癌细胞中TRPV6介导的SOCE,并非通过激活STIM1,而是通过Orai1/TRPC1介导的Ca2+/Annexin I/S100A11通路激活,将通道转位到胞膜,增加Ca2+内流,对SOCE产生作用[25]。此外,过表达的TRPV6通过细胞内信号通路GSK3β、MAP激酶和Akt,参与前列腺癌细胞PC-3和乳腺癌细胞MCF-7细胞的增殖。其中,在TRPV6过表达的PC3细胞诱导的肿瘤中可检测到cyclin D1、CDK4和PCNA等细胞周期标记物[25]。
Ca2+与细胞存活率有关,可以促进G1期向S期转换。敲低TRPV6减少Ca2+内流,使S期细胞的百分数明显减少,引起24 h内细胞积累在G1期[1]。TRPV6静默可减少基础Ca2+内流,使乳腺癌细胞系内源性基因表达增加[26]。此外,在T47D乳腺癌细胞中,TRPV6 不表达则肿瘤细胞存活率降低,雌激素增加则TRPV6 mRNA表达增加。
TRPV6也被认为是恶性肿瘤进展和侵袭力的预测标志,在晚期前列腺癌中TRPV6 mRNA高表达,与格里森N7级(gleason N7 grading)相关。研究表明,相比正常和良性上皮细胞(PREC,Bph1),TRPV6 mRNA在人前列腺癌细胞株(LNCaP和PC3)中表达增加[26]。TRPV6的迁移和侵袭作用使其在甲状腺、结肠癌和卵巢癌中的肿瘤侵袭部位高表达[18]。
3 TRPM和肿瘤TRPM通道蛋白亚家族有8个成员,根据同源性分为4 组:① TRPM1 /TRPM3。TRPM1可能与黑色素瘤细胞有关;TRPM3 通道可能参与调节肾脏渗透压平衡;② TRPM6/TRPM7。TRPM6和TRPM7对Ca2+和Mg2+都有通透性,对细胞内Ca2+平衡起关键作用。TRPM7还受机械刺激调节;③ TRPM2/TRPM8。在表达TRPM2的人胚肾细胞中,二磷酸腺苷核糖核苷(adenosine2dip hosp hate ribose,ADP2ribose) 能激活TRPM2 通道,导致Ca2+内流。TRPM8遇冷后被激活,胞外Ca2+进入神经元,并诱发动作电位,并对细胞内pH值敏感;④ TRPM4/TRPM5。TRPM4和TRPM5的开放依赖于胞内Ca2+浓度的升高,并受电压调节。目前认为,TRPM5主要介导甜和苦这两种味觉的传递,在舌、胃、小肠中表达较高。TRPM与肿瘤的关系研究目前多集中于TRPM7和TRPM8(Fig 1)。
3.1 TRPM7TRPM7的独特在于其非典型丝氨酸/苏氨酸激酶结构域和其对Ca2+和Mg2+通透性。正常细胞和前列腺癌细胞中TRPM7均有表达,增加细胞外Ca2+/Mg2+比会导致前列腺癌细胞较正常细胞增殖明显增加[27],但TRPM7的表达不依赖于Ca2+/Mg2+比本身。同组实验显示,胆固醇激活TRPM7通道并增加细胞内Ca2+水平,不仅提高了TRPM7表达,还可诱导Akt和(或)活化ERK通路,促进前列腺癌细胞的增殖[28]。TRPM7在MCF-7乳腺癌细胞增殖中发挥作用,其过表达可能提示是高级别和高增殖的乳腺癌。
TRPM7高表达与多种肿瘤侵袭性标志物密切相关,循环中高胆固醇水平已被证明增加前列腺癌整体侵袭性风险。胆固醇激活TRPM7通道增加了基础Ca2+浓度,刺激钙依赖蛋白(钙蛋白酶,Calpain),降低了钙黏附蛋白E(E-cadherin)的表达[28],调节前列腺癌细胞的迁移(Fig 1)。TRPM7由于其激酶活性(MAPK通路的激活和细胞黏附调节)中钙依赖的方式,在乳腺癌细胞中也调节细胞迁移和转移[27]。在对照或EGF激活条件下,抑制TRPM7可降低乳腺癌细胞迁移[29]。
3.2 TRPM8TRPM8沉默和薄荷醇介导的TRPM8激活[30]都可以降低前列腺癌细胞株LNCaP细胞活力,体现了Ca2+信号作为治疗前列腺癌细胞潜在的药物活化剂和抑制剂的双重性,与Ca2+是细胞增殖的重要调节因子,也是Ca2+超载情况下细胞死亡的引发剂一致。在LNCaP细胞中应用TRPM8受体拮抗剂辣椒素和TRPM8 siRNA后,发现该通道是细胞生存所必需的,但没有证据显示其对细胞增殖有影响[31]。
TRPM8是冷觉传感通道,因温度变化或薄荷醇的存在发生反应,还可能发挥ROCC作用,与细胞迁移密切相关。前列腺特异性抗原(PSA)作用于缓激肽受体2,引起TRPM8在胞膜内聚集,增加胞内Ca2+,维持黏着斑稳定,通过降低FAK磷酸化起限制迁移作用[7](Fig 1),TRPM8是TRP家族中唯一具有前列腺癌保护作用的通道。研究表明,雄激素敏感的LNCaP细胞中TRPM8增加,是癌细胞系中激素介导Ca2+通道表达变化的首个例子[32]。除胞膜上的TRPM8在肿瘤进展中发挥作用外,还可以在LNCaP细胞内质网中观察到TRPM8,使内质网Ca2+水平降低,抗凋亡性增加。TRPM8过表达与黑色素瘤、胰腺癌、结肠癌和肺癌有关,也与多种肿瘤侵袭性标志物密切相关[33]。
4 结语到目前为止,虽然对TRPC、TRPV和TRPM通道参与肿瘤的增殖和迁移作用有一定了解,但所研究的肿瘤类型多局限于欧美高发的前列腺癌、乳腺癌和肺癌等,对于我国高发的消化道癌症,如结肠癌、胃癌、食道癌等研究资料仍较少,有关TRP 参与肿瘤细胞增殖、迁移和转移的分子学机制,以及TRP家族各成员是否全部参与肿瘤发生发展过程等还未完全阐明,仍有许多问题尚待我们进一步去解决。
| [1] | Kim S Y, Yang D, Myeong J, et al. Regulation of calcium influx and signaling pathway in cancer cells via TRPV6-Numb1 interaction[J]. Cell Calcium, 2013, 53 (2): 102-11. doi:10.1016/j.ceca.2012.10.005 |
| [2] | Deliot N, Constantin B. Plasma membrane calcium channels in cancer: alterations and consequences for cell proliferation and migration[J]. Biochim Biophys Acta, 2015, 1848 (10 Pt B): 2512-22. |
| [3] | Lin M J, Leung G P, Zhang W M, et al. Chronic hypoxia-induced upregulation of store-operated and receptor-operated Ca2+ channels in pulmonary arterial smooth muscle cells: a novel mechanism of hypoxic pulmonary hypertension[J]. Circ Res, 2004, 95 (5): 496-505. doi:10.1161/01.RES.0000138952.16382.ad |
| [4] | 穆云萍, 焦海霞, 朱壮丽, 等. 慢性低氧大鼠TRPC1表达与肺动脉收缩变化时间曲线关系[J]. 中国药理学通报, 2014, 30 (12) : 1667-71. Mu Y P, Jiao H X, Zhu Z L, et al. Relationship of time-course curve between the expression of TRPC1 and vascular tone of pulmonary arteries in chronic hypoxia pulmonary hypertension rats[J]. Chin Pharmacol Bull, 2014, 30 (12): 1667-71. |
| [5] | 刘青, 林默君. 钙池操纵性钙通道的激活信号分子与肺动脉高压[J]. 中国动脉硬化杂志, 2012, 20 (3) : 273-7. Liu Q, Lin M J. Pulmonary artery hypertension and signaling molecules in activation of store-operated calcium channels[J]. Chin J Arterioscler, 2012, 20 (3): 273-7. |
| [6] | Schmidt S, Liu G, Liu G, et al. Enhanced Orai1 and STIM1 expression as well as store operated Ca2+ entry in therapy resistant ovary carcinoma cells[J]. Oncotarget, 2014, 5 (13): 4799-810. doi:10.18632/oncotarget |
| [7] | Kim J H, Lkhagvadorj S, Lee M R, et al. Orai1 and STIM1 are critical for cell migration and proliferation of clear cell renal cell carcinoma[J]. Biochem Biophys Res Commun, 2014, 448 (1): 76-82. doi:10.1016/j.bbrc.2014.04.064 |
| [8] | Jardin I, Rosado J A. STIM and calcium channel complexes in cancer[J]. Biochim Biophys Acta, 2016, 1863 (6 Pt B): 418-26. |
| [9] | Xie J, Pan H, Yao J, et al. SOCE and cancer: recent progress and new perspectives[J]. Int J Cancer, 2016, 138 (9): 2067-77. doi:10.1002/ijc.v138.9 |
| [10] | Tajeddine N, Gailly P. TRPC1 protein channel is major regulator of epidermal growth factor receptor signaling[J]. J Biol Chem, 2012, 287 (20): 16146-57. doi:10.1074/jbc.M112.340034 |
| [11] | Jiang H N, Zeng B, Zhang Y, et al. Involvement of TRPC channels in lung cancer cell differentiation and the correlation analysis in human non-small cell lung cancer[J]. PLoS One, 2013, 8 (6): e67637. doi:10.1371/journal.pone.0067637 |
| [12] | Carson C, Raman P, Tullai J, et al. Englerin A agonizes the TRPC4/C5 cation channels to inhibit tumor cell line proliferation[J]. PLoS One, 2015, 10 (6): e127498. |
| [13] | Bomben V C, Sontheimer H W. Inhibition of transient receptor potential canonical channels impairs cytokinesis in human malignant gliomas[J]. Cell Prolif, 2008, 41 (1): 98-121. doi:10.1111/j.1365-2184.2007.00504.x |
| [14] | Bomben V C, Turner K L, Barclay T T, et al. Transient receptor potential canonical channels are essential for chemotactic migration of human malignant gliomas[J]. J Cell Physiol, 2011, 226 (7): 1879-88. doi:10.1002/jcp.v226.7 |
| [15] | Zhu Y, Pan Q, Meng H, et al. Enhancement of vascular endothelial growth factor release in long-term drug-treated breast cancer via transient receptor potential channel 5-Ca2+-hypoxia-inducible factor 1alpha pathway[J]. Pharmacol Res, 2015, 93 : 36-42. doi:10.1016/j.phrs.2014.12.006 |
| [16] | Yang S L, Cao Q, Zhou K C, et al. Transient receptor potential channel C3 contributes to the progression of human ovarian cancer[J]. Oncogene, 2009, 28 (10): 1320-8. doi:10.1038/onc.2008.475 |
| [17] | Ding X, He Z, Zhou K, et al. Essential role of TRPC6 channels in G2/M phase transition and development of human glioma[J]. J Natl Cancer Inst, 2010, 102 (14): 1052-68. doi:10.1093/jnci/djq217 |
| [18] | Dhennin-Duthille I, Gautier M, Faouzi M, et al. High expression of transient receptor potential channels in human breast cancer epithelial cells and tissues: correlation with pathological parameters[J]. Cell Physiol Biochem, 2011, 28 (5): 813-22. doi:10.1159/000335795 |
| [19] | El H Y, Ahidouch A, Lehen′Kyi V, et al. Extracellular signal-regulated kinases 1 and 2 and TRPC1 channels are required for calcium-sensing receptor-stimulated MCF-7 breast cancer cell proliferation[J]. Cell Physiol Biochem, 2009, 23 (4-6): 335-46. doi:10.1159/000218179 |
| [20] | 宋阳, 詹磊, 黄成, 等. 瞬时感受器电位离子通道香草素受体亚家族4调控肝星状细胞活化增殖作用研究[J]. 中国药理学通报, 2016, 32 (5) : 681-7. Song Y, Zhan L, Huang C, et al. Regulatory effects of TRPV4 on liver fibrosis of rats[J]. Chin Pharmacol Bull, 2016, 32 (5): 681-7. |
| [21] | Monet M, Gkika D, Lehen′Kyi V, et al. Lysophospholipids stimulate prostate cancer cell migration via TRPV2 channel activation[J]. Biochim Biophys Acta, 2009, 1793 (3): 528-39. doi:10.1016/j.bbamcr.2009.01.003 |
| [22] | Monet M, Lehen′Kyi V, Gackiere F, et al. Role of cationic channel TRPV2 in promoting prostate cancer migration and progression to androgen resistance[J]. Cancer Res, 2010, 70 (3): 1225-35. doi:10.1158/0008-5472.CAN-09-2205 |
| [23] | Adapala R K, Thoppil R J, Ghosh K, et al. Activation of mechanosensitive ion channel TRPV4 normalizes tumor vasculature and improves cancer therapy[J]. Oncogene, 2016, 35 (3): 314-22. doi:10.1038/onc.2015.83 |
| [24] | 刘强, 刘国兴, 方雨, 等. TRPV4通道蛋白在肿瘤发生发展中的研究进展[J]. 中国普通外科杂志, 2016, 25 (1) : 132-7. Liu Q, Liu G X, Fang Y, et al. TRPV4 in occurrence and development of cancer: recent progress[J]. Chin J Gen Surg, 2016, 25 (1): 132-7. |
| [25] | Raphael M, Lehen′Kyi V, Vandenberghe M, et al. TRPV6 calcium channel translocates to the plasma membrane via Orai1-mediated mechanism and controls cancer cell survival[J]. Proc Natl Acad Sci USA, 2014, 111 (37): E3870-9. doi:10.1073/pnas.1413409111 |
| [26] | Peng J B, Zhuang L, Berger U V, et al. CaT1 expression correlates with tumor grade in prostate cancer[J]. Biochem Biophys Res Commun, 2001, 282 (3): 729-34. doi:10.1006/bbrc.2001.4638 |
| [27] | Meng X, Cai C, Wu J, et al. TRPM7 mediates breast cancer cell migration and invasion through the MAPK pathway[J]. Cancer Lett, 2013, 333 (1): 96-102. doi:10.1016/j.canlet.2013.01.031 |
| [28] | Sun Y, Sukumaran P, Varma A, et al. Cholesterol-induced activation of TRPM7 regulates cell proliferation, migration, and viability of human prostate cells[J]. Biochim Biophys Acta, 2014, 1843 (9): 1839-50. doi:10.1016/j.bbamcr.2014.04.019 |
| [29] | Gao H, Chen X, Du X, et al. EGF enhances the migration of cancer cells by up-regulation of TRPM7[J]. Cell Calcium, 2011, 50 (6): 559-68. doi:10.1016/j.ceca.2011.09.003 |
| [30] | 陈晨, 刘兆国, 汪思亮, 等. 薄荷醇及其受体TRPM8与肿瘤关系研究进展[J]. 中国药理学通报, 2015, 31 (3) : 312-4. Chen C, Liu Z G, Wang S L, et al. Research progress in the role of menthol and its receptor TRPM8 in tumor[J]. Chin Pharmacol Bull, 2015, 31 (3): 312-4. |
| [31] | Zhang L, Barritt G J. TRPM8 in prostate cancer cells: a potential diagnostic and prognostic marker with a secretory function[J]. Endocr Relat Cancer, 2006, 13 (1): 27-38. doi:10.1677/erc.1.01093 |
| [32] | Bidaux G, Roudbaraki M, Merle C, et al. Evidence for specific TRPM8 expression in human prostate secretory epithelial cells: functional androgen receptor requirement[J]. Endocr Relat Cancer, 2005, 12 (2): 367-82. doi:10.1677/erc.1.00969 |
| [33] | Monteith G R, Davis F M, Roberts-Thomson S J. Calcium channels and pumps in cancer: changes and consequences[J]. J Biol Chem, 2012, 287 (38): 31666-73. doi:10.1074/jbc.R112.343061 |

