


2. 重庆市中药研究院,重庆 400065
2. Chongqing Academy of Chinese Materia Medica,Chongqing 400065,China
鸦胆子(Fructus Bruceae),别名老鸦胆、苦参子、鸦蛋子、小苦楝,是苦木科植物鸦胆子(Brucea javanica L. Merr.)属的干燥成熟果实,呈卵圆形,质地坚硬,顶端稍尖,长6~10 mm,直径4~7 mm;表面为凸起的网状纹路,在成熟时变为黑色或棕色;通常于秋天收获,去除杂质干燥后入药[1]。鸦胆子属植物有6种,主要分布于非洲、亚洲热带地区和北太平洋地区,多为民间用药,在我国主要为鸦胆子(Brucea javanica L. Merr.)和柔毛鸦胆子(Brucea mollis Wall.exKurz)[2],主产于我国南方沿海热带及亚热带地区的海南、两广及云南等地。其性苦,味寒,有毒,有清热、燥湿、杀虫、解毒作用,可治疗痢疾、肿瘤、久泻、疟疾、痔疮、疔毒,外用可治赘疣、鸡眼[3-4],最早记载出自《本草纲目拾遗》:“鸦胆子,出闽、广,药肆中皆有之。形如梧子,其仁多油,生食令人吐,作霜,捶去油,入药佳”[5]。鸦胆子具有多种药理活性,目前在临床上被广泛应用于肺癌、前列腺癌和胃肠癌的治疗。我国于1978年开始研制鸦胆子油静脉乳剂,并用于各种恶性肿瘤的治疗[6]。研究发现,鸦胆子油乳与其他抗癌药共用时,有一定的耐药逆转作用,可以增强其他药物对耐药细胞的细胞毒作用[7]。现代研究表明,鸦胆子的主要成分为苦木内酯、生物碱、三萜和脂肪酸类,其中苦木内酯类成分是鸦胆子的特征性成分,也是鸦胆子的有效活性成分,具有抗肿瘤、抗寄生虫、抗炎、抗病毒、抗菌和降血糖等多种药理活性[8]。为此,回顾文献报道,本文就鸦胆子中苦木内酯类成分及其药理活性作一简要综述。
1 鸦胆子苦木内酯类化学成分的研究概况鸦胆子化学成分研究始于上世纪60年代初,迄今为止,已从鸦胆子种子和全草中分离鉴定了150多个化合物,其中主要包括苦木内酯类、黄酮类、蒽醌类、三萜类、甾体类、脂肪酸类、倍半萜类等化合物。苦木内酯类成分的基本结构(Fig 1)是由1个含C8-CH2-O-C13的五元氧环、3个六元环和1个内酯环组成的四环三萜类,代表性化合物为鸦胆丁、鸦胆苦醇、鸦胆因、鸦胆子苷。鸦胆丁(bruceantin),是在1973年首次从中药鸦胆子中分离得到,研究发现其具有潜在的抗肿瘤活性,但存在很强的细胞毒性,曾被列为候选化疗药。上世纪80年代初,美国对鸦胆丁进行了Ⅰ期和Ⅱ期临床试验[9],研究发现,Ⅰ期临床试验时,注射鸦胆丁会导致血压降低,另外还会引起发热、恶心、厌食和轻度脱发等不良反应;Ⅱ期临床试验以成人转移性乳腺癌和恶性黑色素瘤患者为研究对象,但疗效并不理想,因此研究被中止[10]。鸦胆苦醇(brusatol)是在1968年首次从鸦胆子中分离出来,据报道其具有抗白血病、抗炎、抗锥体虫、抗烟草花叶病毒(TMV)的活性,相关研究证明鸦胆苦醇是一个在体外抗胰腺癌效果比喜树碱更强的化合物,其对PANC-1和SW1990两种胰腺癌细胞系的IC50值分别为0.36 μmol·L-1和0.10 μmol·L-1[11]。研究证明,鸦胆苦醇的构效关系如下:① C-2位的烯醇氧和不饱和羰基氧是必需的,但是C-3位的氧不是活性所必需的;② C-11位的β-羟基基团是活性的重要部位;③ C-21位的的酯烷氧基侧链对活性稍有影响[9]。《中药学》记载鸦胆子的壳及种子均有毒,毒性成分主要分布于水溶性的苦味成分中,而鸦胆子中水溶性的苦味成分主要为鸦胆子苷,说明鸦胆子苷可能是鸦胆子的主要毒性成分[4]。相关文献报道显示,至2015年为止,一共有77个苦木内酯类化合物从鸦胆子中分离出来,主要有:Bruceaketolic acid、Bruceanic acid E-F、Bruceanic acid E methyl ester、Bruceantin、Bruceantinol、Bruceantinol A-B、Dihydrobruceantin、Dehydro-bruceantinol、Brusatol、Dehydrobrusatol、Desmethyl-brusatol、Bruceantarin、Bruceantinoside A、Desmethyl- bruceantinoside A、Butyl ester of bruceoside D、Bruceoside A-G、BruceeneA、Bruceine A-L、Dehydrobruceine A-B、Javanic acid A-B、Javanicoside A-H、Javanicolide A-F/H、Yadanzioside A-P、Yadanziolide B-D/S/W,现将其代表性成分及相关药理活性总结如Tab 1。
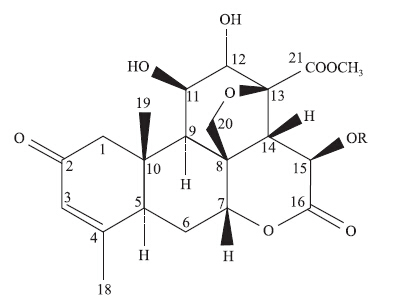
|
| Fig 1 Basic structure of quassinoids |
苦木内酯类化合物具有很强的抗肿瘤活性,其中,研究最多的是鸦胆丁,Tang等[24]研究证明鸦胆丁在体内外对一系列肿瘤细胞生长都有明显的抑制作用,但是在临床研究中,其对实体瘤未见明显的抑制作用。早期研究表明,鸦胆丁抗肿瘤作用机制主要是通过干扰肽基转移酶,抑制蛋白质的合成而实现。最近的研究报道表明,鸦胆丁不仅仅是蛋白质合成抑制剂,其抗肿瘤活性很可能与其诱导细胞凋亡、细胞分化和降低c-MYC原癌基因蛋白的表达有关[25-26]。鸦胆苦醇、鸦胆丁醇(bruceantinol)、鸦胆因A(bruceine A)、鸦胆他林(bruceantarin)等拥有3-羟基-3烯基-2酮结构的苦木内酯类化合物,具有强烈的抗肿瘤活性,均显示出对MCF-7和MDA-MB-231两种人乳腺癌细胞强烈的抑制活性,其IC50值范围分别为0.063~0.182 μmol·L-1和0.081~0.238 μmol·L-1,而且效果都强于阳性对照多柔比星[12]。另有研究显示,鸦胆丁醇(bruceantinol)可通过内在线粒体凋亡途径诱导MCF-7细胞凋亡[12]。研究表明,鸦胆因D可以通过线粒体途径诱导人胰腺癌Capan-2细胞凋亡,表现为降低Capan-2细胞线粒体膜电位、降低Bcl-2、caspase-9和caspase-3的表达、诱导细胞DNA基因组碎裂、增加细胞在G1期的比重[22],鸦胆因D也可通过激活p38-MAPK途径来诱导胰腺癌细胞系PANC-1的凋亡[27]。
另一被广泛研究的苦木内酯类化合物是鸦胆苦醇,研究证实其具有明显的抗肿瘤活性。早在20世纪70~80年代期间,北卡罗来纳大学的一个团队就研究了鸦胆苦醇作为抗癌药物在白血病中的应用,研究结果显示,鸦胆苦醇在P-388淋巴白血病细胞中具有抑制DNA、RNA和蛋白合成以及氧化磷酸化的作用[17]。1984年,Lee等[15]报道鸦胆子的CHCl3部位提取物有较强的抗小鼠体内P-388淋巴细胞白血病的活性,进一步研究发现其抗P-388白血病的活性成分为鸦胆苦醇。后续研究证实,鸦胆苦醇还能诱导HL-60细胞分化,并伴随强烈的抗增殖活性和细胞毒性,生理浓度下的鸦胆苦醇能强烈下调癌基因蛋白c-MYC,促进HL-60细胞的分化,而高浓度的鸦胆苦醇能诱导HL-60细胞的凋亡,而不是细胞分化,这都说明鸦胆苦醇是一个治疗白血病很好的候选化合物[28-30]。研究还发现鸦胆苦醇对S180瘤株有边缘活性[16]及抗胰腺癌的活性[11]。研究表明,鸦胆苦醇能使癌细胞增敏,提高化疗药物的疗效,减轻化学耐药性,是一个独特的Nrf-2[红细胞系-2p45(NF-E2) 相关因子-2]通路抑制剂,能增加很多癌细胞对顺铂或者其他化疗药物的敏感性[17]。Nrf-2为亮氨酸拉链型的核转录因子[31],在体内的作用具有两面性,一是启动细胞保护机制,使健康机体免受外源物质和氧化应激引起的侵害;二是Nrf-2在许多类型的肿瘤细胞中高表达,Nrf-2的异常持续激活会导致癌细胞对化疗和放疗的化学抵抗性[19, 24, 32]。说明Nrf-2是一个促进化学耐药性的重要因素[17]。因此,Nrf-2被认为是预防癌症的最佳药物靶点之一,抑制Nrf-2通路有望成为有效治疗癌症的新策略,因此,调节Keap-Nrf2通路成为治疗的研究热点[32-33]。鸦胆子中苦木内酯类的代表性成分—鸦胆苦醇能通过抑制Nrf-2,增强化疗药的疗效,其抑制Nrf-2的作用独立于它的抑制剂Keap1、蛋白酶体和自噬蛋白降解系统[34],其作用机制是通过提高Nrf-2的泛素化和降解,选择性地减少Nrf-2蛋白水平[24, 30]。
2.2 抗炎作用目前研究认为,抑制基质细胞衰老和慢性炎症的方法对于预防或转化早期上皮细胞癌具有重要价值[32]。鸦胆子具有很好的抗癌活性,这与其抗炎活性密不可分。
鸦胆子中的鸦胆苦醇和其类似物能诱导一系列的生物应答,包括在小鼠模型上有抗炎的效果[28]。Hall等[19]第一次报道了和鸦胆苦醇结构相关的苦木内酯类化合物具有潜在的抗炎和抗啮齿动物关节炎的活性。鸦胆子的醇提取物能减轻巴豆油引起的耳肿胀和琼脂引起的小鼠耳朵肉芽肿,鸦胆子也能被用于预防由放射引起的急性肠炎和口咽黏膜炎,这说明其有抗急、慢性炎症的活性[1]。Hall等[19]观察到一系列苦木内酯类对于诱发的啮齿类动物的炎症和关节炎具有抑制活性,其中,鸦胆苦醇具有最强的活性,其对大鼠爪部炎症和关节炎抑制活性强于吲哚美辛。研究显示,苦木内酯类作为抗炎药物的作用模式之一是稳定溶酶体膜,减少水解酶的释放,水解酶会对周围组织造成损伤。虽然鸦胆苦醇有较好的抗炎活性,但是其高毒性限制了其作为抗炎药物的开发和应用[33]。鸦胆苦醇的毒副作用机制与其抗炎途径是否相关、是否存在其他毒副作用机制有待进一步的研究。炎症是机体免疫系统对感染或刺激做出的第一反应,巨噬细胞是免疫效应细胞,具有多种免疫功能:免疫防御、免疫监视、免疫调节以及抗原呈递等,在炎症的发生发展过程中起着重要的作用[35]。NO是激活的巨噬细胞杀灭病原微生物及肿瘤细胞的主要效应分子,能提高机体免疫;但过量的NO也会促进炎症发生,诱导炎症因子如 IL-1β、TNF-α等的产生,而且持续过量的IL-1β和TNF-α释放会导致炎症反应的不断扩大、加重,对机体组织器官造成伤害[36]。研究表明,苦木内酯类化合物及其衍生物对脂多糖(LPS)刺激的巨噬细胞产生NO有抑制作用,而且对诱导型NO合酶(iNOS)的表达有抑制作用[33, 37]。鸦胆子的乙酸乙酯部位提取物对LPS刺激的巨噬细胞生成NO以及IL-6、TNF-α、IL-1β等炎症介质有抑制作用[35]。近期,有研究者通过对鸦胆苦醇进行结构修饰,合成了40个鸦胆苦醇衍生物,其中的75号化合物与鸦胆苦醇相比,对NO具有很强的抑制活性(IC50=0.067 μmol·L-1),但是毒性更低,且在很低剂量(2 μmol·kg-1·d-1)时,显示了对LPS和香烟烟雾(cigarette smoke,CS)诱导的COPD小鼠炎症模型有很强的抑制效应,毒性比鸦胆苦醇低100倍(LD50>3 852 μmol·kg-1)[33]。
| 编号 | 英文名称 | 化学分子式 | 结构式 | 分子量 | 药理活性 |
| 1 | Bruceantin | C28H36O11 | 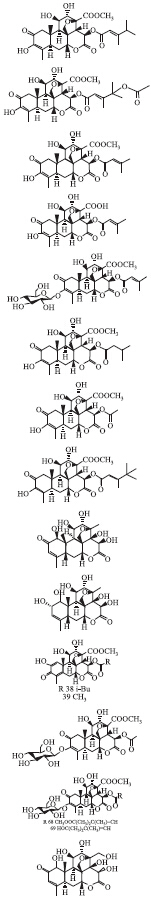 | 548.59 | 抗肿瘤[10];抗阿米巴原虫[10];拒食烟草蚜虫[2] |
| 2 | Bruceantinol | C30H38O13 | 606.62 | 抑制MCF-7和MDA-MB-231两种人乳腺癌细胞[12];抗伊氏椎体虫活性[13];抗吉氏阿米巴虫活性[14] | |
| 3 | Brusatol | C26H32O11 | 520.53 | 抗胰腺癌[11];抗P-388白血病[15];对S180瘤株有边缘活性[16];抑制MCF-7和MDA-MB-231两种人乳腺癌细胞[12];是Nrf-2的抑制剂,可以增敏肿瘤对抗癌药物的反应[17];抗烟草花叶病毒(TMV)活性[2];抗恶性疟原虫活性[18];抗炎,抑制关节炎[19];抗锥体虫活性[20] | |
| 4 | Bruceantarin | C28H30O11 | 542.54 | 抑制MCF-7和MDA-MB-231两种人乳腺癌细胞[12] | |
| 5 | Bruceoside B | C32H42O16 | 682.68 | 抗TMV活性[2] | |
| 6 | Bruceine A | C26H34O11 | 522.55 | 抑制MCF-7和MDA-MB-231两种人乳腺癌细胞[12];抗伊氏锥体虫活性[13];抑制金鱼里的指环虫[12];抗巴贝西虫活性[21] | |
| 7 | Bruceine B | C23H28O11 | 480.47 | 抗TMV活性[2] | |
| 8 | Bruceine C | C28H36O12 | 564.58 | 抗伊氏锥体虫活性[13] | |
| 9 | Bruceine D | C20H26O9 | 410.42 | 诱导Capan-2细胞凋亡[22];抗TMV活性[2];拒食烟草蚜虫[2];抑制金鱼里的指环虫[12];降血糖作用[23] | |
| 10 | Bruceine E | C20H28O9 | 412.44 | 降血糖作用[23] | |
| 11 | Dehydrobruceine B | C23H26O11 | 478.45 | 抗TMV活性[2] | |
| 12 | Yadanzioside I | C29H38O16 | 642.61 | 抗TMV活性[2] | |
| 13 | Yadanzioside L | C34H46O17 | 726.73 | 抗烟TMV活性[2] | |
| 14 | Yadanziolide A;Bruceine H | C20H26O10 | 426.42 | 抗TMV活性[2] |
鸦胆子苦木内酯类化合物有抑制寄生虫性原生虫病的作用,例如恶性疟原虫、阿米巴痢疾、肠源性败血症和弓形虫。1987年,Lee等[18]研究发现鸦胆苦醇有较强的抗恶性疟原虫活性,鸦胆子苷(bruceolide)具有较弱的抗恶性疟原虫活性,鸦胆苦醇相关的苦木内酯类化合物中的C15酯基部分是抗疟疾活性的关键结构。鸦胆因A和D对中型指环虫具有明显的抗虫活性,EC50分别为0.49 mg·L-1和0.57 mg·L-1,效果优于阳性对照药甲苯咪唑(EC50=1.25 mg·L-1)[38]。研究报道显示,鸦胆子粗提物显示了很强的体外抗伊氏锥体虫活性[13],其中,苦木内酯类化合物鸦胆因A、鸦胆丁醇、鸦胆因C、鸦胆苦醇以及鸦胆因B均显示出了强烈的抗锥体虫活性(IC50值为2.9~17.8 nmol·L-1),效果与标准的杀锥体虫的药物三氮脒(贝尼尔)(IC50=8.8 nmol·L-1)和苏拉明(IC50=43.2 nmol·L-1)相当或略优。构效关系和活性研究表明,苦木内酯类化合物的A环上的布枯酚( 1-甲-2-羟-3-氧-4-异丙环己烯)部分和C15上自带的侧链对其抗锥体虫活性而言是非常重要的[20]。此外,有研究报道,鸦胆因A和鸦胆丁醇具有抗巴贝西虫活性[21]、抗阿米巴虫活性[14]等。
2.4 抗病毒活性鸦胆子被广泛应用于多种病毒性疣的治疗,包括对尖锐湿疣、平疣、鸡眼等均有效。临床研究显示,注射鸦胆子用于尖锐湿疣治疗具有起效快、方便、低毒性、对皮肤黏膜的刺激小的明显优势[1]。有研究者用传统的半叶法和叶盘法加上Western blot方法筛选苦木素类化合物的抗TMV活性,结果显示,所有的17个苦木素类化合物均显示了极强的抗TMV活性[39]。Yan等[39]研究证实,Brusatol、Bruceine B、Bruceine D、Bruceoside B、Yadanzioside Ⅰ、Yadanzioside L和Yadanziolide A均具有很强的抗TMV活性,其IC50为3.42~5.66 μmol·L-1,疗效优于阳性药宁南霉素(IC50=117.3 μmo l·L-1)。 2.5 其他活性降血糖作用 Ablat等[40]用糖原磷酸酶α(GPα)抑制方法和对非糖尿病大鼠的口服葡萄糖耐受测试(OGTT)发现,鸦胆子种子的乙醇提取物和乙酸乙酯部位,在体内外均有降低血糖的作用。NoorShahida等[23]报道,苦木素类成分Bruceine D、Brueeine E有降低血糖的作用,其降血糖效果可与格列苯脲相媲美,它们可能具有促胰岛素分泌活性。
3 总结与展望鸦胆子具有抗肿瘤、抗寄生虫、降血糖等药理作用,是非常具有药物开发利用价值的常用中药。苦木内酯类化合物是鸦胆子的主要活性成分,具有很强的抗肿瘤、抗炎等多种生物活性,但到目前为止,仍未发现可用于临床治疗的有效化学成分[41]。而且,鸦胆子抗炎的特定机制还不清楚,进一步的全面研究很有必要[1]。鸦胆苦醇促进Nrf-2的降解可能是以Keap-1依赖性方式进行的,但是其提高Nrf-2泛素化的更详细机制有待进一步的研究[17]。总之,鸦胆子苦木内酯类成分具有非常好的药物开发价值与临床应用前景,尤其在抗肿瘤、抗炎方面。此外,对鸦胆子苦木内酯类有毒活性成分进行化学结构改造修饰,以达到减毒增效的目的,是有毒中药成分开发利用的重要手段。
| [1] | Chen M, Chen R, Wang S, et al. Chemical components, pharmacological properties, and nanoparticulate delivery systems of Brucea javanica[J]. Int J Nanomedicine, 2013, 8 : 85-92. |
| [2] | 周中流, 梁燕君, 黄诗瑶, 等. 鸦胆子属植物苦木内酯类化合物的研究进展[J]. 中成药, 2013, 35 (5) : 1040-6. Zhou Z L, Liang Y J, Huang S Y, et al. The research progress of quassinoids from Brucea javanica[J]. Chin Tradit Pat Med, 2013, 35 (5): 1040-6. |
| [3] | 路广秀, 范洁宇, 马瑞莲. 鸦胆子临床新用及研究进展[J]. 内蒙古医学院学报, 2012, 34 (5) : 423-7. Lu G X, Fan J Y, Ma R L. The progression of clinical application of Brucea Javanica[J]. J Inner Mongolia Med Coll, 2012, 34 (5): 423-7. |
| [4] | 陈义杰. 华东区第二十次中兽医科研协作与学术研讨会论文集[C].杭州:中兽医学杂志,2011. Chen Y J.Chinese association of animal science and veterinary medicine. CAAV 2011:Proceedings of the twentieth China veterinary scientific research collaboration and academic seminar in east China[C]. Hangzhou:Chin J Tradit Vet Sci,2011. |
| [5] | 杨倩, 郑丽娜, 谢元璋, 等. 鸦胆子不同组分抗炎药效伴随毒副作用机制研究[J]. 中国药物警戒, 2011, 8 (6) : 333-5. Yang Q, Zheng L N, Xie Y Z, et al. Study on adjoint toxical mechanism of anti-inflammatory effect of different extract from Fructus Bruceae[J]. Chin J Pharmacov, 2011, 8 (6): 333-5. |
| [6] | 丁晨旭, 索有瑞. 中药鸦胆子化学成分及药理学研究进展[J]. 中成药, 2006, 28 (1) : 117-20. Ding C X, Suo Y R. The chemical components and pharmacological research progress of Chinese traditional medicine Brucea javanica[J]. Chin Tradit Pat Med, 2006, 28 (1): 117-20. |
| [7] | 汤涛, 蒙凌华, 陈陵际, 等. 鸦胆子油乳具有多药耐药逆转和拓扑异构酶Ⅱ抑制作用[J]. 中国药理学通报, 2001, 17 (5) : 534-9. Tang T, Meng L H, Chen L J, et al. Reversal of multidrug resistance and inhibition of DNA topoisomerase Ⅱ by emulsion of seed oil of Brucea Javanica[J]. Chin Pharmacol Bull, 2001, 17 (5): 534-9. |
| [8] | Wei S Z, Xiang Q S. Chemical constituents of fruits from Brucea javanica[J]. J Trop Subtrop Bot, 2013, 21 (5): 466-70. |
| [9] | Hitotsuyanagi Y, Kim I H, Hasuda T, et al. A structure-activity relationship study of brusatol, an antitumor quassinoid[J]. Tetrahedron, 2006, 62 (17): 4262-71. doi:10.1016/j.tet.2006.01.083 |
| [10] | Zhao L, Li C, Zhang Y, et al. Phytochemical and biological activities of an anticancer plant medicine: Brucea javanica[J]. Anti cancer Agents Med Chem, 2014, 14 (3): 440-58. doi:10.2174/18715206113136660336 |
| [11] | Zhao M, Lau S T, Leung P S, et al. Seven quassinoids from Fructus Bruceae with cytotoxic effects on pancreatic adenocarcinoma cell lines[J]. Phytother Res, 2011, 25 (12): 1796-800. doi:10.1002/ptr.v25.12 |
| [12] | Ye Q, Bai L, Hu S, et al. Isolation, chemotaxonomic significance and cytotoxic effects of quassinoids from Brucea javanica[J]. Fitoterapia, 2015, 105 : 66-72. doi:10.1016/j.fitote.2015.06.004 |
| [13] | Elkhateeb A, Tosa Y, Matsuura H, et al. Antitrypanosomal activities of acetylated bruceines A and C; a structure-activity relationship study[J]. J Nat Med, 2012, 66 (1): 233-40. doi:10.1007/s11418-011-0571-5 |
| [14] | Subeki, Matsuura H, Takahashi K, et al. Screening of Indonesian medicinal plant extracts for antibabesial activity and isolation of new quassinoids from Brucea javanica[J]. J Nat Prod, 2007, 70 (10): 1654-7. doi:10.1021/np070236h |
| [15] | Lee K, Hayashi N, Okano M, et al. Antitumor agents, 65 brusatol and cleomiscosin-A, antileukemic principles from Brucea javanzca[J]. J Nat Prod, 1984, 47 (3): 550-1. doi:10.1021/np50033a030 |
| [16] | 林隆泽, 张金生, 陈仲良, 徐任生. 鸦胆子化学成分的研究[J]. 化学学报, 1982, 40 (1) : 73-8. Lin L Z, Zhang J S, Chen Z L, Xu R S. Studies on chemical constituents of Brucea Javanica(L)Merr[J]. Acta Chim Sin, 1982, 40 (1): 73-8. |
| [17] | Ren D, Villeneuve N F, Jiang T, et al. article-title>Brusatol enhances the efficacy of chemotherapy by inhibiting the Nrf2-mediated defense mechanism[J]. Proc Natl Acad Sci USA, 2011, 108 (4): 1433-8. doi:10.1073/pnas.1014275108 |
| [18] | Lee K, Tani S, Imakura Y. Antimalarial agents, 4 synthesis of a brusatol analog and biological activity of brusatol-related compounds[J]. J Nat Prod, 1987, 50 (5): 847-51. doi:10.1021/np50053a012 |
| [19] | Hall I H, Lee K H, Imakura Y, et al. Anti-inflammatory agents Ⅲ: structure-activity relationships of brusatol and related quassinoids[J]. J Pharm Sci, 1983, 72 (11): 1282-4. doi:10.1002/jps.2600721111 |
| [20] | Bawm S, Matsuura H, Elkhateeb A, et al. In vitro antitrypanosomal activities of quassinoid compounds from the fruits of a medicinal plant, Brucea javanica[J]. Vet Parasitol, 2008, 158 (4): 288-94. doi:10.1016/j.vetpar.2008.09.021 |
| [21] | Nakao R, Mizukami C, Kawamura Y, et al. Evaluation of efficacy of bruceine A, a natural quassinoid compound extracted from a medicinal plant, Brucea javanica, for canine babesiosis[J]. J Vet Med Sci, 2009, 71 (1): 33-41. doi:10.1292/jvms.71.33 |
| [22] | Liu L, Lin Z X, Leung P S, et al. Involvement of the mitochondrial pathway in bruceine D-induced apoptosis in Capan-2 human pancreatic adenocarcinoma cells[J]. Int J Mol Med, 2012, 30 (1): 93-9. |
| [23] | NoorShahida A, Wong T W, Choo C Y. Hypoglycemic effect of quassinoids from Brucea javanica(L.) Merr(Simaroubaceae) seeds[J]. J Ethnopharmacol, 2009, 124 (3): 586-91. doi:10.1016/j.jep.2009.04.058 |
| [24] | Tang W, Hemm I, Bertram B. Recent development of antitumor agents from Chinese herbal medicines; Part I. Low molecular compounds[J]. Planta Med, 2003, 69 (2): 97-108. doi:10.1055/s-2003-37718 |
| [25] | Duncan G R, Henderson D B. Bruceines from Brucea sumatrana: the structure of bruceine G[J]. Experientia, 1968, 24 (8): 768-9. doi:10.1007/BF02144855 |
| [26] | Kim I H, Takashima S, Hitotsuyanagi Y, et al. New quassinoids, javanicolides C and D and javanicosides B-F, from seeds of Brucea javanica[J]. J Nat Prod, 2004, 67 (5): 863-8. doi:10.1021/np030484n |
| [27] | Lau S T, Lin Z, Liao Y, et al. Brucein D induces apoptosis in pancreatic adenocarcinoma cell line PANC-1 through the activation of p38-mitogen activated protein kinase[J]. Cancer Lett, 2009, 281 (1): 42-52. doi:10.1016/j.canlet.2009.02.017 |
| [28] | Cuendet M, Gills J J, Pezzuto J M. Brusatol-induced HL-60 cell differentiation involves NF-κB activation[J]. Cancer Lett, 2004, 206 (1): 43-50. doi:10.1016/j.canlet.2003.11.011 |
| [29] | Mata-Greenwood E, Cuendet M, Sher D, et al. Brusatol-mediated induction of leukemic cell differentiation and G1 arrest is associated with down-regulation of c-myc[J]. Leukemia, 2002, 16 (11): 2275-84. doi:10.1038/sj.leu.2402696 |
| [30] | Mata-Greenwood E, Daeuble J F, Grieco P A, et al. Novel esters of glaucarubolone as inducers of terminal differentiation of promyelocytic HL-60 cells and inhibitors of 7,12-dimethylbenz[J]. J Nat Prod, 2001, 64 (12): 1509-13. doi:10.1021/np010212p |
| [31] | Wang X J, Li X, Tang X W. The role of Nrf2 in carcinogenesis[J]. Prog Chem, 2013, 25 (9): 1544-52. |
| [32] | Goruppi S, Dotto G P. Mesenchymal stroma: primary determinant and therapeutic target for epithelial cancer[J]. Trends Cell Biol, 2013, 23 (12): 593-602. doi:10.1016/j.tcb.2013.08.006 |
| [33] | Tang W, Xie J, Xu S, et al. Novel nitric oxide-releasing derivatives of brusatol as anti-inflammatory agents: design, synthesis, biological evaluation, and nitric oxide release studies[J]. J Med Chem, 2014, 57 (18): 7600-12. doi:10.1021/jm5007534 |
| [34] | Olayanju A, Copple I M, Bryan H K, et al. Brusatol provokes a rapid and transient inhibition of Nrf2 signaling and sensitizes mammalian cells to chemical toxicity-implications for therapeutic targeting of Nrf2[J]. Free Radic Biol Med, 2015, 78 : 202-12. doi:10.1016/j.freeradbiomed.2014.11.003 |
| [35] | Yang J, Li S, Xie C, et al. Anti-inflammatory activity of ethyl acetate fraction of the seeds of Brucea Javanica[J]. J Ethnopharmacol, 2013, 147 (2): 442-6. doi:10.1016/j.jep.2013.03.034 |
| [36] | 张莘莘, 李文娟, 聂少平, 等. 黑灵芝多糖对体外培养的小鼠腹腔巨噬细胞功能的影响[J]. 中国药理学通报, 2010, 26 (9) : 1139-42. Zhang S S, Li W J, Nie S P, et al. Effects of polysaccharide of Ganoderma atrum on the function of mouse peritoneal macrophages in vitro[J]. Chin Pharmacol Bull, 2010, 26 (9): 1139-42. |
| [37] | Liu J H, Zhao N, Zhang G J, et al. Bioactive quassinoids from the seeds of Brucea javanica[J]. J Nat Prod, 2012, 75 (4): 683-8. doi:10.1021/np200920c |
| [38] | Wang Y, Wu Z, Wang G, et al. In vivo anthelmintic activity of bruceine A and bruceine D from Brucea javanica against Dactylogyrus intermedius(Monogenea) in goldfish(Carassius auratus)[J]. Vet Parasitol, 2011, 177 (1-2): 127-33. doi:10.1016/j.vetpar.2010.11.040 |
| [39] | Yan X H, Chen J, Di Y T, et al. Anti-tobacco mosaic virus (TMV) quassinoids from Brucea javanica(L.) Merr[J]. J Agric Food Chem, 2010, 58 (3): 1572-7. doi:10.1021/jf903434h |
| [40] | Ablat A, Mohamad J, Awang K, et al. Evaluation of antidiabetic and antioxidant properties of Brucea javanica seed[J]. Scientific World Journal, 2014, 2014 : 786130. |
| [41] | Lau S T, Lin Z, Zhao M, et al. Brucea javanica fruit induces cytotoxicity and apoptosis in pancreatic adenocarcinoma cell lines[J]. Phytother Res, 2008, 22 (4): 477-86. doi:10.1002/(ISSN)1099-1573 |
