


WNK (with-nolysine protein kinase)家族是20世纪90年代新发现的一类丝氨酸/苏氨酸蛋白激酶,因其功能结构域中缺乏赖氨酸而被命名,其作为一类新发现的离子通道调控蛋白越来越受到关注。WNK1是WNK激酶家族中的一个成员,首次描述WNK1激酶的作用是在肾脏中,其能动态地控制离子通道进而调节并改变细胞体积[1]。近年来有研究表明,在损伤、炎症、低渗透压等复杂情况下WNK家族能被激活,其中WNK1激活后通过调控下游离子通道从而影响细胞内外的Cl-浓度,而Cl-浓度的变化与疼痛相关。伤害性刺激传入神经元,导致胞内Cl-浓度升高,使原本起突触前抑制作用的初级传入去极化增大为背根反射,引起原发性痛觉过敏[3-5]。本实验通过观察WNK1在骨癌痛大鼠疼痛的中枢传导通路脊髓中的表达变化,明确WNK1激酶对骨癌痛的作用,进而为研究WNK1在骨癌痛发生发展过程中的可能机制奠定基础。
1 材料与方法 1.1 主要试剂和仪器Walker256肿瘤细胞为南京中医药大学新药与海洋药物研究中心药理毒理研究室惠赠;兔抗大鼠WNK1一抗(sc-28897)购自美国Santa Cruz公司;山羊抗兔IgG(H+L)二抗(GAR007)、小鼠抗兔GAPDH一抗(Mab5465)、山羊抗小鼠IgG二抗(GAM007)均购自联科生物技术股份有限公司;qRT-PCR试剂盒购自加拿大ABM公司;PCR引物及内参由上海生物工程有限公司设计并合成。von Frey阈值测痛仪器Stoelting(58011)购自美国Stoelting Touch Test公司。Western blot仪器:伯乐生命bio-rad;qRT-PCR仪器:德国Roche LightCycler480实时荧光定量PCR仪。
1.2 实验动物选择与分组清洁级健康♀ SD大鼠170 g~200 g 30只,由昭衍(苏州)新药研究中心有限公司提供,使用许可证号SCXK(苏)2013-0003。实验动物饲养室温度保持为(22~24)℃,湿度45%~55%, 光照周期为8:00~19:00, 大鼠自由进食和饮水。随机分为3组:对照组(C组,n=3)、假手术组(S组,n=3)、骨癌痛组(BCP组,n=24),其中骨癌痛组再根据处死时间不同分为4组(造模后3、6、9、12 d,n=6)。
1.3 实验方法 1.3.1 骨癌痛模型的制备参照本实验室的方法建立胫骨癌痛模型[6-9]。大鼠腹腔注射本实验室冻存的Walker256乳腺癌细胞(细胞量约为1×1010个细胞),可稳定于3~7 d出现大量腹水。消毒大鼠腹部后经腹腔抽取腹水5 mL,经PBS液洗涤3次后浓缩细胞浓度至约2×1010·L-1。大鼠于腹腔注射4%水合氯醛(0.01 mL·g-1)麻醉后,在左胫骨上段膝关节下切开约3 mm小口,钝性分离肌肉等组织后暴露胫骨干骺端,然后用1 mL针筒的针头在胫骨干骺端钻孔,用自制弯头的10 μL微量注射器注入5 μL walker256细胞(1×105个细胞)的悬浊液,待1 min后拔出注射器弯头并及时用医用胶水堵住针眼,消毒伤口周围的皮肤以防感染。假手术组仅注入PBS液5 μL。
1.3.2 机械痛阈的测定各组大鼠分别于术前d 1以及术后d 3、6、9、10、11、12时机测定机械痛阈。将大鼠放入底部为铁丝网的有机玻璃笼中30 min,待其安静并适应周围环境后进行测量。利用Touch test Von Frey纤维毛针刺激大鼠左后肢足底,刺激强度以26 g开始,逐渐用力使毛针弯曲,至超过毛针轴线1 cm。若大鼠不出现缩足反应则换高一级强度的毛针,直至大鼠出现缩足反应,记录此时Von Frey纤维毛针的力度,反映大鼠的机械痛阈。机械痛阈连续测定3次,每次间隔5 min,取其平均值。
1.3.3 WNK1 mRNA表达的测定采用TRIzol一步法提取L4~6脊髓组织的总RNA。测量每个样本RNA的浓度后取等量总RNA,按Abm公司逆转录试剂盒说明操作合成cDNA,继而进行PCR的扩增。
WNK1引物序列:上游引物5′-CAGAGTGAGCAGCCAACAGA-3′,下游引物5′-CCACGGACTGAGGCATACTT-3′;β-actin内参引物序列:上游引物5′-CACCCGCGAGTACAACCTTC-3′,下游引物5′-CCCATACCCACCATCACACC-3′。进行qRT-PCR,最终反应体系10 μL。经过多次预实验结合溶解曲线摸索出最佳的反应条件,为三温法:95℃预变性3 min后,95℃变性30 s,58℃退火30 s,72℃延伸20 s,80℃读板1 s,共40个循环后绘制溶解曲线,72℃再延伸5 min。采集各组的荧光阈值循环数(CT值),并设2复孔进行重复,取其平均值,采用2-ΔΔCT方法计算基因表达,以反映WNK1 mRNA的相对表达量。
1.3.4 WNK1蛋白表达的测定各组取脊髓(L4~6),称重后剪碎加入研磨器中,加入细胞裂解液RIPA(10 μL·mg-1)和PMSF(1 :100),冰浴中研磨。取组织匀浆,4℃ 12 000 r·min-1离心30 min后取上清液,BCA法测定蛋白浓度。配制8%SDS-PAGE凝胶,取总蛋白样品50 μg用RIPA补齐至相同体积,加入蛋白上样缓冲液后80℃煮10 min后加入样品孔中,浓缩胶恒压80 V、分离胶恒压120 V分离蛋白后恒流350 mA、240 min转移至PVDF膜上。室温下于封闭液(5 g脱脂奶粉溶于100 mL TBS溶液)中封闭2 h。加入GAPDH、WNK1一抗,4℃孵育过夜。加入辣根过氧化物酶标记的二抗,室温孵育2 h,滴加化学发光液,室温孵育30 s,曝光拍照,所得图片采用Image J图像分析软件进行分析,以WNK1条带积分光密度值与GAPDH条带积分光密度值的比值反映WNK1的相对表达水平。
1.4 统计学处理采用SPSS 21.0统计学软件进行分析,计量资料以x±s表示。机械痛阈组间比较采用单因素方差分析,组内比较采用重复测量方差分析;qRT-PCR、Western blot组间比较采用单因素方差分析,组内比较采用t检验。
2 结果 2.1 各组大鼠机械痛阈的比较各组间大鼠基础痛阈值差异无统计学意义(P > 0.05),C组、S组机械痛阈与自身基础值差异无统计学意义(P > 0.05),与C组比较,S组各时点机械痛阈差异无统计学意义(P > 0.05)。与自身基础值相比BCP组模型制备后d 3开始机械痛阈降低(P < 0.05),d 6~12各对应时间点的机械痛阈明显降低(P < 0.01),见Tab 1。
| Group | Baseline | Post-inoculation day/d | |||||
| 3 | 6 | 9 | 10 | 11 | 12 | ||
| Control | 31.7±4.8 | 36.2±5.2 | 36.2±5.2 | 32.8±4.5 | 32.8±4.5 | 32.8±4.5 | 36.2±5.2 |
| Sham | 36.2±5.2 | 29.4±3.4 | 36.2±5.2 | 36.2±5.2 | 32.8±4.5 | 36.2±5.2 | 32.8±4.5 |
| BCP | 32.8±4.5 | 22.7±1.7*# | 15.1±1.4**## | 7.8±0.7**## | 6±0.6**## | 5±0.3**## | 5.2±0.3**## |
| *P < 0.05, **P < 0.01 vs baseline; #P < 0.05, ##P < 0.01 vs control | |||||||
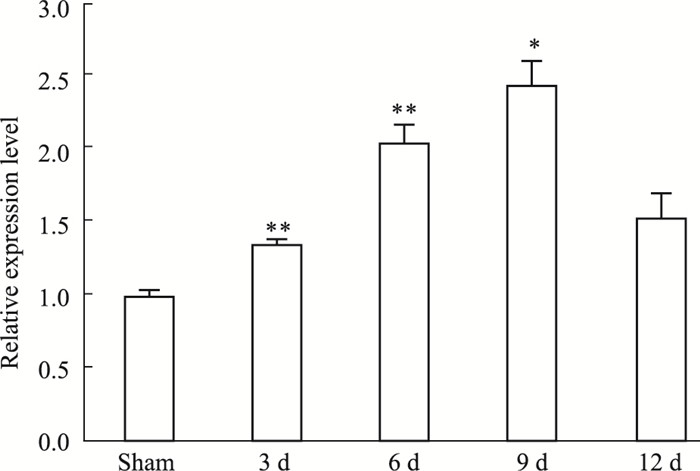
与S组比较,术后d 3起脊髓中WNK1 mRNA表达呈现递增趋势(P < 0.01),并且在d 9达到峰值(P < 0.05),之后表达开始下降,与S组比较,术后d 12 WNK1 mRNA的表达差异无统计学意义(P > 0.05),见Tab 2、Fig 1。
| Group | qRT-PCR | Western blot |
| Sham | 1 | 1 |
| BCP | ||
| 3 d | 1.34±0.04** | 0.95±0.10 |
| 6 d | 2.04±0.21** | 2.33±0.13** |
| 9 d | 2.42±0.28* | 2.53±0.44** |
| 12 d | 1.51±0.29 | 2.71±0.18** |
| *P < 0.05, **P < 0.01 vs sham | ||
|
| Fig 1 Relative mRNA expression level of WNK1 in spinal cord (L4~6)(x±s, n=3) *P < 0.05, **P < 0.01 vs sham |
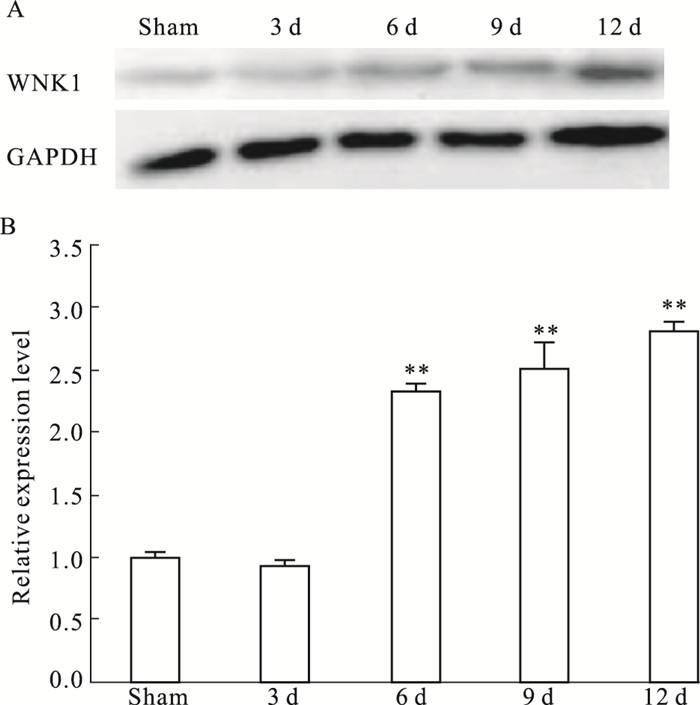
与S组比较,术后d 3 BCP组脊髓中WNK1蛋白的表达差异无统计学意义(P > 0.05),自术后d 6起表达呈递增趋势,至d 12达到峰值(P < 0.01),见Tab 2、Fig 2。
|
| Fig 2 Relative protein expression level of WNK1 in rat spinal cord(L4~6)(x±s, n=3) A:Images of western blot bands; B:Figures of Western blot.Values **P < 0.01 vs sham |
本实验采用Walker256大鼠乳腺癌细胞接种至同源♀SD大鼠左侧胫骨骨髓腔内,由此建立大鼠胫骨骨癌痛模型[6-9],是本实验室较为成熟稳定的模型。结果表明,在模型制备后d 3开始大鼠左后肢机械痛阈下降,d 6以后肉眼可观察到接种处胫骨肿胀,左后肢活动度降低,d 9以后左后肢不能负重并且拖地行走,机械痛阈处于低值且逐渐稳定,提示模型建立成功。
而WNK1作为新发现的一类离子通道调控蛋白,历来多在高血压病例中进行大量深入探讨。Richardson等[10]研究得出,WNK1能激活Ste20/SPS1相关的富含脯氨酸和丙氨酸的激酶(SPS1-related proline/alanine rich kinase,SPAK),继之磷酸化阳离子氯离子共转运体(cationchloride cotransporters,CCCs)家族成员之一的钠氯联合转运蛋白(sodium-chloride co-transporter,NCC),导致高血压。在疼痛领域关于WNK1的研究较少,而最新研究发现[11-12],在神经病理性疼痛的大鼠模型中WNK1在中枢神经系统中大量表达,并通过调节CCCs的表达参与疼痛机制。CCCs是一组转运钠、钾、氯离子进出细胞的膜蛋白,CCCs家族成员中的钠钾氯联合转运蛋白1(sodium-potassium-chloride co-transporter 1,NKCC1)与钾氯联合转运蛋白2(potassium-chloride co-transporter 2,KCC2)是中枢神经系统内氯离子平衡的主要调控蛋白。目前研究认为NKCC1和KCC2参与了中枢神经系统脊髓疼痛传导的调控,通过改变胞内氯离子浓度来调控GABA能和甘氨酸能神经元的功能,从而影响疼痛信号的传导[12-13]。由此可见,WNK1位于疼痛传导通路的上游,其通过调节胞内氯离子的浓度来影响疼痛信号的传导。因此,以WNK1为研究靶点对于揭示疼痛的机制、干预疼痛的进程具有重要的意义。然而,关于WNK1在骨癌痛中的表达及其在骨癌痛发生发展过程中的可能机制尚未见相关报道。
本实验结果表明,WNK1在大鼠中枢神经系统中表达,且骨癌痛大鼠的脊髓中WNK1在mRNA水平和蛋白水平均存在时间相关性的上调。通过对各时间点数据的分析,mRNA表达的上调先于蛋白,而蛋白的上调与机械痛阈降低相关联,这表明在骨癌痛大鼠的疼痛传导通路中,脊髓内的WNK1表达存在异常增高。结合上述的一系列研究报道,我们推测:WNK1能够通过调控CCCs家族成员来改变神经细胞内外的氯离子浓度从而调控GABA能神经元的功能,参与痛觉的形成和维持。因此,本课题组拟在本实验的基础上,继续深入探究WNK1及其下游通路在骨癌痛发生发展中的作用。
综上所述,WNK1在骨癌痛大鼠的脊髓中表达异常增高,可能参与了大鼠骨癌痛的发生发展与维持。
( 本实验在苏州大学附属第一医院南区中心实验室由沈濛溦、钱晓波费时约半年完成,在此衷心感谢导师杨建平教授、感谢实验室高建瓴、王丽娜、孟晓文老师的指导! )
| [1] | Krueger E M, Miranpuri G S, Resnick D K. Emerging role of WNK1 in pathologic central nervous system signaling[J]. Ann Neurosci, 2011, 18 (2): 70-5. |
| [2] | Lenertz L Y, Lee B H, Min X, et al. Properties of WNK1 and implications for other family members[J]. J Biol Chem, 2005, 280 (29): 26653-8. doi:10.1074/jbc.M502598200 |
| [3] | Price T J, Cervero F, Gold M S, et al. Chloride regulation in the pain pathway[J]. Brain Res Rev, 2009, 60 (1): 149-70. doi:10.1016/j.brainresrev.2008.12.015 |
| [4] | Price T J, Cervero F, de Koninck Y. Role of cation-chloride-cotransporters(CCC) in pain and hyperalgesia[J]. Curr Top Med Chem, 2005, 5 (6): 547-55. doi:10.2174/1568026054367629 |
| [5] | 何雁冰, 徐世元, 黄俊杰. 鞘内注射布美他尼在大鼠足底切口痛模型中的镇痛作用[J]. 中国疼痛医学杂志, 2014, 7 : 463-466. He Y B, Xu S Y, Huang J J. Analgesic effect of intrathecal injection of bumetanide in rats with postoperative incisional pain[J]. Chin J Pain Med, 2014, 7 : 463-466. |
| [6] | 姚明, 杨建平, 王丽娜, 等. 腹水传代与体外培养Walker 256癌细胞系建立大鼠骨癌痛模型的可行性[J]. 中华医学杂志, 2008, 83 (13) : 880-4. Yao M, Yang J P, Wang L N, et al. Feasibility of establishment of rat model if bone cancer pain by using Walker 256 cells cultured in vitro or in vivo[J]. Natl Med J China, 2008, 83 (13): 880-4. |
| [7] | Brigatte P, Sampaio S C, Gutierrez V P, et al. Walker 256 tumor-bearing rats as a model to study cancer pain[J]. Pain, 2007, 8 (5): 412-21. doi:10.1016/j.jpain.2006.11.006 |
| [8] | Mao-Ying Q L, Wang X W, Yang C J, et al. Robust spinal neuroinflammation mediates mechanical allodynia in Walker 256 induced bone cancer rats[J]. Mol Brain, 2012, 5 : 16. doi:10.1186/1756-6606-5-16 |
| [9] | Wang J, Zhang R, Dong C, et al. Topical treatment with Tong-Luo-San-Jie gel alleviates bone cancer pain in rats[J]. J Ethnopharmacol, 2012, 143 (3): 905-13. doi:10.1016/j.jep.2012.08.026 |
| [10] | Richardson C, Rafiqi F H, Karlsson H K, et al. Activation of the thiazide-sensitive Na+-Cl- cotransporter by the Wnk-regulated kinases spak and osr1[J]. J Cell Sci, 2008, 121 (5): 675-84. doi:10.1242/jcs.025312 |
| [11] | Ahmed M M, Lee H, Clark Z, et al. Pathogenesis of spinal cord injury induced edema and neuropathic pain: Expression of multiple isoforms of Wnk1[J]. Ann Neurosci, 2014, 21 (3): 97-103. |
| [12] | Hasbargen T, Ahmed M M, Miranpuri G, et al. Role of Nkcc1 and Kcc2 in the development of chronic neuropathic pain following spinal cord injury[J]. Ann N Y Acad Sci, 2010, 1198 (1): 168-72. doi:10.1111/j.1749-6632.2010.05462.x |
| [13] | He Y, Xu S, Huang J, et al. Analgesic effect of intrathecal bumetanide is accompanied by changes in spinal sodium-potassium-chloride co-transporter 1 and potassium-chloride co-transporter 2 expression in a rat model of incisional pain[J]. Neural Regen Res, 2014, 9 (10): 1055-62. doi:10.4103/1673-5374.133170 |

