


2. 中国医学科学院北京协和医学院药物研究所,北京 100050;
3. 美国俄亥俄州立大学药学院药理室, 美国 哥伦布市 43210;
4. 合肥医工医药有限公司,安徽 合肥 230031
 ,
KANG Chen3,
CHEN Mei-ling1,
, ZHOU Pei-pei1,
HE Guang-wei4,
CUI Ya-jiao1,
YANG Di1,
WU Yu-lin1
,
KANG Chen3,
CHEN Mei-ling1,
, ZHOU Pei-pei1,
HE Guang-wei4,
CUI Ya-jiao1,
YANG Di1,
WU Yu-lin1

2. Institute of medicine, Chinese Academy of Medical Sciences, Peking Union Medical College, Beijing 100050, China ;
3. Division of Pharmacology, College of Pharmacy, The Ohio State University, Columbus, OH, USA 43210 ;
4. Hefei Medical Professionals Pharmaceutical Co., LTD, Hefei 230031, China
脑缺血/再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)可发生于多种脑血管疾病过程中,其病理生理机制是涉及多环节、多因素、多途径损伤的复杂的酶促级联反应。脑缺血可以引起严重的神经损伤,影响病人的神经功能恢复和预后。而脑水肿是缺血性脑血管病中常见的并发症之一,它可以引起颅内高压、加重病情,甚至造成病人死亡。目前,由于对脑水肿发生的机制尚不十分清楚,因此,临床治疗也仅限于对症处理,不能达到标本兼治的目的。关于脑水肿的发生存在着脑微循环障碍、脑机能代谢障碍、血脑屏障障碍、自由基增加、钙超载、膜分子结构紊乱等多种学说。而脑内血脑屏障(blood brain barrier,BBB)通透性改变既是损伤后的结果,又是导致损伤进一步加重的重要因素[1]。水通道蛋白4(aquaporin,AQP4)是膜水通道蛋白家族的一员,在脑组织中广泛表达,是控制水进出脑组织的通道,在脑组织水平衡、星形细胞迁移、神经兴奋及炎症等方面均起着重要作用[2]。大量研究表明,AQP4与脑水肿关系密切,参与了多种疾病所引起的脑水肿的病理过程。先前的大量研究[3]显示,脑缺血/再灌注(ischemia-reperfusion, I/R)早期,迅速引起脑损伤,损伤程度随时间变化很大,这一时期所造成的脑水肿程度也最为严重。更有研究指出,I/R发生的48h之内是脑水肿发展的关键时期,也是临床药物治疗的黄金时期。本课题组先前的研究[4]也证实了上述的研究。为了进一步研究CIR发生前48 h内各时间段具体的病理生理过程,我们选取了I/R-6h、I/R-12h、I/R-24h及I/R-48h这4个重要的时间节点分别进行研究,以期探寻大鼠脑缺血/再灌注后早期水通道蛋白4(aquaporin4,AQP4)及相关蛋白的动态表达规律及其与脑水肿关系。
1 材料 1.1 材料与试剂水合氯醛[(A.R.中国医药(集团)上海化学试剂公司)];氯化-2, 3, 5-三苯基四氮唑(TTC)(Biosharp公司);0.9%氯化钠注射液(生理盐水)(湖南科伦制药有限公司);生物素标记山羊抗兔IgG/小鼠IgG二抗试剂盒(北京中杉金桥生物技术有限公司);Western一抗、二抗去除液、Western转膜液、BCA蛋白浓度测定试剂盒(增强型)、SDS-PAGE凝胶配制试剂盒和SDS-PAGE电泳液均购自碧云天生物技术研究所;ProSieve Color ptrotein makers(美国Lonza Rockland公司)。PVDF膜(0.45 μm;美国SERVA公司);增强型化学发光试剂(美国Millipore公司);所用单克隆抗体为:AQP4和JAM-1((美国Abcam公司),MMP-9(美国Cell Signaling Technology公司),Occludin(美国Santa Cruz公司),β-actin(美国Ambobio公司);PCR引物(中国BioSune);逆转录试剂盒(美国ThermoFisher公司)。
1.2 仪器JA1203精密电子天平,HH.S21-6-S恒温水浴锅,DHG-9143BS-Ⅲ电热恒温鼓风干燥箱,80-2型电动离心机,Infinite M 200 PRO全波长酶标仪,TP1020自动脱水机,RM型石蜡切片机,Tission-Tek TEL组织包埋中,Azure cSeries 400型化学发光显影仪。
1.3 动物健康♂ Sprague-Dawley (SD)大鼠,SPF级,体质量250~300 g,由江苏大学提供,合格证号:SCXK(苏)2013-0011
2 方法 2.1 动物分组及给药150只SD大鼠,随机分为假手术对照组和脑缺血/再灌注(ischemic/reperfusion, I/R)模型组。I/R模型组按照时间点不同分为I/R后6、12、24、48 h 4个时间点组别,每个时间点各设置1个假手术组。每组I/R大鼠各30只,假手术对照大鼠各6只。
2.2 模型构建将麻醉成功的大鼠固定好,暴露左侧颈总动脉,钝性分离左侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA)及迷走神经。在颈外动脉下垫双线分别两次结扎颈外动脉,两节点之间保留一定距离(约2 mm)。用血管夹夹闭颈总动脉、颈内动脉,将右侧颈外动脉近心段剪开一小口,将所做成线栓子缓慢插入ECA及ICA入颅至大脑中动脉(MCA)开口处,鱼线插入的平均深度为(18.5±0.5) mm,外留1 cm长渔线,此时即在大脑中动脉起始端堵塞大脑中动脉,造成局灶性脑缺血,结扎渔线与血管。缺血后120 min实施再灌注,即将置于皮下的渔线尾端轻轻拔出,扎死CCA前端,消毒并逐层缝合皮肤。假手术组:除不插鱼线外,其余操作与手术组相同。
2.3 神经行为学评分模型制作成功后,按照Bederson的方法对大鼠的行为缺陷进行评分,分数越高,大鼠行为障碍越严重。评分结束后,挑选评分在1~3分者入组,造模后死亡及评分为4分的实验鼠排除入组,参考Berderson[5]评分标准在4个时间点对实验鼠进行神经功能评分。
| Score | Changes of neural behavior |
| 0 points | No neurological symptoms were observed, normal behavior |
| 1 points | At the end of the lifting of the tail, the animal's operation on the side of the front legs of the performance of the wrist elbow flexion, shoulder rotation |
| 2 points | When the animal is placed on a smooth plane, the resistance is reduced when the side of the shoulder moves toward the side of the operation side |
| 3 points | When walking to the animal free operation on the side ring or circle |
| 4 points | Soft paralysis, no spontaneous activity or death of the limbs |
大鼠脑缺血/再灌注后48 h,经尾静脉注射伊文思蓝(2%,4 mL·kg-1),注射完依文思蓝后2 h麻醉大鼠,将其固定于鼠板上,打开胸腔,用12号针头经左心室插入心脏,并在右心耳处剪口,用静脉滴注的方式将0.9%生理盐水灌注入心脏(灌注压为110 mmHg),至右心耳流出无色清亮的液体,断头取脑,去除硬脑膜,生理盐水冲洗后,滤纸吸干表面水分,取缺血侧大脑称其湿重后置于甲酰胺溶液(每100 mg脑组织中加入1 mL甲酰胺)中,56 ℃水浴24 h。24 h后1 000 r·min-1离心5 min,用吸管轻吸出上清液,可见光分光光度计(λ=632)测定上清液OD值,甲酰胺做空白比色,按公式计算脑组织EB含量:脑组织EB渗透率=(左脑OD值/左脑重量)/(右脑OD值/右脑重量)。
2.5 脑组织含水量测定采用干湿重法测定脑含水量。不同时相点,大鼠处死后迅速取脑,将取出的脑组织放在培养皿中,培养皿内含有生理盐水温润的定性滤纸,以防止脑组织水分蒸发。去除皮质表面的软脑膜、小脑、脑干,用滤纸轻轻拭去脑组织表面的血迹,分离获取梗死侧大脑半球,置于称量杯中称取湿重,从取脑到称重完毕时间控制在5min内。然后将脑组织放入电热恒温箱中,100℃烘干24~48 h烘烤至恒重,记录干重(两次干重之差≤0.2 mg)。按如下公式计算:脑组织含水量/%=(湿重-干重)/湿重×100%。
2.6 脑梗死体积百分比I/R之后,将各实验鼠麻醉后迅速断头取脑,切除嗅球和低位脑干,用生理盐水冲洗后迅速将脑组织置于-20℃冰箱中速冻15~20 min,取出脑组织放入脑槽中,在冰床上进行操作。大脑沿冠状面自前脑额极起向后连续切片,一般切成5~6片、厚度平均约2 mm的冠状脑切片。小心的将脑片置于2% TTC溶液中,放入37℃恒温箱中避光孵育30 min。正常脑组织可染成深红色,梗死灶为白色,将脑片置于4%多聚甲醛中固定12 h,数码照相机拍照。选择每一切面的额侧面用Image-pro plus6.0图像分析软件计算每张脑片的面积和梗死面积。大鼠脑梗死百分比=(正常侧大脑半球体积-梗死侧非梗死区大脑半球的体积)/正常侧大脑半球体积%=[(A1′+A2′+…+An′)d-(A1+A2+…+An)d]/(A1′+A2′+…+An′)d%,An′表示每片正常脑组织面积,An表示梗死侧非梗死区每片脑组织面积,d表示每片厚度。以此百分比来代表脑梗死灶的体积,表示I/R后脑损伤的严重程度。
2.7 脑组织取材大鼠脑缺血/再灌注后,将大鼠断头处死,迅速置于冰盘上分离脑组织,在视交叉前行冠状切取脑组织,取右侧脑组织块在冰冷的生理盐水中漂洗称重,分离的梗死脑组织半球再分为两部分:一部分用4%多聚甲醛固定,后续经脱水、透明、包埋,制成脑组织石蜡块;另一部分置于EP管,于液氮中保存待用。
2.8 免疫组化测定AQP4的表达及分布取石蜡切片常规脱蜡,磷酸盐缓冲液PBS(PH 7.4)洗涤,浸入3%过氧化氢封闭液中室温封闭30 min。枸橼酸缓冲液(0.01 mol·L-1,PH 6.0)高压3 min,冷却至室温后滴加5% BSA室温孵育。PBS洗涤后滴加一抗4℃湿盒过夜。次日切片恢复至室温后分别滴加二抗和辣根酶标记工作液,37℃温箱分别孵育20 min。PBS洗涤后DAB显色,苏木精轻度复染,自来水水洗返蓝,梯度酒精常规脱水,中性树胶封片,于Eclipse TE 2000-S免疫荧光显微镜下观察结果。
2.9 Western blot先提取总蛋白再用BCA法测定总蛋白浓度。30~50 μg总蛋白上样量以浓度为8%的凝胶电泳分离。冰水浴下恒流(300 mA)湿法转膜1.5 h,以体积分数5%的脱脂奶粉封闭1 h,加一抗。4℃共孵育过夜。TBS-T洗涤,与二抗共孵育2 h,用增强型化学发光试剂进行显色,并利用灰度分析软件定量分析,以β-actin的灰度值标化蛋白表达水平。
2.10 Quantitive real-time polymerase chain reaction(qRT-PCR)取约100 mg脑组织放入研钵中,加入少量液氮敲碎,用预冷的广口枪头转移至匀浆器中,加入1 mL TRIzol匀浆使裂解充分,转移至EP管中待用;提取组织总RNA;按AMV逆转录试剂盒操作说明进行逆转录后,4℃保存。扩增条件: 94℃ 15 s,55 ℃ 15 s,72 ℃ 20 s,共35个循环。2%琼脂糖凝胶电泳后,凝胶成像仪观察,用BandScan 5.0软件测定条带灰度值,将各mRNA表达水平分别与β-actin mRNA灰度值的比值作为观察指标,进行统计学分析。扩增引物如下表。
2.11 统计学处理应用SPSS19.0统计软件进行数据处理,数据均以x±s表示,组间差异比较采用方差分析及t检验。
3 结果 3.1 I/R大鼠的一般特征实验期间,Sham组大鼠一般状态良好、健壮、皮毛有光泽,对外界反应灵敏,无死亡。与Sham组比较,I/R组大鼠精神萎靡,出现运动功能障碍,行走向对侧旋转或倾倒,甚至瘫痪。Sham组造模全部成功,I/R模型组造模成功96只,成功率80%。
3.2 神经功能评分Sham组因未闭塞大脑中动脉,故未出现局灶性神经功能缺损症状,评分均为0分;而在造模后I/R模型组神经功能评分均3分左右,表明各模型组均出现不同程度的神经功能缺损症状,行走向对侧旋转或倾倒。随着再灌注时间延长,自6~48 h神经功能缺损症状呈逐渐加重趋势;与I/R-6 h相比较,I/R-24 h及I/R-48 h神经功能评分差异有显著性(均为P < 0.05),见Fig 1。
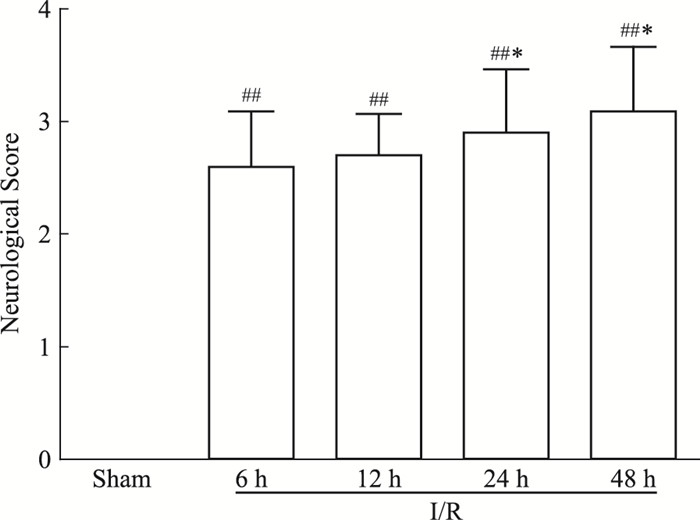
|
| Fig 1 Score of nerve function for I/R rats at different time points(x±s, n=6) ##P < 0.01 vs Sham; *P < 0.05 vs I/R-6 h |
实验结果如Tab 4、Fig 2所示,EB染色范围反映了大鼠血脑屏障通透性。I/R组与假手术组相比,血脑屏障通透性明显增加(P < 0.01);随着时间的持续,与I/R-6 h相比较,I/R-24 h及48 h脑组织均明显增加血脑屏障通透性(P < 0.05),而I/R-12 h与I/R-6 h组相比较略有增加,但相互之间差异无显著性(P > 0.05), 见Fig 2。
| Gene | Forward primers(sense/antisense 5′-3′) | Reverse primers(sense/antisense 5′-3′) | Length |
| AQP-4 | GGAATTTCTGGCCATGCTTA | AAGACAGACTTGGCGATGCT | 231 |
| MMP-9 | GGTCCCCCCACTGCTGGCCCTTCTACGGCC | GTCCTCAGGGCACTGCAGGATGTCATAGGT | 504 |
| JAM-1 | GGTCAAGGTCAAGCTCAT | CTGCATTTGCCTTACTCAG | 581 |
| Occludin | TCAGGGAATATCCACCTATCACTTCAG | GTGAAGAGTACATGGCTGCTGCTGATC | 136 |
| β-actin | CTGCCGCATCCTCTTCCTC | CTCCTGCTTGCTGA TCCACTA | 398 |
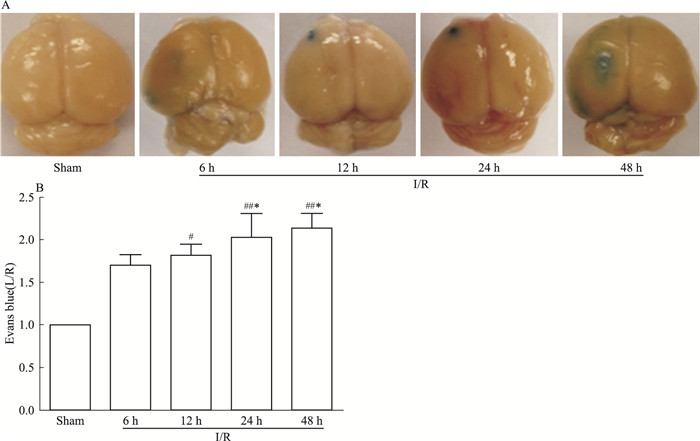
|
| Fig 2 Changes of evans blue(EB) extravasation for I/R rats(x±s, n=6) A:Typical images of evans blue(EB) extravasation at 48 h after MCAO. The blue region indicated BBB was broken; B:TSF extenuated BBB hyperpermeability after ischemic stroke.#P < 0.05, ##P < 0.01 vs Sham; *P < 0.05 vs I/R |
Sham组各时间点脑组织含水量都维持在较低的正常水平,相互之间差异无显著性;与Sham相比较,I/R组各时间点,脑含水量明显增加(均为P < 0.05);随着再灌注时间延长,各组别脑含水量均逐渐升高,与I/R-6 h相比较,I/R-12 h、24 h及48 h差异均存在显著性(均P < 0.05), 见Fig 3。
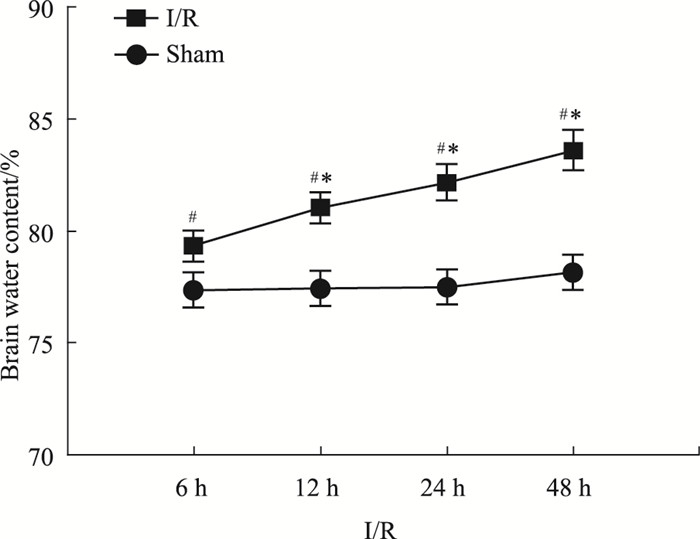
|
| Fig 3 Changes of brain water for I/R rats at different time points #P < 0.05 vs Sham; *P < 0.05 vs I/R-6 h |
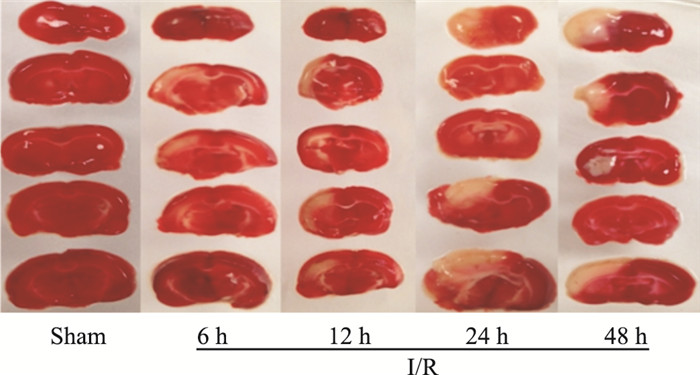
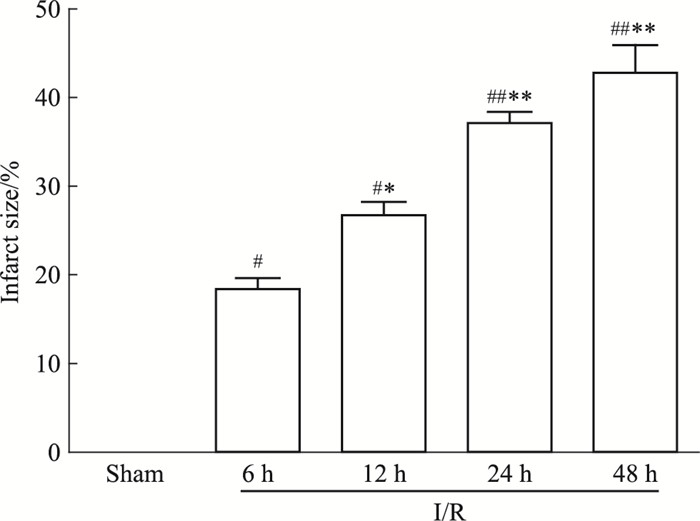
与假手术组相比,I/R各组脑组织梗死范围从再灌注6 h逐渐升高(P < 0.05),再灌注48 h达到峰值,差异有显著性(P < 0.01)。假手术组无缺血改变,TTC染色呈均匀红色。I/R组梗死体积百分比,随再灌注时间的延长逐渐增加(P < 0.05),在I/R-48 h达最大(Fig 4,5)。
|
| Fig 4 Volume of cerebral infarction for I/R rats at different time points |
|
| Fig 5 Cerebral infarction for I/R rats at different time points(x±s, n=6) #P < 0.05, ##P < 0.01 vs Sham; *P < 0.05, **P < 0.01 vs I/R-6 h |
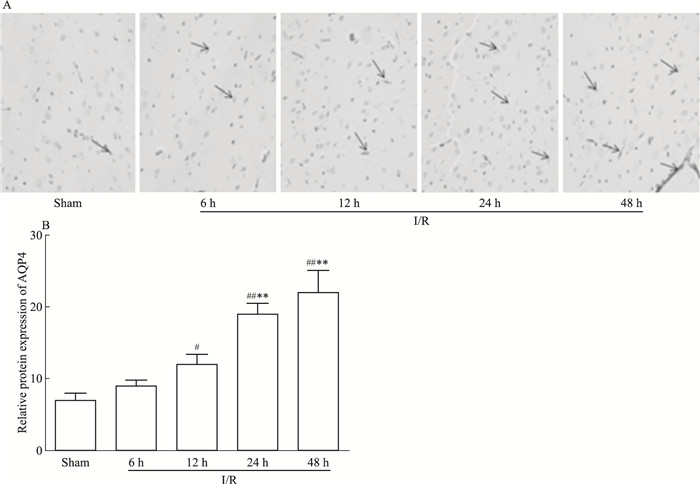
在免疫组化中检测中,AQP4表达阳性细胞内显示棕黄色颗粒。如Fig 6分布图及统计图所示,AQP-4蛋白在Sham组表达很少,与Sham组相比较,I/R模型组各时间点I/R脑组织AQP-4蛋白表达差异均有不同程度的上调,其中I/R-12 h、24 h及48 h差异均存在显著性(分别为P < 0.05,P < 0.01,P < 0.01)。与I/R-6 h相比较,AQP-4蛋白在I/R-24 h及48 h的表达水平差异均有显著性(分别为P < 0.05,P < 0.01),I/R-12h的表达亦增高,差异无显著性(P > 0.05 vs I/R-6 h),Fig 6。
|
| Fig 6 Expression and distribution of AQP4 protein level in brain for I/R rats at different time points(x±s, n=6) #P < 0.05, ##P < 0.01 vs Sham; *P < 0.05, **P < 0.01 vs I/R-6 h |
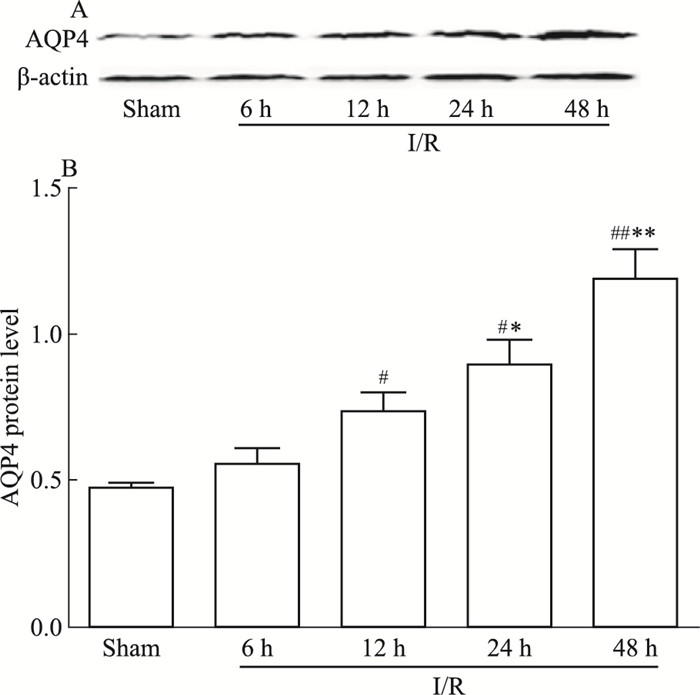
如Fig 7 Western blot条带及灰度定量分析结果所示,I/R模型组各时间点AQP4蛋白表达升高,其中I/R-24 h及48 h蛋白表达升高显著,与Sham组差异存在显著性(分别为P < 0.05,P < 0.01 vs Sham);与I/R-6h模型组相比较,I/R-24 h及48 h时间点,AQP4蛋白表达增加明显(P < 0.05,P < 0.01 vsI/R-6 h),I/R-12 h模型组表达增加不明显(P > 0.05), 见Fig 7。
|
| Fig 7 Expression of AQP4 protein level in brain for I/R rats at different time points(x±s, n=6) #P < 0.05, ##P < 0.01 vs Sham; *P < 0.05, **P < 0.01 vs I/R-6 h |
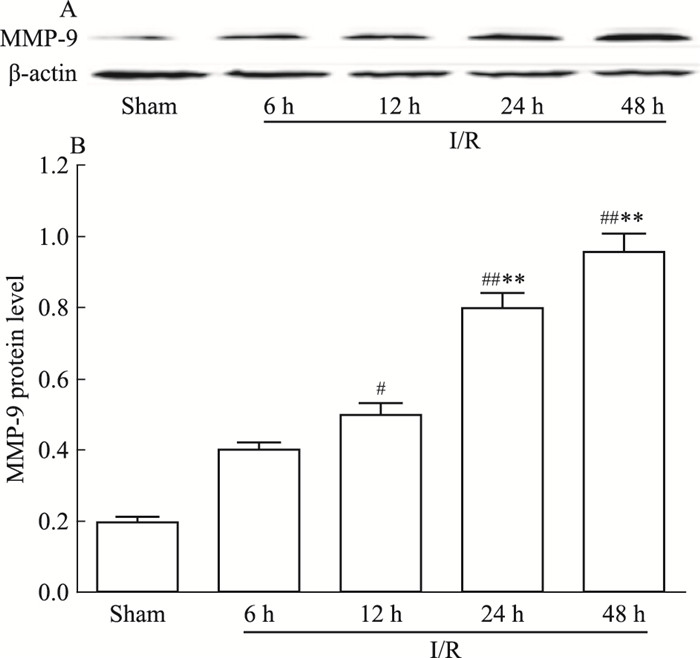
如Fig 8 Western blot检测结果所示,与AQP4蛋白表达趋势相似。I/R模型组各时间点MMP-9蛋白表达持续升高,其中I/R-12 h、24 h及48 h蛋白表达均明显升高,与Sham组差异存在显著性(分别为P < 0.05,P < 0.01,P < 0.01);与I/R-6 h模型组相比较,I/R-24 h及48 h时间点,MMP-9蛋白表达增加明显(均为P < 0.01),I/R-12 h模型组表达有增加趋势,但与I/R-6 h组差异无显著性(P > 0.05), 见Fig 8。
|
| Fig 8 Expression of MMP-9 protein level in brain for I/R rats at different time points(x±s, n=6) #P < 0.05, ##P < 0.01 vs Sham; **P < 0.01 vs I/R-6 h |
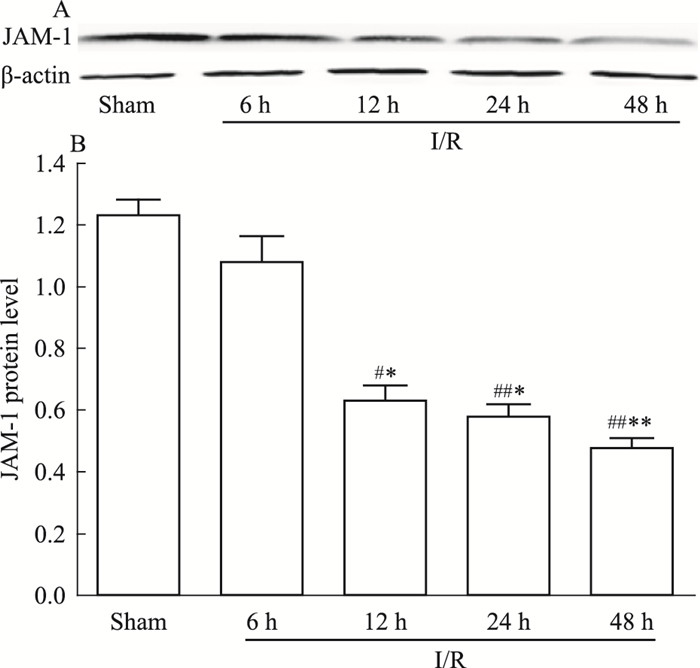
如Fig 9结果所示,Sham组JAM-1蛋白表达水平较高,I/R模型组各时间点,随着I/R时间的延长,JAM-1蛋白表达持续降低;其中I/R-12 h、24 h及48 h蛋白表达均降低明显,与Sham组差异存在显著性(分别为P < 0.05,P < 0.01,P < 0.01),I/R-6 h模型组降低不明显(P > 0.05);与I/R-6 h模型组相比较,I/R-12 h、24 h及48 h时间点,JAM-1蛋白表达均降低明显(P < 0.05,P < 0.01,P < 0.01), 见Fig 9。
|
| Fig 9 Expression of JAM-1 protein level in brain for I/R rats at different time points(x±s, n=6) #P < 0.05, ##P < 0.01 vs Sham; *P < 0.05, **P < 0.01 vs I/R-6 h |
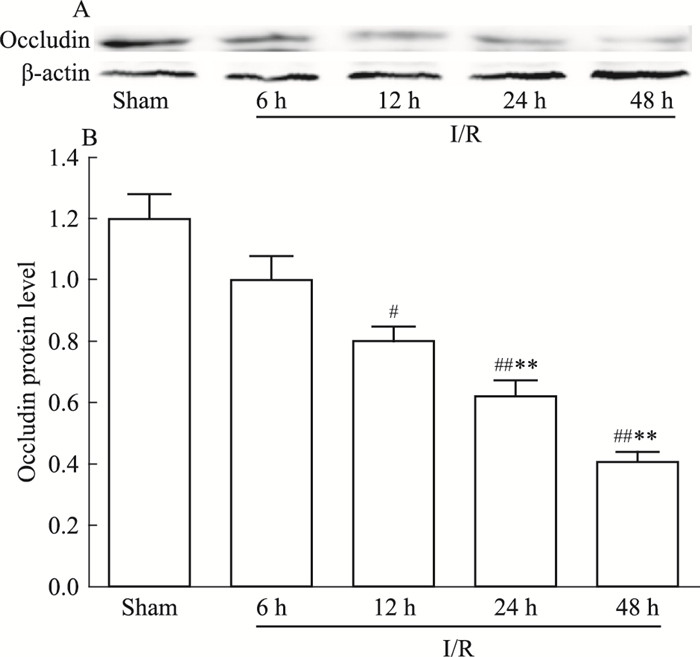
Occludin蛋白表达变化与JAM-1蛋白表达趋势相似,Sham组蛋白表达水平较高,I/R模型组各时间点,随着I/R时间的延长,Occludin蛋白表达稳步降低;其中I/R-12 h、24 h及48 h蛋白表达均降低明显,与Sham组差异存在显著性(分别为P < 0.05,P < 0.01,P < 0.01),I/R-6 h模型组降低不明显(P > 0.05);与I/R-6 h模型组相比较,I/R-24 h及48 h时间点,Occludin蛋白表达均降低明显(均为P < 0.01),I/R-12 h模型组降低不明显(P > 0.05), 见Fig 10。
|
| Fig 10 Expression of Occludin protein level in brain for I/R rats at different time points(x±s, n=6) #P < 0.05, ##P < 0.01 vs Sham; **P < 0.01 vs I/R-6 h |
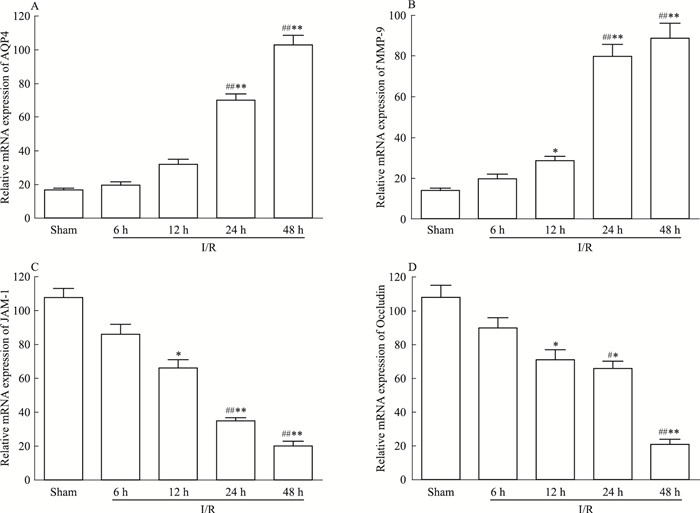
RT-PCR检测I/R大鼠模型脑组织相关基因转录水平的差异,见Fig 11,结果显示,AQP4 mRNA水平在I/R模型各时间点均高于Sham组,其中I/R-24 h及48 h AQP4 mRNA的水平明显高于Sham组和I/R-6 h时间点模型组(P < 0.01);MMP-9 mRNA水平在I/R-6 h升高不明显,I/R-12 h、24 h及48 h升高明显(P < 0.05,P < 0.01,P < 0.01),与I/R-6 h相比较,I/R-12 h变化不大,I/R-24 h及48 h升高明显(均为P < 0.01);JAM-1 mRNA水平在Sham组表达较高,I/R模型组在12 h以后降低明显(分别P < 0.05,P < 0.01,P < 0.01),与I/R-6 h相比较,I/R-24 h及48 h降低明显(均P < 0.01);Occludin mRNA水平与JAM-1 mRNA表达变化趋势相似,I/R-12 h、24 h及48 h降低明显(P < 0.05,P>0.01,P < 0.01),其中I/R-24 h及48 h相对于I/R-6 h降低明显(P < 0.05,P < 0.01),见Fig 11。
|
| Fig 11 Expression of mRNA levels of related factors with AQP4 in brain for I/R rats at different time points(x±s, n=6) A:Relative mRNA expression of AQP4;B:Relative mRNA expression of MMP-9;C:Relative mRNA expression of JAM-1;D:Relative mRNA expression of Occludin.#P < 0.05, ##P < 0.01 vs Sham; *P < 0.05, **P < 0.01 vs I/R-6 h |
近年来,在脑缺血病理生理方面的大量研究表明,缺血性脑损伤过程中,除缺氧和能量代谢衰竭外,由缺血诱导的一系列瀑布样效应是导致神经元死亡的重要机制[6]。
本实验结果显示,I/R后各时间段模型大鼠神经功能评分都增加,且随着时间延长,神经功能评分也就越高;随后的脑组织取材研究中也显示,无论是脑组织含水量、脑组织通透率,还是脑梗死体积分数都随着时间的延长而进行性加重。
为了进一步探讨I/R后早期脑水肿发生的相关分子机制,我们对I/R模型脑组织中AQP4表达水平进行相关的检测。先前的研究表明[2],水分子的主动转运和平衡调节需要水通道蛋白参与。进一步研究表明[4],AQP4与脑水肿的形成密切相关,广泛参与I/R后脑损伤的不同发展阶段。近年来,AQP4参与脑水肿的形成越来越受到关注,成为脑水肿的治疗靶点[7-8]。AQP4主要表达于毛细血管周围的星形胶质细胞足突和室管膜细胞,尤其在星形胶质细胞表达丰富。之前的研究已经表明,短暂性I/R增加AQP4的表达,导致脑水肿。本研究通过免疫组化及Western blot技术手段研究缺血区AQP4蛋白的表达水平及脑组织分布特征,研究结果表明,AQP4蛋白表达水平随着时间的延长迅速的增加,在I/R-48 h时间点达到最大表达水平。伴随着脑水肿程度加重,AQP4蛋白的表达增强,这一结果表明,AQP4的表达变化与I/R后脑水肿的形成密切相关。之后的RT-PCR测定AQP4 mRNA的表达也验证了上述结果。
紧密连接(tight junction, TJ)是存在于BBB上内皮细胞与毛细血管之间的复杂的细胞系统,是BBB的结构基础,对维持BBB生理功能具有重要意义[9]。Occludin和JAM-1是组成TJ的主要结构蛋白,是衡量TJ功能变化的重要指标[10]。研究显示[11],Occludin和JAM-1与BBB通透性的调节密切相关,其表达变化可作为衡量BBB损伤程度的标志。Terry等[12]研究证实,Occludin与脑微血管内皮细胞的“屏障”作用密切相关。进一步研究表明,在脑微血管内皮系统损伤中,Occludin含量降低,伴随着BBB通透性的降低。与此同时,研究显示JAM-1参与紧密连接创伤后的再修复及上皮屏障功能的调节,JAM-1的表达与Occludin相一致,提示JAM-1同样参与脑组织紧密连接的构成。本研究通过对TJPs的蛋白表达检测,发现随着I/R后时间的延长,JAM-1及Occludin蛋白的表达水平降低,伴随着血脑屏障通透性的增加以及脑含水量的增加。据此我们推测I/R导致的脑损伤是通过下调TJPs的表达,包括JAM-1及Occludin在内的相关蛋白表达水平下降,从而降低了血脑屏障完整性,增加了I/R后血脑屏障的通透性,从而造成了不断加重的脑水肿症状。
MMP-9是脑缺血后过度表达的炎症因子。研究证实[13-14],MMP-9可以通过降解Occludin等紧密连接蛋白,导致血脑屏障通透性增加。脑缺血时给予MMP-9组织抑制剂或MMP-9中和抗体治疗,可明显降低血脑屏障通透性,减小梗死体积[15]。进一步阐明脑水肿发生过程中TJPs表达降低的具体病理生理过程,我们检测了MMP-9蛋白的表达水平。Western blot结果显示,随着I/R后脑损伤的加剧,MMP-9的表达也是相伴增加的。
由此,我们推测I/R后伴随着脑组织损伤而产生的脑水肿可能是因为MMP-9蛋白的过表达,导致脑组织中大量的JAM-1及Occludin蛋白的降解,破坏了脑血脑屏障的结构与功能,大量的AQP4蛋白的表达,使得脑组织水及电解质转运紊乱,各种炎性介质也随之进入脑组织,从而导致脑水肿的发生与不断的发展。总之,本部分研究内容从分子角度初步探究了I/R后脑水肿形成的病理生理过程,为进一步药物干预研究提供了研究基础和理论依据,也为临床预防和治疗脑水肿将提供重要的参考。
( 致谢: 本实验全部由中国药科大学药理学实验室吴玉林老师课题组独立完成,感谢我的导师吴玉林老师在实验设计思路上提出的建议和意见及实验技术上给予的指导。 )
| [1] | Zhu M X, Xing D, Lu Z H, et al. DDR1 may play a key role in destruction of the blood-brain barrier after cerebral ischemia-reperfusion[J]. Neurosc Res, 2015, 96 : 14-9. doi:10.1016/j.neures.2015.01.004 |
| [2] | 缪睿, 李昌煜. 水通道蛋白-依赖性细胞迁移的研究进展[J]. 中国药理学通报, 2011, 27 (5) : 601-5. Miao R, Li C Y. The research progress of AQP-dependent cell migration[J]. Chin Pharmacol Bull, 2011, 27 (5): 601-5. |
| [3] | Toscano E C, Silva B C, Victori E C. Platelet-activating factor receptor(PAFR) plays a crucial role in experimental global cerebral ischemia and reperfusion[J]. Brain Res Bull, 2016, 124 : 55-61. doi:10.1016/j.brainresbull.2016.03.022 |
| [4] | 许淑红, 尹茂山, 吴玉林. 吡拉格雷钠对氧糖剥夺/复氧后星形胶质细胞水肿及AQP4表达的影响[J]. 中国药理学通报, 2015, 31 (12) : 1661-7. Xu S H, Yin M S, Wu Y L. Effects of Tetramethylpyrazine-2′-O-Sodium Ferulate on the swelling of astrocytes and the expression of AQP4 after oxygen-glucose deprivation[J]. Chin Pharmacol Bull, 2015, 31 (12): 1661-7. |
| [5] | Bederson J B, Pitts L H, Tsuji M, et al. Rat middle cerebral artery occlusion:Evaluation of the model and development of a neurologic examination[J]. Stroke, 1986, 17 (6): 472-6. |
| [6] | 涂献坤, 石松生, 杨卫忠, 等. 齐留通通过激活ERK1/2信号通路减轻大鼠脑缺血炎症反应和缺血性脑损伤[J]. 中国药理学通报, 2014, 30 (10) : 1441-4. Tu X K, Shi S X, Yang W Z, et al. Zileuton via ERK1/2 pathway to alleviate cerebral ischemia inflammatory reaction in rats with ischemic brain injury[J]. Chin Pharmacol Bull, 2014, 30 (10): 1441-4. |
| [7] | 赵薇, 王树, 李方江. 大黄酚对小鼠脑缺血/再灌注脑组织抗氧化应激和AQP4的影响[J]. 中国药理学通报, 2015, 31 (10) : 1477-8. Zhao W, Wang S, Li F J. Effects of chrysophanol on antioxidative stress and AQP4 in brain tissue of mice induced by cerebralischemia-reperfusion injury[J]. Chin Pharmacol Bull, 2015, 31 (10): 1477-8. |
| [8] | Tajes M, Ramos-Fernández E, Weng-Jiang X, et al. The blood-brain barrier: Structure, function and therapeutic approaches to cross it[J]. Mol Membr Biol, 2014, 31 (5): 152-67. doi:10.3109/09687688.2014.937468 |
| [9] | Lécuyer M A, Kebir H, Prat A. Glial influences on BBB functions and molecular players in immune cell trafficking[J]. Biochim Biophys Acta, 2016, 1862 (3): 472-82. doi:10.1016/j.bbadis.2015.10.004 |
| [10] | Shin J A, Yoon J C, Kim M, Park E M. Activation of classical estrogen receptor subtypes reduces tight junction disruption of brain endothelial cells under ischemia/reperfusion injury[J]. Free Rad Biol Med, 2016, 92 : 78-89. doi:10.1016/j.freeradbiomed.2016.01.010 |
| [11] | Liu W Y, Wang Z B, Zhang L C, et al. Tight junction in blood-brain barrier: an overview of structure, regulation, and regulator substances[J]. CNS Neurosci Ther, 2012, 18 (8): 609-15. doi:10.1111/cns.2012.18.issue-8 |
| [12] | Terry S, Nie M, Matter K, et al. Rho signaling and tight junction functions[J]. Physiology(Bethesda), 2010, 25 (1): 16-26. |
| [13] | Jia W, Martin T A, Zhang G, et al. Junctional adhesion molecules in cerebral endothelial tight junction and brain metastasis[J]. Anticancer Res, 2013, 33 (6): 2353-9. |
| [14] | Jiao H, Wang Z, Liu Y, et al. Specific role of tight junction proteins claudin-5, occludin, and ZO-1 of the blood-brain barrier in a focal cerebral ischemic insult[J]. J Mol Neurosci, 2011, 44 (2): 130-9. doi:10.1007/s12031-011-9496-4 |
| [15] | Fang X, Tao D B, Shen J S, et al. Neuroprotective effects and dynamic expressions of MMP9 and TIMP1 associated with atorvastatin pretreatment in ischemia-reperfusion rats[J]. Neurosc Lett, 2015, 603 : 60-5. doi:10.1016/j.neulet.2015.07.013 |