


2. 湖南中医药大学 药学院,湖南 长沙 410208;
3. 澳门科技大学中药质量研究国家重点实验室,澳门 999078
 ,
ZENG Rong2
,
ZENG Rong2 ,
LI Xin1,
SONG Hou-pan1,
WEI Yan-xia1,
LI Ru-yi1,2,
LI Tao2,
LIU Liang3,
WANG Wei2
,
LI Xin1,
SONG Hou-pan1,
WEI Yan-xia1,
LI Ru-yi1,2,
LI Tao2,
LIU Liang3,
WANG Wei2
 ,
CAI Xiong1
,
CAI Xiong1

2. School of Pharmaceutical Sciences, Hunan University of Chinese Medicine, Changsha 410208, China ;
3. State Key Laboratory of Quality Research in Chinese Medicine, Macau University of Science and Technology, Macau 999078
类风湿关节炎(rheumatoid arthritis, RA)是一种以关节滑膜病变、软骨及骨组织侵蚀,最终导致关节结构破坏、畸形为临床特征的慢性、对称性、系统性的自身免疫炎性疾病[1]。流行病学研究表明,全球RA发病率约为0.5%~1.2%,我国RA患病率约为0.28%,其5年致残率高达30%~50%,是造成人类劳动力丧失和致残的主要疾病[2-3]。
目前国内外临床治疗RA常用传统缓解病情抗风湿药(DMARDs)及生物制剂,也包括改善症状的非甾体类抗炎药(NSAIDs)和糖皮质激素,但常用DMARDs如甲氨蝶呤、来氟米特等存在疗程长、病人难以耐受、明显肝肾损害等毒副反应问题,而新型生物制剂价格昂贵,长期使用且有可能诱发癌症[4-5]。中医药治疗自身免疫疾病历史悠久,其疗效主要通过整体调节实现,对病情的缓解和治疗均具有明显的优势,且大部分毒副作用小,使用中医药治疗RA已成为发展趋势[6]。经典土家族药物血筒,为五味子科南五味子属植物异型南五味子Kadsuraheteroclita(Roxb) Craib的藤茎,具有补血活血、祛风除湿、行气止痛之功效,土家民族民间习用于治疗风湿痹痛、骨痛、风湿关节炎等[7-8]。
我们课题组对血筒进行了多年的化学成分研究工作,从其乙醇提取物中分离鉴定了40个单体化合物,其中新化合物24个,主要是具有生物活性的木脂素类和三萜类化合物[9-11]。近期的急毒评价显示血筒醇提物小鼠最大耐受剂量为26 g·kg-1,我们也发现血筒醇提物具有很好的抗炎镇痛药效作用。为探索血筒治疗RA的开发与应用,我们选择大鼠佐剂性关节炎(adjuvant-induced arthritis, AIA)模型,设定1.0 g·kg-1的血筒醇提物剂量,从临床症状、组织病理学、放射学及血清学等方面,初步评价血筒的抗关节炎药效作用,从而为下一步系统和深入研究其治疗RA药效作用及分子机制奠定基础。
1 动物与材料 1.1 动物SD ♂大鼠30只,体质量100 g~120 g(购自湖南斯莱克景达实验动物有限公司,合格证号43004700021529),适应性喂养7 d后开始实验。
1.2 药物血筒饮片经湖南中医药大学王炜教授鉴定为异型南五味子的干燥藤茎。血筒醇提物由湖南中医药大学第一附属医院药剂科制备(制备工艺:以8倍量95%的乙醇回流提取3次,每次2 h;浓缩干燥后,1 g干燥粉末相当于50 g原药材,提取率为2%)。采用0.3% CMC-Na溶液制备血筒醇提物均匀混悬液。
1.3 试剂0.3% CMC-Na(北京索莱宝生物科技有限公司,428A029);热灭活结核分枝杆菌H37Ra(美国Sigma Aldrich公司,20150411);矿物油(美国Sigma Aldrich公司,M8410);大鼠肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)、白介素6(IL-6)ELISA试剂盒(天津安诺瑞康生物技术有限公司,201608);异氟烷气体麻醉剂(深圳市瑞沃德生命科技有限公司,084978);苏木精-伊红染色液(南昌雨露实验器材有限公司,20160201);甲醛溶液(烟台市双双化工有限公司,20150318)。
1.4 仪器足肿测定仪(意大利UGO Basile 37140);高分辨率小动物微型CT(美国PerkinElmer-Caliper LS Quantum FX Demo);高速冷冻离心机(德国Eppendorf5810R);匀浆机(德国IKA T10 basic);气体麻醉机(美国赛极威小动物气体麻醉机SurgiVetCDS9000);电子天平(日本岛津ATY224)。
2 方法 2.1 造模及给药♂ SD大鼠30只,随机分为正常对照组、模型组和药物组,每组10只。模型组和药物组大鼠尾根部皮下注射0.1 mL含200 μg热灭活结核杆菌(H37Ra)的完全弗氏佐剂(CFA)[12-13]。自造模d 1起,每日灌胃给药,药物组灌服1.0 g·kg-1血筒醇提物,模型组灌服等容积0.3% CMC-Na溶液。
2.2 药效作用评价造模后,每天观察大鼠关节炎发病症状,每3 d进行后足肿胀体积测量、关节炎指数评分及体质量称量[13-14]。
2.3 放射学和病理学检查血筒治疗结束后,小动物CT扫描大鼠后足评价关节骨破坏程度;处死大鼠,切除后足,用福尔马林溶液固定,经脱钙处理,石蜡包埋、切片,HE染色后,于光镜下检查踝关节组织病理学变化。评分标准:正常:0分;轻度改变:1分;中等程度改变:2分;严重改变:3分[13, 15]。
2.4 炎性细胞因子检测血筒治疗结束后,处死大鼠,腹主动脉采血,4℃、3 500 r·min-1离心15 min。分离上层血清,用ELISA试剂盒检测各组大鼠血清TNF-α、IL-1β、IL-6含量。
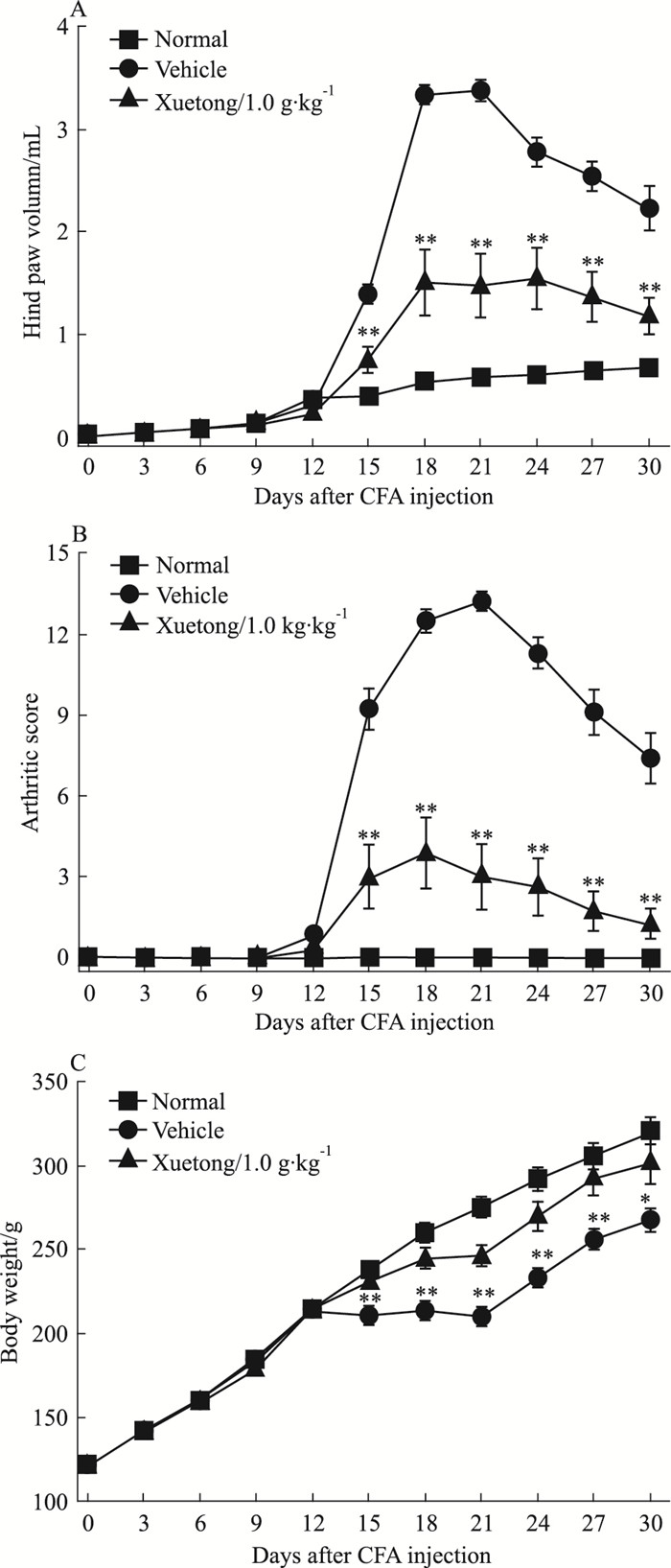
3 结果 3.1 血筒对大鼠AIA发生发展影响经CFA免疫后d 12~15,模型组大鼠足趾开始出现红、肿等炎症,随后尾部出现炎症结节,关节肿胀在d 21达到高峰,后足趾肿胀体积平均3.38 mL,四肢关节炎指数平均评分达13.2。伴随AIA的发生发展,模型组大鼠体质量增长明显减慢,甚至减轻(Fig 1, 2)。与模型组相比,血筒治疗组大鼠AIA发病率只有55%(P=0.035)(Fig 1),关节肿胀度降低1.8~2.3倍(P < 0.01),体质量稳定增长,比模型组大鼠平均重10%~20%(P < 0.05或P < 0.01),见Fig 2。

|
| Fig 1 Effect of Xuetong on incidence of AIA in rats(n=10) Incidences of arthritis in different groups of rats were analyzed on day 30 after AIA induction. *P < 0.05 vs vehicle |
|
| Fig 2 Effects of Xuetong on disease progression of AIA in rats(x±s, n=10) Disease progression of arthritis was examined by measurement of bi-hind paw volumes, arthritic scoring, and body weight every 3 days after arthritis induction.*P < 0.05, **P < 0.01 vs the vehicle-treated arthritic rats. |
经CFA免疫后d 30,模型组大鼠关节严重肿胀、僵直、活动障碍。CT扫描显示,后足趾各个关节出现严重骨侵蚀,关节腔隙狭窄甚至消失,关节变形(Fig 3B)。与模型组相比,1.0 g·kg-1血筒治疗组大鼠后足趾关节骨侵蚀、关节腔隙狭窄程度都较轻,关节结构较完整(Fig 3C),放射学评分差异有统计学意义(P < 0.01)(Fig 3D),提示血筒具有较好的关节骨保护作用。

|
| Fig 3 Effects of Xuetong on bone destruction of AIA in rats(x±s, n=10) Treatment with Xuetong significantly protected AIA rats from bone destruction, the radiological change.**P < 0.01 vs the vehicle-treated arthritic rats. |
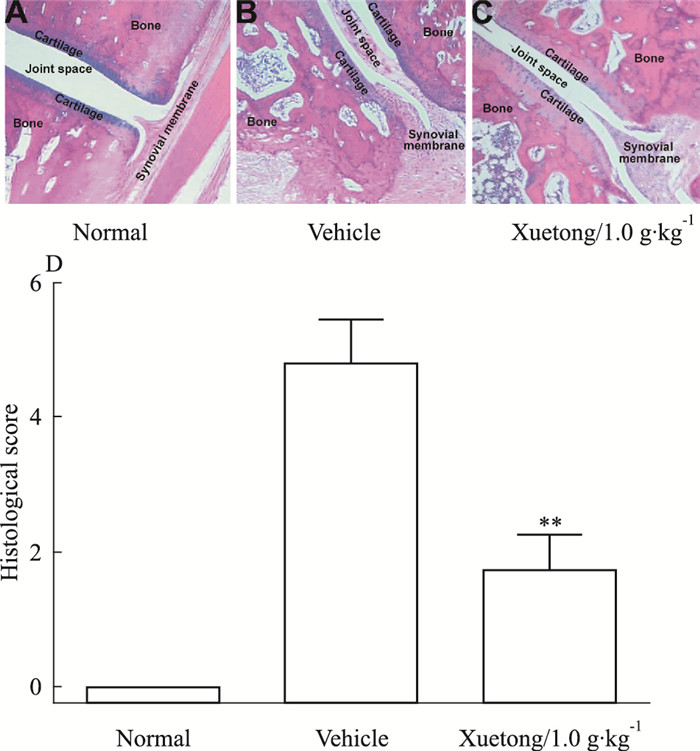
后足踝关节组织病理学检查显示,模型组大鼠出现炎症细胞浸润、滑膜增生、广泛的血管翳生成、关节腔变形,并伴有大面积的骨质侵蚀(Fig 4B),而血筒治疗组大鼠只见较少炎症细胞浸润和滑膜增生,关节损伤较轻,关节面完整(Fig 4C),组织病理学评分差异有统计学意义(P < 0.01)(Fig 4D),提示血筒具有较好的关节组织保护作用。
|
| Fig 4 Effects of Xuetong on histopathological lesions of ankle joint of AIA in rats(x±s, n=10) Histopathological lesions are markedly reduced in the Xuetong-treated rats.**P < 0.01 vs the vehicle-treated arthritic rats. |
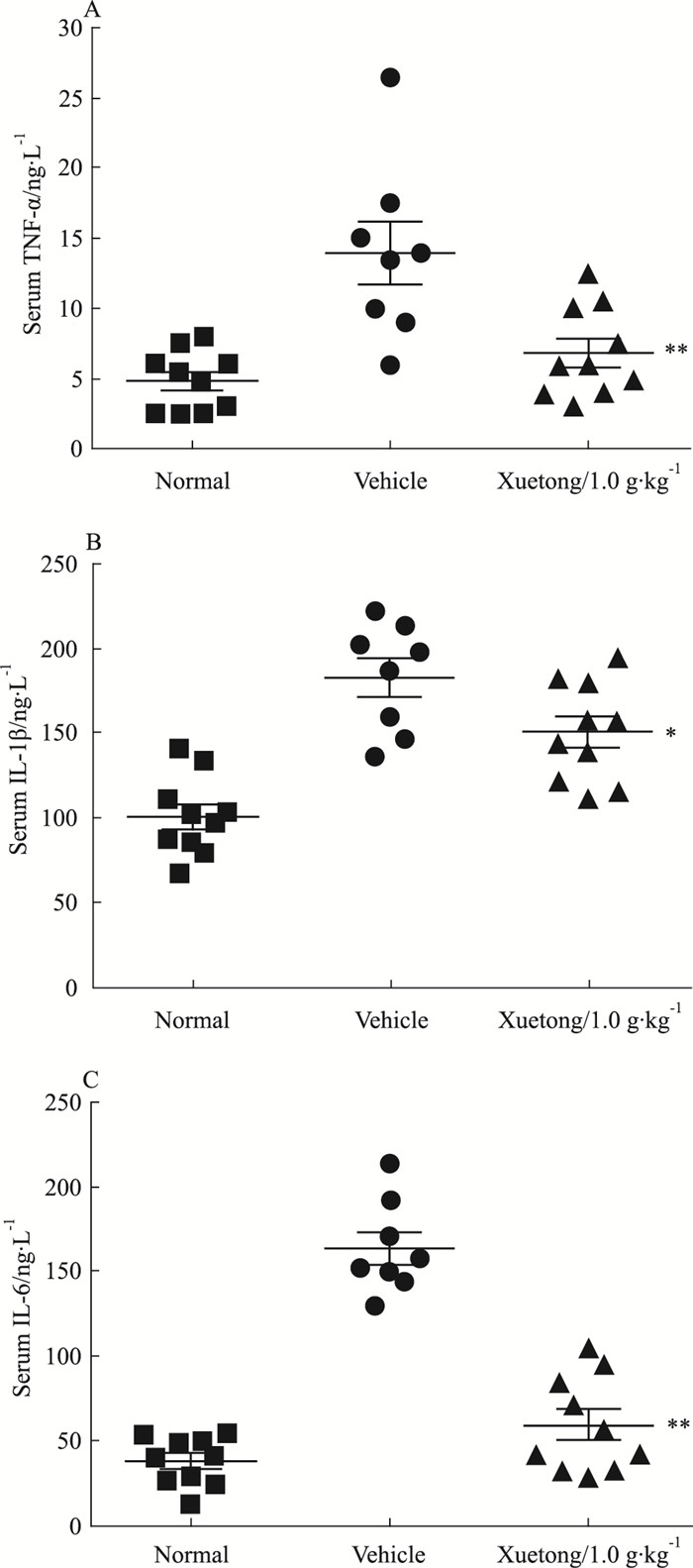
与正常对照组相比,模型组大鼠血清中TNF-α、IL-1β、IL-6等炎性因子水平明显升高,而血筒明显下调TNF-α、IL-1β、IL-6炎性因子水平(P < 0.05或P < 0.01),提示血筒可能通过抑制关键炎性细胞因子表达而发挥抗AIA药效作用(Fig 5)。
|
| Fig 5 Effects of Xuetong on serum TNF-α, IL-1β and IL-6 levels of AIA in rats(x±s, n=10) Treatment with Xuetong markedly decreased over-production of TNF-α, IL-1β, and IL-6 in sera.*P < 0.05, **P < 0.01 vs the vehicle-treated arthritic rats. |
土家族医药历史悠久,形成了“三元论”、“三元性”等具有民族特色的“土家族医药理论”体系,是中医药伟大宝库的一部分[16]。对尚未发掘的民族医药进行深入挖掘和系统研究,极有可能获得具有原创性的重大疑难疾病治疗新药。RA病因不明,发病机制复杂,仍缺乏理想的治疗药物与方法[1, 4]。湘西北土家族经典药物血筒,民间习用于治疗风湿痹痛、骨痛、风湿关节炎等[7-8],但至今未见其相关药效作用等研究报道。
我们通过建立SD系大鼠AIA模型,对血筒醇提物进行了初步的抗关节炎药效作用评价研究。AIA是应用最广泛的经典RA动物模型,因其诱导方法简便,成模率高(90%~100%),病理程度较重,是抗关节炎药物评价的理想动物模型[13, 14, 17, 18]。AIA最早由细菌学家Pearson[19]在Lewis系大鼠上建立,而研究报道SD系大鼠对AIA敏感性较低[20-21]。我们课题组成员2006年报道了AIA大鼠模型制备影响因素及SD和Lewis大鼠AIA模型平行比较的系统研究[13-14]。研究发现,选择结核分支杆菌(MtbH37Ra),采用手工研磨制备CFA,并于尾根部皮下免疫,成功建立成模率100%、重复性好及病理程度差异性小的♂ SD系大鼠AIA,其临床表现、血清学(ESR、CRP)、组织病理和放射学改变以及免疫改变等与人RA相似[13-14]。与Lewis大鼠AIA比较,该SD大鼠AIA模型具有更接近人类杂合性基因背景、价格便宜、易获得性等优势,得到国内外风湿免疫学界公认[22-23]。
血筒醇提物得率约为2%,HPLC检测鉴定醇提物中主要含有木脂素和三萜类化合物。根据前期抗炎镇痛研究结果,本研究设定了1个1.0 g·kg-1的较高剂量,研究其抗关节炎的药效作用。课题组成员研究发现,AIA病理程度与所注射免疫CFA中的Mtb量呈正比关系[14]。本研究中,我们给予SD大鼠注射免疫0.1 mL含200 μg Mtb的CFA,诱导建立AIA模型,其发病率达到100%(Fig 1);模型组大鼠后足平均肿胀度为正常组的2.5~4.8倍(Fig 2)。而血筒醇提物发病率仅为55%,后足平均肿胀度为正常组的1.8~2.3倍(Fig 1, 2),显示血筒具有很强的抗关节炎作用,其抑制炎症的主要成分根据前期初步研究可能是三萜类成分。此外,CFA免疫12 d开始,模型组大鼠体质量增长较正常组明显缓慢甚至下降,而血筒治疗组大鼠保持稳定增长,较模型组大鼠平均重10%~20%(Fig 2C),提示血筒对AIA大鼠的生理机能有一定的保护作用。放射学和组织病理学检查显示,血筒能有效阻止进行性骨侵蚀,保护大鼠关节(Fig 3, 4)。
研究证实,TNF-α、IL-1β、IL-6是介导RA关节滑膜炎症及关节破坏的关键炎性细胞因子,其通过分子信号转导通路的级联放大效应及相互调控作用,形成一个复杂的网络,促进RA的发展,引起关节软骨及骨组织的进行性侵蚀,最终导致关节结构破坏和功能障碍[1]。研究结果显示,血筒醇提物能明显抑制AIA大鼠血清TNF-α、IL-1β、IL-6表达,提示血筒可能通过抑制致炎细胞因子产生,减少足组织中炎性浸润,降低基质金属蛋白酶含量,减少骨和组织的破坏发挥治疗RA作用,但尚需进一步研究。
因此,我们的研究结果明确了血筒临床治疗风湿或关节疾病的药效作用,显示了血筒的研究开发和应用前景。我们将系统和深入研究血筒治疗RA药效作用及分子机制,为将其开发为安全、有效的民族创新药物奠定基础。
( 致谢: 本实验在湖南中医药大学中医诊断学湖南省重点实验室进行,感谢实验室及课题组所有老师的帮助。 )
| [1] | McInnes I B, Schett G. The pathogenesis of rheumatoid arthritis[J]. N Engl J Med, 2011, 365 (23): 2205-19. doi:10.1056/NEJMra1004965 |
| [2] | Myasoedova E, Davis J M, Crowson C S, et al. Epidemiology of rheumatoid arthritis: rheumatoid arthritis and mortality[J]. Curr Rheumatol Rep, 2010, 12 (5): 379-85. doi:10.1007/s11926-010-0117-y |
| [3] | Li Z G. A new look at rheumatology in China-opportunities and challenges[J]. Nat Rev Rheumatol, 2015, 11 (5): 313-7. doi:10.1038/nrrheum.2014.218 |
| [4] | Smolen J S, Aletaha D. Rheumatoid arthritis therapy reappraisal: strategies, opportunities and challenges[J]. Nat Rev Rheumatol, 2015, 11 (5): 276-89. doi:10.1038/nrrheum.2015.8 |
| [5] | 黄玲. 甲氨蝶呤治疗类风湿关节炎常见不良反应分析[J]. 中国药物经济学, 2013 (1) : 83-4. Huang L. Analysis of adverse reactions of Methotrexate in treatment of rheumatoid arthritis[J]. Chin J Pharm Econom, 2013 (1): 83-4. |
| [6] | Lu S, Wang Q, Li G, et al. The treatment of rheumatoid arthritis using Chinese medicinal plants: From pharmacology to potential molecular mechanisms[J]. J Ethnopharmacol, 2015, 176 : 177-206. doi:10.1016/j.jep.2015.10.010 |
| [7] | 沈芳仪, 刘杨, 苏维, 等. 土家族"七"类药物考辩[J]. 湖南中医药大学学报, 2015, 35 (1) : 1-6. Shen F Y, Liu Y, Su W, et al. Research on the Tujia Ethnomedicine"Seven" Drugs[J]. J Hunan Univ Chin Med, 2015, 35 (1): 1-6. |
| [8] | 熊鹏辉. 土家族"七"类药物考[J]. 中国民族医药杂志, 2007 (2) : 40-3. Xiong P H. Research on the Tujia ethnomedicine"Seven"drugs[J]. Chin J Ethnomed, 2007 (2): 40-3. |
| [9] | Wang W, Liu J Z, Liu R X, et al. Four new lignans from the stems of Kadsuraheteroclita[J]. Planta Med, 2006, 72 (3): 284-8. doi:10.1055/s-2005-916213 |
| [10] | Wang W, Liu J Z, Han J, et al. New Triterpenoids from Kadsuraheteroclita and their cytotoxic activity[J]. Planta Med, 2006, 72 (5): 450-7. doi:10.1055/s-2005-916263 |
| [11] | Wang W, Liu J, Yang M, et al. Simultaneous determination of six major constituents in the stems of kadsuraheteroclita by LC-DAD[J]. J Ethnopharmacol, 2006, 64 (4): 297-302. |
| [12] | Cai X, Zhou H, Wong Y F, et al. Suppressive effects of QFGJS, a preparation from an anti-arthritic herbal formula, on rat experimental adjuvant-induced arthritis[J]. Biochem Biophys Res Commun, 2005, 337 (2): 586-94. doi:10.1016/j.bbrc.2005.09.083 |
| [13] | Cai X, Wong Y F, Zhou H, et al. Manipulation of the induction of adjuvant arthritis in Sprague-Dawley rats[J]. Inflamm Res, 2006, 55 (9): 368-77. doi:10.1007/s00011-006-6026-x |
| [14] | Cai X, Wong Y F, Zhou H, et al. The comparative study of Sprague-Dawley and Lewis rats in adjuvant-induced arthritis[J]. Naunyn Schmiedebergs Arch Pharmacol, 2006, 373 (2): 140-7. doi:10.1007/s00210-006-0062-5 |
| [15] | 卢小冬, 陈文列, 林如辉, 等. 小动物影像学技术在骨关节炎动物模型研究中的应用[J]. 中国骨科临床与基础研究杂志, 2015, 7 (4) : 236-42. Lu X D, Chen W L, Lin R H, et al. The application of small animal imaging technology in the study of osteoarthritis animal model[J]. Chin Orthop J Clin Basic Res, 2015, 7 (4): 236-42. |
| [16] | 杨德胜. 土家族药物发展研究[J]. 湖南中医杂志, 2006, 22 (3) : 98-101. Yang D S. Study on the development of Tujia medicine[J]. Hunan J Trad Chinese Med, 2006, 22 (3): 98-101. |
| [17] | Ethan M. Shevach. Animal Models for Autoimmune and Inflammatory Disease[M]. Current Protocols Immunol, 2002, 3: 1-6. |
| [18] | 孙晓静, 徐澍, 贾晓益, 等. 大鼠佐剂性关节炎病程不同阶段T细胞亚群及重要器官的病理学变化[J]. 中国药理学通报, 2015, 31 (4) : 475-81. Sun X J, Xu S, Jia X Y, et al. Variation of T-cell subsets in spleen and tissue histopathologicalchanges in rats with adjuvant arthritis[J]. Chin Pharmacol Bull, 2015, 31 (4): 475-81. |
| [19] | Pearson C M. Development of arthritis, periarthritis and periostitis in rats given adjuvant[J]. Proc Soc Exp Biol Med, 1956, 91 : 95-101. doi:10.3181/00379727-91-22179 |
| [20] | Rosenthale M E. A comparative study of the Lewis and Sprague Dawley rat in adjuvant arthritis[J]. Arch Int Pharmacodyn Ther, 1970, 188 : 14-22. |
| [21] | Banik R K, Kasai M, Mizumura K. Reexamination of the difference in susceptibility to adjuvant-induced arthritis among LEW/Crj, Slc/Wistar/ST and Slc/SD rats[J]. Exp Anim, 2002, 51 : 197-201. doi:10.1538/expanim.51.197 |
| [22] | Adan N, Guzman-Morales J, Ledesma-Colunga M G, et al. Prolactin promotes cartilage survival and attenuates inflammatory arthritis[J]. J Clin Invest, 2013, 123 (9): 3902-13. doi:10.1172/JCI69485 |
| [23] | Kim E Y, Mougil K D. The determinants of susceptibility/resistance to adjuvant arthritis in rats[J]. Arthritis Res Ther, 2009, 11 (4): 239. doi:10.1186/ar2755 |