


2. 河北中医学院河北省心脑血管病中医药防治重点实验室,河北 石家庄 050200
2. Hebei University of Chinese Medicine, Hebei Key Laboratory of Chinese Medicine Research on Cardio-cerebrovascular Disease, Shijiazhuang 050200, China
脑血管疾病是一种严重威胁人类健康的常见病,特别是50岁以上的中老年人具有更高的患病率、致残率和死亡率,而缺血性脑血管疾病占据了60%~80%[1]。脑缺血/再灌注损伤是缺血性脑血管疾病发病的重要的病理生理过程,而细胞凋亡是缺血/再灌注损伤发生的重要机制之一[2]。大量研究证实[3],中药黄芪是临床上治疗缺血性脑血管疾病的常用药物,可明显抑制细胞凋亡的发生。本课题组前期研究发现:黄芪注射液可以减轻大鼠脑缺血/再灌注损伤,抑制神经元凋亡[4]。黄芪甲苷是黄芪皂苷类单体成分,被认为是黄芪主要活性成分之一。黄芪甲苷能否抑制缺氧缺糖/复氧复糖引起的PC12细胞凋亡,尚需进一步探索。本实验以经神经生长因子(NGF)诱导后的高分化PC12细胞为实验对象,建立缺氧缺糖/复氧复糖细胞模型,模拟神经元体外缺氧缺糖/复氧复糖模型,并于复氧复糖的同时给予黄芪甲苷处理,探讨黄芪甲苷对缺氧缺糖/复氧复糖引起PC12细胞凋亡的影响。
1 材料与方法 1.1 材料 1.1.1 细胞神经生长因子(NGF)诱导后的高分化PC12细胞,由河北医科大学附属第一医院实验中心许顺江教授惠赠。
1.1.2 试剂和仪器TUNEL检测凋亡试剂盒购于Roche公司;Annexin V-FITC/PI双染色试剂盒购于BD公司;噻唑蓝(MTT)购于Biosharp公司;马血清购于BI公司;胎牛血清购于PAR公司;胰蛋白酶和青链霉素混合液由BIOND公司生产;RPMI 1640培养基由Gibco公司生产;Earle’s平衡盐溶液由LEAGENE公司生产;DAB试剂盒购于北京中山金桥生物技术公司;Triton X-100购于北京索莱宝科技有限公司;黄芪甲苷由上海士峰生物科技有限公司生产,20mg/瓶,纯度≥98%,生产批号:15082136;其他试剂为国产分析纯。主要仪器:二氧化碳(CO2)培养箱3111型和三气培养箱3131型购于Thermo公司;倒置显微镜DMI3000B型购于Leica公司;超净工作台SW-CJ-ID型购于苏州净化公司;酶联免疫检测仪ELx800型购于BioTek公司;流式细胞仪FACSAriaⅡ型购于BD公司。
2 方法 2.1 PC12细胞的培养PC12细胞接种于含10%胎牛血清、5%马血清、1%青链霉素混合液的RPMI 1640培养液,置于CO2培养箱(37℃,5% CO2,饱和湿度)进行培养,2~3 d换液1次,待细胞融合度达70%~80%进行传代。
2.2 PC12细胞缺氧缺糖/复氧复糖模型的建立及实验分组取对数生长期的PC12细胞,随机分为4组:正常对照组(Control)、模型组(即缺氧缺糖/复氧复糖组,Model)、黄芪甲苷组(AST)和溶媒组(即黄芪甲苷溶剂对照组,DMSO)。除正常对照组外,其余各组建立缺氧缺糖/复氧复糖细胞模型:PC12细胞弃去正常细胞培养液(RPMI 1640培养液,含10%胎牛血清、5%马血清、1%青链霉素混合液),用预热的PBS清洗2次,更换培养液为无糖Earle′s培养液模拟细胞缺血状态,然后放入含94% N2+5% CO2+1% O2的37℃三气培养箱内培养,氧糖剥夺3 h后,更换无糖Earle′s培养液为正常细胞培养液,放入37℃ 5% CO2培养箱中培养12 h。正常对照组正常培养,不做任何处理;黄芪甲苷组氧糖剥夺3 h后复氧复糖的同时加入黄芪甲苷(终浓度为100 μmol·L-1,溶媒为DMSO),直到培养结束;溶媒组与黄芪甲苷组处理相同,但只加入等量的DMSO。
2.3 MTT法检测细胞活性取对数生长期的PC12细胞,将100 μL细胞接种到96孔板中,初始浓度为1×105个/mL,置于CO2培养箱培养24 h。细胞贴壁后,对细胞进行缺氧缺糖/复氧复糖处理,然后每孔加入MTT(终浓度为0.5 g·L-1), 置于CO2培养箱中继续培养4 h。小心吸取全部培养基,每孔加入150 μL DMSO,室温震荡10 min,酶联免疫监测仪测OD490nm值,检测细胞活性。
2.4 TUNEL染色检测细胞凋亡将细胞接种到6孔板中,做细胞爬片,初始浓度为2×105个/mL,置于CO2培养箱培养24 h,细胞贴壁后,进行造模及给药处理。将细胞爬片在4%多聚甲醛中室温固定25 min;PBS浸洗2次;0.2%的Triton X-100透化细胞5 min;PBS浸洗2次;新鲜配制的3% H2O2室温处理细胞5 min;PBS浸洗2次;玻片干后,加50 μL TUNEL反应混合液(TdT与dUTP按1 :9混合)于细胞上,阴性对照组仅加50 μL dUTP液,避光湿盒37℃反应60 min;PBS浸洗3次;玻片干后,加50 μL converter-POD于细胞上,避光湿盒37℃反应30 min;PBS浸洗3次;加100 μL DAB显色剂,室温反应10 min;PBS浸洗3次;苏木精复染,数秒后立即用自来水冲洗;梯度酒精脱水,二甲苯透明,中性树胶封片。PC12细胞的胞核被染成棕黄色者为凋亡细胞,即阳性细胞。每张切片在高倍镜下(×400)随机选取5个不重叠的视野,计算每个视野中阳性细胞所占比例(即细胞凋亡指数),取其平均值。
2.5 流式细胞术检测细胞凋亡百分率参考BD公司Annexin V-FITC/PI凋亡试剂盒说明书进行操作,用0.25%胰蛋白酶(不含EDTA)对细胞进行消化,4℃ PBS清洗两遍细胞,1 500 r·min-1离心5 min,100 μL 1×Binding Buffer重悬细胞(含1×105个细胞),加入5 μL FITC和5 μL PI,室温避光反应15 min,然后加入400 μL 1X Binding Buffer,1 h内上机检测细胞凋亡百分率。
2.6 统计学处理数据用x±s表示,用SPSS19.0统计软件进行方差分析。
3 结果 3.1 倒置显微镜观察缺氧缺糖/复氧复糖PC12细胞形态变化正常对照组PC12细胞贴壁生长,细胞呈多角形,突起明显,突起之间交织成网状,细胞膜光滑且完整,胞体折光性较强。与正常对照组相比,模型组细胞变圆或肿胀,突起回缩或消失,细胞膜褶皱或破损,胞体折光性差,细胞出现聚集倾向,可见大量凋亡细胞;与模型组相比,黄芪甲苷组细胞形态明显改善,突起明显,细胞膜较为完整,胞体折光性较好,凋亡细胞明显减少;溶媒组与模型组之间无明显差异。见Fig 1。
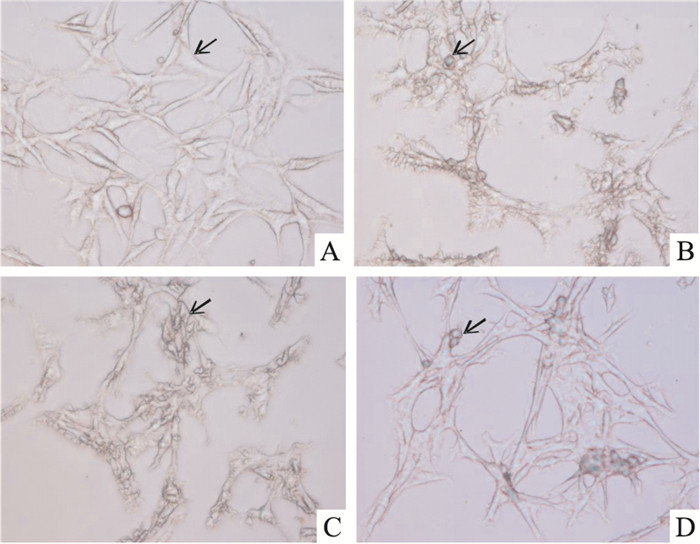
|
| Fig 1 Morphological observation under optical microscope in each group(×400) A:Control; B:Model; C:DMSO; D:AST |
与正常对照组相比,模型组细胞活性明显下降(P < 0.05);与模型组相比,黄芪甲苷组细胞活性升高(P < 0.05),差异有统计学意义;溶媒组与模型组之间无明显差异(P > 0.05),见Tab 1。
| Group | OD490nm |
| Control | 96.90±0.68 |
| Model | 37.13±3.29* |
| DMSO | 37.80±2.05* |
| AST | 64.67±3.05# |
| *P < 0.05 vs control; #P < 0.05 vs model. | |
正常对照组中偶见数个凋亡细胞;与正常对照组相比,模型组细胞凋亡指数明显升高(P < 0.05);与模型组相比,黄芪甲苷组细胞凋亡指数下降(P < 0.05),差异有统计学意义;而溶媒组与模型组之间差异无显著性(P > 0.05),见Fig 2。
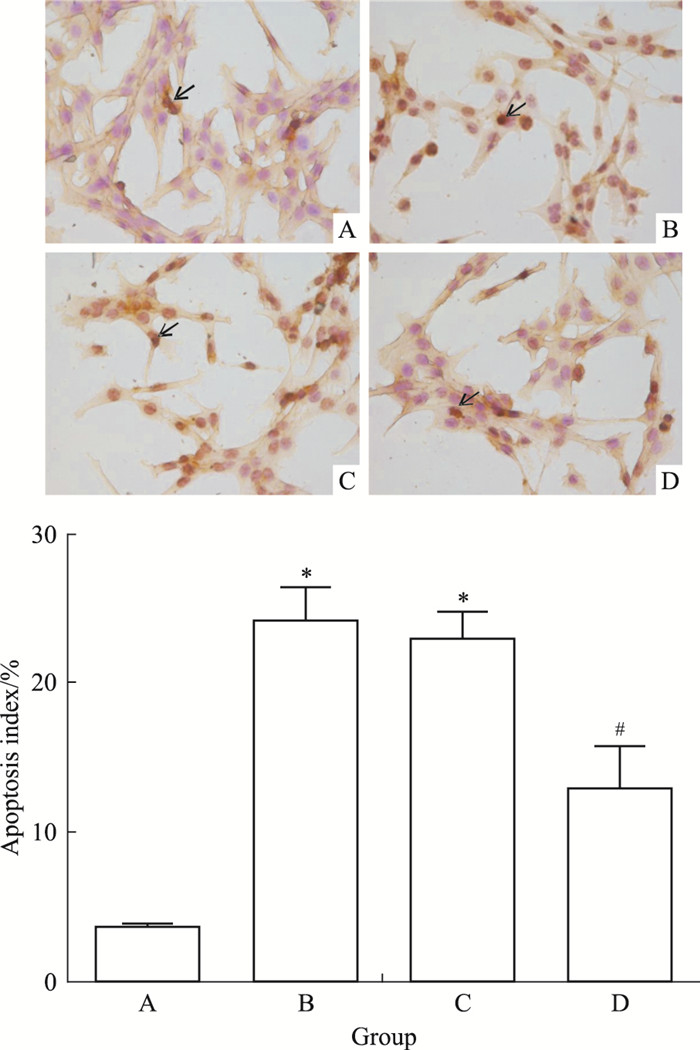
|
| Fig 2 Results of cell apoptosis examined with TUNEL(×400, x±s, n=3) A:Control; B:Model; C:DMSO; D:AST.*P < 0.05 vs control group; #P < 0.05 vs model group. |
与正常对照组相比,模型组细胞凋亡率明显升高(P < 0.05);与模型组相比,黄芪甲苷组细胞凋亡率下降(P < 0.05),差异有统计学意义;而溶媒组与模型组之间差异无显著性(P > 0.05),该实验结果与MTT、TUNEL染色所得实验结果趋势相一致,见Fig 3。
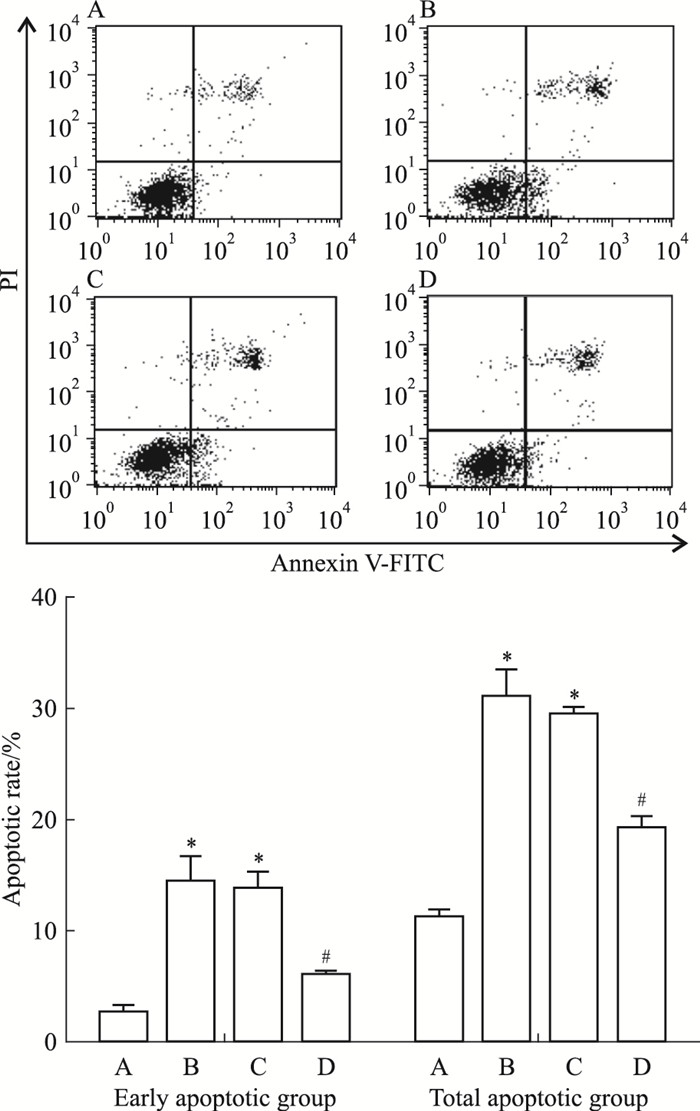
|
| Fig 3 Results of cell apoptotic rates examined by Annexin V-FITC/PI with flow cytometry(x±s, n=3) A:Control; B:Model; C:DMSO; D:AST.*P < 0.05 vs control group; #P < 0.05 vs model group |
脑缺血/再灌注损伤是指脑组织在缺血基础上恢复血流后组织损伤加重,甚至出现不可逆性损伤的现象[5]。神经细胞坏死是脑缺血/再灌注损伤的主要表现形式,而神经细胞凋亡在脑缺血/再灌注损伤的发生发展过程中同样扮演着至关重要的角色。缺氧缺糖/复氧复糖所导致的神经细胞损伤是脑缺血/再灌注损伤的主要细胞模型之一,并且缺氧缺糖/复氧复糖后的神经细胞常常发生细胞凋亡[6]。Kalinichenko等[7-8]研究表明,细胞凋亡是脑缺血/再灌注后继发性损伤的重要机制。王凤章等[9-10]报道,细胞凋亡是海马CA1区神经细胞缺氧缺血/再灌注后的主要死亡形式。因此,探索脑缺血/再灌注损伤的机制,应用特效药物及时抑制神经细胞发生凋亡是亟待解决的重要问题。
中医临床研究表明,脑缺血损伤的症候特点表现为血瘀和气虚,应用活血化瘀药和补益气血药常可收到不同程度的治疗效果,而中药黄芪具有补气升阳、消肿生肌、活血化瘀的功效,是中医治疗缺血性脑血管疾病的临床常用药。黄芪甲苷是黄芪皂苷类的单体成分,是一种羊毛酷醇型四环三菇皂苷,被认为是黄芪主要活性成分之一,现代药理学研究证实黄芪甲苷具有抗炎、抗氧化、抗血小板凝集等生物活性,这些特性均可以影响脑缺血/再灌注损伤的发生发展。研究表明[11-13],黄芪甲苷可以促进Bcl-2蛋白的表达,抑制Bax、caspase-3、JNK-3和细胞色素C(cyt-c)蛋白的表达,同时上调低氧诱导因子的表达[14],从而抑制脑缺血/再灌注损伤神经细胞发生凋亡,发挥脑保护作用。孙丽等[15]报道,黄芪甲苷还可以通过增加血管内皮生长因子(VEGF)、血管内皮生长因子受体2(VEGFR2)及神经营养因子(BDNF)的表达来抑制神经细胞凋亡,促进神经再生。
PC12细胞来源于大鼠肾上腺髓质嗜铬细胞瘤,其主要分泌产物为多巴胺、去甲肾上腺素等儿茶酚胺类。PC12细胞膜上有NGF受体,经过神经生长因子(NGF)诱导后的PC12细胞停止分裂,长出突起,最终分化为具有交感神经元特性的细胞,被广泛应用于神经系统疾病体外研究[16-17]。
本实验以PC12细胞为实验对象,建立缺氧缺糖/复氧复糖细胞模型,模拟神经元体外缺氧缺糖/复氧复糖模型,复氧复糖的同时给予黄芪甲苷处理,探讨黄芪甲苷对缺氧缺糖/复氧复糖PC12细胞凋亡的影响。实验证实:缺氧缺糖/复氧复糖可明显增加凋亡细胞数目,降低细胞活性,加重细胞损伤,而给予黄芪甲苷处理后凋亡细胞明显减少,细胞损伤明显减轻。表明黄芪甲苷可减轻缺氧缺糖/复氧复糖引起的PC12细胞损伤,提高细胞活性,抑制细胞凋亡,从而发挥神经保护作用。
本实验初步研究了黄芪甲苷可以抑制缺氧缺糖/复氧复糖引起的PC12细胞凋亡,而黄芪甲苷具体通过什么途径或哪条通路来抑制细胞凋亡发挥保护作用将是我们继续研究的重点。
( 注:本实验在高维娟教授的细心指导下,由靳晓飞、张颖、周晓红、武密山、赵艳萌在河北省心脑血管病中医药防治重点实验室共同完成,谢谢! )
| [1] | Piironen K, Tiainen M, Mustanoja S, et al. Mild hypothermia after intravenous thrombolysis in patients with acute stroke: a randomized controlled trial[J]. Stroke, 2014, 45 (2): 486-91. doi:10.1161/STROKEAHA.113.003180 |
| [2] | Cho Y S, Shin M S, Ko I G, et al. Ulinastatin inhibits cerebral ischemia-induced apoptosis in the hippocampus of gerbils[J]. Mol Med Rep, 2015, 12 (2): 1796-802. |
| [3] | 刘广义, 付志新, 郝娟芝, 等. 大鼠脑缺血/再灌流后Bcl-2、Caspase-3 mRNA水平表达与大脑皮质及纹状体区炎性细胞浸润的影响[J]. 神经疾病与精神卫生, 2004, 4 (4) : 252-5. Liu G Y, Fu Z X, Hao J Z, et al. The level expression of Bcl-2 and Caspase-3 mRNA and influence of the relationshipof the infiltrationof inflammation cells and in cerebral cortex and in corpus striatum region after cerebral ischemia reperfussion in rats[J]. Nervolog Dis Ment Health, 2004, 4 (4): 252-5. |
| [4] | 张霞, 高维娟, 钱涛, 等. 黄芪注射液对脑缺血/再灌注大鼠海马神经元caspase-3表达的影响[J]. 中国药理学通报, 2012, 28 (6) : 867-71. Zhang X, Gao W J, Qian T, et al. Effect of astragalus injection on the expression of caspase-3 after cerebral ischemia and reperfusion in hippocampal neurons of rats[J]. Chin Pharmacol Bull, 2012, 28 (6): 867-71. |
| [5] | 王建枝, 殷莲华. 病理生理学[M]. 第8版 北京: 人民卫生出版社, 2013 : 152 -61 . Wang J Z, Yin L H. Pathologic Physiology[M]. 8th ed Beijing: People′s Medical Publishing House, 2013 : 152 -61 . |
| [6] | Raisova M, Hossini A M, Eberle J, et al. The Bax/Bcl-2 ratio determines the susceptibility of human melanoma cells to CD95/Fas2 mediated apoptosis[J]. Invest Dermatol, 2001, 117 (2): 333-40. doi:10.1046/j.0022-202x.2001.01409.x |
| [7] | Kalinichenko S G, Matveeva N I. Morphological characteristic of apoptosis and its significance in neurogenesis[J]. Neurosci Behav Physiol, 2008, 38 (4): 333-44. doi:10.1007/s11055-008-0046-7 |
| [8] | Wang P, Wang W, Xuy L, et al. Comparison of focal cerebral ischemia/reperfusion induced apoptosis of astrocytes and neurons in rats[J]. Chin J Histochem Cytochem, 2006, 16 (2): 113-8. |
| [9] | 王凤章, 李巍. 小鼠颞叶缺血/再灌注后海马CA1区细胞凋亡及行为学实验研究[J]. 中国临床康复, 2002, 6 (19) : 2861-2. Wang F Z, Li W. Experimental study on apoptosis and behavior of CA1 zone in the hippocampus after cerebral ischemia reperfusion in mice[J]. Chin J Clin Rehab, 2002, 6 (19): 2861-2. |
| [10] | Zhao J, Pei D S, Zhang Q G, et al. Down-regulation Cdc42 attenuates neuronal apoptosis through inhibiting MLK3/JNK3 cascade during ischemic reperfusion in rat hippocampus[J]. Cell Signal, 2007, 19 (4): 831-43. doi:10.1016/j.cellsig.2006.10.006 |
| [11] | 郭蕴琦, 郭蕴岚, 郭学鹏. 黄芪对缺氧缺血大鼠脑组织Bc1-2及Bax蛋白表达的影响[J]. 中华实用儿科临床杂志, 2010, 25 (9) : 3025-7. Guo Y Q, Guo Y L, Guo X P. Effects of astragalus root on Bcl-2 and Bax protein expressions of brain in rats with hypoxia-ischemia[J]. Chin J Appl Clin Pediatr, 2010, 25 (9): 3025-7. |
| [12] | 焦俊霞, 高维娟, 钱涛, 等. 黄芪有效成分对缺氧缺糖/复氧复糖大鼠海马神经元cyt-c、CcO表达的影响[J]. 中国药理学通报, 2011, 27 (2) : 211-5. Jiao J X, Gao W J, Qian T, et al. Effective compositions of astragalus injection affects the expression of cyt-c and CcO following oxygen-glucose deprivation and reintroduction in rat hippocampal neurons[J]. Chin Pharmacol Bull, 2011, 27 (2): 211-5. |
| [13] | Liu G, Song J, Guo Y, et al. Astragalus injection protects cerebral ischemic injury by inhibiting neuronal apoptosis and the expression of JNK3 after cerbral ischemic reperfusion in rats[J]. Behav Brain Funct, 2013, 9 (5): 443-53. |
| [14] | 梁顺利, 徐彬, 张宇燕. 黄芪注射液对梗死灶周脑组织HIF-1α和VEGF的影响[J]. 心脑血管病防治, 2011, 11 (1) : 21-3. Liang S L, Xu B, Zhang Y Y. The effect of astragalus injection on the expression of HIF-1α and VEGF in the cerebral tissue after focal cerebral ischemia[J]. Prevention and Treatment of Cardio-Cerebral-Vascular Disease, 2011, 11 (1): 21-3. |
| [15] | 孙丽, 王岭, 李艳, 等. 黄芪甲苷对大鼠脑缺血/再灌注损伤的保护作用和机制研究[J]. 中国临床神经科学, 2014, 22 (1) : 43-9. Sun L, Wang L, Li Y, et al. The protective effect and mechanism of astragaloside in cerebral ischemia reperfusion in rats[J]. Chine J Clin Neurosci, 2014, 22 (1): 43-9. |
| [16] | Zhu J R, Tao Y F, Lou S, Wu Z M. Protective effects of ginsenoside Rb(3) on oxygen and glucose deprivation-induced ischemic injury in PC12 cells[J]. Acta Pharmacol Sin, 2010, 31 (3): 273-80. doi:10.1038/aps.2010.9 |
| [17] | Cui D, Wang L, Qi A, et al. Propofol prevents autophagic cell death following oxygen and glucose deprivation in PC12 cells and cerebral ischemia-reperfusion injury in rats[J]. PloS One, 2012, 7 (4): e35324. doi:10.1371/journal.pone.0035324 |

