


2. 中国医学科学院、北京协和医学院药物研究所活性物质发现与适药化研究北京市重点实验室, 北京 100050;
3. 山东大学国家糖工程技术研究中心, 山东 济南 250100
 ,
WANG Su-Bo1,3,
ZHANG Hui-fang1,
CHEN Yu-cai1,
JIAO Xiao-zhen2,
XIE Ping2,
FANG Lian-hua1
,
WANG Su-Bo1,3,
ZHANG Hui-fang1,
CHEN Yu-cai1,
JIAO Xiao-zhen2,
XIE Ping2,
FANG Lian-hua1
 ,
DU Guan-hua1
,
DU Guan-hua1

2. Beijing Key Laboratory of Drug Targets Identification and Drug Screening, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China ;
3. National Glycoengineering Research Center, Shandong University, Jinan 250100,China
Rho激酶是一种在人体中广泛存在的丝氨酸/苏氨酸蛋白激酶,在多种生理与病理过程中发挥作用,尤其是在心血管系统作用突出[1-2]。在血管平滑肌细胞(vascular smooth muscle cell, VSMC)中,当Rho激酶被激活,将磷酸化多种蛋白底物,激活下游信号通路,其中包括磷酸化肌球蛋白轻链(myosin light chain, MLC)导致细胞的收缩和运动[3],同时通过激活ERM和LIMK/Cofilin通路增加肌动蛋白微丝,使细胞骨架重塑,发生形态变化[4-5]。因此,Rho激酶是治疗血管紧张性疾病,如高血压、心绞痛等药物的重要靶点[6]。
本实验室长期致力于发现新的Rho激酶抑制剂,以期发现治疗心血管疾病的新型药物。DL0805是本实验室前期工作中发现的一个全新结构小分子Rho激酶抑制剂,并且发现其在离体血管环上具有良好的舒张血管作用[7]。然而,DL0805在整体动物水平表现出一定的毒性,可能不适于进一步研究和开发,因此对这一化合物进行了结构改造。通过对改造得到的系列化合物进行生物活性系统评价,发现J35242和J35243这两个化合物对血管的舒张作用较强,并且二者具有相同的骨架结构。因此,在本实验中,观察两个新结构Rho激酶抑制剂对离体大鼠胸主动脉环的舒张作用,并对其作用机制进行深入研究。
1 材料 1.1 试剂J35242和J35243由中国医学科学院药物研究所谢平教授实验室提供,纯度>98%(化合物结构如Fig 1所示)。在前期工作中两个化合物Rho激酶抑制活性IC50值分别为48.21和44.65 mg·L-1。

|
| Fig 1 Chemical structure of tested compounds J35242: C20H22N4O2, MW 350.42; J35243:C19H19FN4O, MW 338.39 |
去甲肾上腺素(norepinephrine, NE)、乙酰胆碱(acetylcholine, ACh)、吲哚美辛(indomethacin, Indo)、N-硝基-L-精氨酸甲基酯(N-nitro-L-arginine methyl ester hydrochloride, L-NAME)、亚甲蓝(methylene blue, MB)、格列苯脲(glibenclamide, Glib)、TEA(tetraethyl ammonium)和4-AP(4-aminopyridine)均购自美国Sigma公司;EGTA购自美国Amresco公司;NaCl、KCl、KH2PO4、NaHCO3、葡萄糖、CaCl2和MgCl2均为国产分析纯;配气(95% O2,5% CO2)购自北京如源如泉科技有限公司。
1.2 仪器Polygraph MP100A(BIO-PAC,美国);SC-15超级恒温槽(江南仪器厂,宁波);DK-98-1型电热恒温水浴锅(泰斯特仪器有限公司,天津);JH-2肌张力传感器(航天医学工程研究所,北京);台式pH计(梅特勒,德国)。
1.3 动物SPF级SD大鼠,♂,体质量200 g~220 g, 购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。
2 方法 2.1 离体大鼠胸主动脉环制备根据已有方法制备大鼠离体胸主动脉环模型[7],步骤简述如下:断头处死大鼠,开胸腔后迅速取出胸主动脉,小心剥离血管外周脂肪和结缔组织,将血管剪成长度为3~4 mm的动脉环;去内皮大鼠胸主动脉环是在将血管剪为血管环后,用直径略小于血管环内径的自制细长棉签,轻轻擦拭血管内壁,用机械法损伤血管内皮;将动脉环固定在三脚架并置于浴槽中,浴槽中加入10 mL KH液,维持37℃,不断充入95% O2和5% CO2混合气;血管张力由MP100A记录,初始张力为1.2 g,血管平衡稳定后用高钾KH液进行刺激活化,重新平衡后,用10-7 mol·L-1 NE刺激血管收缩,用10 μmol·L-1 ACh验证内皮完整性,血管环舒张率达70%以上则认为血管环内皮层保留完整;如血管环舒张少于5%则认为血管环内皮完全去除[8];然后用普通KH液使血管环张力重新平衡到初始值1.2 g,根据实验需要选择内皮完整或去除内皮的血管环。
2.2 DL0805衍生物对高钾预收缩血管环的舒张作用采用内皮完整大鼠胸主动脉环,验证内皮完整性后,用普通KH液重新平衡血管至基础张力;用含60 mmol·L-1 KCl的高钾KH液刺激血管收缩达到平台后,浓度累积给予待测化合物J35242、J35243,终浓度为1、2.5、5、10、20 μmol·L-1,空白对照组加入同体积溶剂,记录并观察待测化合物对高钾预收缩的血管环的舒张作用。
2.3 血管内皮对DL0805衍生物舒张血管作用的影响实验首先采用10-6 mol·L-1 NE预收缩内皮完整和去除内皮的血管环,张力达到平台后,浓度累积加入待测化合物,终浓度为0.1、0.2、0.5、1、2.5、5 μmol·L-1,记录并观察血管内皮对待测化合物舒张血管环作用的影响。
为研究内皮对化合物舒张血管作用影响的相关机制,加入一氧化氮合酶(endothelial nitric oxide synthase, eNOS)抑制剂L-NAME(100 μmol·L-1)、鸟苷酸环化酶(guanylate cyclase, GC)抑制剂亚甲蓝(10 μmol·L-1)和环氧化酶(cyclooxygenase, COX)抑制剂吲哚美辛(5 μmol·L-1),预孵育20 min后加入10-6 mol·L-1 NE预收缩血管,张力达到平台后,浓度累积加入待测化合物,终浓度为0.1、0.2、0.5、1、2.5、5 μmol·L-1,观察内皮功能相关工具药对血管环舒张作用的影响,从而推测J35242和J35243舒张血管的内皮相关作用机制。
2.4 钾离子通道对DL0805衍生物舒张血管作用的影响为研究待测化合物舒张血管作用是否与钾离子通道相关,实验采用去除内皮的血管环;观察了3种钾离子通道阻滞剂:电压敏感性K+通道阻断剂4-AP(100 μmol·L-1)、钙依赖K+通道阻断剂TEA(5 mmol·L-1)和ATP敏感性K+通道阻断剂格列苯脲(Gilb, 10 μmol·L-1),孵育20 min后加入10-6 mol·L-1 NE预收缩血管,张力达到平台后,浓度累积加入待测化合物,终浓度为0.1、0.2、0.5、1、2.5、5 μmol·L-1,观察化合物舒张血管作用变化情况,从而推测化合物是否通过开放钾离子通道发挥舒张血管作用。
2.5 DL0805衍生物的舒张血管作用与Ca2+的关系无钙KH液中NE能够引起血管一过性收缩,其机制是细胞内钙释放。使用去除内皮的血管环进行实验:首先将血管用含50 μmol·L-1 EGTA的无钙KH液换洗2次,每次持续10 min,然后换成不含EGTA的无钙KH液,分别加入终浓度为0.1、1、5 μmol·L-1待测化合物预孵育20 min,加入10-6 mol·L-1 NE刺激血管收缩。计算在待测化合物影响下各血管环的收缩率。
收缩率/%=(给予样品后张力-基础张力)/(最大收缩张力-基础张力)×100%。
无钙高钾KH液中,CaCl2能够引起血管收缩,其机制是细胞外钙内流。使用去内皮的血管环进行实验:首先将血管用含1 mmol·L-1 EGTA的无钙KH液换洗2次,每次持续10 min,然后换成不含EGTA的无钙高钾KH液。分别加入终浓度为1、5、20 μmol·L-1待测化合物预孵育20 min,浓度累积加入CaCl2,其终浓度为0.1、0.5、1、1.5、2、2.5 mmol·L-1,计算收缩率。
收缩率/%=(给予样品后张力-基础张力)/(最大收缩张力-基础张力)×100%。
2.6 数据统计数据均以x±s表示,各组间的差异比较采用单因素方差分析(One-way ANOVA)。
3 结果 3.1 DL0805衍生物舒张KCl预收缩的离体大鼠胸主动脉血管环如Fig 2所示,在内皮完整的血管环上,J35242和J35243(1~20 μmol·L-1)能够明显舒张KCl(60 mmol·L-1)预收缩的大鼠胸主动脉环,并呈剂量依赖性,其pEC50(-LgEC50, mol·L-1)值分别为5.32±0.09和4.62±0.21(n=6),J35242的舒张作用强于J35243。
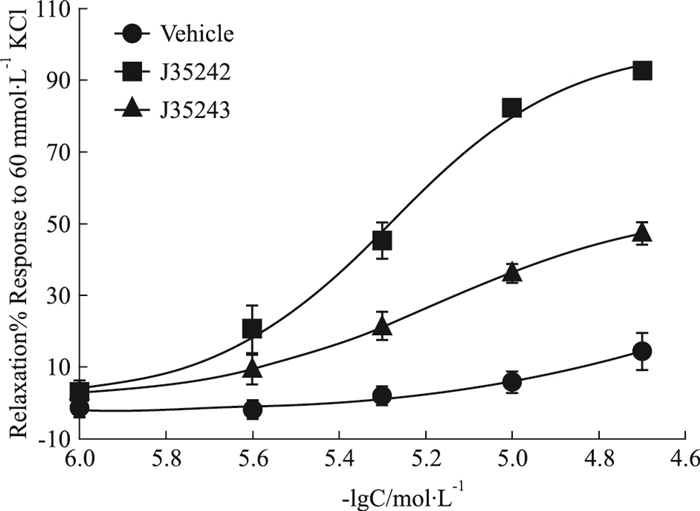
|
| Fig 2 Vasorelaxant effects of J35242 and J35243 (1~20 μmol·L-1) on endothelium-intact thoracic aorta rings pre-contracted with 60 mmol·L-1 KCl |
J35242和J35243 (0.1~5 μmol·L-1)对NE(10-6 mol·L-1)预收缩的内皮完整与去除内皮血管环的舒张作用有明显差异(Fig 3)。在待测样品浓度较低时,样品对内皮完整的大鼠胸主动脉环有更强的舒张作用。由此可见,DL0805衍生物舒张血管作用部分依赖于内皮。

|
| Fig 3 Vasorelaxant effects of J35242(A) and J35243(B) on contraction induced by NE in the endothelium-intact (+endo) or endothelium-denuded(-endo) aortic rings. (x±s=6), *P < 0.05, **P < 0.01 vs +endo. |
为了研究J35242和J35243舒张作用的内皮依赖性相关机制,实验使用了3种内皮功能相关工具药,这3种工具药分别针对舒张血管的3条不同分子信号通路:L-NAME是一氧化氮合酶eNOS抑制剂,eNOS是内皮细胞中合成NO的重要分子;MB是鸟苷酸环化酶GC的抑制剂,GC通过生成cGMP降低平滑肌细胞内钙,起到使血管舒张的作用;Indo是环氧化酶COX抑制剂,COX通过生成cAMP起到舒张血管作用。L-NAME、MB及Indo预孵育后,待测化合物对血管环的舒张作用表现出不同的变化(Fig 4)。L-NAME明显降低了J35242、J35243在内皮完整血管环上的舒张作用;MB能够降低J35242的舒张能力,Indo对化合物的血管舒张作用没有明显影响,说明两个化合物可能通过激活eNOS,提高NO释放来发挥舒张血管作用,另外J35242可能对GC具有激活作用。
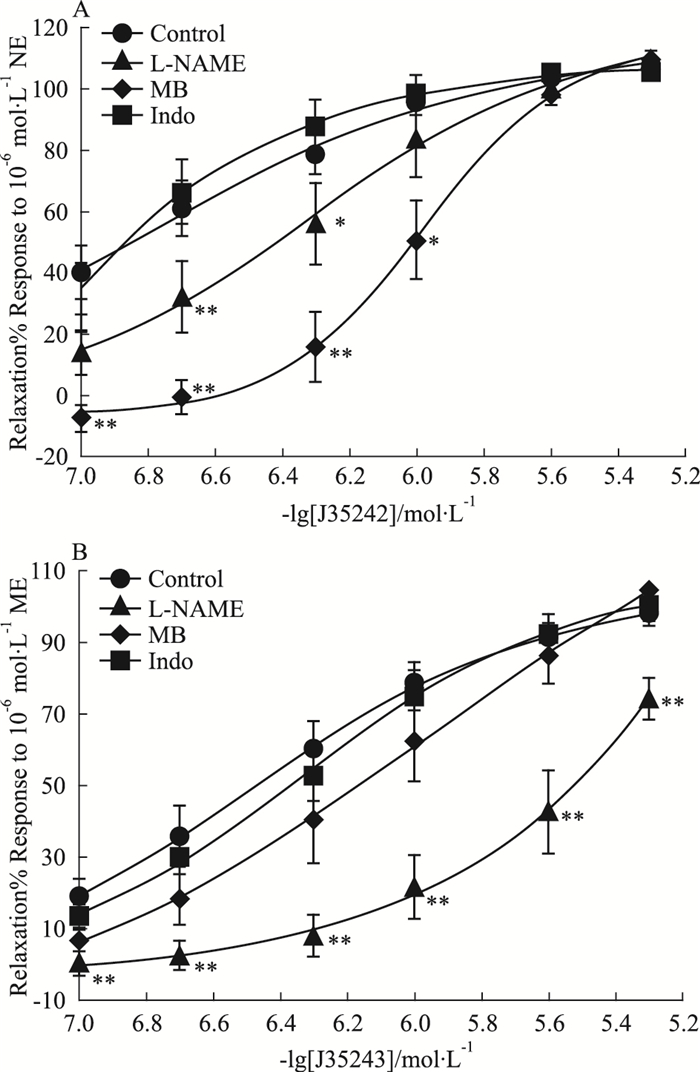
|
| Fig 4 Influences of MB(5 μmol·L-1), L-NAME (5 μmol·L-1), and Indo(100 μmol·L-1) on relaxant effect of J35242(A) and J35243(B) in endothelium-intact aorta rings pre-contracted by NE (x±s=6), *P < 0.05, **P < 0.01 vs control. |
为考察钾通道对DL0805衍生物舒张血管作用的影响,本实验使用不同的钾通道阻滞剂4-AP、TEA和Glib对血管进行预孵育。结果发现(Fig 5),TEA对J35242和J35243引起的舒张作用均有较弱的抑制作用,但差异没有统计学意义。4-AP和Glib对化合物舒张血管作用影响不明显。提示DL0805衍生物的舒张血管作用可能不是通过开放钾离子通道来实现的。
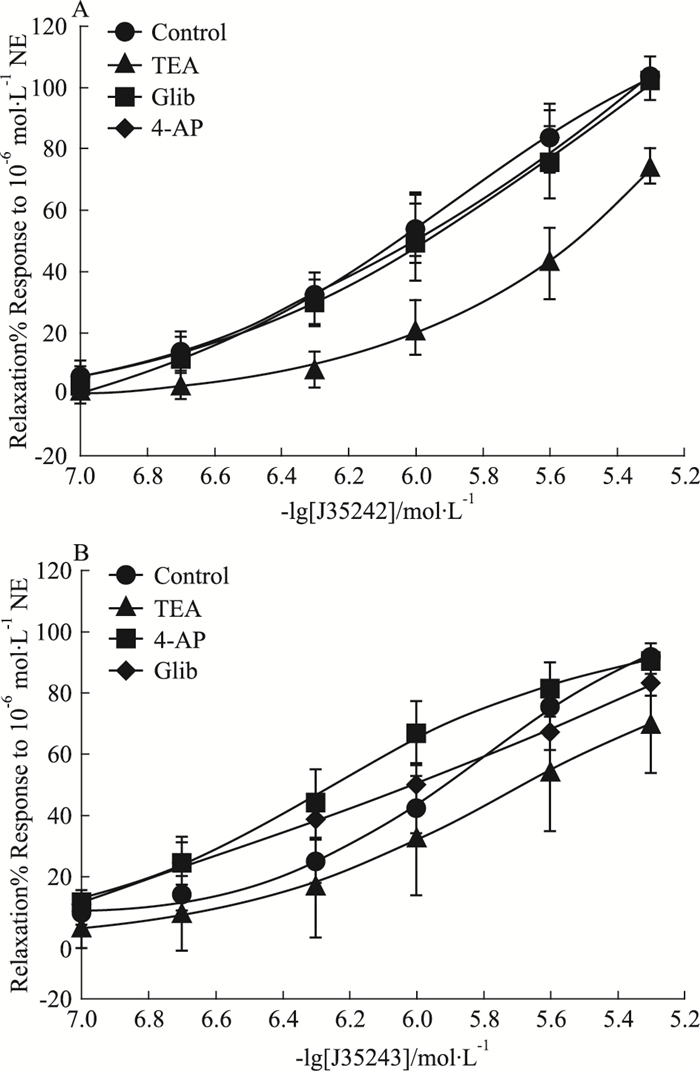
|
| Fig 5 Influences of TEA(5 mmol·L-1), Glib (10 μmol·L-1), and 4-AP (100 μM) on relaxant effect of J35242(A) and J35243(B) in endothelium-denuded aorta rings pre-contracted by NE. (x±s=6) |
在无钙KH液中,10-6 mol·L-1 NE能够引起血管的收缩,其收缩机制是细胞内钙的释放。从结果中发现(Fig 6),0.1、1、5 μmol·L-1的DL0805衍生物孵育20 min后,5 μmol·L-1的J35242能够明显抑制NE引起的血管收缩,血管收缩率从28.45%±3.23%降为3.73%±0.95%,而J35243没有表现出显著的抑制血管细胞内钙释放的作用,J35242有可能是通过抑制内钙释放发挥其舒张血管作用。
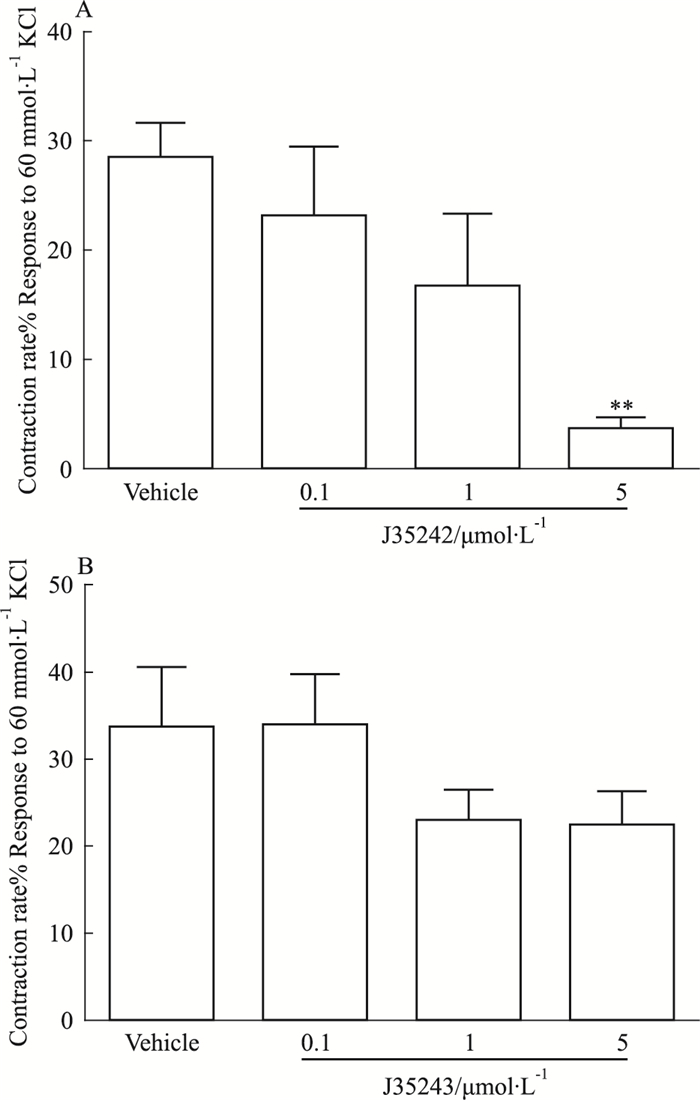
|
| Fig 6 Inhibitory effect of J35242(A) and J35243(B) on contraction induced by intracellular calcium release(±s, n=6) **P < 0.01 vs vehicle. |
在无钙高钾KH液中外加入CaCl2(0.1~2.5 mmol·L-1)能够引起血管的收缩,其机制是细胞外钙内流。1、5和20的DL0805衍生物孵育20 min后,均能够明显抑制浓度累积加入CaCl2引起的血管收缩(Fig 7)。绘制CaCl2的收缩曲线,以空白对照组2.5 mmol·L-1 CaCl2引起的收缩效应为100%,与空白对照组相比,各剂量J35242抑制外钙内流引起的血管收缩曲线,而J35243在抑制外钙内流引起的血管收缩曲线方面作用较J35242弱,由此推测DL0805衍生物可能是通过抑制外钙内流发挥舒张血管作用,其中J35242的作用较强。

|
| Fig 7 Inhibitory effects of J35242(A) and J35243(B) on cumulative-contraction curve dependent on extracellular calcium influx induced by KCl (60 mmol·L-1) in Ca2+-free KH solution(x±s=6) *P < 0.05, **P < 0.01 vs vehicle. |
本实验研究了J35242和J35243这2个全新结构的Rho激酶抑制剂的体外生物学活性。这2个化合物具有相同的结构母核,并且具有Rho激酶抑制活性和血管舒张活性。在此,通过体外血管环实验,进一步评价了2个化合物的血管舒张作用及其相关机制,为化合物的进一步研究和开发提供实验基础。
KCl可以引起细胞膜去极化,造成电压门控型钙离子通道开放,细胞外钙内流,引起平滑肌细胞收缩[9]。在KCl预收缩胸主动脉血管环上,J35242和J35243均表现出明显的血管舒张作用,但J35243的作用明显弱于J35242。
NE作用于平滑肌细胞α受体,并通过IP3信号通路激活受体门控性钙离子通道,造成血管收缩[10]。在NE预收缩的血管环上J35242和J35243同样表现出良好的血管舒张作用,并且作用远强于KCl模型,这提示2个化合物可能对α受体具有拮抗作用,或对受体门控性钙离子通道具有阻滞作用。与此同时,在该模型上,观察到化合物的血管舒张作用呈现一定的内皮依赖性。为了研究内皮途径参与化合物舒张血管作用的机制,在实验中使用了内皮功能相关工具化合物。结果发现,NO合酶抑制剂L-NAME预处理能明显削弱2个化合物的血管舒张作用,提示化合物可能通过抑制NO合成途径介导血管舒张作用[11]。鸟苷酸环化酶抑制剂MB预处理后仅降低了J35242的血管舒张作用,提示J35242可能通过激活鸟苷酸环化酶相关通路发挥血管舒张作用[12]。但COX抑制剂Indo对受试化合物的舒张作用没有明显影响,因此不能证明化合物的舒张血管作用与COX-cAMP有关[13]。
在去除内皮的血管环上,J35242和J35243仍然能够舒张血管,说明其对血管平滑肌细胞具有直接的舒张作用。动脉平滑肌细胞膜K+通道活性的改变可调节膜电位,是参与动脉血管收缩与舒张活动的重要机制[14-15]。为了研究化合物是否通过开放钾离子通道发挥舒张血管作用,实验中使用了3种不同类型钾离子通道阻滞剂,结果发现,化合物舒张血管作用未受到明显影响,因此推测化合物不是通过开放K+通道发挥舒张血管作用的。
正常生理条件下,细胞内Ca2+浓度很低,当细胞兴奋时,细胞内Ca2+浓度升高,则引起细胞收缩。血管平滑肌细胞上主要有两种Ca2+通道:电压门控性钙离子通道(VDCC)和受体门控性钙离子通道(ROCC)[16-17],本实验分别针对两个通道引起的外Ca2+内流和内Ca2+释放进行了研究。结果显示J35242对血管平滑肌细胞内钙释放和外钙内流引起的血管收缩均具有一定的抑制作用,J35242对外钙内流引起的收缩抑制较明显。其作用机制可能为:化合物能够抑制VDCC和ROCC的激活,引起外钙内流和内钙释放的减少,降低细胞胞质中Ca2+浓度,从而抑制血管环的收缩作用;另外作为Rho激酶抑制剂,两个化合物可通过对Rho激酶的抑制作用,使肌球蛋白磷酸酶活化,进而引起细胞对Ca2+敏感性下降,诱导舒张[18];并通过抑制Rho激酶活性,降低MLC和MYPT1磷酸化水平,抑制由Rho激酶介导的非依赖于Ca2+浓度的血管收缩[19]。
综上所述,J35242和J35243具有一定的体外血管舒张作用,其作用机制可能是通过促进内皮NO合成、激活鸟苷酸环化酶相关通路、降低细胞内钙离子来发挥。并且,作为Rho激酶抑制剂,可能通过抑制Rho激酶活性起到一定的舒张血管作用[20]。两个化合物在整体动物水平的药效作用值得进一步探讨,其可能在心血管相关疾病的治疗上具有一定的潜力。另外,值得注意的是,两个化合物具有相同母核,因此以该结构母核为基础进行结构优化,并且甲氧基取代的J35242作用要明显强于氟取代的J35243,这些结果对于发现更多、活性更好的化合物提供重要的借鉴价值。
| [1] | Huveneers S, Daemen M J, Hordijk P L. Between Rho(k) and a hard place: the relation between vessel wall stiffness, endothelial contractility, and cardiovascular disease[J]. Circ Res, 2015, 116 (5): 895-908. doi:10.1161/CIRCRESAHA.116.305720 |
| [2] | Shimokawa H, Sunamura S, Satoh K. RhoA/Rho-kinase in the cardiovascular system[J]. Circ Res, 2016, 118 (2): 352-66. doi:10.1161/CIRCRESAHA.115.306532 |
| [3] | Shibata K, Sakai H, Huang Q, et al. Rac1 regulates myosin II phosphorylation through regulation of myosin light chain phosphatase[J]. J Cell Physiol, 2015, 230 (6): 1352-64. doi:10.1002/jcp.24878 |
| [4] | Han Y, Wang X, Chen J, et al. Noise-induced cochlear F-actin depolymerization is mediated via ROCK2/p-ERM signaling[J]. J Neurochem, 2015, 133 (5): 617-28. doi:10.1111/jnc.2015.133.issue-5 |
| [5] | Li Z, Liang J, Wu W K, et al. Leptin activates RhoA/ROCK pathway to induce cytoskeleton remodeling in nucleus pulposus cells[J]. Int J Mol Sci, 2014, 15 (1): 1176-88. doi:10.3390/ijms15011176 |
| [6] | Loirand G, Pacaud P. Involvement of Rho GTPases and their regulators in the pathogenesis of hypertension[J]. Small GTPases, 2014, 5 (4): 1-10. |
| [7] | 阎雨, 王夙博, 袁天翊, 等. Rho激酶抑制剂DL0805-0对大鼠离体胸主动脉的舒张作用及机制研究[J]. 中国药理学通报, 2014, 30 (4) : 473-7. Yan Y, Wang S B, Yuan T Y, et al. Vasorelaxant effect of Rho kinase inhibitor DL0805-0 on isolated rat aortic rings and its underlying mechanisms[J]. Chin Pharmacol Bull, 2014, 30 (4): 473-7. |
| [8] | Zhu X M, Fang L H, Li Y J, et al. Endothelium-dependent and -independent relaxation induced by pinocembrin in rat aortic rings[J]. Vascul Pharmacol, 2007, 46 (3): 160-5. doi:10.1016/j.vph.2006.09.003 |
| [9] | Xie Y L, Zhou M, Ma H H, et al. Vasorelaxation effect of gastrodin on isolated thoracic aorta rings of rats[J]. Chin J integr Med, 2015, 21 (12): 944-8. doi:10.1007/s11655-015-2082-9 |
| [10] | Gong L L, Fang L H, Qin H L, et al. Analysis of the mechanisms underlying the vasorelaxant action of coptisine in rat aortic rings[J]. Am J Chin Med, 2012, 40 (2): 309-20. doi:10.1142/S0192415X12500243 |
| [11] | Xia T, Guan W, Fu J, et al. Tirofiban induces vasorelaxation of the coronary artery via an endothelium-dependent NO-cGMP signaling by activating the PI3K/Akt/eNOS pathway[J]. Biochem Biophys Res Commun, 2016, 474 (3): 599-605. doi:10.1016/j.bbrc.2016.03.110 |
| [12] | Evora P R. Methylene Blue Is a Guanylate cyclase inhibitor that does not interfere with nitric oxide synthesis[J]. Texas Heart Institute J, 2016, 43 (1): 103. doi:10.14503/THIJ-15-5629 |
| [13] | Kabbesh N, Gogny M, Chatagnon G, et al. Vasorelaxant effect of propentofylline in isolated equine digital veins[J]. Eur J Pharmacol, 2013, 718 (1-3): 124-30. doi:10.1016/j.ejphar.2013.09.003 |
| [14] | Kohler R, Kaistha B P, Wulff H. Vascular KCa-channels as therapeutic targets in hypertension and restenosis disease[J]. Exp Opinion Therap Targets, 2010, 14 (2): 143-55. doi:10.1517/14728220903540257 |
| [15] | Protic D, Radunovic N, Spremovic-Radenovic S, et al. The role of potassium channels in the vasodilatation induced by resveratrol and naringenin in isolated human umbilical vein[J]. Drug Dev Res, 2015 . |
| [16] | Kumrungsee T, Akiyama S, Saiki T, et al. Vasorelaxant Effect of 5′-Methylthioadenosine Obtained from Candida utilis Yeast Extract through the Suppression of Intracellular Ca Concentration in Isolated Rat Aorta[J]. J Agric Food Chem, 2016, 64 (17): 3362-70. doi:10.1021/acs.jafc.6b00679 |
| [17] | Gong L, Peng J, Fang L, et al. The vasorelaxant mechanisms of a Rho kinase inhibitor DL0805 in rat thoracic aorta[J]. Molecules, 2012, 17 (5): 5935-44. |
| [18] | Zicha J, Behuliak M, Pinterova M, et al. The interaction of calcium entry and calcium sensitization in the control of vascular tone and blood pressure of normotensive and hypertensive rats[J]. Physiol Res, 2014, 63 (Suppl 1): S19-27. |
| [19] | Qiao Y N, He W Q, Chen C P, et al. Myosin phosphatase target subunit 1(MYPT1) regulates the contraction and relaxation of vascular smooth muscle and maintains blood pressure[J]. J Biol Chem, 2014, 289 (32): 22512-23. doi:10.1074/jbc.M113.525444 |
| [20] | 李莉, 郭晶, 袁天翊, 等. Rho激酶抑制剂DL0805对血管紧张素Ⅱ刺激的大鼠离体胸主动脉环的舒张作用及机制研究[J]. 中国药理学通报, 2014, 29 (10) : 22512-23. Li L, Guo J, Yuan T Y, et al. Vasorelaxant effect of Rho kinase inhibitor DL0805 on isolated rat thoracic aortic rings stimulated by angiotensin Ⅱ and its underlying mechanisms[J]. Chin Pharmacol Bull, 2014, 29 (10): 22512-23. |