


心肌缺血是指心脏的血液灌注减少,导致心脏的供氧减少,心肌能量代谢不正常,不能支持心脏正常工作的一种病理状态[1]。而炎症反应是参与心肌缺血后心肌损伤和修复的一个重要过程。研究显示[2],固有免疫系统中模式识别受体NOD样受体(nod-like receptors, NLRs)已被证实与心肌梗死中无菌性炎症反应有关,而炎症小体NLRP3是研究最为广泛的炎症小体。在心肌缺血的发展过程中,大量氧自由基等危险因素通过活化NLRP3,诱导IL-1β释放,从而产生炎症反应[3]。Sal B(salvianolic acid B, Sal B)是丹参的水溶性有效活性成分,研究证实Sal B对心肌缺血/再灌注损伤及动脉粥样硬化等疾病有保护作用,其主要机制可能为抗氧化、清除氧自由基、抑制TLR4-NF-κb-TNF-α炎症通路及线粒体凋亡等[4]。因此本实验通过构建大鼠ISO心肌缺血模型,从清除氧自由基、减少心肌炎症和降低NLRP3相关蛋白表达等方面观察Sal B对心肌缺血的影响,从而揭示Sal B抗大鼠心肌缺血损伤作用的相关机制,为临床相关中药应用提供理论和实验依据。
1 材料与方法 1.1 药品与试剂丹酚酸B(Sal B),南京虹桥医药技术研究所,批号:151218;异丙肾上腺素ISO,Sigma,批号:Lot#SLBG3431V;LDH、GOT、CK试剂盒,南京建成生物工程研究所,批号:201605;MDA、T-SOD试剂盒,南京建成生物工程研究所,批号:201605;大鼠IL-1β ELISA试剂盒,NeoBioscience,批号:R160119-007aa;BCA蛋白定量试剂盒,Beyotime,批号:P0012S;NLRP3抗体,proteintech,批号:19771-1-AP;caspase-1/p20抗体,proteintech,批号:22915-1-AP;IL-1β抗体,proteintech,批号16806-1-AP;GAPDH抗体,proteintech,批号10494-1-AP;辣根过氧化物酶标记山羊抗兔IgG二抗,Cell Signaling,批号:7074。
1.2 仪器ML870型Power-lab生理记录仪(澳大利亚AD Instrument);FA1204B型电子天平(上海精科天美科学仪器有限公司);Synergy HT酶标仪(美国Bio-Tek公司);Allegra 64R型冷冻离心机(美国Beckman-Coulter公司);164-5050型Western电泳仪(美国Bio-Rad公司);GelDoc2000型凝胶成像仪(美国Bio-Rad公司)。
1.3 实验动物健康成年SD大鼠,SPF级,♂,体质量180 g~220 g,北京维通利华实验动物技术有限公司,许可证号:SXCK(京):2012-0001。饲养在南京中医药大学实验动物中心,环境温度为22℃~25℃,湿度为50%~65%,实验前动物均进行1周适应性饲养。
1.4 动物分组及处理将大鼠按体重分层法随机分成5组,每组10只,分别为对照组、模型组、Sal B低、中、高剂量组。腹腔注射给予大鼠不同剂量的(5、10、15 mg·kg-1)Sal B,模型组和空白组腹腔注射等体积生理盐水,连续腹腔注射给药7 d;从d 5开始,皮下多点注射ISO(30 mg·kg-1),连续2 d造模。末次造模24 h后,腹腔注射对应剂量的Sal B 30 min后,大鼠腹腔注射10%水合氯醛3 mg·kg-1麻醉,记录心电图 30 min,在心电图终点后腹主动脉取血,3 500 r·min-1离心10 min,离心后取上清,-20℃冻存,备用;一部分心脏放于-80℃冻存,一部分心脏放入10%甲醛固定。
1.5 心电图统计大鼠麻醉,取仰卧位,针状电极小心刺入四肢皮下,描记大鼠1、5、10、20和30 min心电图,记录T波值的变化,进行统计学分析。
1.6 病理组织学形态观察心脏组织标本经固定,脱水,包埋,切片和HE染色,在光学显微镜观察心肌病理组织形态学的变化。
1.7 血清中指标的检测心电图记录完毕后,腹主动脉取血,3 500 r·min-1离心10 min,离心后取上清,按照试剂盒说明书中操作方法检测血清CK、LDH、GOT、MDA、SOD及IL-1β含量。
1.8 Western bolt检测蛋白表达取心脏组织50 mg研磨,加含1%磷酸酶抑制剂、1% PMSF的裂解液500 μL裂解,用BCA法蛋白定量,加上样缓冲液(样本与上样缓冲液体积比为4 :1),加热使蛋白变性,蛋白上样量30 μg,按所需体积混匀后上样,SDS-PAGE电泳,再转移到PVDF膜上,用含5%脱脂奶粉的TBST(0.3% Tris,0.8% NaCl,0.02% KCl,0.01%吐温-20,pH 7.4)常温封闭1.5 h,分别加入相应的一抗(1 :1 000),4℃过夜。次日用TBST洗PVDF膜3次,每次5 min。加入辣根过氧化酶标记的二抗(1 :10 000)摇床上摇动1 h,用TBST洗PVDF膜3次,每次10 min。最后ECL化学发光显色。以GAPDH对照,实验重复3次,进行定量灰度扫描。
1.9 统计方法数据以x±s表示,应用GraphPad Prism 5.0统计软件,两组组间比较采用student t-test检验,多组间比较采用One-way Anova(Dunnet′t)。
2 结果 2.1 心电图的检测连续2 d注射ISO后,造模24 h后,模型组大鼠心电图T波值明显升高(P < 0.01),而Sal B各剂量组可降低不同时间点的T波值,10~30 min时间段内,Sal B 10、15 mg·kg-1组T波值降低更明显(P <0.05, P <0.01);Sal B 5 mg·kg-1组在1 min后与模型组比较虽有降低的趋势,但差异无统计学意义。可知Sal B能够降低ISO导致的大鼠心电图上T波的升高,改善其心电图的病理变化,高剂量效果更加明显(Fig 1)。
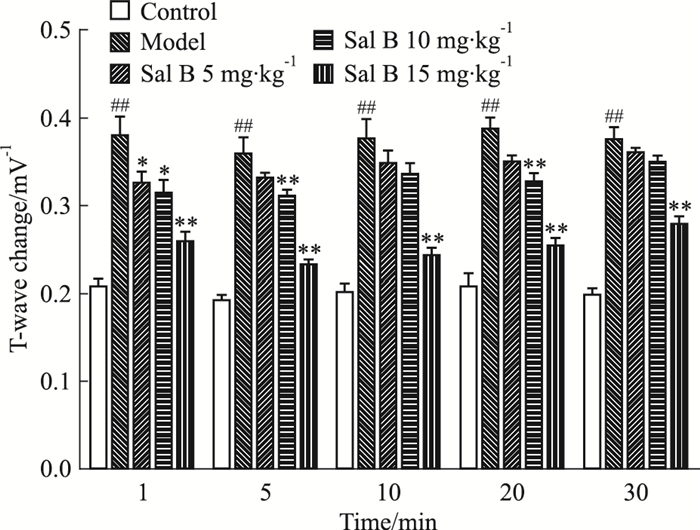
|
| Fig 1 Effects of Sal B on change of T-wavein myocardial ischemic rats induced by ISO(x±s=8) ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group |
空白组大鼠心肌细胞横纹清晰,无细胞坏死等病变及炎性细胞浸润,心外、内膜无异常;模型组心脏可见局灶性大量心肌纤维重度变性坏死,大量炎细胞浸润,局灶性心肌纤维变性坏死。Sal B各给药组心肌纤维变性坏死和炎细胞浸润程度均明显减少(Fig 2)。
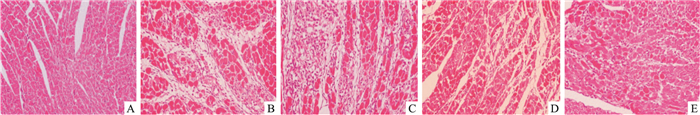
|
| Fig 2 Effects of Sal B on histopathology in ISO-induced myocardial ischemic rats(HE×200)c A:Control; B:Model; C:Sal B 5 mg·kg-1; D:Sal B 10 mg·kg-1; E:Sal B 15 mg·kg-1 |
模型组与空白组比较,血清心肌酶CK、GOT、LDH水平均明显升高且差异性具有统计学意义(P <0.01);Sal B 5、10、15 mg·kg-1组与模型组比较,血清心肌酶CK和GOT水平均明显降低(P <0.05, P <0.01);Sal B 10 mg·kg-1组与模型组比较,血清心肌酶LDH水平明显降低(P <0.05)(Fig 3)。
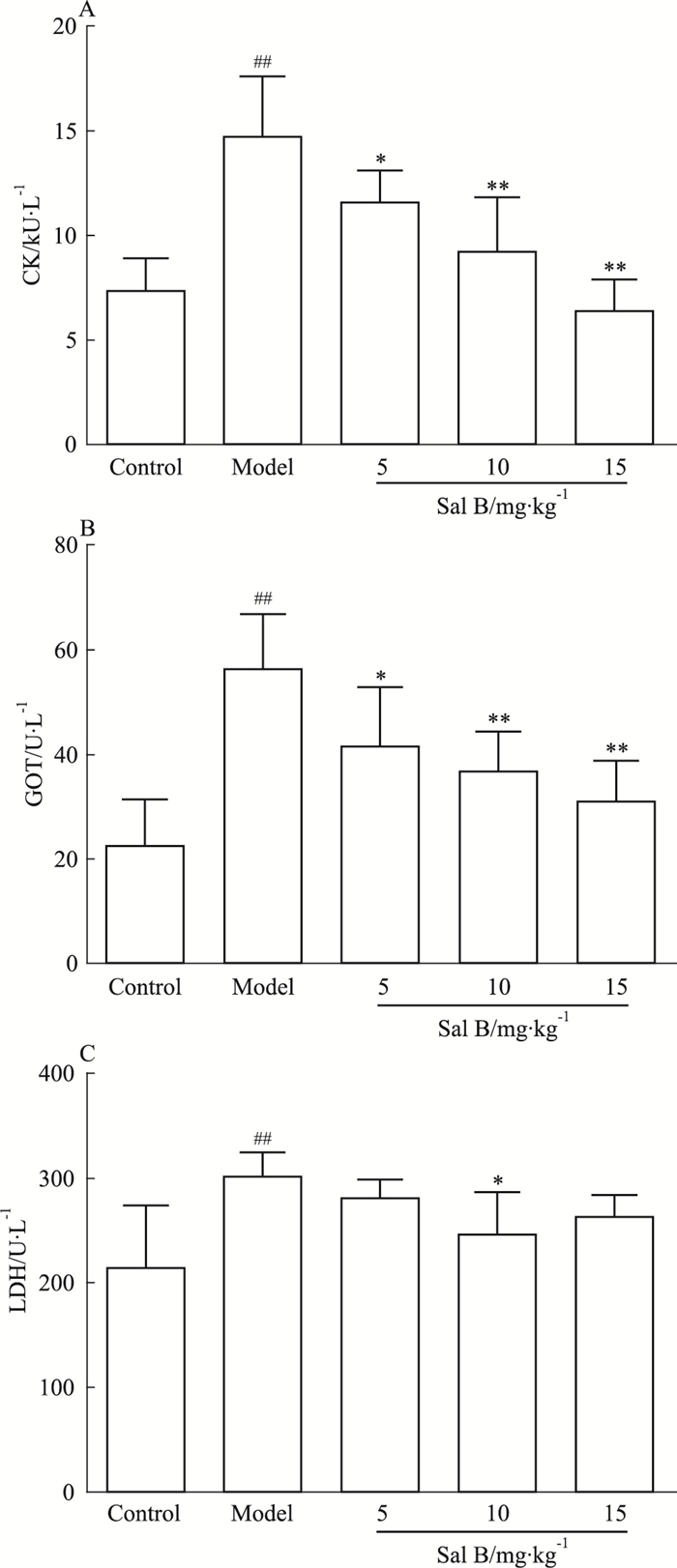
|
| Fig 3 Effects of Sal B on serum level of CK, GOTand LDH in ISO-induced myocardial ischemic rats(x±s=8) ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group |
模型组与空白组比较,血清MDA和IL-1β明显升高,血清T-SOD明显下降差异具有统计学意义(P <0.01);Sal B 5、10、15 mg·kg-1组与模型组比较,血清MDA和IL-1β水平均明显降低(P < 0.01);Sal B 10、15 mg·kg-1组与模型组比较,血清T-SOD明显升高(P <0.05, P <0.01)(Fig 4)。
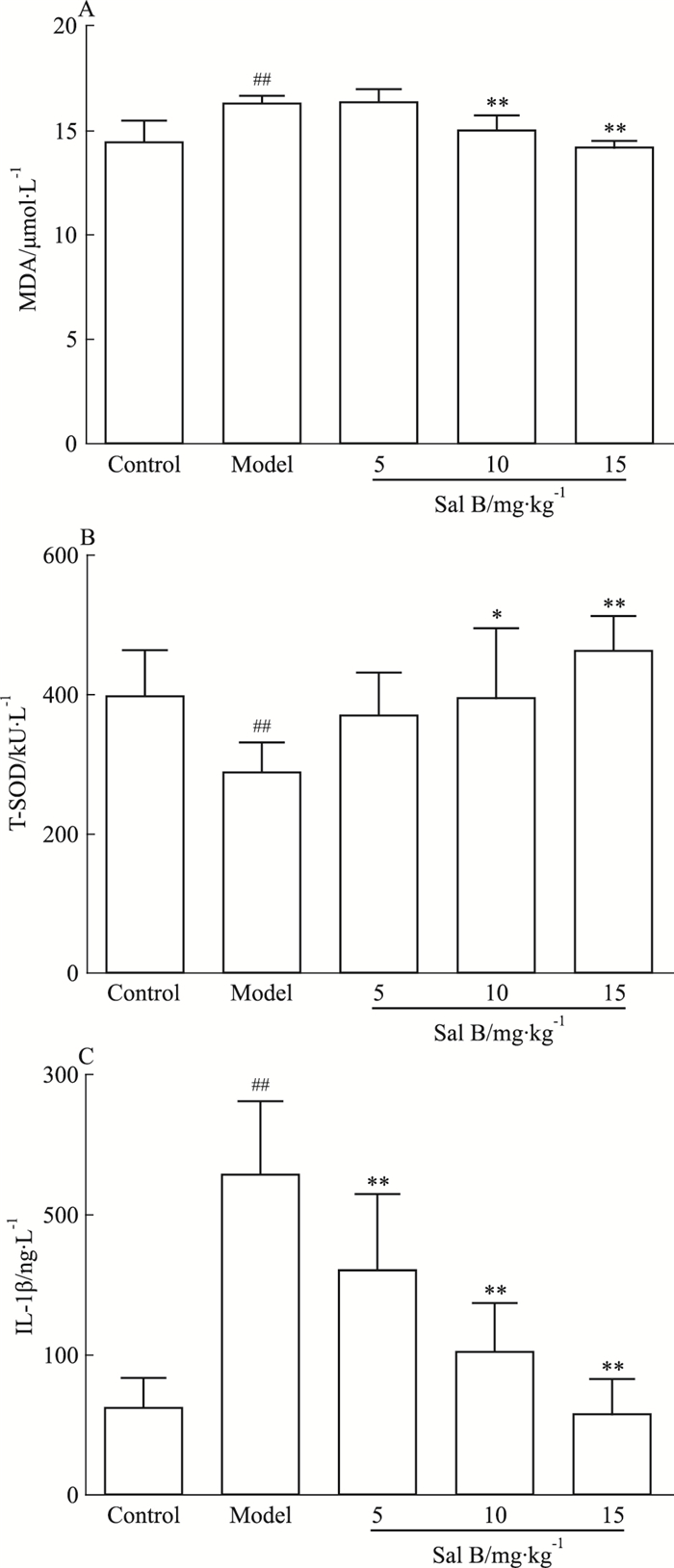
|
| Fig 4 Effects of Sal B on serum level of MDA, T-SODand IL-1β in ISO-induced myocardial ischemic rats(x±s=8) ##P < 0.01 vs control group; *P < 0.05, **P < 0.01 vs model group |
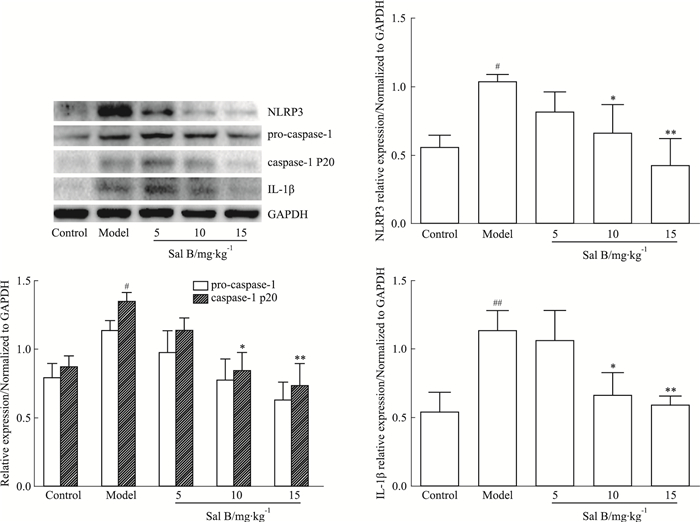
模型组与空白组比较,NLRP3相关蛋白表达均明显升高且差异具有统计学意义(P <0.05);Sal B 10、15 mg·kg-1组与模型组比较,大鼠心脏组织中NLRP3、caspase-1 P20和IL-1β的蛋白表达明显降低(P <0.05, P <0.01)(Fig 5)。
|
| Fig 5 Effects of Sal B on expression of NLRP3 associated proteins in ISO-induced myocardial ischemic rats(±s, n=3) #P < 0.05, ##P < 0.01 vs Control group; *P < 0.05, **P < 0.01 vs Model group |
ISO诱导的心肌缺血模型是心肌缺血损伤常用模型之一。心肌缺血临床表现:心电图T波抬高,其上升程度可以反映心肌缺血和心肌损伤的严重程度[5];心肌酶异常升高,可反映心肌缺血损伤的范围和严重程度,常用作心肌损伤的诊断标志物[6]。本研究发现Sal B干预能够明显抑制ISO导致的心电图缺血样改变,改善受损心肌组织病理形态学和CK、GOT、LDH这些心肌损伤标志酶的病理性升高。MDA和T-SOD活力的高低间接反映体内脂质过氧化物的情况和机体清除氧自由基的能力。表明Sal B对ISO所致的大鼠心肌缺血具有保护作用,且与清除氧自由基有关。
心肌缺血是一个无菌性炎症反应过程,固有免疫系统的激活和IL-1β等促炎因子的分泌在缺血性心脏病中起重要作用[7]。正常情况下,IL-1β的前体pro-IL-1β处于失活状态,pro-caspase-1也是与抑制分子结合亦处于失活状态。NLRP3激活后能够通过与接头蛋白(apoptosis-associated speck-like protein containing a CARD, ASC)相互作用,活化pro-caspase-1为caspase-1 P20,进而形成蛋白复合物“炎症小体”,对pro-IL-1β等底物进行切割,使成熟的IL-1β释放到胞外发挥作用[8-9]。Hu等[10]研究发现丹参脂溶性成分丹参酮ⅡA可以抑制心肌中NLRP3炎症小体的激活,发挥抗心肌梗死损伤的作用。本研究发现Sal B干预后能明显降低心肌缺血大鼠的血清中IL-1β的含量和心脏组织中NLRP3、caspase-1 P20和IL-1β的表达。
NLRP3炎症小体活化的共同上游机制包括:细胞内K+外流、溶酶体破裂以及活性氧(ROS)的产生[11]。心肌缺血产生过量的ROS及自由基也可诱发溶酶体膜通透性增加,影响溶酶体功能进而导致细胞死亡。Orlowski等[12]证实溶酶体破坏,释放蛋白水解酶到细胞质中可能是除了ROS外另一条导致NLRP3激活的重要途径。
以上实验表明,Sal B能够明显减少心肌缺血所引起心肌酶和炎症因子的释放,减少组织的坏死和炎性细胞渗出,其机制可能是通过增加氧自由基的清除从而抑制NLRP3的增加,进而减少下游IL-1β的活化达到保护缺血心肌的目的。但是Sal B能否通过保护溶酶体来抑制NLRP3激活,从而保护缺血心肌尚有待于今后进一步的研究。
( 致谢: 本实验在南京中医药大学药学院,江苏省中药药效与安全性评价重点实验室完成。在此感谢实验室为我提供的优越实验条件与平台,同时感谢导师和同学对我的指导和帮助以及中国药理学通报编辑老师对本文提出的宝贵意见。 )
| [1] | 许波华, 许立. 中药抗心肌缺血作用机制的研究进展[J]. 中国实验方剂学杂志, 2011, 17 (15) : 265-9. Xu B H, Xu L. Advance in studying on chinese medicine of anti-myocardial ischemia pharmacology[J]. Chin J Exp Tradit Med Formulae, 2011, 17 (15): 265-9. |
| [2] | Butts B, Gary R A, Dunbar S B, et al. The importance of NLRP3 inflammasome in heart failure[J]. J Card Fail, 2015, 21 (7): 586-93. doi:10.1016/j.cardfail.2015.04.014 |
| [3] | Sandanger ø, Gao E, Ranheim T, et al. NLRP3 inflammasome activation during myocardial ischemia reperfusion is cardioprotective[J]. Biochem Biophys Res Commun, 2016, 469 (4): 1012-20. doi:10.1016/j.bbrc.2015.12.051 |
| [4] | 林超, 刘兆国, 钱星, 等. 丹酚酸B在心血管疾病中药理作用研究进展[J]. 中国药理学通报, 2015, 31 (4) : 449-52. Lin C, Liu Z G, Qian X, et al. Research progress of salvianolic acid B in cardiovascular diseases[J]. Chin Pharmacol Bull, 2015, 31 (4): 449-52. |
| [5] | Tsigkas G, Kopsida G, Xanthopoulou I, et al. Diagnostic accuracy of electrocardiographic ST-segment depression in patients with rapid atrial fibrillation for the prediction of coronary artery disease[J]. Can J Cardiol, 2014, 30 (8): 920-4. doi:10.1016/j.cjca.2014.03.023 |
| [6] | Radhiga T, Rajamanickam C, Senthil S, et al. Effect of ursolic acid on cardiac marker enzymes, lipid profile and macroscopic enzyme mapping assay in isoproterenol-induced myocardial ischemic rats[J]. Food Chem Toxicol, 2012, 50 (11): 3971-7. doi:10.1016/j.fct.2012.07.067 |
| [7] | Bracey N A, Beck P L, Muruve D A, et al. The Nlrp3 inflammasome promotes myocardial dysfunction in structural cardiomyopathy through interleukin-1β[J]. Exp physiol, 2013, 98 (2): 462-72. doi:10.1113/expphysiol.2012.068338 |
| [8] | Allan S M, Tyrrell P J, Rothwell N J. Interleukin-1 and neuronal injury[J]. Nat Rev Immunol, 2005, 5 (8): 629-40. doi:10.1038/nri1664 |
| [9] | Huising M O, Stet R J, Savelkoul H F, et al. The molecular evolution of the interleukin-1 family of cytokines; IL-18 in teleost fish[J]. Dev Comp Immunol, 2004, 28 (5): 395-413. doi:10.1016/j.dci.2003.09.005 |
| [10] | Hu Q, Wei B, Wei L, et al. Sodium tanshinone IIA sulfonate ameliorates ischemia-induced myocardial inflammation and lipid accumulation in Beagle dogs through NLRP3 inflammasome[J]. Int J Cardiol, 2015, 196 : 183-92. doi:10.1016/j.ijcard.2015.05.152 |
| [11] | Gao J, Liu R T, Cao S, et al. NLRP3 inflammasome: activation and regulation in age-related macular degeneration[J]. Mediators inflamm, 2015, 2015 : 690243. doi:10.1155/2015/690243 |
| [12] | Orlowski G M, Colbert J D, Sharma S, et al. Multiple cathepsins promote Pro-IL-1beta synthesis and NLRP3-mediated IL-1beta activation[J]. J Immunol, 2015, 195 (4): 1685-97. doi:10.4049/jimmunol.1500509 |

