


心血管疾病是威胁人类健康的重大疾病,由血管闭阻再通而引起的心肌缺血/再灌注(myocardial ischemia/reperfusion,MI/R)损伤则进一步增加了继发溶栓或介入疗法后的再狭窄,严重可导致心律失常、心衰等[1-2]。预防和改善MI/R损伤是提高心血管疾病治疗效果的重要环节。
降香为豆科植物降香檀Dalbergia odorifera T.Chen树干和根的干燥心材,是一味治疗心脑血管疾病的常用中草药,在临床被广泛应用[3]。香丹注射液是由丹参的水提物和降香挥发油精制而成[4],而冠心II号方是由丹参和降香的水提物精制而成[5]。目前有关丹参的药理研究较为深入,但降香水提物和降香挥发油的相关药理研究较少。
代谢组学主要是通过分析机体(细胞、组织或生物体)受外部影响所产生的所有代谢物变化及随时间的变化,来推测机体的生理病理机制[6-7]。参与机体新陈代谢、维持机体正常功能的所有内源性小分子是其研究对象,精确、灵敏、高通量的检测手段是其研究的基础。气质联用系统(GC-MS)因具有高灵敏度、高分离效率,可同时提供样品相对分子质量与结构信息等优点[8-9]而被广泛用于代谢组学研究[10]。本研究基于气相飞行时间质谱(GC-TOF-MS)代谢组学技术从血清代谢物角度分析MI/R损伤大鼠及降香干预后大鼠血清化学成分的变化,为缺血性心脏疾病发病机制及降香药效研究提供依据。
1 材料与方法 1.1 仪器与试剂Agilent7890A气相色谱仪(安捷伦公司),LECO Chroma TOF PEGASUS HT质谱仪(LECO公司),SIMCA 14.1软件(瑞典Umetrics公司),降香水提物、降香挥发油(西安小草植物科技有限责任公司,批号20141225,20141011),色谱级甲酸、乙睛(Sigma公司),使用前经孔径为0.22 μm微孔滤膜过滤。EB、TTC染料(Sigma公司),4%的多聚甲醛(广州威佳科技有限公司),LDH试剂盒(南京建成生物研究工程所)、CK-MB试剂盒(上海西唐生物科技有限公司)。
1.2 药材提取方法将降香药材切碎打粉,用8倍高纯蒸馏水浸泡30 min,回流2次,每次1.5 h,滤过浓缩,得到降香水提物;降香药材经水蒸气回流法蒸煮6 h直至挥发油不再增加,无水硫酸钠干燥,得到的挥发油为棕褐色透明油状物,具有特殊的清香味。将提取的降香水提物和降香油提物储存在4℃冰箱。
1.3 实验动物造模与分组SD大鼠由第四军医大学实验动物中心提供(生产许可证号:SCXK-(军)-2012-007),体质量(250±30)g,严格控制环境温度、湿度、光照。实验动物的使用符合第四军医大学动物实验使用规范,同时参照了国立卫生研究院(美国)动物实验指南。大鼠称重后,腹腔注射体积分数为0.1的水合氯醛(3 mL·kg-1)麻醉,仰卧位固定于鼠板并连接心电监护仪,随后进行气管插管并连接于小动物呼吸机(频率:每分钟75次;潮气量:6.0 mL;呼吸比:2 :1)。用体积分数为0.75的酒精消毒胸骨左缘,钝性分离肌肉,打开胸腔并挑起心包,暴露心脏,以左冠状动脉前降支为标志,于左心耳下方1~2 mm处进针,并将一小硅胶管从丝线两端穿入,稳定后结扎30 min,再灌注持续180 min。假手术组只穿线,不结扎[11]。将实验大鼠随机分为假手术组、模型组、DOA组(2.5 g·kg-1)、DOO组(0.5 mL·kg-1)4组,每组6只。给药组分别于造模前灌服,连续7 d,每天1次,假手术组和模型组灌胃生理盐水。
1.4 心肌酶检测各组大鼠再灌注结束时收集动脉血液,室温静置30 min,3 500 r·min-1离心10 min,取上层血清,根据LDH、CK-MB试剂盒说明书进行心肌酶含量检测。
1.5 心梗面积测定各组大鼠再灌注结束后,再次结扎左冠状动脉前降支,于左颈静脉注射2 mL 3%的伊文思蓝(evans blue,EB)后迅速摘除心脏,用生理盐水洗净心脏内积血,去除血管、脂肪,置于冰箱里冷冻10 min。切成1 mm薄片,置入含2%氯化三苯基四氮唑蓝(2, 3, 5-tetrazolium chloride,TTC)液体中,37 ℃避光孵育15 min,将心脏切片压平,置于4%的多聚甲醛固定24 h,数码相机拍照并采用Image ProPlus软件测量心梗面积,心肌梗死面积(infarct area)/%=梗死区/(梗死区+缺血区)×100%[11]。
1.6 血清样品的采集及预处理再灌注结束后,采集各组大鼠全血,4 ℃静置60 min进行分层凝固,3 500 r·min-1离心10 min取上清,高速10 000 r·min-1离心,取上清于-80℃保存备用。取大鼠血清样本100 μL,加入0.35 mL甲醇、20 μL L-2-氯苯丙氨酸,漩涡混匀后将样本4 ℃、12 000 r·min-1离心15 min,取0.4 mL上清于2 mL进样瓶(甲烷硅基化)中。真空浓缩器中干燥提取物37 ℃,2 h,随后向干燥后的代谢物加入60 μL甲氧胺盐试剂(甲氧胺盐酸盐,溶于吡啶20 g·L-1),轻轻混匀,放入烘箱中80 ℃孵育20 min;向每个样品中迅速加入80 μL BSTFA(含有1% TCMS,V/V),将混合物70 ℃孵育1 h,冷却至室温,向混样的样本中加入5 μL FAMEs(饱和脂肪酸甲酯标准混合液,溶于氯仿C8-C16:1 g·L-1;C18-C24:0.5 g·L-1),混匀并上机检测[12-13]。
1.7 色谱质谱条件色谱柱为Restek Rxi-5Sil MS毛细管柱(30 m×250 μm×0.25 μm);进样口温度为280 ℃;进样量为1 μL,载气氦气流速1 mL·min-1;采用程序升温模式,60 ℃保持1 min,以10 ℃·min-1的速率上升至330 ℃,保持10 min;毛细管柱流出组分进入TOFMS离子源,传输线温度为280 ℃,EI离子源温度为220 ℃,离子化电压为-70 eV;MS采用全扫描方式进行数据采集,扫描范围85~600 m/z,扫描速率20 spectra/sec,溶剂延迟276 s。
1.8 数据处理首先对总离子流色谱图进行滤噪、基线矫正、色谱峰判别及匹配,然后将所有归一化的数据进行平均中心化和Pareto scaling预处理[14]。再进行多元统计学分析,包括主成分分析(principal components analysis,PCA)、最小二乘法判别分析(partial least squares discriminate analysis,PLS-DA)和正交最小二乘法判别分析(orthogonal partial least squares discriminate analysis,OPLS-DA),通过OPLS-DA可以鉴别造成聚集和分散的主要差异变量,获得与MI/R损伤及降香干预治疗后的有关潜在生物标志物,再结合Fiehn代谢物数据库和NIST谱库匹配检索,对生物标志物进行鉴定。统计学差异分析采用SPSS 13.0软件,各组数据间的统计采用方差分析,实验结果以x±s表示。
2 结果 2.1 心肌酶和心梗面积如Tab 1所示,模型组大鼠LDH、CK-MB水平与假手术组相比均有显著性差异(P < 0.01),而与模型组比较,降香水提物组和降香挥发油组的LDH、CK-MB水平明显降低。如Fig 1所示,与假手术组相比,模型组大鼠的心梗面积(46.9±2.6)%,明显增大,差异具有统计学意义(P < 0.01);与模型组相比,降香水提物组、降香挥发油组心肌梗死面积(38.6±1.2)、(31.6±2.2)%明显减小(P < 0.01)。
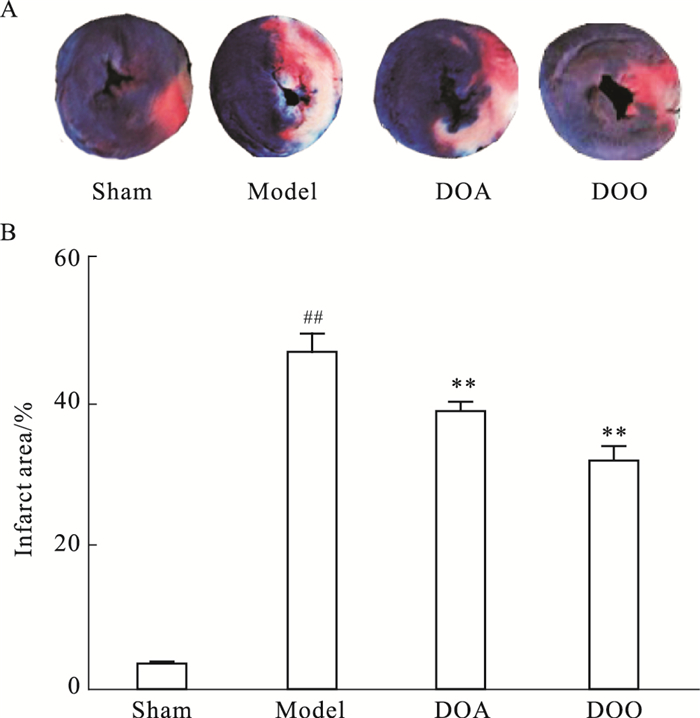
|
| Fig 1 Representative photomicrographs(A)and statistical chart(B) of myocardial infarct size in rats ##P < 0.01 vs sham group; **P < 0.01 vs model group |
| Group | LDH/U·L -1 | CK-MB/mg·L -1 |
| Sham | 123.4±40.9 | 67.3±15.3 |
| Model | 586.6±38.8 ## | 221.9±27.3 ## |
| DOA | 505.5±29.3 ** | 181.2±21.5 |
| DOO | 393.5±32.0 ** | 131.9±18.0 ** |
| ## P < 0.01 vs sham group; *P < 0.05 vs model group, ** P < 0.01 vs model group | ||
采用PCA和PLS-DA方法对各组样本的GC-TOF-MS数据进行分析,结果见Fig 2。结果显示模型组和假手术组沿t[1]轴明显分开,表明MI/R损伤模型复制成功,且两组之间血清化学成分明显不同。而DOA给药组和DOO给药组与模型组存在明显的分离趋势,表明DOA、DOO干预后MI/R损伤大鼠内源性代谢物发生了改变,且DOO给药组大鼠内源性代谢物变化趋势较DOA给药组更加接近假手术组。
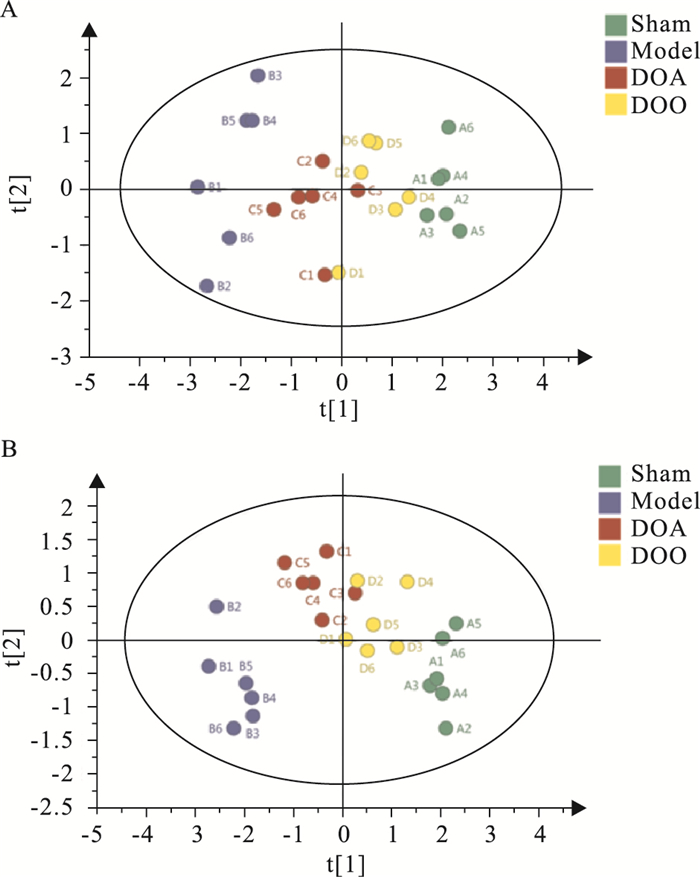
|
| Fig 2 PCA and PLS-DA scores plots of serum in rats |
为了找出发生明显变化的生物标志物,本研究对模型组与假手术组及模型组与各给药组进行OPLS-DA,得到代谢物得分图和载荷图,结果见Fig 3~5。由Fig 3可知,假手术组和模型组能够很好地分开,说明大鼠造模后血清中内源性物质的代谢发生明显异常。由Fig 4~5可知,DOA给药组与模型组明显分开,DOO给药组和模型组明显分开,说明给药组大鼠血清的代谢物相较于模型组发生了改变。
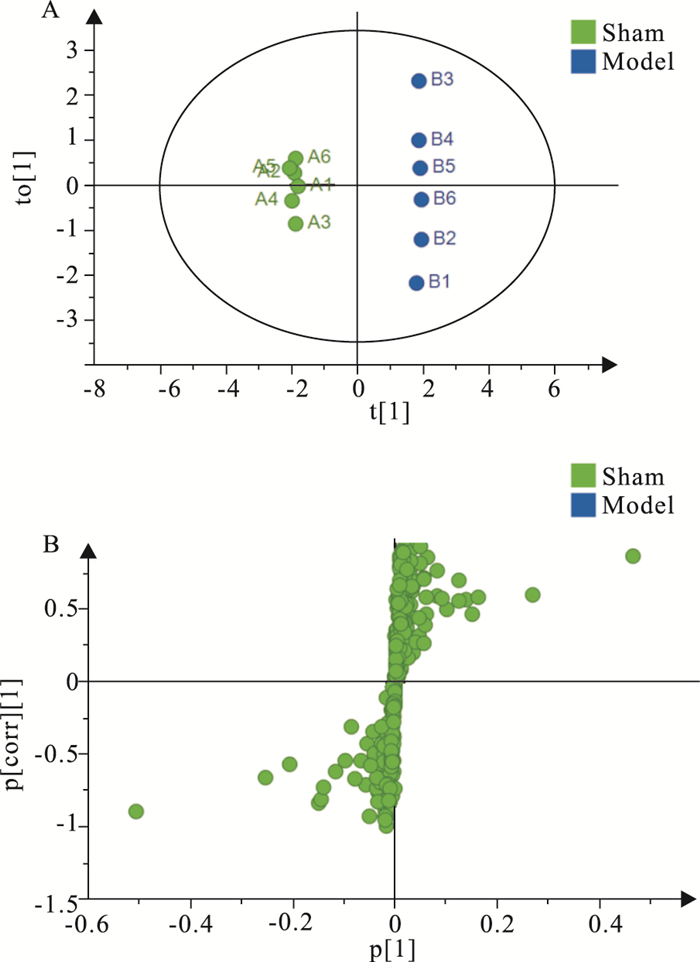
|
| Fig 3 OPLS-DA scores plot (A) and loading S-plot (B) of rat serum in Sham and Model groups |
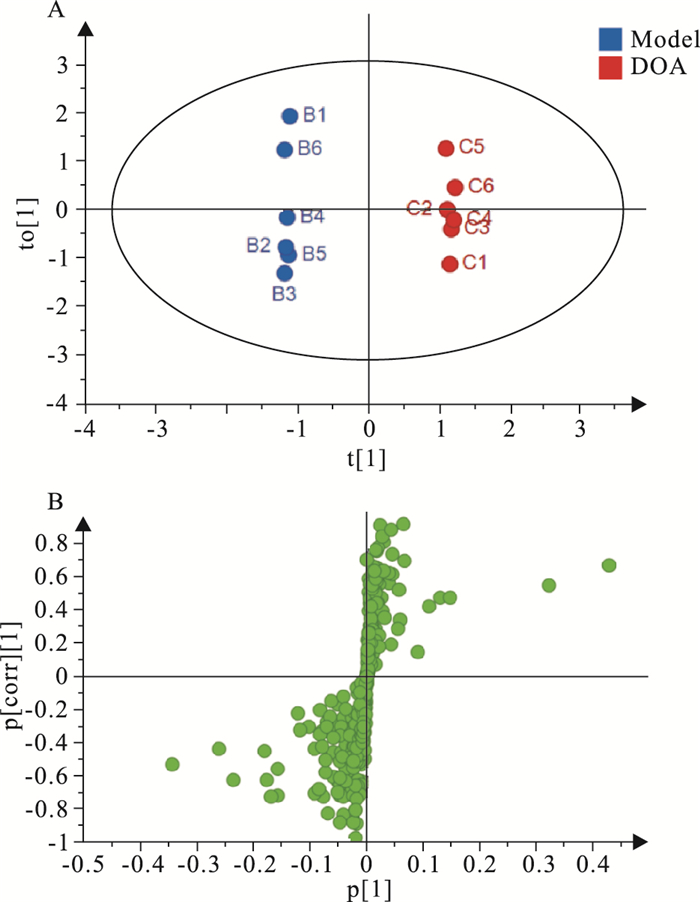
|
| Fig 4 OPLS-DA scores plot (A) and loading S-plot (B) of rat serum in DOA and Model groups |
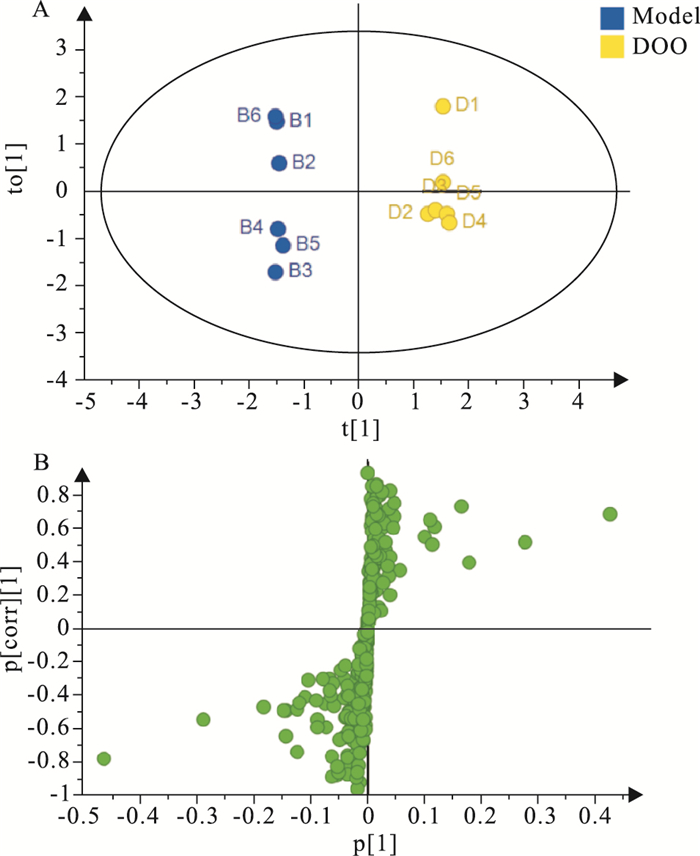
|
| Fig 5 OPLS-DA scores plot (A) and loading S-plot (B) of rat serum in DOO and Model groups |
依据载荷图中,离原点最远的点对分组贡献最大的原则,同时对位于载荷图中边缘位置代谢物的峰面积进行独立样本t检验和VIP (variable importance in projection)计算,以P < 0.05,VIP>1为标准,选取差异具有显著性的潜在生物标志物共13种,结果见Tab 2。与假手术组相比,模型组中乳酸(lactic acid)、3-羟基丁酸(3-hydroxybutyric acid)、磷酸(phosphate)、丝氨酸(serine)、丙二酸(malonic acid)、葡糖庚糖酸(glucoheptonic acid)、花生四烯酸(arachidonic acid)水平升高,而丙氨酸(alanine)、缬氨酸(valine)、亮氨酸(leucine)、肌酸(creatine)、葡萄糖-1-磷酸(glucose-1-phosphate)、柠檬酸(citric acid)水平降低。通过寻找有明显差异的化学组分,即生物标志物,能够说明DOA给药组对MI/R损伤大鼠血清化学成分的影响主要表现在上调丙氨酸水平、下调磷酸和色氨酸水平,而DOO给药组除此之外还可上调缬氨酸、柠檬酸水平,下调花生四烯酸水平,其生物标志物的水平更接近正常组, 结果得到Fig 2验证。
| NO. | Metabolites | tR/min | VIP | Model a | DOA b | DOO b |
| 1 | Lactic acid | 5.12 | 1.67 | ↑(*) | ↓ | ↓ |
| 2 | Alanine | 5.41 | 8.30 | ↓(*) | ↑(*) | ↑(*) |
| 3 | 3-hydroxybutyric acid | 5.82 | 5.18 | ↑(*) | ↓ | ↓ |
| 4 | Valine | 6.23 | 1.95 | ↓(*) | ↑ | ↑(*) |
| 5 | Leucine | 6.62 | 2.82 | ↓(*) | ↑ | ↑ |
| 6 | Phosphate | 6.65 | 2.94 | ↑(*) | ↓(*) | ↓(*) |
| 7 | Serine | 7.22 | 1.57 | ↑(*) | ↓(*) | ↓(*) |
| 8 | Malonic acid | 7.95 | 1.08 | ↑(*) | ↓ | ↓ |
| 9 | Creatine | 8.51 | 2.45 | ↓(*) | ↓ | ↑ |
| 10 | Glucose-1-phosphate | 9.67 | 1.39 | ↓(*) | ↑ | ↑ |
| 11 | Citric acid | 9.94 | 2.39 | ↓(*) | ↑ | ↑(*) |
| 12 | Glucoheptonic acid | 12.19 | 7.77 | ↑(*) | ↓ | ↓ |
| 13 | Arachidonic acid | 12.60 | 1.05 | ↑(*) | ↓ | ↓(*) |
| Note:acompared to sham group, bcompared to model group. Arrow (↑) indicates relative increase in signal. Arrow (↓) indicates relative decrease insignal. Asterik (*) represents a statistically significant difference (P < 0.05). | ||||||
本研究探讨了DOA和DOO对MI/R损伤大鼠心肌酶、心肌梗死面积的影响,并应用代谢组学方法从整体血清代谢表型及其潜在生物标志物的角度初步探索了其药效和作用机制。心肌酶、心梗面积结果表明大鼠MI/R损伤模型建立成功,降香水提物和降香挥发油都能明显减少大鼠MI/R损伤,提示其对缺血性心脏疾病具有防治作用。基于GC-TOF-MS代谢组学结果共筛出13个潜在的生物标志物,与假手术组相比,模型组大鼠血清中部分代谢物含量异常,这些物质参与了多种生理生化过程,特别是糖代谢、脂代谢和氨基酸代谢,而DOA给药组和DOO给药组干预后,这些变化的代谢物都有不同程度的回调。
与假手术组相比,模型组中糖代谢的紊乱主要体现在乳酸、丙二酸、葡萄糖庚酸含量升高,柠檬酸、丙氨酸、葡萄糖-1-磷酸含量下降。乳酸是葡萄糖无氧酵解的特异性产物,模型组含量升高提示组织缺氧缺血与糖酵解途径的紊乱有关[15]。丙二酸、丙酮酸含量的升高、柠檬酸含量的降低提示三羧酸循环障碍[16-17]。磷酸含量增加,提示能量代谢障碍导致心肌耗氧量和能耗的增加,在某种程度上加重了心肌缺氧[18-19]。本研究结果显示,DOA给药组和DOO给药组可降低大鼠血清中乳酸、丙二酸、葡萄糖庚酸含量,升高柠檬酸、丙氨酸、葡萄糖-1-磷酸含量,且可明显降低磷酸含量,提示其可能的机制为调节糖代谢紊乱从而改善大鼠心肌能量代谢障碍。模型组大鼠3-羟基丁酸的升高提示脂代谢增强,当糖氧化功能障碍时,脂肪动员代偿性增强,脂肪酸β-氧化进行供能,3-羟基丁酸含量升高[20]。而DOA给药组和DOO给药组可降低3-羟基丁酸含量,提示DOA和DOO可抑制缺血心肌的脂肪酸氧化,进而减少缺血心肌氧耗,改善心肌能量代谢保护缺血心肌。
氨基酸在许多物质代谢通路中起重要作用,任何一种氨基酸的异常都会影响免疫系统和其它器官功能的正常发挥[21-22]。本研究中模型组亮氨酸、缬氨酸含量的降低提示机体糖脂有氧功能不足,动员外周组织氨基酸代谢加强供能。同时丝氨酸作为非必需氨基酸,含量反而上升,可能与它对缺血细胞的保护作用有关,使得血清中非必需氨基酸增多。肌酸是胞质中高能磷酸储备,能为机体快速提供能量,而模型组水平降低说明能量供应障碍。本研究显示DOA给药组和DOO给药组可回调各氨基酸水平,其中DOA给药组可明显降低丝氨酸含量,DOO给药组可明显降低丝氨酸含量,升高缬氨酸含量,提示DOA和DOO通过改善氨基酸代谢而发挥预防心血管疾病作用。
在心肌缺血/再灌注损伤发生后,磷脂酶活化,花生四烯酸在缺血心肌聚集,其代谢异常也与炎症反应密切相关,可导致心脏的收缩力下降,心输出量减少,诱发或加重心肌梗死和心绞痛[23]。而降香干预组尤其是降香挥发油组明显降低了花生四烯酸的含量,提示降香挥发油可以改善MI/R损伤大鼠的炎症反应,减少其病理损害。
DOA和DOO对这13种潜在的生物标志物都有不同程度的回调,DOA给药组通过改善三羧酸循环、氨基酸代谢,从而改善能量代谢从而发挥预防作用,而DOO给药后预防效果更佳,不仅对丙氨酸、磷酸、丝氨酸具有改善作用,而且还对缬氨酸、柠檬酸、花生四烯酸代谢有所改善,提示降香油通过改善三羧酸循环、氨基酸代谢、降低炎症反应而发挥预防作用。
综上所述,DOA和DOO对MI/R损伤大鼠具有预防作用,能够通过改变机体代谢物的变化,改善机体代谢网络,调节糖代谢、脂代谢紊乱,降低氨基酸代谢,从而改善能量代谢,充分体现了中药复方“多途径”、“多层次”、“多靶点”的整体作用的特点。
( 致谢: 本文实验在第四军医大学西京医院新药研发中心和上海阿趣生物科技有限公司完成,在整个研究过程中得到了奚苗苗副教授、段佳林研究员及邓军亮研究员的悉心指导和热忱帮助,再次深表谢意! )
| [1] | Deng Y, Yang M, Xu F, et al. Combined Salvianolic acid B and Ginsenoside Rg1 exerts cardioprotection against ischemia/reperfusion injury in rats[J]. PLoS One, 2015, 10 (8): e135435. |
| [2] | Tian Y, Li H, Liu P, et al. Captopril pretreatment produces an additive cardioprotection to isoflurane preconditioning in attenuating myocardial ischemia reperfusion injury in rabbits and in humans[J]. Mediat Inflamm, 2015, 2015 : 1-12. |
| [3] | Sugiyama A, Zhu B M, Takahara A, et al. Cardiac effects of salvia miltiorrhiza/dalbergia odorifera mixture, an intravenously applicable Chinese medicine widely used for patients with ischemic heart disease in China[J]. Circ J, 2002, 66 (2): 182-4. doi:10.1253/circj.66.182 |
| [4] | Song M, Huang L, Zhao G, et al. Beneficial effects of a polysaccharide from Salvia miltiorrhiza on myocardial ischemia-reperfusion injury in rats[J]. Carbohyd Polym, 2013, 98 (2): 1631-6. doi:10.1016/j.carbpol.2013.08.020 |
| [5] | Li Y H, Huang X, Wang Y, et al. Pharmacokinetic comparison of the vasorelaxant compound ferulic acid following the administration of Guanxin II to healthy volunteers and patients with angina pectoris[J]. Exp Ther Med, 2013, 6 (5): 1283-9. |
| [6] | 周红光, 陈海彬, 王瑞平, 等. 代谢组学在中药复方研究中的应用[J]. 中国药理学通报, 2013, 29 (2) : 161-5. Zhou H G, Chen H B, Wang R P, et al. Metabonomics and its application in TCM formula study[J]. Chin Pharmacol Bull, 2013, 29 (2): 161-5. |
| [7] | 何君, 周宏灏. 代谢组学及其在药理学中的进展[J]. 中国药理学通报, 2006, 22 (11) : 1304-9. He J, Zhou H H. Metabonomics and its growing insights into pharmacology[J]. Chin Pharmacol Bull, 2006, 22 (11): 1304-9. |
| [8] | Zhang M, Wen C, Zhang Y, et al. Serum metabolomics in rats models of ketamine abuse by gas chromatography-mass spectrometry[J]. J Chromatogr B, 2015, 1006 : 99-103. doi:10.1016/j.jchromb.2015.10.037 |
| [9] | Hua Y, Xue W, Zhang M, et al. Metabonomics study on the hepatoprotective effect of polysaccharides from different preparations of Angelica sinensis[J]. J Ethnopharmacol, 2014, 151 (3): 1090-9. doi:10.1016/j.jep.2013.12.011 |
| [10] | 涂佳玉, 阿基业. 通塞脉微丸干预缺血性脑中风大鼠的脑组织代谢组学研究[J]. 中国药理学通报, 2011, 27 (10) : 1467-71. Tu J Y, A J Y. Brain metabonomics study of ischemic cerebral apoplexy rats treated with Tongsaimai pellets[J]. Chin Pharmacol Bull, 2011, 27 (10): 1467-71. |
| [11] | 闫佳佳, 伍晓晓, 段佳林, 等. 楤木皂苷对大鼠心肌缺血/再灌注损伤的保护作用[J]. 现代生物医学进展, 2015, 15 (15) : 2829-32. Yan J J, Wu X X, Duan J L, et al. Protective effects of total Saponins extracted from Aralia taibaiensis on myocardial ischemia/reperfusion injury[J]. Prog Mod Biomed, 2015, 15 (15): 2829-32. |
| [12] | Qiu Y, Cai G, Su M, et al. Serum metabolite profiling of human colorectal cancer using GC TOFMS and UPLC QTOFMS[J]. J Proteome Res, 2009, 8 (10): 4844-50. doi:10.1021/pr9004162 |
| [13] | Xiao Y P, Wu T X, Sun J M, et al. Response to dietary L-glutamine supplementation in weaned piglets: a serum metabolomic comparison and hepatic metabolic regulation analysis[J]. J Anim Sci, 2012, 90 (12): 4421-30. doi:10.2527/jas.2012-5039 |
| [14] | 刘双梅, 李桂林, 汤晓丽, 等. 甲基莲心碱对2型糖尿病模型大鼠作用的代谢组学研究[J]. 中国药理学通报, 2012, 28 (4) : 490-5. Liu S M, Li G L, Tang X L, et al. Effects of neferine on type 2 diabetic mellitus rats by metabonomics method[J]. Chin Pharmacol Bull, 2012, 28 (4): 490-5. |
| [15] | Bergman B C, Tsvetkova T, Lowes B, et al. Myocardial glucose and lactate metabolism during rest and atrial pacing in humans[J]. J Physiol, 2009, 587 (9): 2087-99. doi:10.1113/jphysiol.2008.168286 |
| [16] | Wang Y, Li C, Chuo W, et al. Integrated proteomic and metabolomic analysis reveals the NADH-mediated TCA cycle and energy metabolism disorders based on a new model of chronic progressive heart failure[J]. Mol Biosyst, 2013, 9 (12): 3135-45. doi:10.1039/c3mb70263d |
| [17] | Liu Y T, Jia H M, Chang X, et al. The metabolic disturbances of isoproterenol induced myocardial infarction in rats based on a tissue targeted metabonomics[J]. Mol Biosyst, 2013, 9 (11): 2823-34. doi:10.1039/c3mb70222g |
| [18] | Wang Y, Liu L, Hu C, et al. Effects of Salviae Mitiorrhizae and cortex moutan extract on the rat heart after myocardial infarction: a proteomic study[J]. Biochem Pharmacol, 2007, 74 (3): 415-24. doi:10.1016/j.bcp.2007.04.017 |
| [19] | Wu F, Zhang E Y, Zhang J, et al. Phosphate metabolite concentrations and ATP hydrolysis potential in normal and ischaemic hearts[J]. J Physiol, 2008, 586 (17): 4193-208. doi:10.1113/jphysiol.2008.154732 |
| [20] | Dardzinski B J, Smith S L, Towfighi J, et al. Increased plasma beta-hydroxybutyrate, preserved cerebral energy metabolism, and amelioration of brain damage during neonatal hypoxia ischemia with dexamethasone pretreatment[J]. Pediatr Res, 2000, 48 (2): 248-55. doi:10.1203/00006450-200008000-00021 |
| [21] | Felig P, Wahren J, Sherwin R, et al. Amino acid and protein metabolism in diabetes mellitus[J]. Arch Intern Med, 1977, 137 (4): 507-13. doi:10.1001/archinte.1977.03630160069014 |
| [22] | Broderick T L, Haloftis G, Paulson D J. L-propionylcarnitine enhancement of substrate oxidation and mitochondrial respiration in the diabetic rat heart[J]. J Mol Cell Cardiol, 1996, 28 (2): 331-40. doi:10.1006/jmcc.1996.0031 |
| [23] | Wang Y, Li C, Liu Z, et al. DanQi pill protects against heart failure through the arachidonic acid metabolism pathway by attenuating different cyclooxygenases and leukotrienes B4[J]. BMC Complement Altern Med, 2014, 14 : 67. doi:10.1186/1472-6882-14-67 |

