


2. 石河子大学医学院第一附属医院药剂科,新疆 石河子 832008
2. Dept of Pharmacy, the First Affiliated Hospital of Medical College of Shihezi University, Shihezi Xinjiang 832008, China
糖尿病(diabetes mellitus,DM)是一种与胰岛素产生和作用异常相关、以高血糖症为主要特征的代谢性疾病,包括以胰岛素绝对缺乏为主的1型(type 1 diabetes,TD1)和以胰岛素相对缺乏和胰岛素抵抗为主的2型(type 2 diabetes,TD2)两种。目前,糖尿病已成为继心脑血管疾病、肿瘤之后严重危害人类健康的第三大慢性病[1]。临床上DM的治疗主要以注射外源性的胰岛素(insulin)和口服多种化学药物(磺酰脲类、双胍类、糖苷酶抑制剂、胰岛素增敏剂等)来控制和影响机体血糖水平。但长期使用外源性的胰岛素和化学药物都表现出一定程度的胰岛素抵抗、受体脱敏、肝肾损害和严重胃肠道反应等不良反应。为了克服和减小这些不良反应,人们开始关注从天然植物中寻找能够有效治疗DM的有效活性成分或有效部位。目前,从天然植物中寻找疗效确切、作用缓和、具有多作用靶点和作用途径,同时,具有较少不良反应的有效成分或有效部位已经成为DM药物研发中的热点[2-5]。
新疆两色金鸡菊又名“雪菊”、“昆仑雪菊”,为菊科金鸡菊属一年生草本植物两色金鸡菊(Coreopsis tinctoria Nutt.)的干燥头状花序(C. tinctoria flowering tops,CTF)。在新疆和田地区广泛种植,主要分布于和田昆仑山区海拔2 300~3 000 m的高海拔山区。当地居民常采集其新鲜头状花泡茶饮,可治疗燥热烦渴、心慌、胃肠不适、食欲不振等病症[6],是维吾尔族民间世代传承下来的一种养生、保健的天然植物[7]。现代药效学研究证实,新疆两色金鸡菊提取物具有较好的降血压、降血脂、抗炎等功效[8-9],同时也具有抗氧化、降血糖和恢复或修复机体糖不耐受的作用[10]。
本研究采用响应面优化提取两色金鸡菊总黄酮部位,提取液经石油醚萃取后,剩余水相分别用乙酸乙酯和正丁醇萃取,获得乙酸乙酯(EAE)和正丁醇提取物(BE)。考察乙酸乙酯和正丁醇提取物抗脂质过氧化的能力;同时考察正丁醇提取物灌胃给药对由链脲佐菌素(STZ)诱导的DM小鼠体内生化指标以及肝脏、胰腺、肾脏和体重的影响。通过本研究,初步探讨新疆两色金鸡菊提取物对DM小鼠的作用效果,为充分利用新疆两色金鸡菊植物资源、开发相关糖尿病的医药产品或保健食品提供参考。
1 仪器与材料 1.1 实验动物SPF级♂昆明小鼠,体质量(25±5) g;SPF级SD大鼠,体质量250 g,由新疆医科大学动物实验中心提供,生产许可证:SCXK(新)2011-0004。室内通风良好,饲养环境模拟自然昼夜光照12 h·d-1,温度21~23 ℃,湿度40%~45%,自由饮水。高糖高脂饲料为每100 kg中含胆固醇25%、胆酸钠0.4%、蛋黄粉10%、蔗糖15%、猪油10%。高糖高脂饲料由新疆医科大学动物实验中心提供。
1.2 试剂与药品试剂:亚油酸、硫氰酸铁、硫代巴比妥酸、EDTA-2Na、Tween20、三氯乙酸、维生素C、叔丁基对羟基茴香醚(butylated hydroxyanisole,BHA);乙醇等各种化学试剂均为分析纯(购于国药集团化学试剂有限公司);链脲佐菌素(≥98%,streptozotocin,Sigma公司);盐酸二甲双胍(中美上海施贵宝制药有限公司);水为去离子纯净水。
原药材:两色金鸡菊购于新疆和田地区策勒县努尔乡高海拔种植区(2013年11月),经石河子大学药学院李鹏副教授鉴定为菊科金鸡菊属一年生草本植物蛇目菊的干燥头状花序。
1.3 仪器Shimadzu-UV2600紫外分光光度计(日本岛津);SHA-B水浴恒温振荡器(北京光明);罗氏Advantage 2型血糖仪及配套试纸;电子天平(北京Sartorius);TP300超声波提取器(北京天鹏电子技术有限公司);旋转蒸发器RE-2000(上海亚荣);Fsh-2型可调高速组织匀浆机(江苏省金坛市宏华仪器厂);日立7080全自动生化测定仪(日本Hitachi)。
2 方法 2.1 两色金鸡菊提取物的制备以总黄酮提取率(总黄酮质量/药材干重)为指标,采用响应面优化设计程序,获得超声波提取最优条件:提取时间29.5 min,液料比20.6 ∶1,59.84%乙醇。提取液经减压浓缩,至无醇味,再用石油醚1 ∶1进行萃取。去除石油醚层,依次使用乙酸乙酯和水饱和的正丁醇进行萃取,可获得乙酸乙酯和正丁醇萃取液。萃取液经减压旋转浓缩,挥至尽干,置冷冻干燥仪中干燥,得乙酸乙酯提取物(EAE)和正丁醇提取物(BE)。
2.2 抗脂质过氧化能力实验-硫代巴比妥酸法(thiobarbituricacid,TBA) 2.2.1 亚油酸反应体系下测定提取物抗脂质过氧化能力[11]分别精密移取1.0 mL不同浓度的样品溶液(20、40、80、160、200 mg·L-1)置10 mL具塞试管中,加入1.0 mL亚油酸溶液(2.5%的Tween 20水溶液)和2.0 mL PBS缓冲液(0.05 mol·L-1,pH 7.0)及1.0 mL去离子水,震荡混匀。混合溶液置(40±1)℃电热恒温培养箱中,每隔24 h用硫氰酸铁法测定1次过氧化物生成量。当所测的溶液吸光度A由最大值开始变小时,分别取0.5 mL的反应溶液,加入1.0 mL三氯乙酸溶液(20%,含0.67%TBA),混合液沸水浴10 min,放冷,于λ=532 nm进行测定吸光度值(A)。同时以维生素C和BHA作为阳性对照,平行测定3次。
计算方法:脂质过氧化抑制率/%=(1-Ai/Ao)×100
其中Ai为含试样培养液的吸光度;Ao为空白培养液(以水替代样品)的吸光度。
2.2.2 大鼠肝细胞匀浆反应体系下提取物抗脂质过氧化实验[12-13]1%大鼠肝细胞匀浆制备:取Sprague Dawley大鼠1只,腹腔麻醉,处死。迅速于4 ℃下摘取肝脏。去除肝脏表面附着的脂肪组织,并用4 ℃的0.9%的生理盐水进行清洗。洗涤完毕后用吸水纸吸干,剪取适量肝脏组织,称重。按1 ∶9(重量体积比)加入0.9%的生理盐水(含0.1 mmol·L-1 EDTA-2Na和0.01 mol·L-1蔗糖)进行组织匀浆,连续3~5次,每次20 s。取组织匀浆继以3 000~4 000 r·min-1离心10~15 min,取适量上清液进行测定。
实验方法:0.2 mL样品乙醇溶液(20、40、80、120、200 mg·L-1)加入1.0 mL 1%大鼠肝组织匀浆,然后加入50 μL FeCl2(0.5 mmol·L-1)和50 μL H2O2溶液(0.5 mmol·L-1 ),于37 ℃孵育1 h后,加入1.0 mL含0.67%硫代巴比妥酸的15%三氯醋酸水溶液中,沸水浴15 min,于λ=532 nm进行测定吸光度值(A)。同时以维生素C和BHA作为阳性对照,平行测定3次。计算公式和计算方法见“2.2.1”。
2.3 正丁醇提取物对DM小鼠体重、体内生化指标和主要器官的影响 2.3.1 糖尿病小鼠模型的建立[14]将75只♂昆明小鼠适应性喂养1周后,从中随机抽取12只作为正常组,其余所有小鼠禁食12 h,腹腔注射链脲佐菌素溶液(0.1 g·kg-1,ip);正常对照组给予相同体积的无菌柠檬酸-柠檬酸钠缓冲液,间隔4d后第2次腹腔注射STZ溶液,经过72 h后,禁食10 h,进行口服葡萄糖耐受实验,选择2 h血糖≥11.1 mmol·L-1的小鼠进行分组实验。
2.3.2 糖尿病小鼠分组及给药正常对照组:给予同体积的0.9%氯化钠注射液。将造模成功的60只小鼠随机分为5组:模型组,给予同体积0.9%氯化钠注射液;阳性对照组,给予同体积的盐酸二甲双胍(0.12 g·kg-1);实验组,给予同体积的新疆两色金鸡菊正丁醇萃取部位低剂量组(0.2 g·kg-1)、中剂量组(0.4 g·kg-1)、高剂量组(0.8 g·kg-1)。模型组与实验组均为12只,加前述正常对照组共6组。正常对照组自由饮水给予基础饲料,其余各组给予充分饮水与高脂高糖饲料,于每天固定时间点灌胃(ig)给药,连续给药4周。
2.4 测定指标 2.4.1 体重变化检测每日观察小鼠的外观、饮水量、摄食量、垫料潮湿程度以及行为活动,每周测量体重1次。实验结束后空腹测定体重,计算实验前后体重变化率。
体重变化率/%=(实验前体重-实验结束后体重)/原体重×100%
2.4.2 肝脏、胰腺、肾脏指数的测定各实验组在给药4周后,空腹称重。小鼠摘眼球取血后立即处死,低温条件下迅速打开腹腔取出肝脏、胰腺、肾脏,用0.9%氯化钠注射液进行漂洗,滤纸吸干后称重并记录,计算脏器指数。
肝脏指数/%=肝脏质量(mg)/小鼠体重(g)×100
胰腺指数/%=胰腺质量(mg)/小鼠体重(g)×100
肾脏指数/%=肾脏质量(mg)/小鼠体重(g)×100
2.4.3 体内生化指标测定采用全自动生化测定仪测定小鼠血浆中多项指标:肝功能(TP、ALB、ALT、AST、GGT、ALP)、血糖(GLU)和血脂(TC、TG、HDL)。
2.4.4 组织病理学检查将上述取得的肝脏、肾脏和胰腺组织拭干后,眼科剪剪取组织块适量浸泡于10%甲醛溶液中固定,24 h后乙醇梯度脱水,石蜡包埋切片,二甲苯漂洗后,HE染色做病理切片检查。
2.5 提取物抗脂质过氧化能力(SC50)计算SC50(50% concentration of scavenging activity,SC50)计算:以样品lgC为横坐标,脂质过氧化抑制率(%)为纵坐标,进行lgC抑制率%最小二乘法回归,获得回归方程。根据回归方程计算出各样品50%抑制率时所需的样品浓度。
2.6 统计学分析体外实验平行重复3次,全部数据表示为均值x±s。采用SPSS 10.0分析软件进行统计学处理。测定结果间均数比较采用one-way ANOVA分析。
3 结果 3.1 亚油酸反应体系下测定提取物抗脂质过氧化结果Fig 1的结果显示,亚油酸反应体系中,BHA表现出很强的抗脂质过氧化的能力,在低浓度(20 mg·L-1)条件下,其脂质过氧化抑制率达到42.12%;在高浓度(200 mg·L-1)下,其脂质过氧化抑制率可达到65.62%;在20~200 mg·L-1浓度范围内正丁醇与乙酸乙酯提取物对脂质过氧化的抑制能力随浓度的增加呈现增强的趋势,在高浓度(200 mg·L-1)下,正丁醇与乙酸乙酯对脂质过氧化的抑制率分别为35%、40%,与阳性对照维生素C的抑制率相当。

|
| Fig 1 Lipid peroxidation inhibitory activity of extracts from C.tinctoria in linoleic acid reaction system |
由Fig 2测定结果可知,在1%大鼠肝细胞匀浆反应体系中,在浓度为20~200 mg·L-1范围内,BHA表现出很强的抗脂质过氧化的能力,其脂质过氧化抑制率达到75.47%~88.11%;在10~200 mg·L-1浓度范围内,正丁醇提取物对脂质过氧化的抑制能力呈现一定的量效关系,随着其浓度的增大对脂质过氧化抑制能力越强,在高浓度(200 mg·L-1)下,其脂质过氧化抑制率可达到100%,并且其抑制活性明显高于阳性对照维生素C与BHA。

|
| Fig 2 Lipid peroxidation inhibitory activity of extracts from C. tinctoria in 1% rat liver homogenate reaction system |
根据测定结果进行统计,按“2.5”的方法计算各样品抑制脂质过氧化能力SC50值,由Tab 1结果可知,乙酸乙酯和正丁醇提取物在两个反应体系中均对脂质过氧化均具有一定的抑制能力。在亚油酸体系和1%大鼠肝细胞体系中,正丁醇提取物与乙酸乙酯提取物、维生素C和BHA的抗脂质过氧化能力(SC50)差异均有显著性(P<0.05)。
| Sample | EAE | BE | Ascorbic acid | BHA |
| Lipid peroxidation inhibitory activity in linoleic acid system SC50/mg·L-1 | 443.96±11.24# | 840.29±16.38*# | 583.39±12.62 | 50.22±2.13 |
| Lipid peroxidation inhibitory activity in liver homogenate system SC50/mg·L-1 | 23.59±3.67*# | 60.37±4.27*# | 46.57±5.46 | 6.98±2.12 |
| *P<0.05 vs ascorbic acid; #P<0.05 vs BHA | ||||
正常对照组小鼠精神状态良好,活动量较大,皮毛光滑,垫料干燥;模型组小鼠精神萎靡,活动量小,皮毛发黄,稀疏且无光泽,形体消瘦,垫料潮湿;给药各组小鼠随着给药周期的延长精神状态逐渐好转,皮毛较模型组有光泽,垫料较干燥。
3.4.2 各组小鼠不同时期体重变化经过4周对糖尿病小鼠的给药,两色金鸡菊提取物对小鼠的体重影响见Tab 2,连续灌胃给药4周后,两色金鸡菊正丁醇提取物低剂量和高剂量组体重与DM模型组体重之间差异有显著性;根据实验前与实验结束体重变化(%)结果比较,两色金鸡菊正丁醇提取物各剂量组均能明显改善DM小鼠体重下降的趋势。
| Group | Body weight/g | The ratio between before and after experiment/% | ||||
| Start value | 1 week | 2 weeks | 3 weeks | 4 weeks | ||
| Normal | 35.86±2.38* | 37.09±2.21* | 37.50±2.25 | 38.90±2.44 | 39.16±2.42* | 9.31±4.47* |
| STZ model | 32.60±4.46 | 34.88±4.81 | 35.09±4.01 | 36.22±4.66 | 31.49±5.35 | -3.65±7.71 |
| Metformin(120 mg·kg-1) | 34.23±3.22 | 35.92±3.61 | 36.79±3.88 | 37.48±4.29 | 36.13±4.83* | 5.75±10.82* |
| Low dosage(200 mg·kg-1) | 32.49±4.17 | 34.46±5.62 | 35.63±4.64 | 35.99±5.50 | 34.43±6.03* | 5.62±6.75* |
| Middle dosage(400 mg·kg-1) | 31.68±5.22 | 32.28±6.02 | 33.33±5.71 | 34.49±6.41 | 33.79±4.99 | 5.58±7.66* |
| High dosage(800 mg·kg-1) | 33.38±5.04 | 34.32±2.47 | 34.73±5.54 | 35.70±6.17 | 35.37±5.65* | 5.84±2.94* |
| *P<0.05 vs STZ model | ||||||
两色金鸡菊提取物对小鼠器官脏器系数的影响见Tab 3。经4周连续灌胃给药后,与STZ模型组相比,BE高剂量组小鼠肝脏指数、胰腺指数、肾脏指数明显降低,差异均有显著性(P<0.05),说明给药能减小或改善这3个组织增生、充血等症状。
| Group | Liver index/mg·g-1 | Kidney index/mg·g-1 | Pancreatic index/mg·g-1 |
| Normal | 44.6±4.65* | 12.2±0.56 | 5.1±1.0* |
| STZ Model | 71.5±11.5 | 13.5±3.3 | 5.6±1.4 |
| Metformin(120 mg·kg-1) | 67.1±10.3 | 11.8±1.1 | 5.5±0.8 |
| Low dosage(200 mg·kg-1) | 78.0±11.6* | 14.3±2.3 | 4.7±1.8* |
| Middle dosage(400 mg·kg-1) | 68.6±12.4 | 12.1±1.3 | 4.1±0.8* |
| High dosage(800 mg·kg-1) | 66.2±16.1* | 11.9±0.9* | 4.0±0.6* |
| *P<0.05 vs STZ model | |||
两色金鸡菊提取物对糖尿病小鼠体内生化指标的影响见Tab 4。由上表结果可知,经连续4周灌胃给药后,除AST和HDL外,药物高剂量组与STZ模型组相比差异均有显著性(P<0.05),数值明显降低,说明新疆两色金鸡菊正丁醇提取物能有效降低糖尿病小鼠的血糖、血脂水平,并且改善或恢复与肝脏功能相关的生化指标。
| Group | TP/ g·L-1 | ALB/ g·L-1 | ALT/ U·L-1 | AST/ U·L-1 | GGT/ U·L-1 | ALP/ U·L-1 | GLU/ mmol·L-1 | TC/ mmol·L-1 | TG/ mmol·L-1 | HDL/ mmol·L-1 |
| Normal | 44.92±3.99* | 27.87±1.40* | 32.50±1.05* | 143.67±5.05 | 17.00±1.41* | 152.67±2.42* | 4.37±1.02* | 2.93±0.64* | 1.03±0.19* | 1.20±0.11 |
| STZ Model | 62.49±1.47 | 36.58±3.36 | 59.45±4.06 | 146.82±2.64 | 53.36±2.69 | 185.6±1.79 | 16.47±1.42 | 5.59±0.29 | 1.93±0.15 | 0.97±0.09 |
|
Metformin (120 mg·kg-1) | 53.39±1.13* | 31.81±2.11 | 44.11±1.76* | 144.33±1.00 | 43.56±1.51* | 126.33±2.78* | 7.28±0.66* | 3.15±0.11* | 1.21±0.08* | 1.11±0.12 |
|
Low dosage (200 mg·kg-1) | 60.23±1.56 | 35.09±2.16 | 56.25±2.12 | 146.13±1.13 | 50.38±2.13 | 136.38±5.40* | 13.75±0.64 | 5.05±0.20 | 1.74±0.11 | 0.99±0.04 |
|
Middle dosage (400 mg·kg-1) | 57.64±1.86* | 34.18±1.60 | 52.00±2.50 | 145.22±0.97 | 47.00±1.50 | 121.56±4.85* | 12.60±0.89* | 4.79±0.20 | 1.60±0.17 | 1.03±0.05 |
|
High dosage (800 mg·kg-1) | 54.33±1.00* | 32.91±2.86* | 45.22±1.09* | 144.11±1.27 | 42.78±1.09* | 109.11±1.05* | 8.11±0.69* | 3.19±0.42* | 1.20±0.03* | 1.10±0.04 |
| *P<0.05 vs STZ model | ||||||||||
如Fig 3结果所示,通过光镜观察可以发现正常对照组肝细胞大小较均匀,结构规则,并且以肝中央静脉为中心向四周呈放射状整齐排列;模型组的小鼠肝细胞肿胀,且有大小不等的脂肪空泡,在中央静脉周围的细胞排列紊乱,结构不清晰;与模型组比较,各给药组小鼠的肝组织结构明显改善,脂肪空泡减少,且细胞排列的较规则,提取物高剂量组与阳性对照药盐酸二甲双胍显示出较好的修复和改善作用。
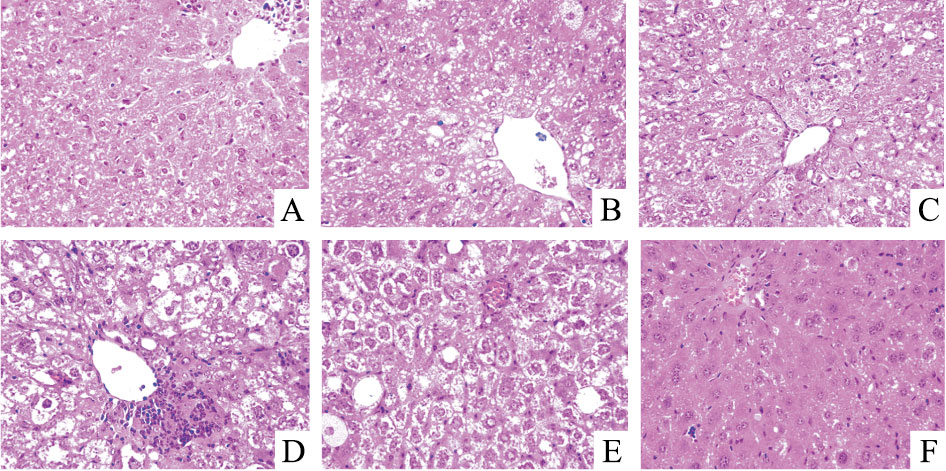
|
| Fig 3 The photograms of mice liver tissue by haematoxylin eosin(HE) staining(×400) A: Normal; B: STZ model; C: Metformin; D: Low dosage; E: Middle dosage; F: High dosage |
如Fig 4所示,正常对照组胰腺腺泡细胞均包膜完整,胞核清晰,胰岛团为圆形或卵圆形,边界清晰,每个胰岛团内细胞数量较多,胞质丰富;模型组胰腺腺泡细胞排列松散,胰岛细胞坏死明显;给药各组与模型组比较,胰腺腺泡细胞排列松散减轻,胰岛细胞坏死减轻,胰岛细胞有再生现象,尤其是提取物高剂量组与阳性对照盐酸二甲双胍组较为明显。
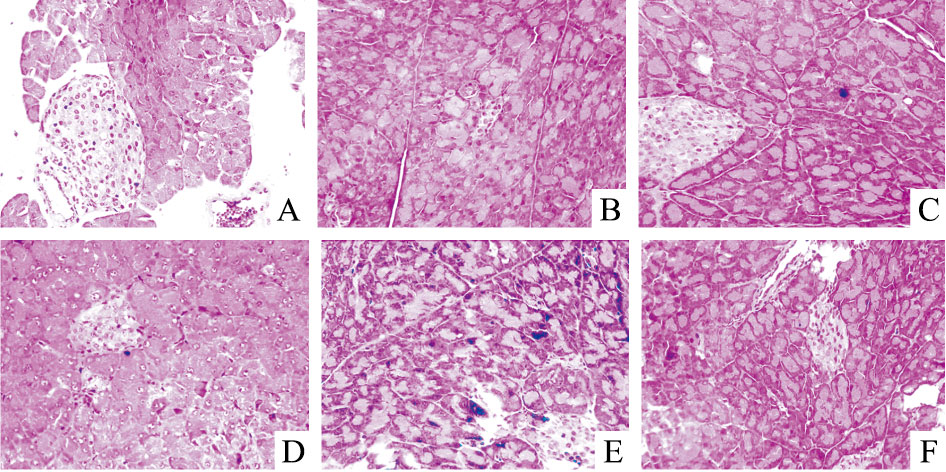
|
| Fig 4 The photograms of mice pancreatic tissue by HE staining(×400) A: Normal; B: STZ model; C: Metformin; D: Low dosage; E: Middle dosage; F: High dosage |
如Fig 5所示,正常对照组肾脏的肾小球饱满,与囊壁无空隙,结构整齐; 模型组小鼠肾小球萎缩囊腔增大,且结构紊乱,肾小球硬化的现象;与模型组比较,各给药组较上述病理改变均出现不同程度地减轻,肾小球仍有萎缩,与囊壁空隙比正常稍大,其中提取物高剂量组与阳性对照盐酸二甲双胍组改善最为明显。

|
| Fig 5 The photograms of mice kidney tissue by HE staining(×400) A: Normal; B: STZ model; C: Metformin; D: Low dosage; E: Middle dosage; F: High dosage |
在DM的发生和发展过程中,血液中高浓度的血糖和游离脂肪酸(FFA)不能被机体充分利用,两类物质极易发生生物氧化反应,产生大量的活性氧簇(reactive oxygen species,ROS),这些物质会导致细胞产生氧化应激反应[15]。氧化应激反应信号通路的激活会导致体内脂质代谢紊乱、胰岛β细胞凋亡、胰岛素分泌受损和胰岛素抵抗等一系列病理过程。因此,活性氧簇和氧化应激反应是引起DM产生和发展的作用机制之一[16]。因此,用体外实验方法考察两色金鸡菊提取物的抗脂质过氧化能力,对探讨通过抑制氧化应激反应途径对DM的作用有一定的指导意义。
本实验通过亚油酸反应体系和1%大鼠肝细胞反应体系来考察两色金鸡菊乙酸乙酯和正丁醇提取物对脂质过氧化的抑制能力,结果显示两种提取物均对脂质过氧化具有一定的抑制作用。有研究表明,两色金鸡菊乙酸乙酯提取物、正丁醇提取物、总黄酮提取物、水提物和两色金鸡菊中性黄酮等部位,在体外均对 α-葡萄糖苷酶活性有较好的抑制作用[17]。本实验通过考察正丁醇提取物对脂质过氧化的抑制能力,同时考察正丁醇提取物对2型糖尿病小鼠的保护作用。另外,在构建2型糖尿病小鼠时,可通过少量多次注射STZ方式损伤胰岛细胞,再以高糖高脂饲料诱导小鼠胰岛素抵抗,进而构建2型糖尿病实验模型。经过连续4周灌胃给药后,与STZ模型组相比,正丁醇提取物可增加糖尿病小鼠体重,减小主要脏器系数,并且对糖尿病小鼠血浆中多数生化指标有较好的改善作用。通过对主要脏器组织病理切片分析,正丁醇提取物对糖尿病小鼠肝脏、胰腺和肾脏的损伤有一定的改善与修复作用。本研究为两色金鸡菊的活性部位和有效活性成分的发现提供参考,同时也为新疆两色金鸡菊的传统用法或民间习用提供科学依据。
( 致谢: 本实验在石河子大学药学院药物分析研究室、石河子大学医学院病理教研室及石河子大学第一附属医院检验科完成,向在实验过程中给予指导和帮助的老师表示感谢! )
| [1] | Ashcroft F M, Rorsman P. Diabetes mellitus and the β cell: the last ten years[J]. Cell, 2012, 148 (6) : 1160-71 doi:10.1016/j.cell.2012.02.010. |
| [2] | Patel D K, Kumar R, Laloo D, et al. Natural medicines from plant source used for therapy of diabetes mellitus: an overview of its pharmacological aspects[J]. Asian Pac J Trop Dis, 2012, 2 (3) : 239-50 doi:10.1016/S2222-1808(12)60054-1. |
| [3] | Chan C H, Ngoh G C, Yusoff R. A brief review on anti-diabetic plants: global distribution, active ingredients, extraction techniques and acting mechanisms[J]. Pharmacogn Rev, 2012, 6 (11) : 22-8 doi:10.4103/0973-7847.95854. |
| [4] | Ameyaw Y, Barku V Y A, Ayivor J, et al. Phytochemical screening of some indigenous medicinal plant species used in the management of diabetes mellitus in Ghana[J]. J Med Plants Res, 2012, 6 (30) : 4573-81 . |
| [5] | 张曼, 王惠好, 臧林泉. 降血糖中药的有效成分与作用机制研究进展[J]. 广东药学院学报, 2011, 27 (3) : 320-3 . Zhang M, Wang H H, Zang L Q. Research progress on ingredients and mechanisms of hypoglycemic traditional Chinese medicines[J]. J Guangdong Pharm Univ, 2011, 27 (3) : 320-3 . |
| [6] | 新疆植物志编辑委员会. 新疆植物志(第5卷) [M]. 乌鲁木齐: 新疆科技卫生出版社, 1999, : 93 . Xinjiang flora editorial board of cas. Flora of Xinjiang(5th volume) [M]. Urumqi: Xinjiang Science and Technology Publishing House, 1999, : 93 . |
| [7] | 刘伟新, 邓继华, 徐鸿. 一种金鸡菊花的生药学研究[J]. 中国民族医药杂志, 2009, 15 (1) : 24-5 . Liu W X, Deng J H, Xu H. Pharmacognostical studies on the flower of one species Coreopsis sp[J]. J Med Pharm Chin Minor, 2009, 15 (1) : 24-5 . |
| [8] | 毛新民, 卢伟, 李琳琳, 等. 两色金鸡菊化学成分和药理作用研究进展[J]. 中国药物应用与监测, 2014, 11 (4) : 235-9 . Mao X M, Lu W, Li L L, et al. The progress of chemical constituents and pharmacological action of Coreopsis tinctoria Nutt[J]. Chin J Drug Appl Monit, 2014, 11 (4) : 235-9 . |
| [9] | 姜保平, 许利嘉, 贾晓光, 等. 两色金鸡菊的化学成分和药理作用研究进展[J]. 现代药物与临床, 2014, 29 (5) : 567-73 . Jiang B P, Xu L J, Jia X G, et al. Research progress on the chemical constituents and pharmacological activities of Coreopsis tinctoria[J]. Drugs Clinic, 2014, 29 (5) : 567-73 . |
| [10] | Dias T, Bronze M R, Houghton P J, et al. The flavonoid-rich fraction of Coreopsis tinctoria promotes glucose tolerance regain through pancreatic function recovery in streptozotocin-induced glucose-intolerant rats[J]. J Ethnopharmacol, 2010, 132 (2) : 483-90 doi:10.1016/j.jep.2010.08.048. |
| [11] | Kikuzaki H, Nakatani N. Antioxidant effects of some ginger constituents[J]. J Food Sci, 1993, 58 (6) : 1407-10 doi:10.1111/jfds.1993.58.issue-6. |
| [12] | Yen G C, Hsieh C L. Antioxidant activity of extracts from Du-zhong(Eucommia ulmoides) toward various lipid peroxidation models in vitro[J]. J Agric Food Chem, 1998, 46 (10) : 3952-7 doi:10.1021/jf9800458. |
| [13] | 褚现明, 王妮, 孙雪霞, 等. C-PC抑制ox-LDL诱导内皮细胞脂质过氧化损伤的机制研究[J]. 中国药理学通报, 2014, 30 (4) : 588-9 . Chu X M, Wang N, Sun X X, et al. Effect of C-PC on ox-LDL-induced lipid peroxide injury of endothelial cells[J]. Chin Phamacol Bull, 2014, 30 (4) : 588-9 . |
| [14] | 曾艳, 贾正平, 张汝学, 等. 地黄寡糖在2型糖尿病大鼠模型上的降血糖作用及机制[J]. 中国药理学通报, 2006, 22 (4) : 411-5 . Zeng Y, Jia Z P, Zhang R X, et al. Hypoglycemic effect of rehmannia glutinosa oligosaccharide in rats with type 2 diabetes[J]. Chin Phamacol Bull, 2006, 22 (4) : 411-5 . |
| [15] | 刘国安, 王莱, 杨庆明, 等. 几种抗氧化剂对脂质过氧化的抑制作用[J]. 西北师范大学学报:自然科学版, 2005, 41 (5) : 52-3 . Liu G A, Wang L, Yang Q M, et al. Inhibitions of lipid peroxidation by several antioxdants[J]. J Northwest Norm Univ (Nat Sci), 2005, 41 (5) : 52-3 . |
| [16] | Rahimi R, Nikfar S, Larijani B, et al. A review on the role of antioxidants in the management of diabetes and its complications[J]. Biomed Pharmacother, 2005, 59 (7) : 365-73 doi:10.1016/j.biopha.2005.07.002. |
| [17] | 张燕, 李琳琳, 木和布力·阿布力孜, 等. 新疆昆仑雪菊对5种α-葡萄糖苷酶活性的影响[J]. 中国实验方剂学杂志, 2011, 17 (7) : 166-9 . Zhang Y, Li L L, Mourboul Ablise, et al. Effect of extracts from Coriopsis ticntoria flowers of Xinjiang Kunlun mountain on α-glucosidase activity[J]. Chin J Exp Tradit Med Form, 2011, 17 (7) : 166-9 . |

