


2. 第四军医大学附属西京医院药剂科,陕西 西安 710032
2. Dept of Pharmacy, Xijing Hospital, the Fourth Military Medical University, Xi’an 710032, China
中药女贞子(fructus ligustri lucidi)为木樨科植物女贞(ligustrum lucidum Ait)的干燥成熟果实,具有补肾滋阴,养肝明目的功效。女贞子中含有的裂环环烯醚萜苷类化合物为一类重要活性成分。药理研究表明,环烯醚萜苷类成分具有保肝利胆、降血糖和血脂、解痉、抗炎、抗肿瘤、免疫调节等作用[1-2]。女贞子醇提物及其裂环环烯醚萜苷类成分能有效清除自由基,起到抗氧化保肝作用[3-5]。特女贞苷(specnuezhenide)是女贞子特征性活性成分,为女贞子裂环环烯醚萜苷类中含量较高的成分之一,现已作为2015版药典女贞子质量控制的含量测定指标[6]。本实验为了验证特女贞苷单体物质的保肝活性,采用CCl4诱导小鼠急性肝损伤模型,结合生化、ELISA指标和病理形态学观察,确证特女贞苷的保肝作用,并探讨其保肝作用的可能作用机制。
1 材料与方法 1.1 实验动物及材料昆明种♂小鼠,48只,体质量(18±22)g,购于第四军医大学实验动物中心,合格证号:SCXK(军)2012-007。小鼠常规喂养,自由饮水,实验开始前适应性饲养1周。
特女贞苷(99.52%,15120101)购于成都普菲德生物技术有限公司;CCl4(20141107)为国产分析纯,购于天津科贸化学试剂有限公司,临用时用花生油配成0.5% CCl4溶液;水飞蓟素(H20040299)购于天津天士力圣特制药有限公司;ALT(20150456)、AST(20150456)、MDA(20150428)、GSH-Px(20150429)、SOD(20150430)、TNF-α、IL-1β和IL-6 ELISA(ISC20150EIA)试剂盒均购自南京建成生物工程研究所。
1.2 仪器电子天平(北京赛多利斯天平有限公司BS110S),全波长酶标仪(美国THERMO,MULTISKAN GO),高速离心机(德国艾本德,5804R)、超声波清洗器(熊猫集团南京电子计量有限公司),超低温冰箱(上海Thermo公司,700Series,VP-SOOH),电热恒温水浴锅(天津市泰斯特仪器有限公司,DK-98-1),倒置显微镜(日本奥林帕斯,IX71+DP72)。
2 方法 2.1 动物分组及给药昆明种♂小鼠48只,随机分为6组:空白对照组,模型组,水飞蓟素(阳性药)组,特女贞苷低、中、高剂量组,每组8只。采用灌胃法给药,每次给药前试药用双蒸水配成所需浓度的溶液。水飞蓟素组给予水飞蓟素100 mg·kg-1;特女贞苷低、中、高剂量组分别给予特女贞苷50、100、200 mg·kg-1;空白对照组和模型组给予双蒸水,每日1次,连续7 d。末次给药后1 h,模型组、水飞蓟素组及特女贞苷各剂量组一次性腹腔注射0.5% CCl4花生油溶液10 mL·kg-1,制作急性肝损伤模型,正常组腹腔注射等量花生油。造模后24 h,小鼠摘眼球法取血,分离血清,-80℃冰箱保存备检ALT、AST、TNF-α、IL-1β、IL-6。取血后脱颈处死小鼠,剖腹,在肝脏右叶同一部位取一小块肝脏组织,用10%的福尔马林溶液固定,石蜡包埋,HE染色做病理检查;另取一小块肝脏组织,制成10%的肝匀浆,-80℃冰箱保存备测MDA、SOD和GSH-Px。
2.2 生化指标检测按照试剂盒相应的说明书操作步骤测定小鼠血清ALT、AST水平;酶联免疫吸附法(ELISA试剂盒)法测定小鼠血清TNF-α、IL-1β、IL-6水平;硫代巴比妥酸法测定肝组织匀浆中MDA含量,考马斯亮蓝蛋白法测定肝组织匀浆中蛋白质含量,黄嘌呤氧化酶法测定SOD活力,二硫代二硝基苯甲酸直接法测定肝组织匀浆中GSH-Px的活力。
2.3 统计学分析采用SPSS 16.0软件对所得数据进行单因素方差统计学分析,所有数据均以x±s表示。
3 结果 3.1 对小鼠血清中ALT、AST的影响各组小鼠ALT、AST水平见Tab 1。由Tab 1可以看出,与空白对照组相比,模型组血清ALT、AST水平明显升高(P<0.01),说明实验造模成功。与模型组相比,特女贞苷各剂量组血清ALT、AST水平均明显降低(P<0.01),且呈剂量依赖性,高剂量特女贞苷与水飞蓟素的药效相当,表明特女贞苷可以减轻CCl4所致小鼠急性肝损伤。
| Group | Dose/ mg·kg-1 | ALT/ U·L-1 | AST/ U·L-1 |
| Control | NS | 25.15±5.00 | 54.51±5.03 |
| Model | NS | 191.77±11.79** | 208.80±6.24** |
| Silymarin | 100 | 70.02±8.19△△ | 80.34±5.56△△ |
| Specnuezhenide(low) | 50 | 179.91±2.95 | 139.39±8.13△△ |
| Specnuezhenide(middle) | 100 | 113.16±7.48△△ | 101.20±6.82△△ |
| Specnuezhenide(high) | 200 | 67.09±7.78△△ | 80.64±4.40△△ |
| **P<0.01 vs control;△P<0.05,△△P<0.01 vs model | |||
各组小鼠MDA、SOD和GSH-Px活力见Tab 2。由Tab 2可以看出,模型组与空白对照组相比,肝脏MDA含量明显增高,SOD和GSH-Px水平明显降低(P<0.01),说明实验造模成功。 与模型组相比,特女贞苷各剂量组肝组织MDA含量明显降低(P<0.05,P<0.01),SOD和GSH-Px活力明显增高(P<0.05,P<0.01),且呈剂量依赖性,高剂量组与水飞蓟素组各个指标水平相当,结果表明特女贞苷可能具有一定的抗氧化作用。
| Group | Dose/mg·kg-1 | MDA/μmol·g-1 Pro | SOD/kU·g-1 Pro | GSH-Px/kU·g-1 Pro |
| Control | NS | 0.50±0.05 | 21.79±3.80 | 107.4±6.4 |
| Model | NS | 0.96±0.15** | 13.10±1.39** | 53.4±7.8** |
| Silymarin | 100 | 0.52±0.11△△ | 17.71±3.45△ | 103.3±4.0△△ |
| Specnuezhenide(low) | 50 | 0.78±0.05△ | 12.01±0.42 | 70.0±5.0△△ |
| Specnuezhenide(middle) | 100 | 0.69±0.03△△ | 15.84±1.93△ | 85.7±6.7△△ |
| Specnuezhenide(high) | 200 | 0.58±0.03△△ | 19.52±1.25△△ | 100.1±9.4△△ |
| **P<0.01 vs control;△P<0.05,△△P<0.01 vs model | ||||
各组小鼠TNF-α、IL-1β和IL-6水平见Tab 3。由Tab 3可以看出,与空白对照组相比,模型组TNF-α、IL-1β和IL-6水平均明显升高(P<0.01),说明实验造模成功。与模型组相比,特女贞苷各剂量组血清中TNF-α、IL-1β和IL-6含量明显降低(P<0.01),且呈剂量依赖性,结果表明特女贞苷可能具有一定的抗炎作用,其作用机制可能通过抑制肝脏内的炎症反应来起保肝作用。
| Group | Dose/mg·kg-1 | TNF-α/ng·L-1 | IL-1β/ng·L-1 | IL-6/ng·L-1 |
| Control | NS | 182.83±9.91 | 35.87±3.39 | 45.18±4.67 |
| Model | NS | 625.21±10.51** | 116.19±3.58** | 154.88±4.25** |
| Silymarin | 100 | 242.84±18.30△△ | 51.94±1.77△△ | 74.99±5.46△△ |
| Specnuezhenide(low) | 50 | 557.02±17.18△△ | 103.89±3.36△△ | 130.75±4.18△△ |
| Specnuezhenide(middle) | 100 | 477.59±13.33△△ | 78.50±2.36△△ | 104.98±4.64△△ |
| Specnuezhenide(high) | 200 | 338.99±15.35△△ | 64.34±3.34△△ | 87.19±4.17△△ |
| **P<0.01 vs control;△△P<0.01 vs model | ||||
Fig 1 HE染色显示,空白对照组小鼠肝细胞正常排列,细胞质均匀,具有明显的细胞核及核仁,中央静脉清晰可见。模型组肝细胞结构严重破坏,部分细胞坏死,细胞核固缩,颗粒变性,中央静脉周围有大量炎性细胞浸润。水飞蓟素组及特女贞苷高剂量组肝细胞结构较为完整,少量炎性细胞,病理损伤情况较模型组明显改善。与模型组相比,特女贞苷低及中剂量组在一定程度上减少了炎性细胞的浸润、减轻肝细胞损伤程度,但效果不如水飞蓟素组和特女贞苷高剂量组明显。
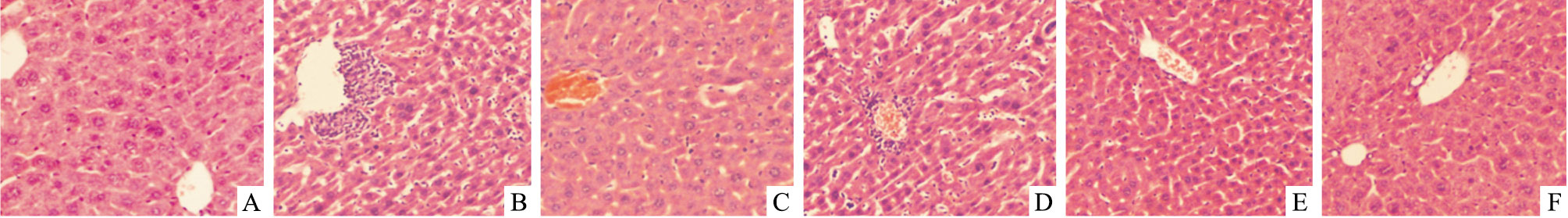
|
| Fig 1 Effects of specnuezhenide on liver histopathology change in mice with hepatic damage(×400) A:Control; B:Model; C:Silymarin; D:Specnuezhenide(low); E:Specnuezhenide(middle); F:Specnuezhenide(high) |
CCl4是经典的化学性肝毒剂,腹腔注射诱导小鼠肝损伤模型重现性好,既可以造成肝细胞实质性损伤(细胞变性和坏死),又可以引起肝功能异常,能够准确反映肝细胞的形态学变化。CCl4诱导肝损伤作用机制十分复杂,主要与脂质过氧化物有关,脂质过氧化物使细胞膜流动性降低,通透性增高,线粒体膜受损,细胞产能障碍,活性氧生成增多,造成细胞损伤[7]。肝细胞膜通透性增高,转氨酶透过损伤细胞膜溢出,血清ALT和AST水平会有大幅度的升高[8]。所以血清中ALT、AST水平的高低在一定程度上反映了肝细胞受损的程度。因此选用ALT、AST指标来反映肝损伤情况。本研究中,模型组小鼠血清的ALT和AST水平较空白对照组明显升高,水飞蓟素组、特女贞苷各给药组均能不同程度降低ALT、AST水平,后者对抗肝损伤作用呈剂量依赖性,表明特女贞苷有较好的保肝降酶作用。
脂质过氧化反应是肝损伤发生的重要机制,SOD是体内清除自由基、抑制自由基反应的主要抗氧化酶,体内SOD活性越高,自由基清除的速度越快。肝细胞受到自由基攻击时,SOD可因其过度消耗而减少,其活性降低则会导致体内氧自由基的积累,引发质膜的过氧化作用,使膜结构与功能受损,最终导致肝细胞的死亡[9]。GSH-Px是一种重要的催化过氧化氢分解的酶,能特异性地清除机体活性氧,减轻和阻止活性氧的过氧化作用,是机体重要的抗氧化剂[10]。脂质过氧化的主要降解产物MDA可严重损伤肝细胞膜结构,导致肝细胞肿胀、坏死,MDA的含量可反映脂质过氧化的程度[11]。本研究中,CCl4损伤组小鼠肝组织中MDA含量明显升高、SOD及GSH-Px活性明显降低,说明肝细胞清除自由基的能力降低,而水飞蓟素组、特女贞苷各给药组小鼠肝组织中MDA含量明显降低、SOD活力及GSH-Px活性明显提高,提示特女贞苷具有一定的抗氧化作用,能有效提高细胞清除自由基的能力,减轻肝细胞在自由基攻击下的损伤程度,其保肝作用可能与这种抗氧化作用有关。
急性肝损伤时肝脏不能有效清除内毒素,TNF-α、IL-1β和IL-6等是由肝Kupffer细胞表达和释放的炎性细胞因子,这些炎性因子参与肝病免疫病理反应,从而加重肝脏损伤程度[12]。本研究中,模型组小鼠血清中TNF-α、IL-1β和IL-6水平明显升高,而特女贞苷可以明显降低TNF-α、IL-1β和IL-6水平,提示特女贞苷可能通过抑制TNF-α、IL-1β和IL-6等炎性因子的释放保护肝脏。
综上所述,特女贞苷对CCl4诱导小鼠急性肝损伤具有明显的保护作用,在本实验设定的剂量范围内,随剂量增加对肝损伤的保护作用增强。肝组织病理学检查结果也表明随剂量增加肝脏损伤程度明显减轻,特女贞苷200 mg·kg-1组的治疗效果几乎与水飞蓟素组相当。研究结果表明其保肝作用机制可能与提高抗氧化酶的活性,清除自由基,减轻细胞在自由基攻击下的损伤程度,降低炎症因子的释放有关。
( 致谢: 本实验在第四军医大学附属西京医院药剂科新药研发实验室完成,全体作者均参与实验,感谢第四军医大学附属西京医院药剂科提供的科研平台,感谢实验室主要参与人员陆杨师兄,房敏峰教授的帮助,感谢导师文爱东教授、王婧雯老师对该实验及论文撰写的悉心指导。 )
| [1] | 郑礼胜, 刘向前. 环烯醚萜类研究进展[J]. 天然产物研究与开发, 2009, 21 (4) : 702-11 . Zheng L S, Liu X Q. Advances in the research of Iridoids[J]. Natl Prod Res Deve, 2009, 21 (4) : 702-11 . |
| [2] | 薛存宽, 何学斌, 张书勤, 等. 缬草环烯醚萜抗肿瘤作用的实验研究[J]. 现代中西医结合杂志, 2005, 14 (15) : 1969-72 . Xue C K, He X B, Zhang S Q, et al. Experimental study of anti -tumor effect of valerian iridoids[J]. Mod J Integr Tradi Chin West Med, 2005, 14 (15) : 1969-72 . |
| [3] | 陆杨, 胡冬梅, 文爱东, 等. 女贞总苷对急性肝损伤小鼠的保护作用[J]. 中国药理学通报, 2016, 32 (4) : 588-9 . Lu Y, Hu D M, Wen A D, et al. The protective effect of privet total glycosides on acute liver injury mice[J]. Chin Pharmacol Bull, 2016, 32 (4) : 588-9 . |
| [4] | 李阳, 左燕, 孙文基. 女贞子中2种主要裂环环醚萜苷成分的分离鉴定及其抗氧化活性研究[J]. 中药材, 2007, 30 (5) : 543-6 . Li Y, Zuo Y, Sun W J. Study on antioxidant activity of two major Secoiridoid G lucosides in the Fruits of Ligustrum lucidum Ait[J]. J Chin Medl Mat, 2007, 30 (5) : 543-6 . |
| [5] | Lin H M, Yen F L, Ng L T, et al. Protective effects of Ligustrum lucidum fruit extract on acute butylated hydroxytoluene-induced oxidative stress in rats[J]. J Ethnopharmacol, 2007, 111 (1) : 129-36 doi:10.1016/j.jep.2006.11.004. |
| [6] | 中国药典. 一部[S]. 北京:中国医药科技出版社,2015:46. Chinese Pharmacopoeia Commission. Part I[S]. Beijng:China Medical Science Press. 2015:46. |
| [7] | Liu S, Lv X H, Sun Z X, et al. Hepatoprotective and antioxidant effects of baicalin against CCl4-induced hepatotoxicity[J]. J Chin Pharm Sci,, 2015, 24 (8) : 538-44 . |
| [8] | 丁传波, 赵婷, 李永娟, 等. 山荆子叶提取物对四氯化碳致小鼠急性肝损伤的保护作用[J]. 中国药理学通报, 2013, 29 (11) : 1627-8 . Ding C B, Zhao T, Li Y J, et al. Protective effect of ethanol extract of Malus baccata leaves on carbon tetrachloride-induced acute liver injury in mice[J]. Chin Pharmacol Bull, 2013, 29 (11) : 1627-8 . |
| [9] | 孙晓晶, 王允, 王毅刚, 等. 苏肝清对四氯化碳致小鼠急性肝损伤的保护作用[J]. 中药材, 2010, 33 (1) : 105-8 . Sun X J, Wang Y, Wang Y G, et al. Protective effects of Su Gan Qing against carbon tetrachloride-induced acute liver injury in mice[J]. J Chin Med Mat, 2010, 33 (1) : 105-8 . |
| [10] | 蔡晓波, 陆伦根. 谷胱甘肽过氧化物酶与肝脏疾病[J]. 世界华人消化杂志, 2009, 17 (32) : 3279-82 . Cai X B, Lu L G. Glutathione perox-idase and liver disease[J]. World Chin J Dig, 2009, 17 (32) : 3279-82 . |
| [11] | 冯芹, 夏文凯, 王现珍, 等. 连翘苷元对四氯化碳大鼠急性肝损伤的保护作用[J]. 中国药理学通报, 2015, 31 (3) : 426-30 . Feng Q, Xia W K, Wang X Z, et al. Effect of phillygenin on acute liver injury induced by CCl4 in rats[J]. Chin Pharmacol Bull, 2015, 31 (3) : 426-30 . |
| [12] | Jaattela M. Biologic activities and mechanisms of action of tumor necrosis factoralpha/cachectin[J]. Lab Invest, 1991, 64 (6) : 724-42 . |

