


神经生长因子(nerve growth factor,NGF)是神经营养因子家族中重要一员,其在感觉神经和交感神经的生长发育中发挥着至关重要的作用[1]。大鼠肾上腺嗜铬瘤细胞(pheochromocytoma cell,PC12)是大鼠肾上腺嗜铬瘤细胞株,由于其可在NGF诱导下向交感神经元样细胞分化,目前广泛用于神经细胞功能等的研究。研究证实,NGF与细胞膜上受体酪氨酸激酶A(tyrosinekinase A,TrkA)结合,调节交感神经等的再生和分布[2]。同时,研究证实,细胞外信号调节激酶1/2 (extracellular signal-regulated kinase,ERK1/2)参与了NGF诱导的PC12细胞分化。
RNA干扰(RNA interference,RNAi)技术是一种由内源性或外源性的双链RNA介导的转录后基因沉默技术,目前广泛应用于基因治疗与研究[3]。短发卡RNA(short-hairpin RNA,shRNA)作为一种重要的小干扰RNA(small interfering RNA,siRNA),在使用慢病毒作为载体介导shRNA转染时,对分裂期和非分裂期细胞均有很高的转染效率[4]。本研究利用慢病毒介导shRNA 沉默NGF基因后,观察其对PC12细胞活力和细胞转化的影响,并探究ERK1/2在这一过程中发挥的作用。
1 材料与方法 1.1 材料 1.1.1 细胞株PC12来源于大鼠肾上腺嗜铬瘤细胞(购自中科院上海细胞库)。
1.1.2 药物与试剂慢病毒NGF-GFP(滴度:5×108 TU·mL-1,分别为NGF shRNA1、NGF shRNA2、NGF shRNA3)、空病毒CON-GFP(滴度:1×109 TU·mL-1)及促转染试剂polybrene(5 mg·L-1),由上海吉凯基因科技有限公司构建合成、提供(合同号:GIEL65719)。DMEM/HG细胞培养液购自美国Hy-clone公司;胎牛血清、0.25%胰酶消化液(含0.02% EDTA)购自加拿大Wisent公司;TRIzol购自美国Invitrogen公司;细胞增殖检验试剂盒(cell counting kit-8,CCK-8)购自日本同仁化学研究所;PVDF膜购自美国Bio-Rad公司;鼠抗β-actin单克隆抗体购自美国Santa Cruz生物技术公司,兔抗NGF多克隆抗体购自于英国Abcam公司,兔抗ERK1/2单克隆抗体和兔抗p-ERK1/2单克隆抗体均来自于美国Cell Signaling公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗兔、羊抗鼠抗体购自北京中杉生物技术公司;PrimeScriptTM RT reagent kit、SYBRPremix Ex TaqTM均购自于日本TaKaRa公司;内参β-actin引物购自于上海生工公司,NGF引物购自广州复能基因公司。
1.1.3 仪器细胞培养箱(美国Thermo公司);CXY-6C型电泳仪(北京六一仪器厂);Tanon Fine Do X6全自动化学发光图像分析系统(上海天能科技有公司);荧光定量PCR仪(美国ABI公司);荧光显微镜(日本OLYMPUS公司)。
1.2 方法 1.2.1 细胞培养PC12细胞株置于37 ℃、5% CO2培养箱(95%空气)中,含10%胎牛血清的DMEM /HG完全培养液培养。细胞贴壁80%~90%时,用0.25%胰酶消化约1 min,计数,以1 ∶3的比例传代,每2~3 d传代1次。取对数生长期的细胞用于后续实验。
1.2.2 实验分组及慢病毒感染PC12细胞以每孔105个接种于6孔培养板。细胞随机分为5组:正常对照组(NC)、空病毒感染组(LV CON)、慢病毒NGF shRNA1感染组(LV shNGF1)、慢病毒NGF shRNA2感染组(LV shNGF2)、慢病毒NGF shRNA3感染组(LV shNGF3)。种板12 h后,除NC组以含10%胎牛血清的DMEM/HG培养基、polybrene(终浓度为2.5 mg·L-1)处理外,其余各组均以含10%胎牛血清的DMEM/HG培养基、polybrene(终浓度为2.5 mg·L-1)及相应感染复数(multiplicity of infection,MOI)为20的慢病毒进行感染,24 h后换用含10%胎牛血清的DMEM/HG完全培养基正常培养。每组3个复孔。
1.2.3 荧光显微镜检测感染效率按照上述方法进行分组和慢病毒感染细胞72 h后,荧光显微镜下观察表达绿色荧光蛋白(green fluorescence protein,GFP)的细胞数目,根据GFP表达情况判断感染效率。感染效率(荧光率)大于90%,说明已筛选出稳定表达的细胞系。
1.2.4 荧光定量RT-PCR检测NGF mRNA表达水平慢病毒感染96 h后,弃培养液,4 ℃预冷PBS清洗细胞,按照RNA提取试剂TRIzol的说明书进行操作,每孔加800 μL TRIzol置于冰上裂解10 min,提取细胞总RNA。经氯仿萃取,异丙醇法沉淀,75%无酶乙醇洗涤法浓缩,DEPC水溶解后,用紫外分光光度计检测总RNA的浓度和纯度,制成RNA样品。按照PrimeScriptTM RT reagent kit试剂盒说明书进行逆转录,用于检测NGF和内参β-actin mRNA (NGF引物序列保密)。β-actin引物:上游引物5’-CCCATCTATGAGGGTTACGC-3’,下游引物5’-TTTAATGTCACGCACGATTTC-3’。逆转录反应条件为:37 ℃ 15 min,85 ℃ 5 s。采用SYBRPremix Ex TaqTM试剂盒进行PCR扩增反应,PCR扩增程序设定为:95 ℃预变性30 s,95 ℃ 3 s,60 ℃ 30 s,重复40个循环进行扩增;反应结束后建立熔解曲线。采用StepOne Software v 2.3软件进行数据分析。同一实验重复3次,实验数据分析采用2-△△CT法计算。
1.2.5 Western blot法检测蛋白表达水平细胞感染72 h后,1 ∶3传代,接种于6孔培养板,继续培养48 h后,弃培养液。4 ℃预冷PBS清洗细胞,培养板内加入蛋白裂解液充分裂解细胞,冰上静置30 min后,15 000 r·min-1 4 ℃离心10 min后,吸取上清,BCA法测定样品蛋白含量后分装保存。每组取20 μg蛋白行聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后将蛋白转移至PVDF膜。将PVDF膜在封闭液(含5%脱脂牛奶的TBST溶液)中室温孵育2 h,随后置于兔抗NGF多克隆抗体、兔抗ERK1/2单克隆抗体、兔抗p-ERK1/2单克隆抗体或鼠抗β-actin单克隆抗体中,4 ℃摇床孵育过夜,TBST洗膜3次,每次5 min;再将膜置入HRP标记的二抗中室温孵育1 h,TBST洗膜3次,每次5 min;采用ECL发光试剂盒,在Tanon全自动凝胶成像系统中自动曝光采集图像,并进行条带光密度分析。
1.2.6 CCK-8法检测细胞活性取对数生长期PC12细胞,以每孔104个接种于96孔培养板,置于37 ℃、5% CO2培养箱中。按上述方法进行分组及慢病毒感染,分别于转染后24、48、72 h检测吸光度。每孔加入10 μL CCK-8溶液(加入的体积为原来培养体积的10% ),细胞培养箱内继续孵育4 h后,置于酶标仪上450 nm测定各组吸光度。在不含细胞的培养液中加入等量CCK-8溶液,按相同方法测定吸光度作为空白对照孔。细胞活力=测定孔的吸光度-空白对照孔吸光度,并计算平均值。实验独立重复3次。
1.2.7 细胞分化程度测定慢病毒感染72 h后,显微镜下观察NC组、LV CON组和LV shNGF3组细胞形态并摄片。采用Image J2图像分析软件测量每组细胞突起长度和最大细胞直径。同一细胞至少重复统计3次。
1.2.8 统计学分析采用SPSS 10.0统计软件进行分析,细胞突起长度和细胞直径采用Image J2软件测量,计量资料以x±s表示,组间比较采用单因素方差分析(ANOVA),两两比较采用turkey检验。
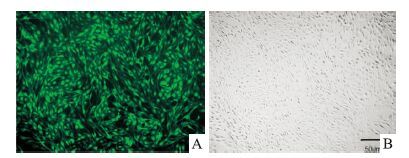
2 结果 2.1 荧光显微镜检测细胞感染效率细胞感染72 h后,荧光显微镜下观察可见大量绿色荧光颗粒,细胞表达GFP蛋白,见Fig 1A。与同一视野下明场相比,表达GFP细胞超过90%,见Fig 1 B,说明已建立稳定表达的细胞系。
|
| Fig 1 Lentivirus transfection efficiency in PC12 cells A:GFP expression of lentivirus infected PC12 cells under fluorescent microscope;B:Cells under bright field of optical microscope |
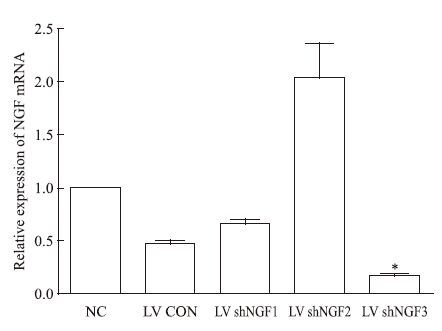
荧光定量RT-PCR检测结果显示,LV shNGF3组NGF mRNA表达明显降低,是NC组的(13±4)%(P<0.05),差异有统计学意义,见Fig 2。
|
| Fig 2 LV shNGF3 restrained NGF mRNA expression in PC12 cells(x±s,n=3) *P<0.05 vs NC group |
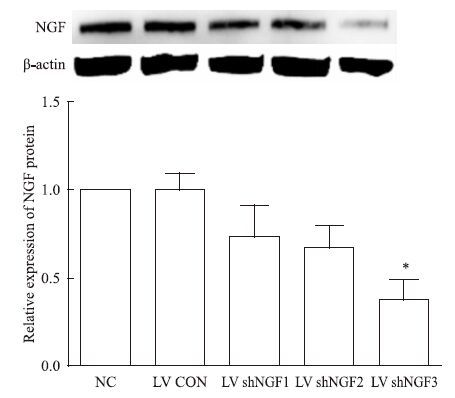
Western blot结果显示,LV shNGF3 NGF蛋白表达水平明显降低,是NC组的(38±19)%(P<0.05),差异有统计学意义,见Fig 3。说明慢病毒LV shNGF3可有效抑制NGF蛋白的表达。
|
|
Fig 3 LV shNGF3 decreased NGF protein expression in PC12 cells(x±s,n |
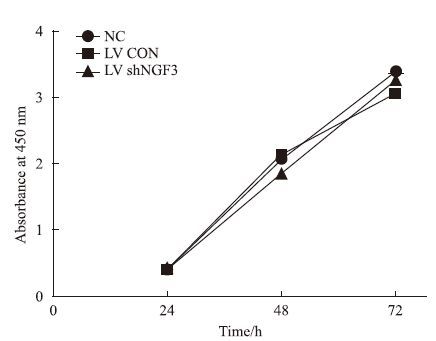
与NC组相比,LV shNGF3组细胞活性差异无统计学意义,见Fig 4。说明慢病毒感染介导NGF基因沉默未影响PC12细胞活性。
|
| Fig 4 Lentivirus mediated NGF shRNA transfection did not impact cell viability(x±s,n=3) |
NGF表达抑制后,PC12细胞形态发生明显变化,见Fig 5A。NC组和LV CON组PC12细胞胞体呈圆形、长梭形,两极有长突起,细胞折光性较强,细胞间形成网络状结构。LV shNGF3组NGF表达抑制后,PC12细胞胞体呈三角形、多角形,细胞除两极有轴突样突起外,有的细胞质伸出其他突起,突起长度明显缩短,细胞折光性降低。与NC组相比,LV CON组细胞突起长度和最大细胞直径无差异,而LV shNGF3组细胞突起长度和最大细胞直径均明显缩短(P<0.01),差异有统计学意义,见Fig 5B。说明慢病毒转染对PC12细胞分化未产生明显影响,而NGF表达降低明显抑制了PC12细胞的分化。
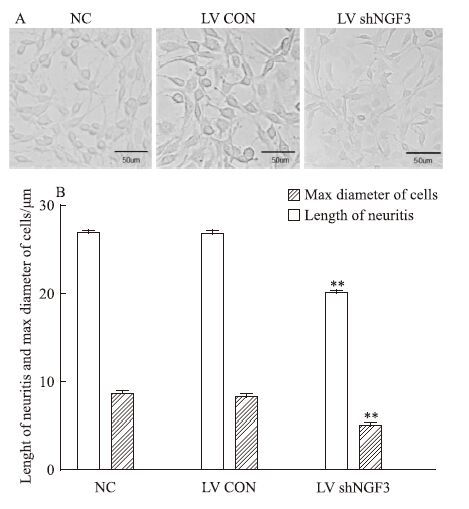
|
| Fig 5 LV shNGF3 inhibited differentiation of PC12 cells(x±s,n=3) A:The morphology of PC12 cells;B:The length of neuritis and max diameter of cells were strained in LV shNGF3 group than that in NC group.**P<0.01 vs NC group |
ERK蛋白以及p-ERK1/2是丝裂素活化蛋白激酶(mitogen-activted protein kinase,MAPK)信号通路的重要蛋白。Western blot结果显示,NC组、LV CON组和LV shNGF3组ERK1/2蛋白表达无差异。而与NC相比,LV shNGF3组p-ERK1/2蛋白表达下降了85.2%(P<0.01),差异有统计学意义,见Fig 6。说明NGF表达抑制后,通过抑制p-ERK1/2表达影响PC12细胞分化。
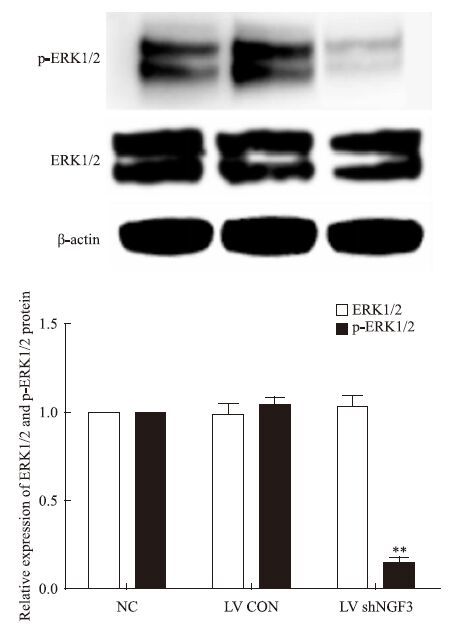
|
| Fig 6 Lentivirus mediated NGF gene silencing decreased expression of p-ERK1/2 rather than ERK1/2(x±s,n=3) A: Western blot analysis of ERK1/2,p-ERK1/2 and β-actin protein;B: The relative protein expression of ERK1/2 and p-ERK1/2 bands were normalized to β-actin.**P<0.01 vs NC group |
慢病毒是一种以人类免疫缺陷病毒-1(human immunodeficiency virus-1,HIV-1)为基础构建的新型载体系统,因其对分裂期和非分裂期细胞均有很高的转染效率,广泛应用于基因转染和基因治疗等[5]。shRNA在利用慢病毒为载体时,shRNA可整合到细胞基因组中。shRNA在细胞内通过一系列酶的作用后,通过碱基互补配对,以序列特异性的方式结合到靶mRNA,从而抑制靶基因的表达[6]。故shRNA在体内抑制靶基因的表达具有很高的特异性[7]。polybrene是一种阳离子聚合物,可以促进慢病毒包膜与细胞膜的相互作用,协助慢病毒对细胞膜的感染过程。本实验参照预实验结果,在polybrene协助下以MOI=20进行感染。结果证实,此感染复数下可以建立稳定表达的细胞系,并且NGF LV shRNA3可以有效抑制NGF mRNA和蛋白的表达(P<0.05)。实验过程中,LV shNGF2组NGF蛋白相比于NC组降低,差异无统计学意义,但LV shNGF2组NGF mRNA表达却明显升高。可能由于NGF LV shRNA2未能与其特异靶序列相结合,并通过影响内源性微小RNA(micro RNA,miRNA),产生脱靶效应,从而影响细胞NGF mRNA和蛋白的表达[8]。
NGF是神经营养因子家族中重要一员,通过作用于高亲和力受体TrkA和低亲和力受体(p75 neurotrophin receptor,P75NTR)调控中枢及周围神经的生长、发育和再生等[2]。最近研究表明,NGF除了具有神经营养作用以外,还可增加初级传入神经元对伤害性刺激的敏感性,在神经元伤害感受信号传导过程中发挥重要作用[9]。NGF通过与TrkA结合,导致自身酪氨酸残基磷酸化,逆转运至胞质,产生多种信号分子,并将信号传递至细胞核,调控细胞的基因表达、代谢等,从而影响细胞分化[10]。近年来研究证实,NGF可以促进PC12细胞向神经元分化,并呈浓度相关性[11]。细胞最长突起长度和最大细胞直径可以作为评价PC12细胞分化程度的指标。本研究通过慢病毒介导的NGF表达沉默后,PC12细胞突起长度和最大细胞直径突起长度均明显缩短,细胞分化程度降低,差异具有统计学意义(P<0.01)。证实NGF表达降低抑制了PC12细胞向神经元分化。
MAPK信号通路在细胞增殖、分化、再生等方面发挥着至关重要的作用[12]。ERK1/2是MAPK信号通路中重要的蛋白,磷酸化后的ERK1/2通过Ras-Raf-MEK-ERK级联通路将信号从胞质转运至胞核,参与调控细胞的增殖和分化等多种生理功能[13]。近来研究表明[14],ERK1/2蛋白在NGF诱导的PC12细胞分化早期活化增加。推测ERK1/2早期活化可能为NGF诱导的PC12分化提供了起始信号。其后,活化的ERK1/2被降解,避免了长时间过度刺激对细胞的不良影响。本研究通过慢病毒介导NGF shRNA转染入PC12细胞,特异性并长期稳定地抑制PC12细胞NGF表达,从而导致了ERK1/2蛋白活化被长期抑制。
综上所述,本实验证实,慢病毒介导的NGF基因沉默通过抑制ERK1/2活化,影响PC12细胞分化,为进一步研究体内NGF基因沉默对神经元功能和伤害感受信号传导的影响,提供了实验基础和理论依据。
( 致谢: 感谢安徽医科大学第二附属医院中心实验室为本课题研究提供仪器设备和技术支持。 )
| [1] | Zheng L R, Zhang Y Y, Han J, et al. Nerve growth factor rescues diabetic mice heart after ischemia/reperfusion injury via up-regulation of the TRPV1 receptor[J]. J Diabetes Complications, 2015, 29 (3) : 323-8 doi:10.1016/j.jdiacomp.2015.01.006. |
| [2] | Marlin M C, Li G. Biogenesis and function of the NGF/TrkA signaling endosome[J]. Int Rev Cell Mol Biol, 2015, 314 (6) : 239-57 . |
| [3] | Guzman-Aranguez A, Loma P, Pintor J. Small-interfering RNAs (siRNAs) as a promising tool for ocular therapy[J]. Br J Pharmacol, 2013, 170 (4) : 730-47 doi:10.1111/bph.12330. |
| [4] | Hu Q, Chen C, Khatibi N H, et al. Lentivirus-mediated transfer of MMP-9 shRNA provides neuroprotection following focal ischemic brain injury in rats[J]. Brain Res, 2011, 1367 (3) : 347-59 . |
| [5] | 严建平, 李亚清, 钟晖, 等. 慢病毒介导的解整合素-金属蛋白酶17 RNA干扰对气道上皮细胞MMP-9表达及NF-κB活性的影响[J]. 中国药理学通报, 2014, 30 (4) : 559-65 . Yan J P, Li Y Q, Zhong H, et al. Lentivirus-mediated shRNA interference targeting ADAM17 down-regulates MMP-9 expression in airway epithelial cells via TNF-α/NF-κB signaling[J]. Chin Pharmacol Bull, 2014, 30 (4) : 559-65 . |
| [6] | Singer O, Verma I M. Applications of lentiviral vectors for shRNA delivery and transgenesis[J]. Curr Gene Ther, 2008, 8 (6) : 483-8 doi:10.2174/156652308786848067. |
| [7] | Yu S Q, Wang D H. Enhanced salt sensitivity following shRNA silencing of neuronal TRPV1 in rat spinal cord[J]. Acta Pharmacol Sin, 2011, 32 (6) : 845-52 doi:10.1038/aps.2011.43. |
| [8] | Fellmann C, Lowe S W. Stable RNA interference rules for silencing[J]. Nat Cell Biol, 2014, 16 (16) : 10-8 . |
| [9] | Mills C D, Nguyen T, Tanga F Y, et al. Characterization of nerve growth factor-induced mechanical and thermal hypersensitivity in rats[J]. Eur J Pain, 2012, 17 (4) : 469-79 . |
| [10] | Hirose M, Kuroda Y, Murata E. NGF/TrkA signaling as a therapeutic target for pain[J]. Pain Pract, 2016, 16 (2) : 175-82 doi:10.1111/papr.2016.16.issue-2. |
| [11] | 王秀力, 陈东, 刘佳梅. NGF诱导PC12细胞向神经元的分化[J]. 吉林大学学报:医学版, 2007, 33 (5) : 827-30 . Wang X L, Chen D, Liu J M. Differentiation of PC12 cells into neurons induced by NGF[J]. Jilin Univ J (Med Ed), 2007, 33 (5) : 827-30 . |
| [12] | Beverly E, Lior V, Eintou F, et al. Pheromone-induced morphogenesis and gradient tracking are dependent on the MAPK Fus3 binding to Gα[J]. Mol Biol Cell, 2015, 26 (18) : 3343-58 doi:10.1091/mbc.E15-03-0176. |
| [13] | Park Y J, Lee J M, Shin S Y, Kim Y H. Constitutively active Ras negatively regulates Erk MAP kinase through induction of MAP kinase phosphatase 3(MKP3) in NIH3T3 cells[J]. BMB Rep, 2014, 47 (12) : 685-90 doi:10.5483/BMBRep.2014.47.12.017. |
| [14] | Ryu H, Chung M, Dobrzynski M, et al. Frequency modulation of ERK activation dynamics rewires cell fate[J]. Mol Syst Biol, 2015, 11 (11) : 838-52 doi:10.15252/msb.20156458. |
文章信息
-
文章历史
- 收稿日期: 2016-03-29
- 修订日期: 2016-04-18

