


糖尿病肾病(diabetic nephropathy,DN)是糖尿病最常见的并发症之一,是导致终末期肾功能衰竭(end-stage renal disease,ESRD)及患者死亡的重要因素之一[1]。DN的发病机制复杂,氧化应激是其发病最关键的因素之一。高糖诱导的线粒体呼吸链产生过量的活性氧自由基(reactive oxygen species,ROS)是糖尿病及其并发症发病机制的始动环节[2]。糖尿病在我国的患病率逐年上升,目前临床对于DN尚无理想的治疗措施[3],大多使用化学合成药物来治疗糖尿病,不仅疗效不理想,而且副作用日益彰显,因此寻找治疗DN的新药有着重要的意义。
经广西中医药研究院鉴定桑枝Mori Ramulus是桑科植物桑Morus alba L.的干燥树枝,含有丰富的多糖、黄酮、生物碱等活性成分,具有祛风活络、通利关节、燥湿利水、降血糖、降血脂以及提高机体免疫功能等多种药效[4-6]。本研究以糖尿病肾病小鼠为模型,探讨桑枝多糖对糖尿病肾病小鼠肾皮质氧化应激作用的影响。
1 材料与方法 1.1 动物SPF级C57BL/6小鼠,体质量18~22 g,由福建医科大学实验动物中心提供。实验动物生产许可证: SCkx(闽)2011-0002。
1.2 药物桑枝粗粉 1 kg,加体积分数为0.8的乙醇6 000 mL,回流提取4次,每次2 h,过滤,加2 000 mL双蒸水,80℃煮2 h,过滤,煮3次,合并滤液,10 000 r·min-1离心10 min,用微波真空干燥器浓缩,得浓缩液250 mL,经氯仿-正丁醇 (5 ∶1)多次萃取后除去蛋白质。提取液4℃静置过夜,10 000 r·min-1离心10 min,过滤,加入5倍量体积分数为0.95的乙醇,使乙醇终浓度为体积分数为0.7,醇沉24 h,抽滤,收集沉淀物,依次用乙醚、无水乙醇、丙酮将沉淀物洗涤3次,所得即为桑枝粗多糖。将多糖粗品溶于水,加样到经PBS缓冲液(pH=7.8)处理的树脂层析柱中,静置12 h,用双蒸水以流速2 mL·min-1进行洗脱,合并洗脱液,真空干燥得桑枝多糖。经紫外-可见分光计测定样品中的桑枝多糖纯度达85.6%。
1.3 试剂与仪器链脲佐菌素(streptozotocin,STZ,美国Sigma公司,批号SO 150~100 mg);考马斯亮蓝蛋白测定试剂盒(南京建成生物工程研究所,批号20151107)、锰超氧化物歧化酶(Mn-SOD)试剂盒(南京建成生物工程研究所,批号20151107);氧化氢酶(CAT)试剂盒(南京建成生物工程研究所,批号20151103);丙二醛(MDA)测试盒(南京建成生物工程研究所,批号 20151118);线粒体呼吸链复合物Ⅰ、Ⅲ试剂盒(上海杰美基因医药科技有限公司,批号 20151209);SDS-PAGE蛋白上样缓冲液(上海西唐生物科技有限公司,批号WB1408);多克隆抗体(Santa Cruz Biotechnology,批号SC-1537); SIRT1、FOXO1、NF-κB蛋白抗体(武汉博士德公司,批号3683107);HRP 标记的兔抗羊IgG抗体(Santa Cruz Biotechnology,批号CV20150909);预染蛋白Marker(西安润德生物技术有限公司,批号QE15034)。UVmini-1240紫外可见分光光度计(岛津国际贸易上海有限公司);全自动生化分析仪(日立公司,7100);Gel doc 2000低温高速离心机(德国西门子公司);垂直电泳仪(BIO-RAD公司);转膜及显影设备(BIO-RAD公司)。
1.4 方法 1.4.1 糖尿病模型建立及分组给药[7]小鼠造模前12 h禁食不禁水,尾静脉注射STZ(120 mg·kg-1)。72 h后尾巴取血测空腹FBG值,选取FBG≥16.7 mol·L-1为糖尿病造模成功小鼠。并随机分为:模型对照组,缬沙坦组(20 mg·kg-1),桑枝多糖(1.2、0.6、0.3 g·kg-1)组,每组20只。另设空白对照组小鼠20只。灌胃给药90 d。空白组和模型组给予等量生理盐水。
1.4.2 观测指标及方法于给药d 45,各组小鼠给药后将小鼠置于代谢笼中收集24 h尿液,检查尿量及尿蛋白含量。d 90末次给药前,禁食不禁水12 h,给药后1 h拔眼球取血,以3 500 r·min-1离心10 min,取血清待测。采用全自动生化分析仪检测小鼠24 h尿蛋白、血清中Cr、BUN的含量;切取部分肾皮质,10%甲醛固定,石蜡包埋切片,苏木精伊红(HE) 染色进行病理学观察。另切除肾皮质,匀浆后测定Mn-SOD、CAT、线粒体呼吸链复合物I(complex Ⅰ)、线粒体呼吸链复合物Ⅲ(complex Ⅲ)的活性和MDA的含量。ELISA法检测肾皮质ROS的含量;蛋白免疫印迹法检测肾皮质中SIRT1、FOXO1、NF-κB的蛋白表达。
1.5 统计学处理应用SPSS 18.0软件进行统计学分析。数据均以x±s表示,经方差齐性检验,方差齐者采用F检验。
2 结果 2.1 桑枝多糖对糖尿病肾病小鼠尿量、尿蛋白的影响与空白组相比,模型组尿量、24 h尿微量白蛋白水平明显升高(P<0.05)。缬沙坦、桑枝多糖各给药组较模型组小鼠24 h尿微量蛋白以及尿量的水平均有所降低(P<0.05)。见Tab 1。
| Group | Dose/g·kg-1 | 24 h urine/mL | Urine protein/mg·24 h-1 |
| Normal | - | 0.71±0.05* | 1.89±0.33* |
| Model | - | 3.04±0.32 | 9.15±1.09 |
| Valsartar | 0.02 | 1.82±0.23* | 3.61±0.54* |
| RMP | 0.30 | 2.71±0.48* | 7.83±1.73* |
| 0.60 | 2.57±0.35* | 6.16±0.84* | |
| 1.20 | 2.09±0.38* | 4.08±0.79* | |
| *P<0.05 vs model | |||
模型组较正常组小鼠血清中BUN、Cr的含量明显升高(P<0.05)。与模型组比较,缬沙坦及桑枝多糖给药组血清中的BUN、Cr含量明显下降(P<0.05)。见Tab 2。
| Group | Dose/g·kg-1 | BUN/mg·dL-1 | Cr/mg·dL-1 |
| Normal | - | 15.62±1.14* | 0.29±0.04* |
| Model | - | 33.83±1.25 | 0.63±0.12 |
| Valsartar | 0.02 | 20.75±1.91* | 0.34±0.08* |
| RMP | 0.30 | 28.57±1.65* | 0.52±0.09* |
| 0.60 | 25.98±2.52* | 0.46±0.11 | |
| 1.20 | 22.81±2.44* | 0.38±0.07* | |
| *P<0.05 vs model | |||
HE染色结果显示,正常组小鼠包曼氏囊腔轮廓清晰、饱满,未见增生、皱缩、炎症浸润等现象出现。模型组小鼠包曼氏囊腔呈皱缩、弥漫性肾小球硬化变化,有炎症浸润发生。缬沙坦以及桑枝多糖给药组肾小球病变情况有所改善,肾小球形态有所恢复。见Fig 1。
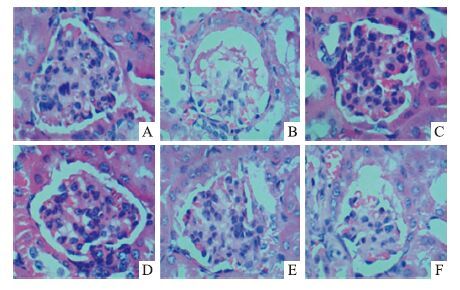
|
| Fig 1 Histological observation of kidney tissues in DN mice A: Normal control group; B: Model group; C: Valsartan group(0.02 g·kg-1); D: 1.2 g·kg-1 RMP group; E: 0.6 g·kg-1 RMP group; F: 0.3 g·kg-1 RMP group |
Tab 3结果显示,模型组小鼠较正常组肾组织中Mn-SOD、CAT的活性明显下降(P<0.05)。与模型组比较,桑枝多糖高剂量组明显升高小鼠肾脏中Mn-SOD、CAT的活性,降低MDA含量(P<0.05)。
| Group | Dose/g·kg-1 | Mn-SOD/U·μg-1 Pro | MDA/μmol·g-1 | CAT/U·μg-1 Pro |
| Normal | - | 53.24±1.74* | 6.55±1.01* | 14.72±1.26* |
| Model | - | 17.62±1.83 | 18.34±3.76 | 8.66±1.83 |
| Valsartan | 0.02 | 38.53±1.65* | 8.78±2.53* | 12.48±2.69* |
| RMP | 0.30 | 23.92±2.39 | 14.36±3.25 | 8.93±1.57 |
| 0.60 | 42.79±2.58* | 9.48±1.94* | 9.34±1.83 | |
| 1.20 | 48.37±3.41* | 7.27±1.39* | 11.87±2.08* | |
| *P<0.05 vs model | ||||
与空白组比较,模型组大鼠血清中线粒体呼吸链复合物Ⅰ、Ⅲ的活性明显下降,ROS含量明显增加(P<0.05)。与模型组比较,桑枝多糖中、高剂量组明显升高大鼠血清中线粒体呼吸链复合物Ⅰ、Ⅲ的活性,ROS的含量明显降低(P<0.05)。见Tab 4。
| Group | Dose/g·kg-1 | Complex Ⅰ/nmol·min·mg·pro-1 | Complex Ⅲ/nmol·min·mg·pro-1 | ROS/kU·L-1 |
| Normal | - | 112.83±12.37* | 65.36±5.38* | 214.69±24.88* |
| Model | - | 63.82±8.75 | 34.58±5.76 | 426.54±34.51 |
| Valsartan | 0.02 | 89.36±7.96* | 50.34±13.35* | 278.13±26.79* |
| RMP | 0.30 | 68.49±9.35 | 41.56±8.99 | 395.87±30.45* |
| 0.60 | 81.58±5.83* | 47.74±11.61* | 349.58±31.82* | |
| 1.20 | 98.21±6.40* | 56.29±10.57* | 317.95±33.57* | |
| *P<0.05 vs model | ||||
与正常组比较,模型组糖尿病小鼠肾皮质中SITR1、FOXO1蛋白表达明显下降,NF-κB蛋白表达明显增加(P<0.05)。与模型组相比,桑枝多糖中、高剂量组可下调小鼠肾皮质中NF-κB的蛋白表达,增加SITR1、FOXO1的蛋白表达(P<0.05)。见Fig 2、Tab 5。
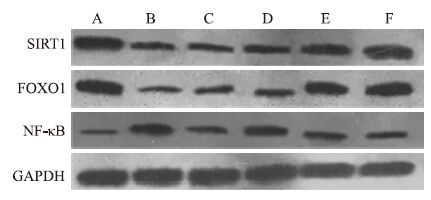
|
| Fig 2 Effects of RMP on SITR1,FOXO1 and NF-κB expressions of renal cortex in DN mice A:Normal control group; B:Model group; C: Valsartan group;D: 0.3 g·kg-1 RMP group; E: 0.6 g·kg-1 RMP group; F: 1.2 g·kg-1 RMP group |
DN是糖尿病最常发生的并发症,也是导致糖尿病患者终末期肾功能衰竭、死亡的重要原因之一,其主要的病理特征为肾小球的基底膜增厚,高渗滤等肾小球病变情况[8]。由于DN的发病机制复杂,目前对其发病机制的了解有限,临床上仍缺乏有效控制DN进展的药物。桑枝为桑科植物桑的树枝,含有丰富的多糖、黄酮、生物碱等活性成分,其主要成分桑枝多糖对糖尿病小鼠具有良好的调节血糖作用及改善糖尿病肾病肾组织的病变[9]。
| Group | Dose/g·kg-1 | SITR1 | FOXO1 | NF-κB |
| Normal | - | 0.91±0.22* | 0.77±0.14* | 0.13±0.03* |
| Model | - | 0.32±0.08 | 0.16±0.03 | 0.63±0.06 |
| Valsartan | 0.02 | 0.39±0.12 | 0.28±0.07* | 0.36±0.05* |
| RMP | 0.30 | 0.44±0.09* | 0.38±0.06* | 0.57±0.12 |
| 0.60 | 0.62±0.11* | 0.53±0.09* | 0.42±0.08* | |
| 1.20 | 0.78±0.13* | 0.61±0.07* | 0.33±0.06* | |
| *P<0.05 vs model | ||||
SIRT1是一种烟酰腺嘌呤二核苷酸(nicotinamide adenosine dinucleotide,NAD+)依赖的组蛋白去乙酰化酶,可以催化依赖NAD+的去乙酰化反应,活化其下游的FOXO、PGC-1α、Ku70、p53等多种转录因子,调控糖脂代谢、氧化应激及线粒体功能等[10]。FOXO1是叉头框(forkhead box,Fox)蛋白家族中最早被发现的一员,是INS/IGF-1信号通路中的关键分子。FOXO1活性受可逆的磷酸化和乙酰化调节,穿梭于细胞核-细胞质内,随之发生转录活性的改变,从而调节细胞增殖、分化、凋亡及氧化反应[11]。
SIRT1、FOXO1与DN的发生发展密切相关。SIRT1表达上调,减少糖尿病小鼠NADH,下调血管紧张素转换酶2及肾脏甘油三酯脂肪酶表达,肾皮质线粒体ROS明显减少,改善肾小球系膜扩张,减轻肾脏炎症和纤维化,促进肾功能恢复[12-13]。通过去乙酰化活化SIRT1下游因子FOXO1,可增加MnSOD、CAT表达,降低炎症因子NF-κB的表达,缓解受损肾组织的炎症反应,减少线粒体损伤,延缓DN肾间质纤维化进程[14]。
肾脏内氧化应激是造成DN足细胞损伤的触发因素之一。机体的糖脂代谢紊乱导致线粒体呼吸链复合物受损,产生过量ROS,损伤周围正常组织蛋白、脂质、核酸,激活一系列信号分子如p38、NF-κB等,导致细胞及组织损伤[15]。Mn-SOD、MDA和CAT 3者可反映出机体的氧化应激状态,机体内ROS降解主要依赖于细胞内多种酶的还原作用,如Mn-SOD、CAT等,而这些酶均是FOXO1的靶基因[16]。Piwkowska等[17]研究发现,高糖培养的小鼠足细胞氧化应激反应增强,FOXO1表达减少,其抗氧化靶基因Mn-SOD、CAT表达下调,ROS产生增加。以限制热量的方式上调DN大鼠SIRT1表达,FOXO1表达也会提高,同时肾皮质MDA减少、SOD活性提高,ROS含量降低[18]。
实验结果表明,桑枝多糖能有效改善糖尿病肾病小鼠肾的功能,缓解受损肾组织的病变,同时可降低MDA、ROS的含量及提高Mn-SOD、CAT 、complex Ⅰ、complex Ⅲ的活性,上调SIRT1和FOXO1蛋白的表达,降低炎症因子NF-κB的表达。提示,桑枝多糖可通过调节肾皮质SIRT1的蛋白表白,激活其下游因子FOXO1,从而增强肾皮质中Mn-SOD、CAT的活性以及下调MDA的含量,提高机体抗氧化能力,对因糖脂代谢紊乱所产生过量ROS进行降解,机体受到ROS的攻击损伤减少,线粒体的呼吸链复合物Ⅰ、Ⅲ的活性提高,从而缓解糖尿病肾病的病情。
( 致谢: 本实验研究在福建医科大学药学院和学校科学实验中心进行,在此感谢对本实验研究付出艰辛和努力的实验人员。 )
| [1] | Cooper M E. Is diabetic nephropathy disappearing from clinical practice[J]. ? Pediatr Diabetes, 2006, 7 (5) : 237-8 doi:10.1111/pdi.2006.7.issue-5. |
| [2] | Brownlee M. The pathobiology of diabetic complications: a unifying mechanism[J]. Diabetes, 2005, 54 (6) : 1615-25 doi:10.2337/diabetes.54.6.1615. |
| [3] | Winiarska K, Szymanski K, Gorniak P, et al. Hypoglycaemic, antioxidative and nephroprotective effects of taurine in alloxan diabetic rabbits[J]. Biochimie, 2009, 91 (2) : 261-70 doi:10.1016/j.biochi.2008.09.006. |
| [4] | Guo C, Li R, Zheng N, et al. Anti-diabetic effect of ramulus mori polysaccharides, isolated from Morus alba L, on STZ-diabetic mice through blocking inflammatory response and attenuating oxidative stress[J]. Int Immunopharmacol, 2013, 16 (1) : 93-9 doi:10.1016/j.intimp.2013.03.029. |
| [5] | 汪宁, 朱荃, 周义维, 等. 桑枝、桑白皮体外降糖作用研究[J]. 中药药理与临床, 2005, 21 (6) : 35-6 . Wang N, Zhu Q, Zhou Y W, et al. Study on hypoglycemic effects of extracts of Ramulus Mori and Cortex Mori in vitro[J]. Pharmacol Clin Chin Mater Med, 2005, 21 (6) : 35-6 . |
| [6] | 王蓉, 卢笑丛, 王有为. 桑枝提取物及抗炎作用研究[J]. 武汉植物学研究, 2002, 20 (6) : 467-9 . Wang R, Lu X C, Wang Y W. Antiinflammatory activity of the extracts of Ramulus mori[J]. J Wuhan Bot Res, 2002, 20 (6) : 467-9 . |
| [7] | 王婧茹, 赵晶晶, 叶春玲, 等. 番石榴叶总三萜对2型糖尿病大鼠的降血糖和血脂作用[J]. 中国病理生理杂志, 2012, 28 (6) : 1109-13 . Wang J R, Zhao J J, Ye C L, et al. Hypolipemic and hypoglycemic effects of total triterpenoids from Psidium guajava leaves on type 2 diabetic rats[J]. Chin J Pathophysiol, 2012, 28 (6) : 1109-13 . |
| [8] | 倪伟建, 丁海华, 唐丽琴, 等. 小檗碱对糖尿病肾病大鼠肾组织VEGF表达的影响[J]. 中国药理学通报, 2015, 31 (6) : 795-800 . Ni W J, Ding H H, Tang L Q, et al. Effect of berberine on expression of vascular endothelial growth factor in diabetic nephropathy rats[J]. Chin Pharmacol Bull, 2015, 31 (6) : 795-800 . |
| [9] | Guo C, Liang T, He Q L, et al. Renoprotective effect of ramulus mori polysaccharides on renal injury in STZ-diabetic mice[J]. Int J Biol Macromol, 2013, 62 (11) : 720-5 . |
| [10] | Ryall J G, Dell′Orso S, Derfoul A, et al. The NAD+-dependent SIRT1 deacetylase translates a metabolic switch into regulatory epigenetics in skeletal muscle stem cells[J]. Cell Stem Cell, 2015, 16 (2) : 171-83 doi:10.1016/j.stem.2014.12.004. |
| [11] | Skarra D V, Thackay V G. FOXO1 is regulated by insulin and IGF1 in pituitary gonadotropes[J]. Mol Cell Endocrinol, 2015, 405 (15) : 14-24 . |
| [12] | Huang K, Chen C, Hao J, et al. Polydatin promotes Nrf2-ARE anti-oxidative pathway through activating Sirt1 to resist AGEs-induced upregulation of fibronetin and transforming growth factor-β1 in rat glomerular messangial cells[J]. Mol Cell Endocrinol, 2015, 399 (5) : 178-89 . |
| [13] | Mori J, Patel V B, Ramprasath T, et al. Angiotensin 1-7 mediates renoprotection against diabetic nephropathy by reducing oxidative stress, inflammation, and lipotoxicity[J]. Am J Physiol Renal Physiol, 2014, 306 (8) : 812-21 doi:10.1152/ajprenal.00655.2013. |
| [14] | Ji H, Wu L, Ma X, et al. The effect of resveratrol on the expression of AdipoR1 in kidneys of diabetic nephropathy[J]. Mol Biol Rep, 2014, 41 (4) : 2151-9 doi:10.1007/s11033-014-3064-2. |
| [15] | Lee H Y, Park S H, Lee M, et al. 1-Dehydro-[10]-gingerdione from ginger inhibits IKKβ activity for NF-κB activation and suppresses NF-κB-regulated expression of inflammatory genes[J]. Br J Pharmacol, 2012, 167 (1) : 128-40 doi:10.1111/j.1476-5381.2012.01980.x. |
| [16] | Shao D, Zhai P, Sadoshima J. The functional crosstalk between YAP and FoxO1 in mediating the oxidative stress response during ischemia/reperfusion in the heart[J]. Circulation, 2013, 128 (22) : A14048 . |
| [17] | Piwkowska A, Rogacka D, Audzeyenka I, et al. High glucose concentration affects the oxidant-antioxidant balance in cultured mouse podocytes[J]. J Cell Biochem, 2011, 112 (6) : 1661-2 doi:10.1002/jcb.v112.6. |
| [18] | Tikoo K, Lodea S, Karpe P A, Kumar S. Calorie restriction mimicking effects of roflumilast prevents diabetic nephropathy[J]. Biochem Biophys Res Commun, 2014, 450 (4) : 1581-6 doi:10.1016/j.bbrc.2014.07.039. |

