


内稳态[1],通过分支状的突起监测外周环境的变化,不断清除损伤的神经元、斑块及炎性物质,在应激状态下(如外伤、炎症等),激活并增强吞噬作用,从而应对损伤;同时释放多种炎症介质,对神经元产生刺激、损伤,驱动并加剧神经系统退行性疾病[2-4]。脂多糖(lipopolysaccharide,LPS)可激活小胶质细胞和星形胶质细胞,并释放炎症介质,引起局部或广泛的中枢神经系统损伤,诱导神经炎性疾病的发生,如阿尔茨海默病、帕金森病等[4-6]。为探索神经系统退行性疾病的治疗新药,本课题组通过前期的在体动物实验发现金钗石斛多糖(noble dendrobium polysaccharides,NDP)能明显改善LPS引起的神经炎性反应。通过建立大鼠皮层胶质细胞-神经元混合培养体系,模拟离体情况下最接近脑组织内的细胞比例,观察NDP对LPS产生炎症的保护作用,为NDP抗神经炎性疾病的应用研究提供基础药理学依据。
1 材料与方法 1.1 药品与试剂NDP由贵阳中医学院提取(分子量为30~1 008 ku、纯度为63.9%),胎牛血清、Iba-1、DMEM/High Glucose培养基由美国Gibco公司提供,脂多糖由Sigma公司提供,NSE和GFAP由 Abcam公司提供,IL-1β、TNF-α、COX-2、β-actin引物由大连宝生物工程有限公司提供。
1.2 仪器Leica光学显微镜由德国Leica Microsystems Ltd公司提供,荧光倒置显微镜由日本Nikon公司提供,Mastercycler Centrifuge PCR仪由德国Eppendorf公司提供。
1.3 实验动物清洁级(SPF级)Sprague-Dawley(SD)大鼠,体质量200~250 g,♀♂兼用以繁殖乳鼠。实验选用出生48 h内的SD大鼠,♀♂不拘。大鼠购自第三军医大学大坪医院实验动物中心。许可证分别为:SCXK(渝)2007-0005及SCXK(渝)2012-0005。
1.4 方法 1.4.1 胶质细胞-神经元混合培养及免疫荧光化学鉴定将出生48 h内的SD大鼠,7.5 g·L-1酒精浸泡后超净台中断头,显微镜下机械分离大脑皮质组织,尽量剥除血管和脑膜,放入预冷的DMEM/High Glucose培养基中。使用电动移液器机械吹打制备细胞悬液,调整细胞密度为1×109·L-1,接种于预先用1 mg·L-1多聚赖氨酸处理的75 cm2培养瓶中,置于37 ℃、5% CO2培养箱培养。每2~3 d更换1次细胞种植培养液,培养8~10 d后造模。
采用上述胶质细胞-神经元混合培养的方法,将细胞悬液调整计数为1×107·L-1,移入预先用1mg·L-1多聚赖氨酸处理的6孔培养板中,置于37 ℃、5% CO2培养箱中培养7 d,分别用小胶质细胞特异性标志物Iba-1、星形胶质细胞特异性标志物GFAP和神经元特异性烯醇化酶(neuron-specific enolase,NSE)进行免疫荧光化学染色鉴定。
1.4.2 实验分组① 正常对照组(Normal):不加任何药物,仅加入细胞种植培养液(主要成分为DMEM/培养基,内含青、链霉素、非必需氨基酸、谷氨酰胺、丙酮酸钠、马血清和胎牛血清);② 模型组(Model):含LPS 1 mg·L-1细胞种植培养液;③ NDP低剂量组(NDP-L):含NDP 0.5 g·L-1+LPS 1 mg·L-1细胞种植培养液;④ NDP中剂量组(NDP-M):含NDP 0.75 g·L-1+LPS 1 mg·L-1细胞种植培养液;⑤ NDP高剂量组(NDP-H):含NDP 1 g·L-1+LPS 1 mg·L-1细胞种植培养液。
1.4.3 Real time PCR检测NDP预处理后LPS刺激大鼠胶质细胞-神经元混合培养体系中炎症因子的表达分别提取以上分组培养细胞中的RNA,采用NanoDrop2000超微量分光光度计,测定RNA样品浓度及260 nm及280 nm处吸光度值。引物序列见Tab 1。
| Gene | GenBank Acc | Forward primer(5′-3′) | Reverse primer(5′-3′) |
| TNF-α | 140331F30 | AGCAAACCACCAAGCGGAGG | CAGCCTTGTCCCTTGAAGAGAAC |
| IL-1β | 140331F28 | AATGACCTGTTCTTTGAGGCTGA | CGAGATGCTGCTGTGAGATTTGA |
| COX-2 | 140428091 | TGAAATATCAGGTCATCGGTGGAG | CATACATCATCAGACCCGGCAC |
| β-actin | NM031144 | GGAGATTACTGCCCTGGCTCTTA | GACTCATCGTACTCCTGCTTGCTG |
通过SPSS17.0软件对实验数据进行统计分析后,将所有数据以x±s表示,方差齐用LSD法、不齐用Dunnett T3法。
2 结果 2.1 小胶质细胞与神经元荧光免疫双标原代新生大鼠皮层胶质细胞-神经元混合培养至7 d,倒置显微镜观察细胞:见混合培养细胞明显分层,底层主要为星形胶质细胞和少量神经元,表层呈圆形、折光性强的细胞为小胶质细胞。混合培养体系中,小胶质细胞与神经元的比例约为 4 ∶3,与在体大脑中两种细胞的比例相符。用特异性标记物Iba-1进行荧光免疫染色,见其发出绿色荧光(Fig 1A)。采用Iba-1和神经元特异标记物NSE对混合细胞培养体系中小胶质细胞和神经元共同染色,可清晰的见到“Fig 1B”中央神经元轴突交织成稀疏的网络状,周围的小胶质细胞呈圆形,胞质被染色。

|
| Fig 1 Primary mixed cultures of microglia(A) and neurons(B) fluorescent immune markers (200×) |
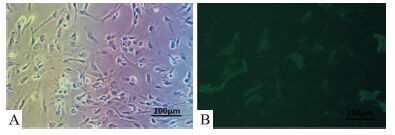
原代新生大鼠皮层胶质细胞-神经元混合培养至7 d,倒置显微镜观察细胞:见混合培养细胞明显分层,底层主要为星形胶质细胞和少量神经元,可见星形胶质细胞铺展于底层,突触呈明显五角星状(Fig 2A)。混合细胞培养体系中,星形胶质细胞约占一半以上,符合在体大脑中星形胶质细胞的生长比例。采用星形胶质细胞特异标记物GFAP进行荧光免疫染色(Fig 2B)。
|
| Fig 2 Primary mixed cultures of astrocytes fluorescent immune markers(200×) A:Mixed cultures;B:Fluorescence astrocytes |
原代新生大鼠皮层胶质细胞-神经元混合培养至d 8,NDP不同剂量(0.5、0.75、1 g·L-1)预处理24 h后,加入LPS作用24 h,倒置显微镜下观察。见空白对照组的小胶质细胞生长情况良好,胞质折光性强(Fig 3A);LPS单独作用的模型组可见表层小胶质细胞的胞质颜色加深,表明激活较多(Fig 3B);NDP 0.5 g·L-1预处理后再LPS作用的低剂量组小胶质细胞激活较少(Fig 3C);中剂量(NDP 0.75 g·L-1)、高剂量(1 g·L-1)组基本未见激活的小胶质细胞(Fig 3D、3E)。

|
| Fig 3 Pretreatment of different concentrations of NDP for 24 hours after 24 hours LPS stimulation in primary mixed cultures(200×) A:Normal;B:Model;C:NDP-L;D:NDP-M;E:NDP-H |
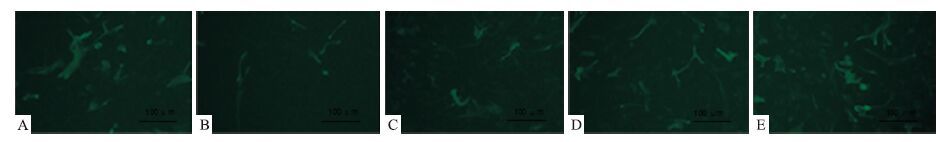
神经元特异标记物NSE荧光免疫染色后倒置显微镜下观察神经元生长情况。见空白对照组生长情况良好,突触明显(Fig 4A);模型组神经元较少且突触稀疏(Fig 4B);NDP 0.5 g·L-1预处理24 h,再LPS作用24 h的低剂量组神经元较少(Fig 4C);NDP 0.75 g·L-1和1 g·L-1预处理24 h,再LPS作用24 h的中、高剂量组神经元生长情况较好,突出清晰可见(Fig 4D、4E)。
|
| Fig 4 Pretreatment of different concentrations of NDP for 24 hours after 24 hours LPS stimulation of neurons in primary mixed cultures(200×) A:Normal;B:Model;C:NDP-L;D:NDP-M;E:NDP-H |
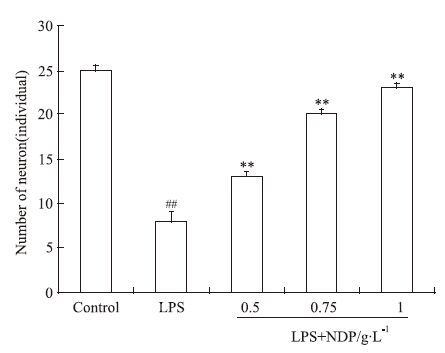
为了更直观地反映神经元在LPS刺激和NDP不同浓度作用后LPS刺激条件下的生长情况,将神经元特异标记物NSE荧光免疫染色后倒置显微镜下的观察结果进行计数并统计。如Fig 5所示,与空白组相比,神经元在LPS的作用下部分死亡,以致数量减少;而NDP不同浓度预处理后再用LPS刺激,神经元的死亡明显减少。
|
| Fig 5 Pretreatment of different concentrations NDP for 24 hours after 24 hours LPS stimulation of neuron number in primary mixed cultures(x±s,n=3) ##P<0.01 vs normal control;**P<0.01 vs model |
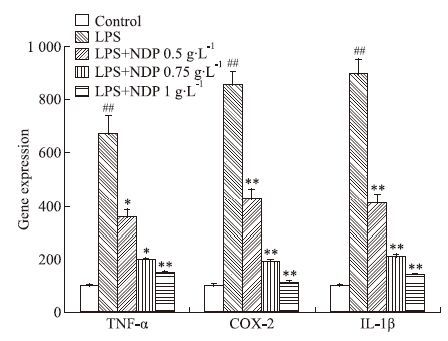
模型组与正常对照组相比,IL-1β、TNF-α、COX-2 mRNA的表达明显升高。与模型组相比,NDP各剂量组IL-1β、TNF-α、COX-2 mRNA的表达均明显降低。
3 讨论LPS可通过单核巨噬细胞谱系细胞表面的糖蛋白-CD14分子启动该类细胞的转膜信号[7-9],LPS 刺激后TNF-α、IL-1β和COX-2等细胞因子生成增加,刺激神经元释放更多的炎性介质,引起如阿尔茨海默病、帕金森病的病理变化,引发炎性反应,导致神经元死亡和脑部损伤[10-12]。静息状态下,小胶质细胞通过分泌神经营养因子维持中枢神经系统微环境的稳定,受到特定刺激(如LPS)时,小胶质细胞被激活,其表型发生改变,细胞表面多种受体表达上调,产生多种炎性因子并诱导神经元变性死亡[13-15]。该体系较在体大脑相比,能够排除个体差异、个体疗效等影响因素,结果显示,NDP能明显拮抗LPS对神经元的毒性作用,抑制炎症因子TNF-α、IL-1β和COX-2的过度表达,防止小胶质细胞过度激活,从而保护神经元免受炎症因子的毒性作用[16-17]。该研究表明,NDP对阿尔茨海默病等神经炎性疾病有预防作用,为科学评价NDP疗效和安全性提供基础依据。
|
| Fig 6 Effects of pretreatment of different concentrations of NDP and LPS stimulation on TNF-α,COX-2 and IL-1β expressions in primary mixed cultures(x±s,n=3) ##P<0.01 vs control;*P<0.05,**P<0.01 vs model |
( 致谢: 感谢导师石京山教授的教导,感谢龚其海老师、吴芹老师、张锋老师、陆远富老师和刘杰老师等指导,感谢陈晶、杜安妮、刘慧宇、林淑娴和李叶丽等的帮助! )
| [1] | Liu X, Su H, Chu T H, et al. Minocycline inhibited the pro-apoptotic effect of microglia on neural progenitor cells and protected their neuronal differentiation in vitro[J]. Neurosci Lett, 2013, 542 : 30-6 doi:10.1016/j.neulet.2013.03.011. |
| [2] | Gonalves N P, Teixeira-Coelho M, Saraiva M J. The inflammatory response to sciatic nerve injury in a familial amyloidotic polyneuropathy mouse model[J]. Exp Neurol, 2014, 257 : 76-87 doi:10.1016/j.expneurol.2014.04.030. |
| [3] | Straub R H. TRPV1, TRPA1, and TRPM8 channels in inflammation, energy redirection, and water retention: role in chronic inflammatory diseases with an evolutionary perspective[J]. J Cell Mol Med, 2014, 92 (9) : 925-37 doi:10.1007/s00109-014-1175-9. |
| [4] | Kobayashi Y, Shiga T, Shibata T, et al. The N-terminal Arg residue is essential for autocatalytic activation of a lipopolysaccharide-responsive protease zymogen[J]. J Biol Chem, 2014, 289 (37) : 987-95 . |
| [5] | Yang S, Li W, Challis J R, et al. Probiotic Lactobacillus rhamnosus GR-1 supernatant prevents lipopolysaccharide-induced preterm birth and reduces inflammation in pregnant CD-1 mice[J]. Am J Obstet Gynecol, 2014, 211 (1) : 44 . |
| [6] | Boltaña S, Tridico R, Teles M, et al. Lipopolysaccharides isolated from Aeromonas salmonicida and Vibrio anguillarum show quantitative but not qualitative differences in inflammatory outcome in Sparus aurata(Gilthead seabream)[J]. Fish Shellfish Immunol, 2014, 39 (2) : 475-82 doi:10.1016/j.fsi.2014.06.003. |
| [7] | Chaotham C, Pongrakhananon V, Sritularak B, Chenvorachote P. A bibenzyl from dendrobium ellipsophyllum inhibits epithelial-to-mesenchymal transition and sensitizes lung cancer cells to anoikis[J]. Anticancer Res, 2014, 34 (4) : 1931-8 . |
| [8] | Schmid A, Kopp A, Hanses F, et al. C1q/TNF-related protein-3(CTRP-3) attenuates lipopolysaccharide(LPS)-induced systemic inflammation and adipose tissue Erk-1/-2 phosphorylation in mice in vivo[J]. Biochem Biophys Res Commun, 2014, 452 (1) : 8-13 doi:10.1016/j.bbrc.2014.06.054. |
| [9] | 张贝贝, 刘文洪, 李俊峰, 等. 铁皮石斛多糖对高糖诱导的血管内皮细胞Bax、Bcl-2 表达的影响[J]. 中国药理学通报, 2015, 31 (1) : 64-70 . Zhang B B, Liu W H, Li J F, et al. Effects of polysaccharides from Dendrobium officinale on expression of Bax and Bcl-2 in vascular endothelial cells induced by high sugar[J]. Chin Pharmacol Bull, 2015, 31 (1) : 64-70 . |
| [10] | Hall J R, Wiechmann A R, Johnson L A, et al. The impact of APOE status on relationship of biomarkers of vascular risk and systemic inflammation to neuropsychiatric symptoms in Alzheimer′s disease[J]. J Alzheimers Dis, 2014, 40 (4) : 887-96 . |
| [11] | 宋修云, 胡金凤, 陈乃宏. 神经细胞凋亡与脑缺血疾病[J]. 中国药理学通报, 2012, 28 (3) : 307-10 . Song X Y, Hu J F, Chen N H. Neurons apoptosis and cerebral ischemia[J]. Chin Pharmacol Bull, 2012, 28 (3) : 307-10 . |
| [12] | Anderson G, Maes M. TRYCAT pathways link peripheral inflammation, nicotine, somatization and depression in the etiology and course of Parkinson′s disease[J]. CNS Neurol Disord Drug Targets, 2014, 13 (1) : 137-49 doi:10.2174/18715273113129990082. |
| [13] | Yang Z, Zhao T, Zou Y, et al. Curcumin inhibits microglia inflammation and confers neuroprotection in intracerebral hemorrhage[J]. Immunol Lett, 2014, 160 (1) : 89-95 doi:10.1016/j.imlet.2014.03.005. |
| [14] | Kim H L, Lee M Y, Park S Y, et al. Comparative effectiveness of cycling of tumor necrosis factor-α(TNF-α) inhibitors versus switching to non-TNF biologics in rheumatoid arthritis patients with inadequate response to TNF-α inhibitor using a Bayesian approach[J]. Arch Pharm Res, 2014, 37 (5) : 662-70 doi:10.1007/s12272-014-0337-1. |
| [15] | 蔡海兰, 黄晓君, 聂少平, 等. 铁皮石斛多糖对RAW264.7细胞分泌TNF-α的影响[J]. 中国药理学通报, 2012, 28 (11) : 1553-6 . Cai H L, Huang X J, Nie S P, et al. Effects of polysaccharides from Dendrobium Officinale on the production of TNF-α by RAW264.7 cells[J]. Chin Pharmacol Bull, 2012, 28 (11) : 1553-6 . |
| [16] | Sharma A A, Jen R, Kan B, et al. Impaired NLRP3 inflammasome activity during fetal development regulates IL-1β production in human monocytes[J]. Eur J Immunol, 2015, 45 (1) : 238-49 . |
| [17] | Yang S, Gong Q, Wu Q, et al. Alkaloids enriched extract from Dendrobium nobile Lindl. attenuates tau protein hyperphosphorylation and apoptosis induced by lipopolysaccharide in rat brain[J]. Phytomedicine, 2014, 21 (5) : 712-6 doi:10.1016/j.phymed.2013.10.026. |

