


2. 重庆医科大学药理学教研室,重庆 400016


2. Dept of Pharmacology, Pharmacy School of Chongqing Medical University, Chongqing 400016,China
结肠癌是常见的消化系统恶性肿瘤之一,其死亡率仅次于肺癌和肝癌,对人类的健康具有严重危害[1]。结肠癌的发病原因与多种信号传导异常和相关抑癌基因发生突变有关,如Wnt/β-catenin信号异常,以及PTEN突变等[2-3]。近年来,随着对结肠癌发病机制认识的进一步深入,临床对结肠癌的治疗水平已有较大提高。除传统的手术与化疗外,靶向治疗也已成功用于治疗结肠癌,如贝伐单抗和西妥昔单抗等,但其治疗效果及预后仍不理想[4]。目前,治疗结肠癌面临的最主要挑战包括传统化疗药物的严重毒性与癌细胞的转移。从传统中药来源的单体成分及其有效衍生物在治疗肿瘤中发挥着重要作用,是抗肿瘤药物的重要来源之一,如长春新碱已用于结肠癌的治疗[5]。白藜芦醇(resveratrol,Res)属天然多酚类物质,又名芪三酚,主要来源于虎杖、葡萄、花生、桑葚等植物[6]。Res因具有抗氧作用,所以临床可用于防治动脉粥样硬化、高血脂、冠心病以及缺血性心脏病等疾病[7]。研究证明,Res还具有明显的抗肿瘤作用,能有效地抑制多种肿瘤细胞增殖并促进其凋亡,如肺癌、肝癌、乳腺癌和结肠癌等[8-9]。我们的前期研究结果也证实Res对人结肠癌细胞具有增殖抑制作用[3]。Res的抗肿瘤作用可能与抑制Wnt/β-catenin信号和促进PTEN表达等多种机制有关[2-3],但确切机制目前仍不十分清楚。本研究进一步分析Res对结肠癌细胞的增殖抑制作用以及可能的分子机制,为将Res用于临床治疗和预防结肠癌提供相应的理论和实验基础。
1 材料与方法 1.1 试剂与细胞培养LoVo细胞购自American Type Culture Collection(ATCC)。白藜芦醇购自西安昊轩生物科技有限公司,实验所用抗体购自Santa Cruz Biotechnology公司,p38 MAPK抑制剂(SB203580)购于赛力克公司(Selleck)。LoVo细胞的培养条件为:DMEM培养基(高糖,含10%胎牛血清、100 kU·L-1青霉素和0.1 g·L-1链霉素),5%的CO2及37 ℃。
1.2 实验设计及分组将LoVo细胞按实验设计分为对照组和实验组。采用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解Res,实验组的细胞采用不同浓度的Res处理,对照组的细胞则用相同体积的DMSO进行处理。
1.3 结晶紫染色实验将生长状态良好的细胞消化,然后种于24孔板中。待细胞贴壁后用不同浓度Res(10、20、40、60、80 μmol·L-1)或DMSO处理,分别于24、48、72 h进行结晶紫染色,检测Res对LoVo细胞增殖的影响。方法简述如下:弃培养基,用PBS(4℃)小心将孔板清洗干净。然后每孔加500 μL结晶紫饱和溶液(采用PBS缓冲的福尔马林配制),在室温下染色20 min。移去结晶紫染液,用自来水小心清洗孔板。最后,将孔板置于室温下晾干后扫描和进行定量分析[2]。每组实验重复3次。
1.4 流式细胞术周期分析实验用不含EDTA的胰酶将处于指数生长期的LoVo细胞消化,然后均匀种于6孔板中,待细胞贴壁后(4~6 h)用不同浓度Res(20、40、60 μmol·L-1)或DMSO进行处理。48 h后收集细胞,用冷的PBS(4℃)重悬并离心(800 r·min-1,5 min×2次)。然后用预冷的70%、50%以及30%乙醇进行固定,并用PBS洗涤。加入1 mL PI(20 g·L-1)溶液(含RNA酶,1 g·L-1)孵育30 min。最后用流式细胞仪进行周期分析。每组实验重复3次。
1.5 Westernblot实验 将处于指数生长期的LoVo细胞种于6孔板中,按实验设计采用不同浓度Res(20、40、60 μmol·L-1)和DMSO处理。各处理组于相应时间点提取总蛋白,并采用BCA法测定样品总蛋白浓度。按常规Western blot实验方法进行电泳、转膜和抗体孵育,最后利用化学发光试剂盒显影并采集图像。每组实验重复3次。
1.6 统计学分析采用Microsoft的Excel对实验结果进行统计分析,采用t-test进行组间比较,实验数据以x±s表示。
2 结果 2.1 Res对LoVo细胞增殖的影响实验结果显示,Res呈浓度依赖性抑制LoVo细胞增殖,并且抑制作用随药物作用时间延长而增强(Fig 1A);Res在低浓度(20 μmol·L-1)时已能明显抑制LoVo细胞生长(P<0.05)。 周期分析结果显示,Res明显诱导LoVo细胞发生S期阻滞(Fig 1B)。Western blot分析结果显示,Res明显增加LoVo细胞PCNA表达(Fig 1C),进一步证实Res可诱导LoVo细胞发生S期阻滞。以上结果提示,Res对LoVo细胞的增殖具有明显抑制作用。
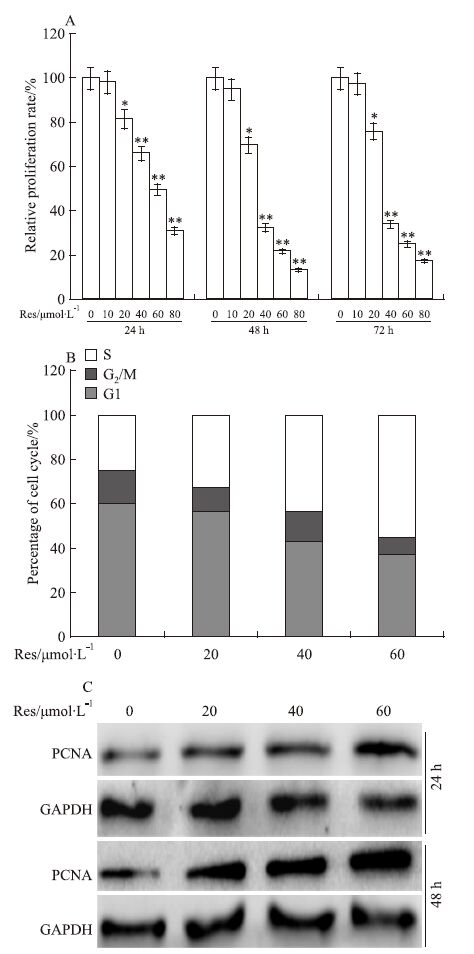
|
| Fig 1 Effects of Res on proliferation of LoVo cells A:The quantification results of crystal violet staining show the effect of Res on proliferation of LoVo cells.*P<0.05,**P<0.01 vs control;B:Flow cytometery analysis results show the effect of Res on cell cycle in LoVo cells;C:Western blot results show the effect of Res on the protein level of PCNA in LoVo cells |
诱导肿瘤细胞凋亡是大多数抗肿瘤药物的一个重要特点。Western blot分析结果显示(Fig 2),Res明显呈浓度依赖性增加Bad的蛋白水平,但下调Bcl-2的蛋白水平。结果提示,Res能促进LoVo细胞凋亡。
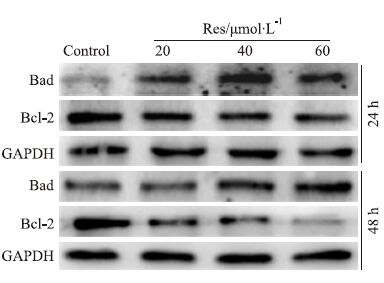
|
| Fig 2 Effects of Res on apoptosis of LoVo cells |
MAPKs信号的异常与结肠癌密切相关,其中p38 MAPK对细胞的增殖具有重要调控作用。Western blot分析结果显示,Res对p38 MAPK总蛋白水平无明显影响,但能明显促进p38 MAPK的磷酸化(Fig 3)。结果提示,Res抑制LoVo增殖和促进LoVo细胞凋亡可能与促进p38磷酸化有关。
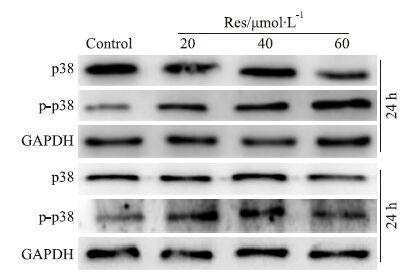
|
| Fig 3 Effect of Res on phosphorylation of p38 MPAK in LoVo cells |
结晶紫染色分析结果显示,Res(40 μmol·L-1)能明显抑制LoVo细胞增殖(P<0.05),p38 MAPK抑制剂能促进LoVo细胞增殖,并明显减弱Res对LoVo细胞的增殖抑制作用(Fig 4)。结果提示,Res对LoVo细胞增殖的抑制作用至少与促进p38 MAPK磷酸化有关。
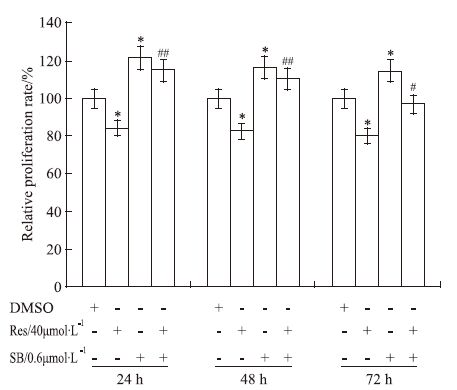
|
| Fig 4 Effect of p38 MPAK on anti-proliferation effect of Res in LoVo cells SB: SB203580,p38 MAPK inhibitor. Quantification results of crystal violet staining show the effect of p38 MAPK on the anti-proliferation effect of Res in LoVo cells.*P<0.05 vs control;#P<0.05,##P<0.01 vs Res. |
Western blot分析结果显示,Res(40 μmol·L-1)明显增加Bad的水平,p38 MAPK抑制剂能减弱Res的这种作用;同时,Res明显降低Bcl-2的蛋白水平,而p38 MAPK抑制剂能增加Bcl-2的蛋白水平,并部分逆转Res对Bcl-2表达的抑制作用(Fig 5)。结果提示,Res诱导LoVo细胞凋亡的作用也与促进p38 MAPK磷酸化有关。
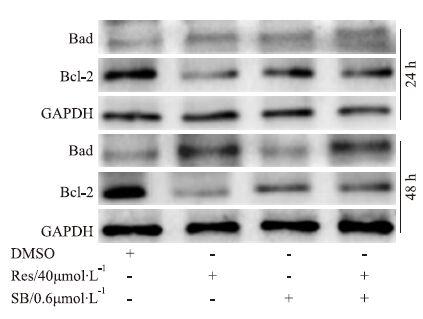
|
| Fig 5 Effect of p38 MPAK on Res-induced apoptosis of LoVo cells SB: SB203580,p38 MAPK inhibitor. |
结肠癌是临床中常见的一种消化系统恶性肿瘤,其发病率和致死率均较高,仅次于肝癌、肺癌和胃癌,全球每年约有50万患者因结肠癌而死亡[1]。目前虽然对结肠癌的诊断技术和治疗水平都已有较大提高,但其预后仍不太乐观。因此,临床急需开发疗效好而低毒性的抗肿瘤药物。本研究表明,Res能明显抑制人结肠癌LoVo细胞增殖,并促进其凋亡,这种作用可能与Res促进p38 MAPK活化有关,但Res活化p38 MAPK的具体分子机制还不清楚。
结肠癌的发病原因目前仍不十分清楚,但研究报道其发生可能与多种信号异常或基因突变有关,如Wnt/β-catenin信号异常,以及PTEN、KRAS和RAF突变等[2-3, 10]。除此之外,有丝分裂原活化激酶(mitogen-activated protein kinases,MAPKs)的功能失调可能也与结肠癌发生有关,MPAKs通过接受各种剌激,对细胞的多种生理功能发挥调节作用。MAPKs包括JNK、p38 MAPK和ERK,其中p38 MAPK受紫外线、渗透压、热休克和多种细胞因子等刺激而产生相应效应,参与调节细胞的增殖、分化、迁移、侵袭和死亡等,其功能异常与包括结肠癌在内的多种肿瘤的发生、进展和患者的生存期明显相关[11]。p38 MAPK可通过调节细胞的增殖、分化与凋亡等过程,实现机体各组织相对稳定,这种作用可能与其影响p53和PTEN等抑制基因有关[12-13]。文献报道,姜黄醇可通过激活p38 MAPK抑制LoVo细胞增殖[14]。 本研究结果显示,抑制p38 MAPK对LoVo细胞的增殖具有促进作用。提示,在结肠癌细胞中(或至少在LoVo细胞中)活化p38 MAPK能抑制结肠癌细胞生长。p38 MAPK可能是治疗结肠癌药物的一个新靶点。
白藜芦醇是来源于葡萄、虎杖、花生、桑葚等植物的一种天然多酚类物质。近年研究表明,Res具有明显抗肿瘤作用,对多种肿瘤细胞增殖具有抑制作用,并能促进其凋亡,如肺癌、肝癌、乳腺癌和结肠癌细胞等。Res的抗肿瘤作用可能与其增强p53的功能、诱导活性氧(reactive oxygen species,ROS)和抑制KRAS表达等有关。我们前期实验结果也证实Res对结肠癌细胞的增殖具有抑制作用,机制可能与促进PTEN表达有关[3]。Res本身对p38 MAPK具有重要调节作用,而p38 MAPK功能的失调本身也与结肠癌有关[11],并且p38 MAPK可通过调节PTEN实现对细胞增殖的调控[13]。因此,我们推测Res对LoVo细胞增殖的抑制作用可能也与调节p38 MAPK的活性有关。结果显示,Res呈浓度依赖性方式抑制LoVo细胞增殖和促进其凋亡,并且明显增加p38 MAPK的磷酸化水平。提示,Res对LoVo细胞的增殖抑制作用很可能与促进p38 MAPK磷酸化有关。进一步分析表明,抑制p38 MAPK能减弱Res对LoVo细胞的增殖抑制和促进凋亡的作用。以上结果证实,Res对LoVo细胞的增殖抑制作用至少与其促进p38 MAPK磷酸化有关。但Res促进p38 MAPK磷酸化的具体机制目前还不清楚。另有报道,抑制p38 MAPK能阻滞结肠癌细胞生长[13],即p38 MAPK对生长的调控可能具有双重作用。之所以产生不同的效应,可能与细胞接受刺激的种类不同、细胞的种类不同以及肿瘤细胞的微环境不同有关[15]。
本研究结果表明,Res能明显抑制结肠癌细胞增殖,这种作用可能与其促进p38 MAPK磷酸化有关。因此,p38 MAPK可能是治疗结肠癌药物的潜在有效靶点。但是,Res促进p38 MAPK磷酸化的详细机制还有待进一步研究。课题组将进一步分析在结肠癌细胞中Res促进p38 MAPK磷酸化可能机制,为将Res用于临床治疗结肠癌提供理论和实验基础。
( 致谢: 感谢研究生袁霜雪以及吴柯和孙文娟副教授对本实验的指导。 )
| [1] | Tárraga López P J, Albero J S, Rodríguez-Montes J A. Primary and secondary prevention of colorectal cancer[J]. Clin Med Insights Gastroenterol, 2014, 7 : 33-46 . |
| [2] | 袁霜雪, 王东旭, 伍秋香, 等. 白藜芦醇抑制HCT116结肠癌细胞增殖与Wnt/β-catenin的关系研究[J]. 中国药理学通报, 2015, 31 (4) : 537-41 . Yuan S X, Wang D X, Wu Q X, et al. Study on the relationship between anti-proliferation effect of resveratrol on HCT116 colon cancer cells and Wnt/β-catenin[J]. Chin Pharmacol Bull, 2015, 31 (4) : 537-41 . |
| [3] | Liu Y Z, Wu K, Huang J, et al. The PTEN/PI3K/Akt and Wnt/β-catenin signaling pathways are involved in the inhibitory effect of resveratrol on human colon cancer cell proliferation[J]. Int J Oncol, 2014, 45 (1) : 104-12 . |
| [4] | Dienstmann R, Salazar R, Tabernero J. Personalizing colon cancer adjuvant therapy: selecting optimal treatments for individual patients[J]. J Clin Oncol, 2015, 33 (16) : 1787-96 doi:10.1200/JCO.2014.60.0213. |
| [5] | Sun Q L, Zhao C P, Wang T Y, et al. Expression profile analysis of long non-coding RNA associated with vincristine resistance in colon cancer cells by next-generation sequencing[J]. Gene, 2015, 572 (1) : 79-86 doi:10.1016/j.gene.2015.06.087. |
| [6] | Wang K H, Lai Y H, Chang J C, et al. Germination of peanut kernels to enhance resveratrol biosynthesis and prepare sprouts as a functional vegetable[J]. J Agric Food Chem, 2005, 53 (2) : 242-6 doi:10.1021/jf048804b. |
| [7] | Petrovski G, Gurusamy N, Das D K. Resveratrol in cardiovascular health and disease[J]. Ann N Y Acad Sci, 2011, 1215 : 22-33 doi:10.1111/j.1749-6632.2010.05843.x. |
| [8] | Singh C K, Ndiaye M A, Ahmad N. Resveratrol and cancer: challenges for clinical translation[J]. Biochim Biophys Acta, 2015, 1852 (6) : 1178-85 doi:10.1016/j.bbadis.2014.11.004. |
| [9] | Carter L G, D′Orazio J A, Pearson K J. Resveratrol and cancer: focus on in vivo evidence[J]. Endocr Relat Cancer, 2014, 21 (3) : R209-25 doi:10.1530/ERC-13-0171. |
| [10] | Yoon H H, Shi Q, Alberts S R, et al. Racial differences in BRAF/KRAS mutation rates and survival in stage Ⅲ colon cancer patients[J]. J Natl Cancer Inst, 2015, 107 (10) . |
| [11] | Koul H K, Pal M, Koul S. Role of p38 MAP kinase signal transduction in solid tumors[J]. Genes Cancer, 2013, 4 (9-10) : 342-59 doi:10.1177/1947601913507951. |
| [12] | Zheng F, Tang Q, Wu J, et al. p38α MAPK-mediated induction and interaction of FOXO3a and p53 contribute to the inhibited-growth and induced-apoptosis of human lung adenocarcinoma cells by berberine[J]. J Exp Clin Cancer Res, 2014, 33 : 36 doi:10.1186/1756-9966-33-36. |
| [13] | Cordero-Herrera I, Martín M A, Bravo L, et al. Epicatechin gallate induces cell death via p53 activation and stimulation of p38 and JNK in human colon cancer SW480 cells[J]. Nutr Cancer, 2013, 65 (5) : 718-28 doi:10.1080/01635581.2013.795981. |
| [14] | Ittner A, Block H, Reichel C A, et al. Regulation of PTEN activity by p38δ-PKD1 signaling in neutrophils confers inflammatory responses in the lung[J]. J Exp Med, 2012, 209 (12) : 2229-46 doi:10.1084/jem.20120677. |
| [15] | Igea A, Nebreda A R. The stress kinase p38α as a target for cancer therapy[J]. Cancer Res, 2015, 75 (19) : 3997-4002 doi:10.1158/0008-5472.CAN-15-0173. |
文章信息
-
文章历史
- 收稿日期: 2016-04-01
- 修订日期: 2016-05-09