


2. 南通大学医学院 药理学系,江苏 南通 226001;
3. 江苏安惠生物科技有限公司,江苏 南通 226006
2. Dept of Pharmacology,Medical College,Nantong University,Nantong Jiangsu 226001,China ;
3. Jiangsu Anhui Biological Technology Co. Ltd,Nantong Jiangsu 226006,China
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病心脏病变中特异性的心肌病变,最终能导致心脏功能减退、心功能衰竭[1],是导致糖尿病患者晚期死亡的主要原因之一。基质金属蛋白酶(MMPs)的蛋白活性改变在心肌间质纤维化过程中起着重要作用[2]。灵芝多糖(ganoderma lucidum polysaccharide,GLPs)为多孔菌科真菌灵芝[Ganoderma lucidum(Leys.Ex Fr.)Karst]中提取出来的以β(1→3)糖苷键为主链的杂多糖[3]。Xiao等[4]发现二甲双胍可减少转化生长因子诱导的胶原蛋白合成,从而改善心肌纤维化。笔者先前研究证实灵芝多糖联合二甲双胍可通过抑制心肌氧化应激,下调糖基化终末产物和结缔组织生长因子的表达来预防心肌纤维化[5]。本实验旨在研究灵芝多糖联合二甲双胍对2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠心肌结构及血流动力学的影响,研究两药联用对MMP-2蛋白的表达的抑制是否具有协同作用。
1 材料与方法 1.1 药品与试剂链脲佐菌素(streptozotocin,STZ,Sigma公司),使用前用0.1 mol·L-1柠檬酸缓冲液配成浓度为1%的STZ溶液;灵芝多糖(江苏安惠生物科技有限公司,纯度74.03%,批号:100601);二甲双胍(上海信谊天平药业有限公司,批号:67100507);VG染色试剂(上海科兴生物公司);第二代免疫组化Elivision TM plus广谱试剂盒(福州迈新生物技术开发有限公司);BCA蛋白浓度测定试剂盒(海门碧云天生物技术研究所);兔抗鼠MMP-2多抗(武汉博士德生物工程有限公司);辣根过氧化酶结合的羊抗兔IgG(武汉博士德生物工程有限公司);小鼠抗β-actin多克隆抗体(上海康成生物工程有限公司);预染蛋白Marker(分子量6.5~175.0 ku,New England Biolabs)Super Singal化学发光试剂盒(PIERCE公司);PVDF膜(Bio-Rad公司)。
1.2 实验仪器One Touch血糖仪(强生医疗器材公司);Medlab生物信号采集系统(南京美易生物技术有限公司);BH-NIC-B型倒置显微镜购自日本Olympus公司;IBAS2.5图像分析系统(南通大学医学院生理教研室);蛋白电泳仪(Bio-Rad公司);SH-100型凝胶图像分析仪(上海复旦四星高科技技术公司)。
1.3 实验动物分组及处理SD大鼠80只,♀♂各半,体质量160~180 g,南通大学实验动物中心提供,动物生产许可证号:SCXK(苏)2014-0001,动物使用许可证号:SYXK(苏)2012-0031。80只大鼠饲养在带不锈钢盖底的塑料笼内,每笼4只,自由饮水,室内温度为25℃,湿度为60%,饮水为普通自来水,饲料和水均可由大鼠自行随意摄取。将大鼠随机分为正常对照组(CON)和造模组。正常对照组10只,给予普通饲料喂养。造模组70只给予高脂饮食(基础饲料70%、脂肪20%、蛋黄粉、5%奶粉5%),喂养4周后禁食12 h,予STZ 30 mg·kg-1腹腔注射。1周后,空腹血糖值≥11.1 mmol·L-1即造模成功,继续高脂饮食。取40只成模大鼠,随机分为4组:糖尿病组(DM);灵芝多糖组(GLPs)(灵芝多糖600 mg·kg-1),二甲双胍组(Met,二甲双胍600 mg·kg-1),联合用药组(COM,灵芝多糖300 mg·kg-1+二甲双胍300 mg·kg-1)。每日上午11 ∶00灌胃给药1次,正常对照组和糖尿病组予生理盐水灌胃,连续给药12周。
1.4 观察指标 1.4.1 血糖测定给药12周末,禁食12 h后,尾静脉取血测空腹血糖。
1.4.2 大鼠血流动力学指标测定将PE-50聚乙烯导管(内径0.5 mm,外径1 mm)插入大鼠左心室腔,用与压力传感器相连的Medlab生物信号采集系统记录血流动力学参数:左室收缩压(LVSP),左室舒张压(LVEDP),室内压最大上升速率(dp/dtmax),室内压最大下降速率(-dp/dtmax)。每只大鼠取5段(10 s)的测定值,利用Medlab生物信号采集系统计算各参数平均值。
1.4.3 心肌胶原含量测定心肌组织常规切片脱蜡,苏木精染色5 min,水洗。VG染色2 min,水洗。95%酒精分色,脱水后封片,观察。染片结果用IBAS2.5全自动图像分析系统作图像分析,测定胶原容积分数(CVF),其为胶原面积与心肌总面积的比值,其中胶原面积剔除血管周围胶原面积,每个标本随机取5个视野,取均值。
1.4.4 免疫组化法检测心肌组织MMP-2表达取部分心肌组织,常规固定,石蜡包埋。采用免疫组织化学法检测心肌组织中MMP-2的含量,具体操作按照试剂盒说明书进行。各抗体按1 ∶50的方法稀释,以PBS替代一抗作为阴性对照,将切片置于高倍镜下(×200),每张切片随机选取10个视野,细胞胞膜和胞质内棕黄色颗粒即为阳性信号。采用JEDA801D型形态学图像分析软件测定阳性信号所占面积及平均灰度,二者乘积(即积分光密度值)越大表明组织中该抗原含量越高。
1.4.5 免疫印迹法检测心肌MMP-2蛋白的表达取心肌组织100 mg,加入含有蛋白酶抑制剂的组织裂解液冰上提取蛋白,BCA法蛋白定量。8%的SDS-PAGE凝胶电泳分离蛋白,电流100 V;300 mA转膜150 min;含有5%脱脂奶粉TBST室温封闭1 h,加入MMP-2和β-actin抗体4℃过夜。滴加相应的二抗室温反应1 h,扫膜并使用Image J进行灰度分析。
1.5 统计学分析采用Stata7.0统计软件分析处理数据,计量资料以x±s表示,比较采用单因素方差分析,q检验。
2 结果 2.1 大鼠空腹血糖糖尿病组空腹血糖水平高于正常对照组,差异有显著性(P<0.01)。用药组空腹血糖水平均低于糖尿病组(P<0.01),其中联合用药组下降幅度最大,并明显低于单独用药组(P<0.05)。见Tab 1。
| Group | Blood glucose/mmol·L-1 |
| CON | 3.51±0.25## |
| DM | 19.13±0.81** |
| GLPs | 11.16±0.33**## |
| Met | 13.77±0.57**## |
| COM | 7.35±0.64*##△ |
| *P<0.05,**P<0.01 vs CON;##P<0.01 vs DM;△P<0.05 vs Met or GLPs | |
第12周末,测定各组大鼠血流动力学指标。与正常对照组相比,糖尿病组的LVEDP上升(P<0.01),LVSP、dp/dtmax和-dp/dtmax均下降(P<0.01);与糖尿病组相比,给药组均有明显改善(P<0.01),其中联合用药组效果明显优于单独用药组(P<0.01)。见Tab 2。
| Group | LVSP/kPa | LVEDP/kPa | dp/dtmax/kPa | -dp/dtmax/kPa |
| CON | 26.23±1.45 | 0.06±0.01 | 654.56±8.69 | 399.17±5.95 |
| DM | 13.51±1.06**## | 0.32±0.03**## | 433.19±5.36**## | 258.33±4.12**## |
| GLPs | 16.95±1.14**## | 0.16±0.02**## | 502.64±6.22**## | 316.46±5.78**## |
| Met | 17.08±1.23**## | 0.17±0.02**## | 511.31±6.45**## | 313.51±4.66**## |
| COM | 21.29±1.55**##△△ | 0.10±0.01**##△△ | 566.77±6.98**##△△ | 350.60±7.63**##△△ |
| **P<0.01 vs CON;##P<0.01 vs DM;△△P<0.01 vs Met or GLPs | ||||
电镜下观察,正常对照组大鼠心肌肌节完整,肌丝、线粒体排列比较整齐。糖尿病组有不同程度的心肌变性、坏死,肌原纤维之间的糖原有减少;肌质网肿胀并扩张;线粒体大小不一,有肿胀和萎缩现象产生;微血管基底膜略增厚。各治疗组心肌病变较糖尿病组明显减轻,间质胶原沉积较糖尿病组减少,微血管基底膜增厚减轻。见Fig 1。各组大鼠CVF的比较见Tab 3。
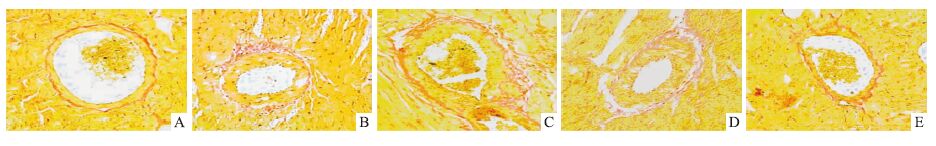
|
| Fig 1 VG staining of myocardial tissue in rats(×100) A~E:A:CON;B:DM;C:GLPs;D:Met;E:COM |
| Group | CVF/% |
| CON | 2.21±0.45## |
| DM | 16.75±1.23** |
| GLPs | 13.63±1.14** |
| Met | 12.23±0.86** |
| COM | 4.25±0.31##△△ |
| **P<0.01 vs CON;##P<0.01 vs DM;△△P<0.01 vs Met or GLPs | |
免疫组织化学(immunohistochemistry,IH)结果如图 2所示:大鼠心肌组织MMP-2免疫组化见细胞胞膜和胞质内棕黄色颗粒即为阳性信号。Fig 2可见,N组大鼠左室心肌组织MMP-2低表达,阳性颗粒散在,染色较浅;DM组高表达,棕黄色信号强,融合成片,而各治疗组表达均明显降低,其中联合用药组降低更为明显。每张切片随机选取10个视野,采用JEDA801D型形态学图像分析软件测定阳性信号所占面积及平均灰度,二者乘积(即积分光密度值)越大表明组织中该抗原含量越高。结果见Tab 4。与N组相比,MMP-2的表达在DM组中明显升高(P<0.01);与DM组相比,3个治疗组MMP-2的表达明显降低(P<0.01),其中联合用药组的两种蛋白表达最低(P<0.01)。

|
| Fig 2 Immunohistochemistry of myocardium of left ventricle of rats(×200) A~E:MMP-2 A:CON;B:DM;C:GLPs;D:Met;E:COM |
| Group | MMP-2 |
| CON | 0.05±0.01## |
| DM | 0.82±0.15** |
| GLPs | 0.46±0.04**## |
| Met | 0.39±0.05**## |
| COM | 0.16±0.03*## |
| *P<0.05,**P<0.01 vs CON,##P<0.01 vs DM | |
Western blot结果见Fig 3,β-actin(42 ku)作为内参,在各组中有较均一的表达;MMP-2在各组中的蛋白条带深浅不一。
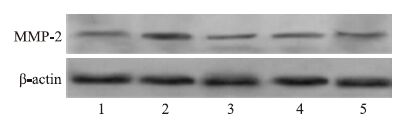
|
| Fig 3 Western blot of MMP-2 in myocardium of diabetic rats 1:CON;2: DM;3: GLPs;4: Met;5: COM |
用四星图像处理系统测出各组MMP-2蛋白表达量与β-actin的表达量,并计算出其比值。DM组MMP-2蛋白的表达明显高于N组(P<0.01),与DM组相比,3个治疗组的两种蛋白表达均下调,联合用药组下调最为明显(Tab 5)。
| Group | MMP-2 |
| CON | 0.14±0.01 |
| DM | 0.87±0.03** |
| GLPs | 0.64±0.02**# |
| Met | 0.69±0.02**# |
| COM | 0.49±0.03**## |
| **P<0.01 vs CON;#P<0.05,##P<0.01 vs DM | |
本研究通过高脂饮食配合注射小剂量STZ诱导2型糖尿病大鼠模型,联合应用灵芝多糖与二甲双胍干预,结果提示,糖尿病组大鼠实验期间血糖维持高水平,联合用药组血糖明显低于模型组(P<0.01),并明显低于单独用药组(P<0.05)。
DCM是糖尿病的重要慢性并发症之一,其主要病理改变有细胞外基质堆积、心肌纤维化、心肌肥厚及心肌重构[6]。其中,心肌间质纤维化是DCM心肌重构的主要标志,其通过降低心脏顺应性,导致心脏收缩及舒张功能障碍[7]。糖尿病心肌重构的发病机制较为复杂,是糖尿病心脏病变导致心力衰竭的重要原因,具体机制仍不很清楚,但有研究发现其发生、发展与MMPs有关[8]。
在衰竭心脏中,正常胶原组织被升高的MMPs降解后,被缺乏连接结构的纤维性间质取代,从而导致室壁变薄,左室扩张。因此,抑制MMPs的活性,减少正常心肌胶原的破坏可预防逆转心室重构。MMPs是一大类锌依赖性内肽酶家族,在结构上具有同源性,并能有效降解心肌细胞外基质,MMPs家族中MMP-2在心肌组织中表达水平较高,是心肌内抗纤维化的重要成分之一[9]。MMP-2是明胶酶,可降解明胶、纤维黏连蛋白、层连蛋白及IV、V型胶原,还能启动纤维性胶原裂解过程。有报道MMP-2改变早于左室重构,其活性改变可能触发左室重构。糖尿病大鼠心肌病变出现后早期MMP-2的活性和蛋白含量均增加,并可持续高表达。已有研究发现,MMP-2表达水平的降低参与了糖尿病大鼠心肌重构的进程[10]。大鼠给药治疗12周后,对每组大鼠心肌MMP-2表达进行Immunohistochemistry与Western blot检测发现,DM组的MMP-2表达明显升高,与DM组相比,3个治疗组MMP-2的表达均明显降低(P<0.01),其中联合用药组的两种蛋白表达最低(P<0.01)。
心脏中的胶原成分对于维持心脏的形态、保证心肌细胞的规律性排列及心脏的有效收缩、舒张起主要作用,这种胶原形成的网络是心脏的支架性结构[11-12]。心肌纤维化导致的心室重构可定义为胶原浓度明显升高或胶原容积分数明显高于正常。DCM大鼠中,CVF明显增加,反映心肌已纤维化。各给药组中CVF明显降低,而联合用药组CVF较单独用药组明显降低,提示联合应用灵芝多糖与二甲双胍的效果要优于单独使用。DCM导致的心室重构后,心肌细胞坏死,原有的胶原网络结构遭到破坏。心肌的收缩和舒张功能受损,血流动力学发生了改变[13]。本实验结果显示,与正常对照组相比,糖尿病组的LVEDP明显上升(P<0.01),LVSP、dp/dtmax和-dp/dtmax均明显下降(P<0.01),提示糖尿病大鼠心脏的收缩功能和舒张功能都出现了异常。使用药物治疗后能改善糖尿病大鼠心脏的血流动力学,尤其是联合使用灵芝多糖与二甲双胍能明显降低LVEDP,升高LVSP、dp/dtmax和-dp/dtmax,改善大鼠心肌舒缩功能,对心室重构发挥保护作用。
本研究结果显示,联合应用灵芝多糖和二甲双胍在改善2型糖尿病大鼠模型心肌重构方面明显优于单用,可能与调节心肌胶原容积分数,改善心肌血流动力学及下调心肌MMP-2的表达有关。在总的治疗药物剂量不变的情况下,联合应用两种药物可减少单药剂量,本研究中联合应用灵芝多糖与二甲双胍,减少了两药的剂量,同时也降低了两种药物剂量过大对降血糖可能带来的副作用。本研究结果提示,联合使用灵芝多糖和二甲双胍可能会成为今后临床治疗糖尿病心血管疾病的一个新的方向。有关MMP家族其他酶类,以及基质金属蛋白酶抑制剂(TIMPs)与MMP的平衡对心肌重构的影响是本课题后续的进一步研究,同时也进一步研究两种药物在临床上的适宜剂量及可能产生的副作用。
| [1] | 刘丽华, 房彩霞, 邓永贵, 等. JNK信号通路介导高糖诱导的大鼠心肌成纤维细胞[J]. 基础医学与临床, 2013, 33 (1) : 200-1 . Liu L H, Fang C X, Deng Y G, et al. C-JUN N-terminal kinase pathway mediates high glucose-induced proliferation of cardiac fibroblasts in rats[J]. Basic Clin Med, 2013, 33 (1) : 200-1 . |
| [2] | Kim H E, Dalal S S, Young E, et al. Disruption of the myocardial extracellular matrix leads to cardiac dysfunction[J]. J Clin Invest, 2010, 16 (1) : 857-66 . |
| [3] | Huang S Q, Li J W, Li Y Q, Wang Z. Purification and structural characterization of a new water-soluble neutral polysaccharide GLP-F1-1 from Ganoderma lucidum[J]. Int J Biol Macromol, 2011, 48 (1) : 165-9 doi:10.1016/j.ijbiomac.2010.10.015. |
| [4] | Xiao H, Ma X, Feng W, et al. Metformin attenuates cardiac fibrosis by inhibiting the TGF-β-Smad3 signalling pathway[J]. Cadiovasc Res, 2010, 87 (3) : 504-13 doi:10.1093/cvr/cvq066. |
| [5] | 乔进, 窦志华, 吴锋, 等. 灵芝多糖联合二甲双胍对2型糖尿病大鼠心肌AGEs及CTGF的影响及其机制[J]. 中国药理学通报, 2014, 30 (4) : 536-41 . Qiao J, Dou Z H, Wu F, et al. Effect of combination of ganoderma lucidum polysaccharide and metformin on AGEs and CTGF of cardiac muscle in type 2 diabetic rats and the mechanism[J]. Chin Pharmacol Bull, 2014, 30 (4) : 536-41 . |
| [6] | Trachanas K, Sideris S, Aggeli C, et al. Diabetic cardiomyopathy:from pathophysiology to treatment[J]. Hellenic J Cardiol, 2014, 55 (5) : 411-21 . |
| [7] | 王栋栋, 何素梅, 张冠英, 等. 大黄游离蒽醌对糖尿病大鼠心肌纤维化的作用[J]. 中国药理学通报, 2015, 31 (4) : 509-13 . Wang D D, He S M, Zhang G Y, et al. Effect of FAR on myocardial fibrosis of diabetic rats[J]. Chin Pharmacol Bull, 2015, 31 (4) : 509-13 . |
| [8] | 王岩, 郭永川, 梁前垒, 等. 参麦注射液对糖尿病心肌病大鼠心肌纤维化的干预作用及相关机制探讨[J]. 中国病理生理杂志, 2014, 30 (3) : 449-53 . Wang Y, Guo Y C, Liang Q L, et al. Intervention effect of Shen Mai injection on myocardial fibrosis in diabetic cardiomyopathy rats and its mechanism[J]. Chin J Pathophysiol, 2014, 30 (3) : 449-53 . |
| [9] | Peng J, Li X, Feng Q, et al. Anti-fibrotic effect of cordyceps sinensis polysaccharide:Inhibiting HSC activation, TGF-β1/Smad signaling, MMPs and TIMPs[J]. Exp Biol Med(Maywood), 2013, 238 (6) : 668-77 doi:10.1177/1535370213480741. |
| [10] | Hou J, Zheng D, Zhong G, et al. Mangiferin mitigates diabetic cardiomyopathy in streptozotocin diabetic rats[J]. Can J Physiol Pharmacol, 2013, 91 (9) : 759-63 doi:10.1139/cjpp-2013-0090. |
| [11] | 刘舒凌, 杨秀芬, 王乃平. 灯盏乙素对L-甲状腺素所致大鼠心肌肥厚的影响[J]. 中国实验方剂学杂志, 2013, 19 (3) : 201-4 . Liu S L, Yang X F, Wang N P. Effect of L- on cardiac hypertrophy induced by thyroid hormone in rats[J]. Chin J Exp Tradit Med Form, 2013, 19 (3) : 201-4 . |
| [12] | 曹琼丹, 杨育红, 于胜男, 等. 黄芪甲苷对Ⅰ型糖尿病大鼠心肌细胞PGC-1α和NRF-1表达的影响[J]. 中国药理学通报, 2015, 31 (8) : 1096-101 . Cao Q D, Yang Y H, Yu S N, et al. Effect of astragaloside Ⅳ on expression of PGC-1α and NRF-1 in myocardial cells of type I diabetic rat[J]. Chin Pharmacol Bull, 2015, 31 (8) : 1096-101 . |
| [13] | 张华丽, 王蕾, 张世杰, 等. 坎地沙坦对兔左室射血分数保留心力衰竭模型心室重构及心功能的影响[J]. 临床急诊杂志, 2016, 17 (1) : 48-52 . Zhang H L, Wang L, Zhang S J, et al. Effects of candesartan on retention of rabbit left ventricular ejection fraction model of ventricular remodeling and cardiac function of heart failure[J]. J Clin Emerg, 2016, 17 (1) : 48-52 . |
