


短暂性脑缺血发作(TIA)是颈动脉或椎-基底动脉系统发生短暂性血液供应不足,引起局灶性脑缺血导致突发的、短暂性、可逆性神经功能障碍。近年大量研究表明,脑缺血/再灌注后引起线粒体功能障碍,包括氧自由基损伤、钙超载、线粒体膜电位的改变、线粒体通透性转换孔(mitochondrial permeability transition pore,MPTP)异常开放、线粒体结构损伤等[1]。线粒体是一种处于高度动态变化的细胞器,频繁的融合分裂形成网状结构,来维持其正常功能与形态,并参与细胞的能量代谢、自噬与凋亡等,这种动态的变化称为线粒体分裂融合(mitochondrial fission and fusion),也称为线粒体动力学(mitochondrial dynamics)[2]。因而,探讨脑缺血/再灌注后线粒体分裂融合的改变,即线粒体动力学异常,以及寻找干预手段,抑制线粒体分裂融合失衡,恢复其正常功能与形态,对脑缺血/再灌注后的治疗具有重要意义。西红花苷(crocin)是中药西红花的提取物之一,由西红花酸(crocetin)与二分子龙胆二糖结合而成,包括西红花苷Ⅰ与西红花苷Ⅱ,又称为西红花素、藏红花素,是一类水溶性的类胡萝卜素,二者都属于二萜类,其在中枢神经系统、心血管系统以及抗肿瘤方面的研究非常广泛。实验表明,西红花苷可以提高大鼠的空间认知能力[3],明显提高海马区SOD、GPx、谷胱甘肽还原酶(GR)等抗氧酶的活性[4],并且西红花苷能有效抑制GRK-2的转运,降低ERK1/2的磷酸化[5],以抑制脑梗、脑缺血等造成的大鼠脑部损伤。本研究以SH-SY5Y细胞OGD模型,模拟脑缺血神经细胞损伤,观察线粒体形态的改变及线粒体分裂融合的异常,并从抑制线粒体动力学异常的角度探讨治疗脑缺血/再灌注、改善记忆障碍的可能机制,对相关中药治疗脑缺血疾病具有借鉴意义。
1 材料与方法 1.1 材料与仪器人神经母细胞瘤细胞SH-SY5Y购自中国医学科学院;DMEMF12培养基(31600-034)、胰酶(0458)、优级胎牛血清购自Gibco公司;DMSO(D-5879)购自Sigma公司;MTT购自东仁化学科技有限公司;JC-1荧光探针购自Sigma公司;Fluo3荧光探针、BCA蛋白定量试剂盒、RIPA裂解液(强)、PMSF均购自碧云天生物技术公司;Drp1抗体、COXIV抗体购自CST公司,Opa1抗体购自Santa Cruz公司;线粒体/胞质制备试剂盒购自普利莱基因技术有限公司;彩色蛋白Marker、ECL发光液购自Thermo公司;西红花苷(含西红花苷Ⅰ、西红花苷Ⅱ)购自北京世纪奥科生物技术有限公司,HPLC≥98%;MCO175 CO2培养箱(Sanyo);Sh1倒置显微镜(Olympus);SYNERGYTM4酶标仪(BioTek);IEC低温冷冻离心机(美国Thermo公司);奥豪斯AR2130型电子天平(美国)。
1.2 方法 1.2.1 细胞培养、OGD模型和给药SH-SY5Y细胞培养于DMEMF12培养基(含体积分数为10%胎牛血清,100 kU·L-1青霉素,100 mg·L-1链霉素),置于37℃,含5% CO2的细胞培养箱中培养,选取对数生长期细胞进行实验。弃去培养液,每孔或皿加入预先以95% N2~5% CO2混合气饱和15 min的无糖DMEM 200 μL或2 mL。将96孔板或35 mm培养皿敞盖,放入缺氧盒内,通入95% N2~5% CO2混合气,流速1 L·min-1。测氧仪实时监测出口氧气浓度,当氧气浓度为1%时,停止通气,夹闭进气管和出气管,将缺氧盒置于培养箱内,此过程为缺氧。夹闭进气管和出气管,并将缺氧盒置于细胞培养箱内4 h进行缺氧。复氧:打开缺氧盒,取出培养皿,吸出缺氧液,每孔或每皿加入200 μL或2 mL含糖DMEM,置培养箱内继续培养2 h。西红花苷均采用DMSO溶解,于缺氧同时给药。
1.2.2 细胞活力的测定将细胞浓度为6×105个每毫升接种于96孔培养板,24 h后换液,继续培养48 h后用于实验,药物剂量设置西红花苷:31.25、62.5、125、250、500 mg·L-1,均采用DMSO溶解。培养好的细胞,正常组加入无血清DMEM,其余组加入相应浓度DMSO或药物。药物作用24 h后,每孔加入MTT溶液100 μL,培养箱内孵育4 h,吸去MTT液,每孔加入DMSO 100 μL;将96孔板置于摇床上低速振荡10 min,使结晶物充分溶解后,酶标仪570 nm波长处检测OD值,同时确定药物最佳给药剂量。
1.2.3 流式对SH-SY5Y细胞线粒体膜电位(△Ψm)的测定将SH-SY5Y细胞以6×105个每毫升的浓度接种于6孔培养板,于缺氧初给药。各组细胞复氧2 h后,胰酶消化细胞约7~8 min,收集细胞,1 000 r·min-1离心5 min,弃上清;阳性对照管中,先以含有50 μmol·L-1 CCCPPBS重悬细胞,37℃,孵育5 min;1 000 r·min-1离心5 min,弃上清;PBS洗涤1次,1 000 r·min-1离心5 min,弃上清;各组细胞均以含2 μmol·L-1 JC-1的PBS重悬,调整细胞浓度为106个每毫升;37℃,5% CO2,孵育30 min;1 000 r·min-1离心5 min,弃上清;37℃预热的PBS清洗细胞1次,1 000 r·min-1离心5 min,弃上清;加入500 μL PBS轻轻混匀细胞,转移至测定管中;流式细胞仪检测:设置激发光488 nm,绿色荧光发射光为529 nm,红色荧光发射光为590 nm。
1.2.4 流式对SH-SY5Y细胞胞内钙离子浓度的测定将SH-SY5Y细胞以6×105个每毫升的浓度接种于6孔培养板,于缺氧初给药。胰酶消化细胞约7~8 min,收集细胞,1 000 r·min-1离心5 min,弃上清;各处理组细胞加入5 μmol·L-1的Fluo-3AM应用液200 μL重悬细胞,于37℃培养箱中避光孵育45 min;1 000 r·min-1离心5 min,弃上清;37℃预热的PBS清洗细胞1次,1 000 r·min-1离心5 min,弃上清;加入500 μL PBS轻轻混匀细胞,转移至测定管中;流式细胞仪检测:设置激发光488 nm,检测荧光强度,结果用相对值表示,钙离子相对荧光强度=FI测量值/FI溶剂对照。
1.2.5 免疫荧光对SH-SY5Y细胞胞内Drp1、Opa1蛋白表达的测定6孔板里铺上盖玻片,将细胞分在此六孔板上,待细胞密度达到50%~80%时即可做后续实验,细胞做OGD处理;PBS清洗,加入2 mL甲醇室温孵育30 min;封闭30 min,孵育目的蛋白,制好的片子4℃保存,在激光共聚焦显微镜下观察。
1.2.6 Western blot检测蛋白水平将SH-SY5Y细胞以每皿5×106的密度接种于9 cm培养皿中,收集各组细胞,加入蛋白裂解液提取总蛋白,按普利莱线粒体/胞质制备试剂盒说明书提取线粒体,裂解线粒体后,BCA法测定蛋白含量并定质量浓度至0.5 g·L-1,进行蛋白表达检测。蛋白含量测定后,进行聚丙烯胺凝胶电泳(SD-SPAGE),采用相关抗体进行Western blot检测,增强化学发光(enhanced chemi-luminescence,ECL)。
1.2.7 统计学分析计量数据以x±s表示,采用SPSS进行数据处理,Western blot图像分析进行非参数检验。
2 结果 2.1 西红花苷对正常培养SH-SY5Y细胞活力的影响与正常组相比较,2% DMSO对正常培养的SH-SY5Y细胞活力没有影响。与2% DMSO对照组相比,西红花苷在31.25~62.5 mg·L-1范围对正常培养的SY-SY5Y细胞活力不产生影响,同时选定最佳浓度25及50 mg·L-1。见Tab 1。
| Group | Concentration/mg·L-1 | Cell viability/OD570 |
| Sham | - | 0.827±0.019 |
| 2% DMSO | - | 0.816±0.026 |
| 31.25 | 0.815±0.028 | |
| 62.5 | 0.775±0.012 | |
| Crocin | 125 | 0.617±0.012** |
| 250 | 0.461±0.047** | |
| 500 | 0.266±0.062** | |
| **P<0.01 vs 2% DMSO | ||
与正常组相比较,缺氧4 h/复氧2 h后,JC-1红绿荧光比值明显降低,表明SH-SY5Y细胞△Ψm明显降低(P<0.01 vs Sham);与模型组比较,西红花苷50 mg·L-1可明显阻止△Ψm降低(P<0.05或P<0.01 vs OGD),见Fig 1。
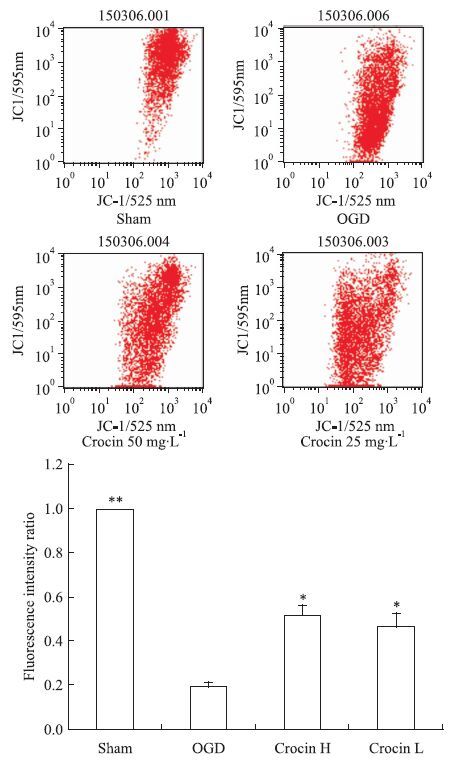
|
| Fig 1 Effect of crocin on △Ψm of SH-SY5Y cell to OGD ( x±s,n=3) P<0.05,**P<0.01 vs OGD |
胞内钙离子浓度Ca2+荧光强度明显升高,与模型组相比,西红花苷预处理后细胞内Ca2+荧光强度降低,且差异有显著性(P<0.05,P<0.01 vs OGD),见Fig 2。
2.4 西红花苷升高Opa 1表达,降低Drp 1表达通过荧光显微镜可观察到,正常组SH-SY5Y细胞内Drp1表达量低,而Opa1荧光强度较高,而缺氧4 h/ 复氧2 h后,模型组细胞Drp1荧光强度较正常组升高,而Opa1荧光强度降低;与模型组比较,西红花苷50 mg·L-1能明显降低Drp1荧光强度(红色),增强Opa1荧光强度(绿色),如Fig 3所示。
2.5 西红花苷对SH-SY5Y细胞线粒体动力学相关蛋白表达的影响为进一步探西红花苷对OGD损伤SH-SY5Y细胞的线粒体保护作用机制,本实验通过免疫印迹的方法,观察SH-SY5Y细胞内蛋白Drp1、Opa1表达。结果显示,与正常组相比较,OGD损伤导致SH-SY5Y细胞Drp1蛋白表达明显增加,同时,Opa1蛋白表达量明显降低;与模型组比较,西红花苷50 mg·L-1能明显降低Drp1表达量,增高Opa1表达量(P<0.01,P<0.05 vs OGD),见Fig 4、5。
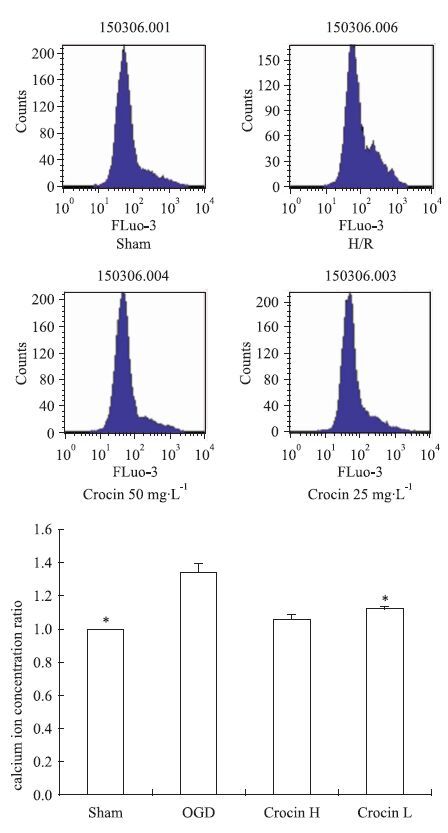
|
| Fig 2 Effect of crocin on intracellular calcium concentrations of SH-SY5Y cell to OGD ( x±s,n=3) P<0.05 vs OGD. |
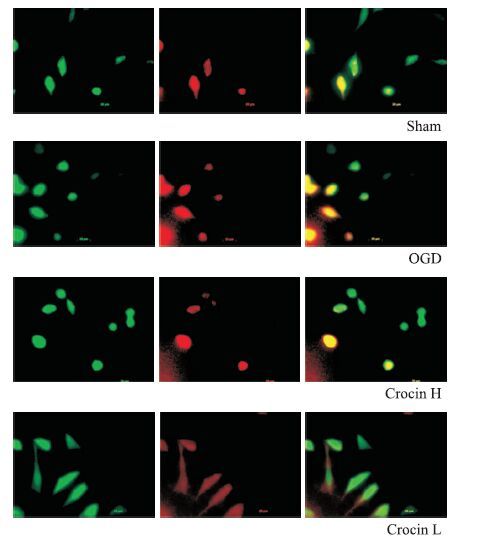
|
| Fig 3 Effect of crocin on expressions of Opa1 and Drp1 induced by OGD |
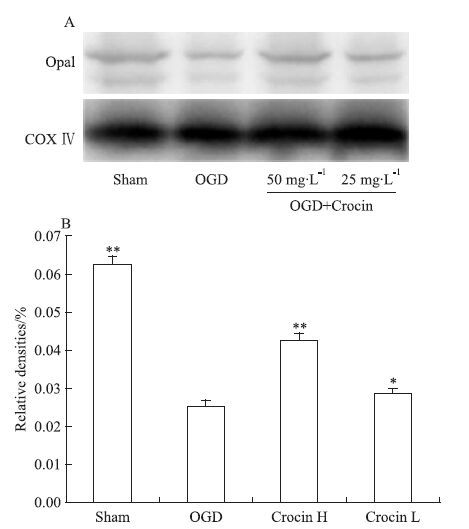
|
| Fig 4 Effect of crocin on expressions of Opa1 in SH-SY5Y cell induced by OGD ( x±s,n=3) A: Protein levels of Opa1; B: The protein levels quantified by band gray-value ratio to COXIV.P<0.05,**P<0.01 vs OGD |
线粒体融合分裂的动态平衡是神经元末梢长距离运输和能量平均分布的基本保证[6],对于神经元而言,线粒体的动力学过程具有非常重要的生物学意义。神经元的各项生物活动均需要消耗能量,而这些能量的供给几乎全部源于线粒体。当线粒体的结构和功能出现障碍时,尤其当线粒体氧化磷酸化过程发生障碍时,神经元不能像其他类型的细胞一样,启动糖酵解过程进行能量代偿,导致细胞内pH值下降而引起细胞酸中毒,线粒体膜电位下降。随着缺血时间的延长,线粒体自身结构与功能会受到严重损害,进而使细胞走向死亡之路。若能抑制线粒体动力学异常,进一步恢复线粒体形态,维持其正常功能,可能在脑缺血损伤早期起到保护神经元的作用。
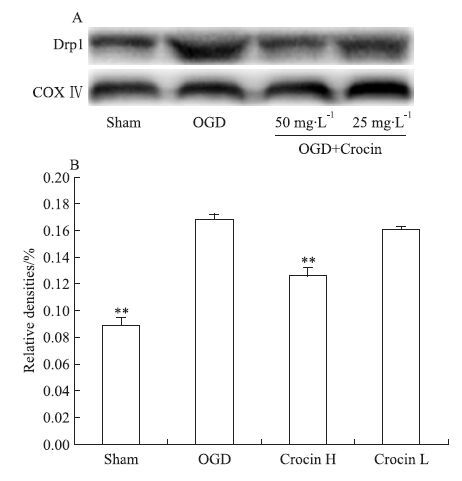
|
| Fig 5 Effect of crocin on expressions of Drp1 in SH-SY5Y cell induced by OGD ( x±s,n=3) A: Protein levels of Drp1; B: The protein levels quantified by band gray-value ratio to COXIV.**P<0.01 vs OGD. |
线粒体的动态变化过程受多个线粒体融合分裂相关蛋白精确控制,其中,线粒体外膜的融合依赖两种线粒体融合蛋白,即mitofusin 1(Mfn 1)和mitofusin 2(Mfn 2)。其主要功能是促进线粒体外膜的融合[7]。Mfn 1、Mfn 2的缺陷会导致线粒体融合障碍、出现大量碎片状线粒体。线粒体内膜的融合由视神经萎缩蛋白1(opticatrophy 1,OPA1)介导,除了参与线粒体融合的控制以外,OPA1对于线粒体嵴结构的维持非常重要,OPA1的缺失可导致因线粒体嵴重构,导致细胞色素C释放[8]。线粒体分裂由Drp1(dynamin-like protein1)和Fis1(fission1)调控,其中Drp1存在于胞质中,由Fis1招募至线粒体外膜,形成环状结构逐渐收缩致使线粒体分裂。实验证实,过表达Drp1分子可以加速线粒体的分裂,从而产生大量片段化的线粒体。线粒体分裂和融合都具有重要的生理作用,对维持健康的线粒体都非常关键。线粒体融合可使线粒体DNA维持正常结构防止突变,阻止细胞发生凋亡[9]。线粒体融合蛋白Opa1可对抗各种典型和非典型的凋亡刺激所诱导的凋亡反应 。线粒体分裂后,膜电位相对高的子线粒体发生融合,而膜电位相对低的子线粒体发生自噬,因此,线粒体融合似乎通过内容物的混合可使蛋白相互补充,代谢物均匀分配,突变DNA得以修复,保持细胞内线粒体的完整性和同质性[12]。而线粒体过度分裂即碎裂可能促进细胞凋亡[13]。本研究证实,SH-SY5Y细胞OGD后线粒体Drp1表达上升,Opa1表达下降,这二者的失衡标志着细胞内线粒体正常形态破坏,线粒体分裂融合失衡,因此,线粒体动力学异常可能在缺血性脑血管病的发病机制中具有重要作用。
已有的研究报道发现,西红花苷可降低脑缺血/再灌后脑梗死面积,对神经元具有保护作用[14],并能明显降低缺血皮层MDA(丙二醛)含量,提高GPx(谷胱甘肽过氧化物酶)和SOD(超氧化物歧化酶)活性[15]。从本研究看出,西红花苷可有效改善OGD损伤细胞后的能量代谢,恢复线粒体膜电位,降低胞内钙离子浓度;进一步实验观察到,西红花苷可以有效下调Drp1表达,上调Opa1表达。以上实验证实了西红花苷能改善OGD损伤SH-SY5Y细胞的能量代谢异常,而其改善能量代谢的途径是改善线粒体动力学异常,恢复线粒体正常的融合分裂。越来越多的研究证明,线粒体动力学异常参与诸多疾病的发展过程,因此,进一步探索脑缺血后线粒体分裂融合的变化及设立时间点寻找其变化规律,寻找相关药物作用靶点,对于防治缺血性脑血管病、促进脑缺血后神经发生及记忆的恢复具有一定意义。
( 致谢: 本实验在中国中医科学院西苑医院基础医学研究所由刘建勋老师、丛伟红老师、李澎老师指导下完成,感谢各位老师的帮助。 )
| [1] | 杨晴, 李新宇. 全脑缺血/再灌注致线粒体损伤的研究进展[J]. 医学综述, 2011, 11 : 1619-21 . Yang Q, Li X Y. Advances in mitochondrial injury Induced by complete cerebral ischemia-reperfusion[J]. Med Recap, 2011, 11 : 1619-21 . |
| [2] | Archer S L. Mitochondrial dynamics-mitochondrial fission and fusion in human diseases[J]. N Engl J Med, 2013, 369 (23) : 2236-51 doi:10.1056/NEJMra1215233. |
| [3] | Pitsikas N, Zisopoulou S, Tarantilis P A, et al. Effects of the active constituents of Crocus sativus L, crocins on recognition and spatial rats′memory[J]. Behav Brain Res, 2007, 183 (2) : 141-46 doi:10.1016/j.bbr.2007.06.001. |
| [4] | Ghadrdoost B, Vafaei A A, Rashidy-Pour A, et al. Protective effects of saffron extract and its active constituent crocin against oxidative stress and spatial learning and memory deficits induced by chronic stress in rats[J]. Eur J Pharmacol, 2011, 667 (1-3) : 222-9 doi:10.1016/j.ejphar.2011.05.012. |
| [5] | Zheng Y Q, Liu J X, Wang J N, Xu L. Effects of crocin on reperfusion-induced oxidative/nitrative injury to cerebral microvessels after global cerebral ischemia[J]. Brain Res, 2007, 1138 : 86-94 doi:10.1016/j.brainres.2006.12.064. |
| [6] | Sheng Z H, Cai Q. Mitochondrial transport in neurons: impact on synaptic homeostasis and neurodegeneration[J]. Nat Rev Neurosci, 2012, 13 (2) : 77-93 doi:10.1038/nrg3141. |
| [7] | Chen H, Detmer S A, Ewald A J, et al. Mitofusins Mfn1 and Mfn2 coordinately regulate mitochondrial fusion and are essential for embryonic development[J]. J Cell Biol, 2003, 160 (2) : 189-200 doi:10.1083/jcb.200211046. |
| [8] | Olichon A, Baricault L, Gas N, et al. Loss of OPA1 perturbates the mitochondrial inner membrane structure and integrity, leading to cytochrome c release and apoptosis[J]. J Biol Chem, 2003, 278 (10) : 7743-6 doi:10.1074/jbc.C200677200. |
| [9] | Chen H, Vermulst M, Wang Y E, et al. Mitochondrial fusion is required for mtDNA stability in skeletal muscle and tolerance of mtDNA mutations[J]. Cell, 2010, 141 (2) : 280-9 doi:10.1016/j.cell.2010.02.026. |
| [10] | Pellegrini L, Scorrano L. A cut short to death: Parl and Opa1 in the regulation of mitochondrial morphology and apoptosis[J]. Cell Death Differ, 2007, 14 (7) : 1275-84 doi:10.1038/sj.cdd.4402145. |
| [11] | Jahani-Asl A, Pilon-Larose K, Xu W, et al. The mitochondrial inner membrane GTPase, optic atrophy 1(Opa1), restores mitochondrial morphology and promotes neuronal survival following excitotoxicity[J]. J Biol Chem, 2011, 286 (6) : 4772-82 doi:10.1074/jbc.M110.167155. |
| [12] | Twig G, Elorza A, Molina A J, et al. Fission and selective fusion govern mitochondrial segregation and elimination by autophagy[J]. EMBO J, 2008, 27 (2) : 433-46 doi:10.1038/sj.emboj.7601963. |
| [13] | Karbowski M, Lee Y J, Gaume B, et al. Spatial and temporal association of Bax with mitochondrial fission sites, Drp1, and Mfn2 during apoptosis[J]. J Cell Biol, 2002, 159 (6) : 931-8 doi:10.1083/jcb.200209124. |
| [14] | Sarshoori J R, Asadi M H, Mohammadi M T. Neuroprotective effects of crocin on the histopathological alterations following brain ischemia-reperfusion injury in rat[J]. Iran J Basic Med Sci, 2014, 17 (11) : 895-902 . |
| [15] | Vakili A, Einali M R, Bandegi A R. Protective effect of crocin against cerebral ischemia in a dose-dependent manner in a rat model of ischemic stroke[J]. J Stroke Cerebrovasc Dis, 2014, 23 (1) : 106-13 doi:10.1016/j.jstrokecerebrovasdis.2012.10.008. |
