


2. 中国人民解放军白求恩国际和平医院药学部,河北 石家庄 050082
2. Dept of Pharmacy, Bethune International Peace Hospital of PLA, Shijiazhuang 050082,China
阿尔茨海默病(Alzheimer’s disease,AD)又称早老性痴呆,是继心脑血管疾病及癌症后,老年人健康的第三大隐患。AD发病机制尚不明确,主要包括Aβ损伤学说[1],Tau蛋白异常修饰学说 以及炎症级联学说[4]等,其中Aβ作为始动因子的观点得到最广泛认可[5]。Aβ在AD发生过程中发挥至关重要的作用,因此减轻Aβ的损伤作用是治疗AD的策略之一。人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)主要存在于脐带华通氏胶中,具有采集方便、来源丰富、免疫原性低、分化潜能大、不存在伦理道德争议等优点[6],是干细胞治疗领域中极具应用前景的种子细胞。已有研究显示,hUCMSCs可分化为胆碱能样神经元[7],且具有改善学习记忆能力的作用[8],但其机制尚不完全明确。本研究通过组织块培养法从人脐带中分离培养hUCMSCs,通过脑立体定位法给予AD样学习记忆障碍模型大鼠侧脑室注射hUCMSCs,通过Morris水迷宫观察hUCMSCs对Aβ损伤大鼠学习记忆能力的影响,并探讨脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)及神经生长因子(nerve growth factor,NGF)在hUCMSCs对抗Aβ神经损伤中的作用。
1 材料与方法 1.1 材料 1.1.1 实验动物及脐带样本Sprague-Dawley(SD)大鼠,♂,体质量210~230 g,清洁级,由河北省实验动物中心提供 。实验动物饲养于清洁级环境,环境温度23 ℃~25 ℃,自由进食进水。饲养7 d适应环境后用于实验。实验过程对动物的处置符合动物伦理学要求。人脐带样本,长约20 cm,取自石家庄市第三医院妇产科足月健康胎儿,经伦理委员会批准,产妇及家属知情同意。
1.1.2 实验试剂及实验仪器Aβ25-35、0.25%胰蛋白酶/EDTA消化液(Sigma-Aldrich);DMED/F12培养基、胎牛血清(Hyclone); BDNF及NGF ELISA试剂盒(北京百奥莱博科技公司);脑立体定位仪(江湾Ⅰ型通用立体定位仪);牙科手钻(Strong Power Unit SSH-90);Morris水迷宫及图像分析系统(上海吉量软件科技公司);组织切片机、展片机、生物组织摊烤机(Leica);低温离心机(Thermo Fisher);光学显微镜(Olympus);酶标仪(TECAN)。
1.2 方法 1.2.1 实验分组及取材实验分5组,分别为:空白对照组(control,con)、Aβ溶剂对照组(v-con)、人脐带间充质干细胞对照组(hUCMSCs-con)、Aβ损伤组(injury)、人脐带间充质干细胞治疗组(hUCMSCs)。空白对照组大鼠不做任何处理,Aβ对照组大鼠海马注射5 μL灭菌水,人脐带间充质干细胞对照组大鼠侧脑室注射10 μL PBS,Aβ损伤组大鼠海马注射5 μL Aβ溶液。hUCMSCs治疗组于Aβ损伤后1 d侧脑室注射(坐标定位:AP:1.0 mm,DV:4.5 mm,±1.5 mm)10 μL悬浮于PBS的hUCMSCs(2×105个)。术后7~12 d进行Morris水迷宫行为学测试,观察大鼠空间学习记忆能力。行为学测试结束后,部分动物经多聚甲醛心脏灌流进行预固定,取脑组织制备病理切片,硫堇尼氏体染色进行组织病理学分析。其余动物断头取脑,冰浴分离海马组织,-20 ℃冻存备ELISA分析。
1.2.2 人脐带间充质干细胞分离、培养无菌条件下收集足月产胎儿的脐带并储存于0.9%的无菌生理盐水中。在超净工作台内用PBS洗去脐带中残余血液并剪为3~4 cm的小段。沿纵轴剖开脐带,暴露并剔除脐动脉和脐静脉,分离脐带基质即华尔通胶,将其剪为(0.5~1.0) mm3的组织块。采用组织块培养法,加入含10%胎牛血清、100 kU·L-1青霉素、100 mg·L-1链霉素的DMEM/F12培养基10 mL;置于37℃、饱和湿度、体积分数为5%的CO2的培养箱中培养。待细胞长至80%~90%汇合后吸弃组织块,细胞进行传代培养。取处于对数生长期的第3~4代细胞用于实验。0.25%胰酶/EDTA消化后PBS漂洗,重悬细胞并调整密度为2×105个每毫升。
1.2.3 Aβ所致学习记忆障碍大鼠模型的制备将1 mg Aβ25-35溶于0.5 mL蒸馏水中得2 g·L-1的Aβ25-35溶液,混匀、分装、-20 ℃冻存。用前将Aβ25-35溶液置于37 ℃孵育1周,使其老化、聚合。
动物经腹腔注射麻醉后,固定于脑立体定位仪,沿颅骨中线切开皮肤,暴露前囟。参照图谱海马CA1区位置,于前囟后3.5 mm,中线左右2.0 mm处,开直径1 mm的骨窗,垂直颅骨表面进针2.7 mm,两侧分别缓慢注射5 μL(2 g·L-1)Aβ溶液,留针10 min使注射物充分扩散,缓慢撤针,缝合切口。Aβ溶剂对照组注射等体积灭菌水。
1.2.4 行为学测试术后7~12 d于实验开始前将动物置于行为学测试房间,使其适应环境1 h。行为学测试于每天14 ∶ 30开始,室温25 ℃,水温22 ℃~24 ℃,动物测试顺序保持不变,测试开始象限随机选取。Morris水迷宫行为学测试历时6 d,前5 d进行定位航行实验(the navigation trial),每天训练4次。记录大鼠入水至寻找到隐匿平台所需的时间,即逃避潜伏期(escape latency)。d 6进行空间探索实验(the probe trial),撤去平台,将大鼠从平台相对的象限面壁放置入水,记录动物90 s内穿越平台区的次数(number of platform crossings)以及在平台所在象限(第4象限)停留的时间百分比(Ⅳ time ratio)等行为学指标。
1.2.5 组织病理学分析预固定的脑组织经4%多聚甲醛固定至少48 h,石蜡包埋,常规脑组织切片(5 μm),硫堇尼氏体染色观察海马组织学改变。每张切片随机选取CA1区3个400倍视野,计数海马CA1区每1 mm区段内细胞膜完整、胞核饱满、核仁清晰的锥体细胞数目,每张切片海马各计数3个区段取平均数。
1.2.6 ELISA分析冰浴分离大鼠双侧海马组织,PBS匀浆后低温离心并取上清,按照试剂盒说明进行操作,450 nm处测定吸光度值(D450)。将D450代入标准曲线所得的直线回归方程,即得BNDF及NGF的含量。
1.2.7 统计学处理各组数据以x±s表示,实验数据通过SPSS 13.0统计软件进行处理。水迷宫行为学测试定位航行实验数据采用重复测量进行方差分析,其他数据比较采用单因素方差分析继以LSD post hoc test进行统计分析。
2 结果 2.1 脐带间充质干细胞原代培养及传代、增殖后细胞形态学观察原代培养3~5 d即有细胞从组织块边缘游出,围绕组织块向外生长(Fig 1A)。10 d左右细胞形态较为均一,呈长梭形放射状或旋涡状排列生长(Fig 1B)。2周左右细胞生长至80%~90%融合后以1 ∶ 3的比例进行传代。传代后细胞迅速贴壁,接种后约24 h即伸展为纺锤形,3~5 d增长趋势最为明显,4~5 d即可达80%~90%融合,镜下呈紧密的漩涡样或放射样排列(Fig 1C)。
|
| Fig 1 Morphology of human umbilical cord mesenchymal stem cells (×400) A:Morphology of adherent cells from Wharton’s jelly on day 5 of primary culture; B:Morphology of adherent cells from Wharton’s jelly on day 10 of primary culture;C:Morphology of adherent cells from umbilical cord on day 5 of third passage. |
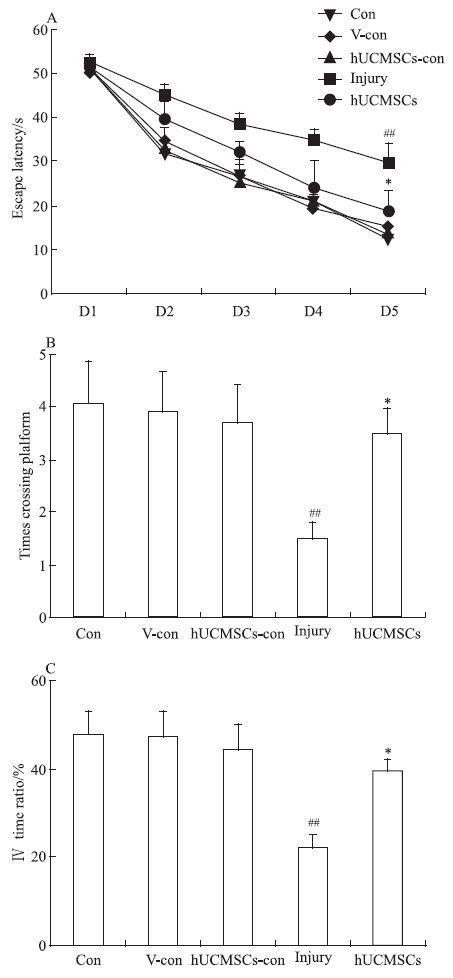
定位航行实验结果显示,空白对照组、Aβ溶剂对照组及人脐带间充质干细胞对照组大鼠学习成绩差异无统计学意义。Aβ损伤组大鼠逃避潜伏期(53.1±1.9、45.1±2.8、38.8±2.4、35.3±2.5、29.9±4.6;d1~d5)较Aβ溶剂对照组(50.8±2.3,34.8±3.1,26.7±2.9,19.9±3.1,15.1±1.7;d1~d5)明显增加(P<0.01,Fig 2A),人脐带间充质干细胞可逆转Aβ损伤大鼠逃避潜伏期增加的现象(P<0.05)。
|
| Fig 2 Effect of hUCMSCs on spatial learning and memory of Aβ treated rats in the Morris water maze behavioral task A: Effect of hUCMSCs on rat’s mean escape latency in navigation trials of the Morris water maze(MWM) behavioral task on different days; B:Effect of hUCMSCs on rat’s numbers of platform crossings in probe trial of MWM behavioral task;C:Effect of hUCMSCs on rat’s Ⅳ time ratio in probe trial of MWM behavioral task. The data were presented as ±s,n=10 in each group.##P<0.01 vs vehicle-control group;P<0.05 vs injury group. |
空间探索实验结果显示,空白对照组、Aβ溶剂对照组及人脐带间充质干细胞对照组大鼠的平台区穿越次数及平台所在象限(第4象限)停留时间百分比差异无统计学意义。Aβ损伤组大鼠穿越平台区的次数及在平台所在象限(第4象限)停留时间百分比均明显减少,分别为Aβ溶剂对照组的38.5%(P<0.05)及47.8%(P<0.01)。人脐带间充质干细胞逆转Aβ损伤大鼠平台区穿越次数及平台所在象限(第4象限)停留时间百分比减少的现象,其平台区穿越次数分别为Aβ损伤组的233.3%(P<0.05);平台象限(第4象限)停留时间百分比分别为Aβ损伤组的174.9%(P<0.05)(Fig 2B,C)。
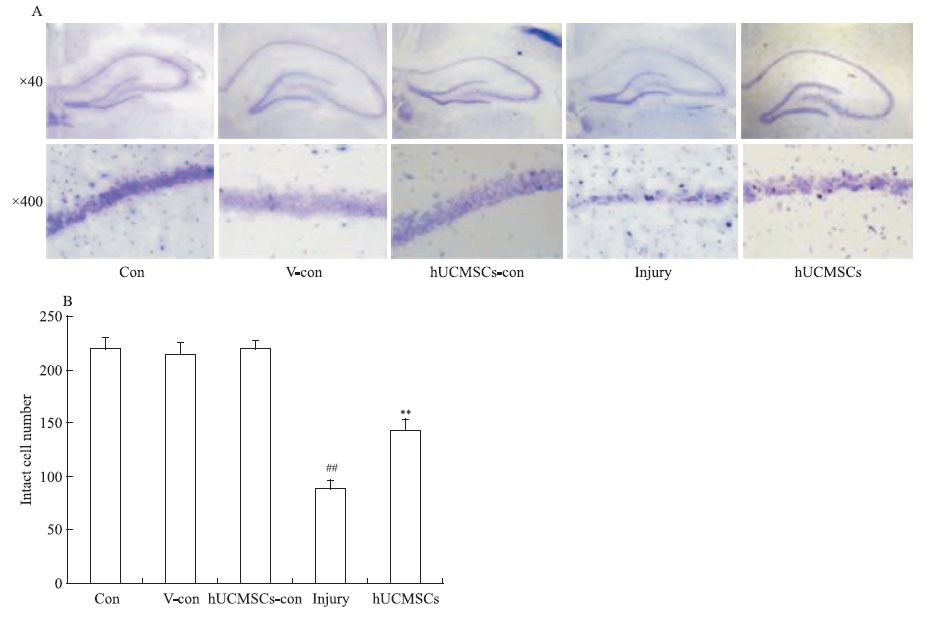
2.3 人脐带间充质干细胞对Aβ损伤大鼠海马CA1区神经元形态及数量的影响硫堇尼氏体染色显示,空白对照组、Aβ溶剂对照组及人脐带间充质干细胞对照组大鼠海马CA1区的神经元有3~4层,排列整齐;细胞形态清晰、完整,可见细胞有大量突起;尼氏体呈紫色,含量丰富;细胞核呈圆形,不着色,边缘光滑;核仁(2~3个)深染、清晰、居中。Aβ损伤组大鼠海马CA1区细胞层数减少,排列松散、紊乱;神经元失去原有细胞形态,可见不完整的胞体和断裂的突起,尼氏体减少(Fig 3A),人脐带间充质干细胞移植可对抗Aβ引起的海马神经元损伤。增加海马CA1区存活细胞数。
|
| Fig 3 Effect of hUCMSCs on pyramidal cells in CA1 hippocampus of Aβ treated rats A: Histological examination of CA1 hippocampus stained with thionin for Nissl body;B: Effect of hUCMSCs on the number of intact pyramidal cells (per 1 mm linear length of the same section of CA1 region). The data were presented as ±s,n=5 in each group.##P<0.01 vs vehicle-control group;**P<0.01 vs injury group. |
细胞计数结果显示,空白对照组,Aβ溶剂对照组及人脐带间充质干细胞对照组大鼠海马CA1区完整锥体细胞数差异无统计学意义;Aβ损伤组大鼠海马CA1区完整锥体细胞数明显减少(P<0.01,Fig 3B),为Aβ溶剂对照组完整锥体细胞数的41.7%;人脐带间充质干细胞治疗组大鼠海马CA1区完整锥体细胞数为Aβ损伤大鼠的161.2 %(P<0.01)。
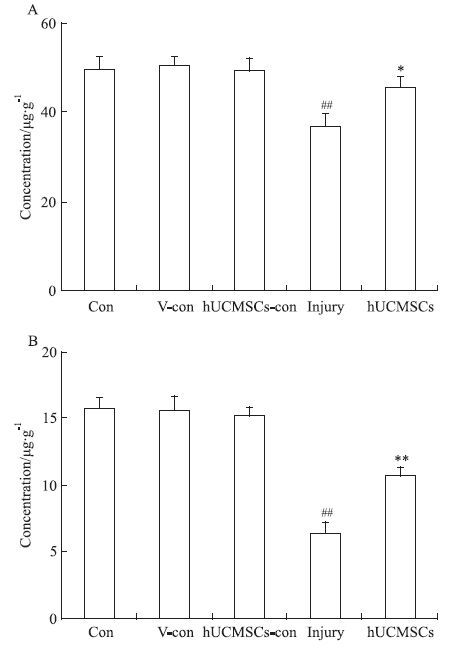
2.4 人脐带间充质干细胞对Aβ损伤大鼠海马组织中神经营养因子含量的影响ELISA结果显示,空白对照组,Aβ溶剂对照组及人脐带间充质干细胞对照组大鼠海马组织内有基础量的BDNF及NGF表达。Aβ损伤大鼠海马组织内二者表达量明显降低(P<0.01),分别为Aβ溶剂对照组的73.3%及41.4%。人脐带间充质干细胞治疗组大鼠海马组织内二者表达较Aβ损伤大鼠明显增加,分别为Aβ损伤大鼠的123.6%(P<0.05)及165.0%(P<0.01,Fig 4)。
|
| Fig 4 Effect of hUCMSCs on expression of BDNF and NGF in hippocampus of Aβ treated rats The levels of BDNF(A) and NGF(B) were detected by ELISA. Values were presented as ±s,n=5 in each group. ##P<0.01 vs vehicle-control group; P<0.05,**P<0.01 vs injury group. |
随着社会老龄化的加速,对AD的预防和治疗不仅为医学界所重视,同时也倍受全社会的关注[9]。干细胞以其独特优势为AD等神经退行性疾病的治疗提供了新视角及思路 。本实验通过双侧海马CA1区定位注射Aβ建立AD样学习记忆损伤大鼠模型,采用组织块培养法从人脐带中分离培养hUCMSCs,通过脑立体定位法给予模型大鼠侧脑室注射hUCMSCs。研究结果显示,hUCMSCs可改善Aβ损伤大鼠的空间学习记忆能力,对抗Aβ对大鼠海马CA1区锥体细胞的损伤作用,增加Aβ损伤大鼠海马组织中神经营养因子NGF及BDNF的含量。促进NT表达发挥细胞保护作用可能是hUCMSCs改善Aβ损伤大鼠空间学习记忆能力的机制之一。
干细胞具有自我更新及多向分化的能力,可通过分泌外源性细胞因子改善损伤局部的微环境,促进神经结构的重建;或通过整合于中枢神经系统内补充或替代受损细胞,直接参与神经系统的重建 。动物研究显示,hUCMSCs可通过抑制氧化应激,抑制炎症因子表达,减少Aβ沉积等方式改善AβPP/PS1小鼠的认知功能 。神经营养因子是机体产生的具有促进神经细胞存活、生长、分化的多肽或蛋白质,主要包括最早发现的NGF、脑内分布最广泛的BDNF等。关于AD患者脑组织及血清中神经营养因子含量变化的流行病学调查结果不尽 一致 。鉴于hUCMSCs表达多种神经营养因子[19],考虑其神经保护作用与分泌神经营养因子有关。hUCMSCs分泌的神经营养因子可以直接发挥神经保护作用,也可以通过促进神经干细胞存活、增殖、分化间接发挥保护作用[20]。本室前期研究已证实,体外培养的hUCMSCs在模拟脑组织微环境中可向神经样细胞定向分化[21];另有研究发现双侧海马注射由hUCMSCs诱导分化成的神经样细胞1周后并未检测到存活的移植细胞,但BDNF含量仍保持高水平,证实hUCMSCs分化成的神经样细胞亦具有分泌或促进NT分泌的作用[22]。本研究结果显示hUCMSCs增加海马组织中BDNF及NGF的含量,减轻Aβ对锥体神经元的损伤,改善Aβ损伤大鼠空间学习记忆能力,但实验中NT含量的升高是hUCMSCs分泌或是hUCMSCs及其他神经细胞共同分泌的结果还需进一步验证。
( 致谢: 本研究在中国人民解放军白求恩国际和平医院药学部实验室完成,实验由文章作者及实验所在科室研究生共同完成,在此感谢白求恩国际和平医院药剂科主任、临床药理室工作人员及在读研究生同学给予的帮助。 )
| [1] | Teich A F, Arancio O. Is the amyloid hypothesis of Alzheimer’s disease therapeutically relevant?[J]. Biochem J, 2012, 446 (2) : 165-77 . |
| [2] | 张蕊, 苑玉和, 赵明, 等. 细胞骨架与神经退行性疾病[J]. 中国药理学通报, 2011, 27 (8) : 1041-4 . Zhang R, Yuan Y H, Zhao M, et al. Cytoskeleton and neurodegenerative diseases[J]. Chin Pharmacol Bull, 2011, 27 (8) : 1041-4 . |
| [3] | 冯利杰, 张瑾, 丁倩, 等. 自噬参与神经细胞中过表达tau和异常磷酸化tau蛋白的降解[J]. 中国药理学通报, 2015, 31 (3) : 356-62 . Feng L J, Zhang J, Ding Q, et al. Autophagy involved in overexpressed tau and okadaic acid-induced hyperphosphorylated tau degradation[J]. Chin Pharmacol Bull, 2015, 31 (3) : 356-62 . |
| [4] | 王灿茂, 程玉芳, 吴金刚, 等. 新型PDE4抑制剂Roflupram改善阿尔茨海默病大鼠的认知障碍及神经炎症[J]. 中国药理学通报, 2015, 31 (3) : 327-33 . Wang C M, Cheng Y F, Wu J G, et al. The new PDE4 inhibitor Roflupram ameliorated cognitive deficits and neuroinflammation in a rat model of Alzhemer’s disease[J]. Chin Pharmacol Bull, 2015, 31 (3) : 327-33 . |
| [5] | Hardy J, Selkoe D J. The amyloid hypothesis of Alzheimer’s disease: progress and problems on the road to therapeutics[J]. Science, 2002, 297 (5580) : 353-6 doi:10.1126/science.1072994. |
| [6] | Secco M, Zucconi E, Vieira N M, et al. Multipotent stem cells from umbilical cord: cord is richer than blood[J]. !Stem Cells, 2008, 26 (1) : 146-50 doi:10.1634/stemcells.2007-0381. |
| [7] | Liang J, Wu S, Zhao H, et al. Human umbilical cord mesenchymal stem cells derived from Wharton’s jelly differentiate into cholinergic-like neurons in vitro[J]. Neurosci Lett, 2013, 532 : 59-63 doi:10.1016/j.neulet.2012.11.014. |
| [8] | Yang H, Yang H, Xie Z, et al. Systemic transplantation of human umbilical cord derived mesenchymal stem cells-educated T regulatory cellsimproved the impaired cognition in AβPPswe/PS1dE9 transgenic mice[J]. PLoS One, 2013, 8 (7) : e69129 doi:10.1371/journal.pone.0069129. |
| [9] | Prince M, Guerchet M, Prina M. World Alzheimer report 2013: Journey of caring: An analysis of long-term care for dementia [M]. London: Alzheimer’s Dis International, 2013, : 19 -20 . |
| [10] | 张喻, 肇玉明, 王晓良, 等. 干细胞治疗阿尔茨海默病的研究进展及挑战[J]. 中国药理学通报, 2015, 31 (7) : 889-94 . Zhang Y, Zhao Y M, Wang X L, et al. Advance and challenges in stem cell therapy for Alzheimer’s disease[J]. Chin Pharmacol Bull, 2015, 31 (7) : 889-94 . |
| [11] | 韩梅, 张文生, 李金凤, 等. 神经退行性或损伤性疾病防治的新视点-干细胞药物[J]. 中国药理学通报, 2008, 24 (7) : 841-4 . Han M, Zhang W S, Li J F, et al. A new insight and strategy of treatment and prevention for neurodegenerated or damaged disease-stem cell drugs[J]. Chin Pharmacol Bull, 2008, 24 (7) : 841-4 . |
| [12] | Fan X, Sun D, Tang X, et al. Stem-cell challenges in the treatment of Alzheimer’s disease: a long way from bench to bedside[J]. Med Res Rev, 2014, 34 (5) : 957-78 doi:10.1002/med.2014.34.issue-5. |
| [13] | 刘晓峰, 吴迪, 吴岩. 干细胞治疗阿尔茨海默病的现状及未来[J]. 中国组织工程研究, 2013, 17 (40) : 7132-7 . Liu X F, Wu D, Wu Y. Stem cells for the treatment of Alzheimer’s disease[J]. Chin J Tissue Engineer Res, 2013, 17 (40) : 7132-7 . |
| [14] | Yang H, Yue C, Yang H, et al. Intravenous administration of human umbilical cord mesenchymal stem cells improves cognitive impairments and reduces amyloid-beta deposition in an AβPP/PS1 transgenic mouse model[J]. Neurochem Res, 2013, 38 (12) : 2474-82 doi:10.1007/s11064-013-1161-6. |
| [15] | Michalski B, Fahnestock M. Pro-brain-derived neurotrophic factor is decreased in parietal cortex in Alzheimer’s disease[J]. Brain Res Mol Brain Res, 2003, 111 (1-2) : 148-54 doi:10.1016/S0169-328X(03)00003-2. |
| [16] | Durany N, Michel T, Kurt J, et al. Brain-derived neurotrophic factor and neurotrophin-3 levels in Alzheimer’s disease brains[J]. Int J Dev Neurosci, 2000, 18 (8) : 807-13 doi:10.1016/S0736-5748(00)00046-0. |
| [17] | 高广生, 徐书雯, 李东风. 散发性阿尔茨海默病患者血清脑源性神经营养因子的测定及临床意义[J]. 中国神经免疫学和神经病学杂志, 2008, 15 (1) : 30-2 . Gao G S, Xu S W, Li D F. Clinical significance of serum levels of brain-derived neurotrophic factor in patients of sporadic Alzheimer’s disease[J]. Chin J Neuroimmunol Nuerol, 2008, 15 (1) : 30-2 . |
| [18] | 王子玫, 胡雅儿. 脑源性神经营养因子与阿尔茨海默病的关系[J]. 上海第二医科大学学报, 2004, 24 (10) : 866-9 . Wang Z M, Hu Y E. Brain-derived neurotrophic factor and Alzheimer’s disease[J]. Acad J Shanghai Second Med Univ, 2004, 24 (10) : 866-9 . |
| [19] | 何远东, 王玉, 彭江. 人脐带间充质干细胞中神经营养因子的表达[J]. 中华神经医学杂志, 2012, 11 (5) : 438-42 . He Y D, Wang Y, Peng J. Expression of neurotrophic factors in human umbilical cord-derived mesenchymal stromal cells[J]. Chin J Neuromed, 2012, 11 (5) : 438-42 . |
| [20] | 孙勇, 侍坚, 陆佩华. 神经营养因子与神经干细胞[J]. 生理科学进展, 2002, 33 (4) : 313-6 . Sun Y, Shi J, Lu P H. Neurotrophic factors and neural stem cells[J]. Progr Physiolog Sci, 2002, 33 (4) : 313-6 . |
| [21] | Wang X, Wu H, Xue G, et al. Progesterone promotes neuronal differentiation of human umbilical cord mesenchymal stem cells in culture conditions that mimic the brain microenvironment[J]. Neural Regen Res, 2012, 7 (25) : 1925-30 . |
| [22] | Yang H, Xie Z, Wei L, et al. Human umbilical cord mesenchymal stem cell-derived neuron-like cells rescue memory deficits and reduce amyloid-beta deposition in an AβPP/PS1 transgenic mouse model[J]. Stem Cell Res Ther, 2013, 4 (4) : 76 doi:10.1186/scrt227. |

