


2. 苏州大学附属第一医院胎儿医学研究所、生殖医学中心,江苏 苏州 215006
2. Institute for Fetology & Reproductive Medicine Center, the First Affiliated Hospital of Soochow University,Suzhou Jiangsu 215006,China
大量研究表明胎儿宫内缺氧(prenatal hypoxia,PH)不仅会引起胎儿宫内生长受限,还会造成胎儿重要组织器官的发育不良,以及成年后的代谢异常[1]。我们以往的研究也表明:PH可引起子代成年后胰岛素敏感性降低和肝脏胰岛素信号通路异常,导致子代大鼠成年后非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)易感性增加[2]。肾素-血管紧张素系统(renin-angiotensin system,RAS)是一种重要的维持机体内环境稳态的激素内分泌系统,由血管紧张素原、肾素、血管紧张素转化酶(angiotensin-converting enzyme,ACE)、血管紧张素Ⅰ(angiotensinⅠ,AngⅠ)、血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)及其相应的受体AT1、AT2构成。近年来诸多研究报道RAS在胰岛素抵抗(insulin resistance,IR)发生和发展的多个环节中发挥重要作用[3],并可通过介导氧化应激诱发大鼠患非酒精性脂肪肝[4]。RAS阻断剂可提高机体胰岛素敏感性,有效逆转肝脏的脂肪沉积及其导致的炎症损伤[5]。RAS系统在胎儿期对机体组织器官的生长发育产生重要影响,胎儿期缺氧可通过RAS介导的“印迹”机制增加出生后个体心脑血管发病的危险性[6]。但PH是否亦可通过RAS系统改变以影响胎儿肝脏,目前国内外尚未见报道。本文在以往研究的基础上,观察了PH对子代大鼠血液循环系统和肝脏局部RAS的影响,探讨PH导致子代NAFLD易感性增加的可能机制,以期寻找药物早期干预的靶点。
1 材料 1.1 药品与试剂水合氯醛(国药集团化学试剂有限公司);EDTA(Sigma,美国);氮气、液氮(苏州长桥气体公司);AngⅠ、AngⅡ、ACE放免试剂盒(北京华英生物技术研究所);生理盐水(江苏鹏鹞药业有限公司)。
1.2 实验仪器Centrifuge 5417R高速冷冻离心机(德国Eppendorf公司);氧气含量监测仪(S-450,美国IST-AIM公司);Architect c8000全自动血液生化分析仪(美国Abbott公司);冰冻切片机(德国Leica公司);AH-2光学显微镜、数码相机(日本Olympus公司);r-911全自动放免计数仪(中国科技大学实业总公司生产)。
2 方法 2.1 建立动物模型及分组将♀♂大鼠以1 ∶ 1合笼,次日晨检测阴栓判断为妊娠时,记为妊娠d 1(GD 1),孕鼠随机分为对照组及缺氧组,每组10只。将缺氧组孕鼠于GD 4~21放入缺氧舱(体积:140L,O2含量(10±0.5)%,对照组放于氧含量正常的等体积饲养舱中饲养(O2含量21%)。GD 21行剖宫产,每窝随机取2只胎鼠,交予 “奶妈”母鼠正常喂养,其余胎鼠按母鼠妊娠期是否受缺氧刺激分为正常组(FC)和PH组(FH)。将子代成年大鼠分为4组,每组10只(♀♂各半):① 正常子代组(O-FC-C);② 宫内缺氧子代组(O-FH-C);③ 正常子代成年缺氧应激组(O-FC-H);④宫内缺氧子代成年缺氧应激组(O-FH-H)。5月龄后将成年后缺氧应激组给予短期缺氧刺激,方法同上,时间为7 d。动物处死前均称量体重。
2.2 血样采集及血浆制备对胎鼠采用断头取血法,将血样收集到含EDTA的抗凝试管中,1 000 r·min-1 4℃离心10 min,分离血浆。子代成年大鼠禁食不禁水10 h后,腹腔注射水合氯醛麻醉,腹主动脉取血,分离血浆,-20℃保存待检。
2.3 10%肝脏组织匀浆液制备分离完整的胎鼠及子代成年大鼠肝脏,称重,并计算肝重指数;肝重指数=肝重/体重。称取0.3 g肝组织加液氮研磨成细粉后,加入生理盐水至3 mL,充分混匀,1 000 r·min-1离心10 min,分离上清液,-20℃保存待检。
2.4 肝组织冰冻切片的制备及苏丹Ⅲ染色快速分离子代大鼠肝脏,切下直径约2 cm的肝组织(胎鼠取整个肝脏),放入-15℃冰箱冷冻。将已冷冻的组织放在组织支承器上,滴上包埋剂,冰冻,切出8 μm厚的冰冻切片,福尔马林中固定10 min,稍水洗后,用乙醇稍洗,苏丹III染液浸染2 min,乙醇洗去多余染液,继而流水冲洗。用苏木精染液复染细胞核,盐酸酒精分化,水洗10 min蓝化,把切片贴于载玻片上,甘油明胶封盖,光学显微镜下观察,拍照。
2.5 血浆及肝匀浆中总胆固醇(TC)和甘油三酯(TG)的检测将血浆和10%肝组织匀浆分别上全自动生化分析仪检测。
2.6 血浆及肝匀浆中AngⅠ、AngⅡ、ACE的检测由北京华英生物技术研究所用放免法代为检测。
2.7 统计方法应用SPSS13.0软件进行统计学处理,所有数据均采用x±s表示,采用两样本均数的One-Way ANOVA检验。
3 结果 3.1 PH对子代大鼠体重、肝重及肝重指数的影响FH组胎鼠较FC组体重、肝重及肝重指数均明显降低(P<0.05)。子代成年O-FC-C组与O-FH-C组之间体重、肝重及肝重指数均无差别。子代成年大鼠给予短期缺氧刺激后,O-FH-H组肝重指数较O-FH-C组明显升高(P<0.05),O-FH-H组大鼠肝脏重量及肝重指数明显高于O-FC-H组(P<0.01),见Tab 1。
| Group | Body weight/g | liver weight/g | body weight /liver weight |
| FC | 4.24±0.124 | 0.281±0.008 | 0.069±0.002 |
| FH | 3.38±0.121ΔΔ | 0.198±0.007ΔΔ | 0.056±0.001ΔΔ |
| O-FC-C | 374.9±11.45 | 9.63±0.19 | 2.58±0.07 |
| O-FH-C | 369.1±11.90 | 9.93±0.33 | 2.70±0.10 |
| O-FC-H | 367.8±12.57 | 9.66±0.27 | 2.64±0.06 |
| O-FH-H | 365.0±13.05 | 10.64±0.28 | 2.93±0.06**# |
| ΔΔP<0.01 vs FC;#P<0.05 vs O-FH-C;P<0.05,**P<0.01 vs O-FC-H | |||
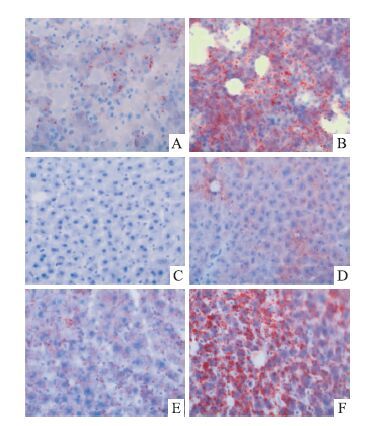
O-FC-C组大鼠的肝组织未见明显的红染脂滴,O-FH-C组和O-FC-H组大鼠的肝组织中见少量红染脂滴。O-FH-H组大鼠肝组织出现大量红染脂滴。GD21胎鼠,FC组肝组织中有少量红染脂滴。FH组胎鼠的肝组织结构松散,因而冰冻切片出现大块空斑,并见大量红染脂滴,见Fig 1。
3.3 PH对胎鼠和子代成年大鼠血浆及肝组织中TG、TC含量的影响子代成年大鼠各组间血浆中TG、TC含量均未见差异(P>0.05);FH组胎鼠与FC组比较,血浆中TG、TC含量也均未见差异(P>0.05)。子代成年大鼠各组间及FH组胎鼠与FC组之间,肝组织中TC含量也均未见差异(P>0.05)。TG含量,O-FH-C组和O-FC-H组大鼠与O-FC-C组相比虽有所增高,但差异均无统计学意义(P>0.05)。而O-FH-H组大鼠肝组织TG含量较O-FH-C组和O-FC-H组明显增高(P<0.05)。FH组胎鼠肝组织TG含量比FC组明显增高(P<0.01),见Tab 2。
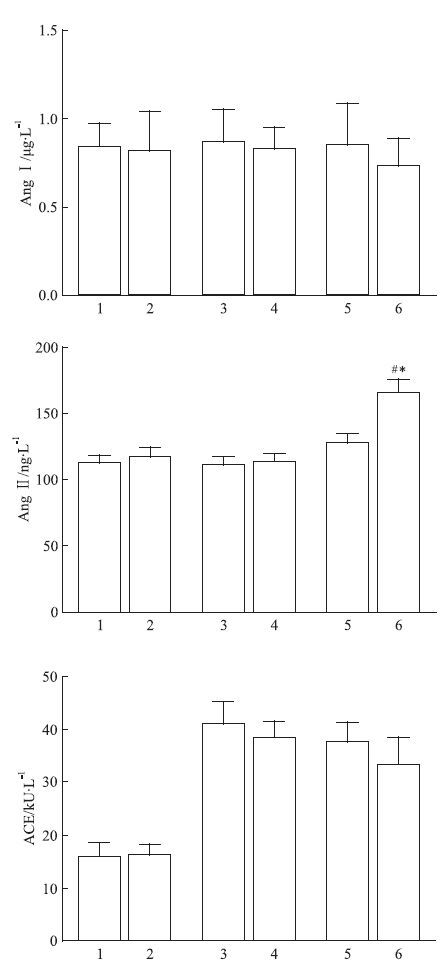
3.4 PH对子代大鼠血浆中AngⅠ、AngⅡ及ACE含量的影响两组胎鼠间血浆中无论是AngⅠ、AngⅡ,还是ACE的含量均未见差异;子代成年大鼠O-FH-C组与O-FC-C组两组相比,血浆中AngⅠ、AngⅡ和ACE含量也均无差异(P>0.05)。子代成年大鼠给予缺氧刺激后,血浆中AngⅠ和ACE含量未见改变;但AngⅡ含量升高,PH子代O-FH-H组大鼠 血浆中AngⅡ含量明显高于O-FC-H组和O-FH-C组(P<0.05),见Fig 2。
| Group | Plasma | Liver homogenate | |||
| TC/mg·L-1 | TG/mg·L-1 | TC/mg·L-1 | TG/mg·L-1 | ||
| FC | 663.0±26.7 | 17.8±0.8 | 0.28±0.07 | 3.29±0.18 | |
| FH | 594.0±20.5 | 18.9±1.2 | 0.21±0.05 | 5.86±0.67ΔΔ | |
| O-FC-C | 814.7±21.5 | 590.2±12.2 | 0.45±0.16 | 10.86±0.59 | |
| O-FH-C | 822.5±37.1 | 608.8±18.3 | 0.48±0.19 | 12.29±0.89 | |
| O-FC-H | 812.9±30.7 | 628.3±23.0 | 0.47±0.14 | 11.71±0.83 | |
| O-FH-H | 826.1±55.7 | 663.9±20.7 | 0.50±0.15 | 17.43±0.12#** | |
| ΔΔP<0.01 vs FC;#P<0.05 vs O-FH-C;**P<0.01 vs O-FC-H | |||||
|
| Fig 1 Light microscopic micrographs for liver tissues staining with Sudan Ⅲ A: FC; B:FH; C:O-FC-C; D:O-FH-C;E:O-FC-H;F:O-FH-H |
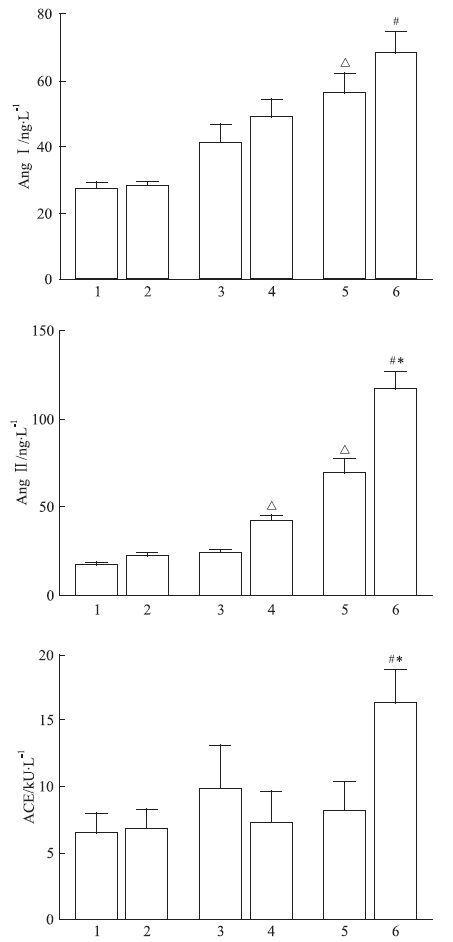
FH组胎鼠较FC组肝匀浆中AngⅡ含量有所增高,但差异无统计学意义(P>0.05),两组胎鼠肝匀浆中AngⅠ、ACE含量也均无差异。子代成年O-FH-C组大鼠肝组织中AngⅡ含量与O-FC-C组相比明显增高(P<0.05),AngⅠ、ACE含量虽有所不同,但两组差异无显著性(P>0.05)。子代成年大鼠给予缺氧刺激后,AngⅠ、AngⅡ含量较缺氧前明显升高(O-FC-H vs O-FC-C;O-FH-H vs O-FH-C);(P<0.05);O-FH-H组大鼠肝匀浆中AngⅡ含量较O-FC-H组明显增高(P<0.05),AngⅠ含量也有增高趋势,但差异无统计学意义(P>0.05);肝组织中ACE含量,O-FC-H组与O-FC-C组相比有所降低,但差异无显著性(P>0.05),O-FH-H组与O-FC-H组和O-FH-C组相比均明显增高(P<0.05),见Fig 3。
4 讨论妊娠期母体的多种疾患及环境因素都可引起胎儿宫内缺氧(PH) 。我们以往的研究结果表明:PH可造成子代成年后胰岛素敏感性降低和肝脏胰岛素信号通路异常,致使子代大鼠成年后NAFLD易感性增加[2]。本研究结果显示:PH胎鼠的体重、肝重及肝重指数均明显低于正常胎鼠,这说明PH不仅造成胎鼠的宫内生长受限,而且还抑制了其肝脏的生长发育。PH子代大鼠5月龄(成年)时,经过“追赶生长”,其与同龄正常子代体重、肝重及肝重指数差异均消失。这种“追赶生长”是在PH子代出生前特殊的代谢应答模式基础上完成的,它常伴有胰岛素及瘦素的抵抗、脂质水平改变[9],成为子代成年后NAFLD易感性增加的原因之一。
|
| Fig 2 Effect of prenatal hypoxia on plasma AngⅠ,AngⅡ and ACE concentration in fetus and offspring rats ( x±s,n=10) 1: FC; 2: FH; 3: O-FC-C; 4: O-FH-C; 5: O-FC-H; 6: O-FH-H.P<0.05 vs O-FC-H;#P<0.05 vs O-FH-C. |
|
| Fig 3 Effect of prenatal hypoxia on 10%(wt/vol) liver homogenate AngⅠ,AngⅡ and ACE concentration in fetus and offspring rats ( x±s,n=10) 1: FC; 2: FH; 3: O-FC-C; 4: O-FH-C; 5: O-FC-H; 6: O-FH-H.ΔP<0.05 vs O-FC-C;P<0.05 vs O-FC-H;#P<0.05 vs O-FH-C. |
肾素-血管紧张素系统(RAS)在血压、体液、电解质平衡中起重要作用。多种因素可促使肾小球旁器中的球旁细胞释放肾素,肾素作用于肝脏和脂肪组织产生的血管紧张素原,使其生成AngⅠ;AngⅠ在ACE作用下裂解转化为AngⅡ[10]。AngⅡ是RAS的关键因子[11]。以往认为 ,RAS是属于循环内分泌系统,后来诸多研究表明,在心、肾、肺、肝和胰腺中都存在着局部RAS,在这些组织中AngⅡ可以不释放到血液中,可通过自分泌、旁分泌或胞内分泌等方式局部发挥作用。近年来,研究者发现胰岛素信号与RAS之间存在着复杂的调控网络,并尝试用RAS调节剂来治疗和预防肝脏疾病。对循环系统及肝脏局部RAS的调控均有利于预防NAFLD和肝纤维化的发生[14]。本研究观察了PH对子代大鼠血液循环系统和肝脏中AngⅠ、AngⅡ及ACE含量的影响。结果显示:PH虽未表现出对胎鼠及子代成年的循环系统AngⅠ、AngⅡ及ACE含量的直接影响,但却对其成年后肝脏局部RAS产生了“印迹”效应,PH成年子代肝脏中AngⅡ含量均明显高于正常对照组。给予缺氧刺激后,PH子代成年大鼠机体RAS受到激活,且肝脏局部RAS的激活强于循环系统RAS。这说明PH不仅可造成子代成年大鼠肝脏的高AngⅡ状态,还可使成年子代的RAS在缺氧刺激后更易被激活。有研究报道:给成年大鼠输注AngⅡ可促进肝脏合成TG,进而增加血浆中TG含量[15],并可通过介导氧化应激损伤线粒体诱发大鼠患NAFLD[16]。这说明PH子代成年延续自胎儿期的肝脏高AngⅡ水平是PH增加子代脂肪肝易感性的机制之一。肝脏局部RAS可能是药物早期干预PH,导致子代NAFLD易感性增加的新靶点。
( 本实验在苏州大学附属第一医院胎儿医学研究所完成。感谢徐智策教授的指导与帮助! )
| [1] | Rueda-Clausen C F, Dolinsky V W, Morton J S, et al. Hypoxia-induced intrauterine growth restriction increases the susceptibility of rats to high-fat diet-induced metabolic syndrome[J]. Diabetes, 2011, 60 (2) : 507-16 doi:10.2337/db10-1239. |
| [2] | Cao L, Mao C, Li S, et al. Hepatic insulin signaling changes: possible mechanism in prenatal hypoxia-increased susceptibility of fatty liver in adulthood[J]. Endocrinology, 2012, 153 (10) : 4955-65 doi:10.1210/en.2012-1349. |
| [3] | Kalupahana N S, Moustaid-Moussa N. The renin-angiotensin system: a link between obesity, inflammation and insulin resistance[J]. Obes Rev, 2012, 13 (2) : 136-49 doi:10.1111/obr.2012.13.issue-2. |
| [4] | 张晓平, 张峰, 陆茵, 等. 肝纤维化中肾素-血管紧张素的作用研究进展[J]. 中国药理学通报, 2011, 27 (7) : 897-900 . Zhang X P, Zhang F, Lu Y, et al. Research progress on the role of renin-angiotensin system in hepatic fibrosis[J]. Chin Pharmacol Bull, 2011, 27 (7) : 897-900 . |
| [5] | Toblli J E, Munoz M C, Cao G, et al. ACE inhibition and AT1 receptor blockade prevent fatty liver and fibrosis in obese Zucker rats[J]. Obesity(Silver Spring), 2008, 16 (4) : 770-6 . |
| [6] | Xue Q, Dasgupta C, Chen M, Zhang L. Foetal hypoxia increases cardiac AT(2)R expression and subsequent vulnerability to adult ischaemic injury[J]. Cardiovasc Res, 2011, 89 (2) : 300-8 doi:10.1093/cvr/cvq303. |
| [7] | Moazzen H, Lu X, Liu M, Feng Q. Pregestational diabetes induces fetal coronary artery malformation via reactive oxygen species signaling[J]. Diabetes, 2015, 64 (4) : 1431-43 doi:10.2337/db14-0190. |
| [8] | Rueda-Clausen C F, Stanley J L, Thambiraj D F, et al. Effect of prenatal hypoxia in transgenic mouse models of preeclampsia and fetal growth restriction[J]. Reprod Sci, 2014, 21 (4) : 492-502 doi:10.1177/1933719113503401. |
| [9] | Coupe B, Grit I, Darmaun D, Parnet P. The timing of "catch-up growth" affects metabolism and appetite regulation in male rats born with intrauterine growth restriction[J]. Am J Physiol Regul Integr Comp Physiol, 2009, 297 (3) : R813-24 doi:10.1152/ajpregu.00201.2009. |
| [10] | Cabello-Verrugio C, Morales M G, Rivera J C, et al. Renin-angiotensin system: an old player with novel functions in skeletal muscle[J]. Med Res Rev, 2015, 35 (3) : 437-63 doi:10.1002/med.2015.35.issue-3. |
| [11] | 田超, 范方田, 陈文星, 等. 血管紧张素Ⅱ及其Ⅰ型受体在肿瘤血管生成中的作用研究[J]. 中国药理学通报, 2014, 30 (5) : 608-11 . Tian C, Fan F T, Chen W X, et al. Research progress on the function of angiotensin Ⅱ and its type Ⅰ receptor in tumor angiogenesis[J]. Chin Pharmacol Bull, 2014, 30 (5) : 608-11 . |
| [12] | 陈京红. 局部肾素血管紧张素系统的生理学和药理学意义[J]. 中国药理学通报, 1990, 6 (6) : 344-6 . Chen J H. Physiology and pharmacology of local renin-angiotensin systems[J]. Chin Pharmacol Bull, 1990, 6 (6) : 344-6 . |
| [13] | Ohashi N, Yamamoto T, Huang Y, et al. Intrarenal RAS activity and urinary angiotensinogen excretion in anti-thymocyte serum nephritis rats[J]. Am J Physiol Renal Physiol, 2008, 295 (5) : F1512-1518 doi:10.1152/ajprenal.00058.2008. |
| [14] | Geogescu E F. Angiotensin receptor blockers in the treatment of NASH/NAFLD: could they be a first-class option[J]. ?Adv Ther, 2008, 25 (11) : 1141-74 . |
| [15] | Ran J, Hirano T, Adachi M. Chronic ANG Ⅱ infusion increases plasma triglyceride level by stimulating hepatic triglyceride production in rats[J]. Am J Physiol Endocrinol Metab, 2004, 287 (5) : E955-61 doi:10.1152/ajpendo.00199.2004. |
| [16] | Moreira de Macedo S, Guimaraes T A, Feltenberger J D, Sousa Santos S H. The role of renin-angiotensin system modulation on treatment and prevention of liver diseases[J]. Peptides, 2014, 62 : 189-96 doi:10.1016/j.peptides.2014.10.005. |

