


2. 山东省千佛山医院保健科,山东 济南 250014
2. Dept of Health Care, Qianfoshan Hospital Affiliated to Shandong University,Jinan 250014,China
心肌肥厚是心肌细胞受各种刺激后的代偿性反应,可短期内增加心肌收缩力,但长期的心肌肥厚最终发展成心力衰竭,是心源性死亡的重要原因[1]。近年来,炎症信号通路及炎症因子在心肌肥厚的发生发展过程中的作用越来越受到重视。研究发现 ,toll样受体(toll like receptor 4,TLR4)信号系统参与心肌肥厚发生发展过程,并发挥重要作用。多种神经内分泌因子、血流动力学变化可促进TLR4表达和活化,活化的TLR4可以使IκBα磷酸化并降解,从而激活NF-κB并转移至细胞核内,促进肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎症因子及心肌肥大基因A型钠尿肽(atrial natriuretic peptide,ANP)的表达,促进心肌肥厚的发生发展[4]。他汀类药物是临床应用广泛的降脂药物,已有研究发现,他汀类药物不仅有降脂作用,而且还具有抗炎、抗氧化、改善内皮功能等非调脂心血管保护作用[5]。已有研究证实,瑞舒伐他汀可抑制压力负荷诱导的心肌肥厚作用[6]。然而这种保护性作用是否通过阻断TLR4/NF-κB/炎症因子(TNF-α等)通路这一途径,目前尚无报道。本研究建立大鼠腹主动脉缩窄模型,检测TLR4、NF-κB、IκBα、TNF-α的表达,探讨TLR4/NF-κB/炎症因子(TNF-α)通路在瑞舒伐他汀抑制心肌肥厚的作用机制。
1 材料与方法 1.1 材料 1.1.1 实验动物健康♂ Wistar大鼠30只,体质量(250±20) g,由山东大学提供。
1.1.2 主要试剂瑞舒伐他汀钙片(阿斯利康公司),1 g·L-1水合氯醛(麻醉用0.3 mL·(100 g)-1腹腔注射,购于山东大学齐鲁医院),TRIzol(美国Invitrogen公司),逆转录试剂盒(日本Toyobo公司),SYBR Green Master (瑞士Roche公司),TLR4单克隆抗体(1 ∶ 1 000稀释,英国Abcam公司),NF-κB p65、IκBα单克隆抗体(1 ∶ 1 000稀释,美国CST公司),辣根过氧化酶标记的二抗(1 ∶ 3 000稀释,北京康为世纪公司),BCA法蛋白定量试剂盒(中国碧云天公司),ECL试剂盒(美国Milipore公司),TNF-α ELISA试剂盒(北京科盈美公司)。
1.1.3 主要仪器惠普HPSonos5500彩色超声诊断仪(美国惠普公司),S12探头,频率10 Hz;Olympus FSX-100显微镜(日本奥林巴斯公司);ABI PRISM 7300实时定量PCR仪(美国应用生物系统公司);Tanon显像仪(上海天能科技有限公司)。
1.2 方法 1.2.1 压力负荷心肌肥厚大鼠模型的制备及分组将大鼠随机分为假手术组(S)、模型组(M)、瑞舒伐他汀给药组(R),每组10只。采用腹主动脉缩窄模型[7]。麻醉大鼠,皮肤消毒后于剑突下沿腹中线打开腹腔,分离腹主动脉,用4号线于肾动脉上0.5~1.0 cm处将腹主动脉与7号针(去尖)结扎,拔出垫针,将腹主动脉缩窄到0.7 mm左右,建立腹主动脉缩窄模型,假手术组不结扎动脉,其余操作同上。R组术前1周起给予瑞舒伐他汀片10 mg·kg-1·d-1灌胃,持续至术后4周实验结束,其余组给予等剂量的生理盐水。
1.2.2 超声心动学检测大鼠在麻醉状态下行超声检查,取左室长轴切面二尖瓣尖水平,在二维影像指导下,M型超声测量舒张期左室后壁厚度(posterior wall thickness at diastole,LVPWd)、室间隔(interventricularseptal thickness at diastole,IVSd)厚度,分别取连续5次心动周期求平均值,M型超声影像麻醉清醒时记录[8]。
1.2.3 组织病理心脏经0.4 g·L-1的多聚甲醛固定、石蜡包埋,经HE染色后观察细胞形态,测量细胞大小。每张切片随机选取10个视野,每个视野选10个细胞,应用图像分析软件Image Pro Plus(IPP)6.0测量有核心肌细胞横截面最短直径。
1.2.4 实时定量PCR① 提取总RNA:TRIzol法提取心肌总RNA。② 逆转录:用10 μL反应体系,将复合物震荡混匀,37 ℃15 min,98 ℃ 5 min逆转录得单链cDNA;③ 荧光定量PCR:ANP引物:上游5′-AGG AGA AGA TGC CGG TAG AAG-3,下游5′- AGA GCC CTC AGT TTG CTT TTC-3′。TLR4引物:上游5′-GAA TCT CAG CAA AAT CCC TCA-3′,下游5′-TCC TGG GGA AAA ACT CTT GAT-3′。内参GAPDH引物:上游5′-ACA GCA ACA GGG TGG TGG AC-3′,下游5′-TTT GAG GGT GCA GCG AAC TT-3′。以cDNA为模板,进行实时聚合酶链反应。所得数据用2-ΔΔCt法计算。
1.2.5 Western blot分别提取左心室心肌组织总蛋白及核蛋白,采用BCA法蛋白定量。蛋白电泳、转膜,于质量分数为0.5 g·L-1的脱脂奶粉中室温封闭1 h,封闭后分别与TLR4、NF-κB p65、IκBα一抗孵育,4 ℃过夜。TBST漂洗后与辣根过氧化酶标记的二抗共孵育,37℃ 1 h,TBST漂洗。显色,拍照。所得蛋白条带应用Image J蛋白印迹分析软件分析。
1.2.6 酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA)根据试剂盒说明书,采用双抗体夹心ELISA法检测左心室脱蜡心肌组织匀浆上清液中TNF-α含量。所有操作严格无菌操作。
1.2.7 免疫组化心脏组织石蜡切片,常规脱蜡水化。质量分数为0.3 g·L-1 H2O2于组织上孵育10 min,蒸馏水冲洗,PBS浸泡5 min。柠檬酸缓冲溶液中高压热抗原热修复,冷却,PBS洗。滴加1 ∶ 1 000稀释的TLR4一抗孵育,4 ℃过夜。PBS洗,滴加辣根过氧化物酶标记的二抗,室温孵育30 min。PBS洗,DAB显色剂显色,显微镜下掌握染色程度,蒸馏水冲洗。苏木精复染2 min,盐酸酒精分化。自来水冲洗终止反应,拍照。所得图片经IPP软件进行分析。
1.3 统计学方法应用SPSS17.0统计软件行统计学分析。实验结果以x±s表示,进行单因素方差分析、直线相关分析。
2 结果 2.1 瑞舒伐他汀降低压力负荷大鼠心肌肥厚程度Tab 1结果显示,与S组相比较,M组大鼠LVPWd、IVSd、心肌细胞直径明显增大(P<0.01),表明大鼠心肌肥厚模型成功。与M组相比,R组LVPWd、IVSd和心肌细胞直径明显降低(P<0.01)。
| Group | LVPWd/mm | IVSd/mm | CSD/μm |
| Group S | 1.91±0.06 | 1.92±0.09 | 15±4 |
| Group M | 2.17±0.09** | 2.14±0.07** | 20±7** |
| Group R | 1.95±0.04## | 1.87±0.06## | 18±3## |
| S:Sham group;M:Model group;R:Rosuvastatin+Model group. LVPWd:Posterior wall thickness at diastole; IVSd:Interventricularseptal thickness at diastole; CSD:The cross sectional diameter of myocardial cells.**P<0.01 vs sham group;##P<0.01 vs model group. | |||
ANP是心肌肥大的标志性基因之一。与S相比,M组ANP (P<0.01)和TLR4(P<0.05)基因mRNA表达水平增加;而瑞舒伐他汀明显抑制以上基因mRNA水平的上调,见Fig 1。
2.3 瑞舒伐他汀抑制压力负荷大鼠TLR4、NF-κBp65、TNF-α的表达及IκBα的降解 M组较S组TLR4蛋白水平上调(P<0.01),免疫组织化学结果显示TLR4表达下调且更向细胞膜聚集,TNF-α、NF-κB p65表达升高(P<0.01;P<0.05)、IκBα表达水平减少(P<0.01)。瑞舒伐他汀明显抑制压力负荷引起的TLR4、NF-κB p65、TNF-α的表达增加和IκBα的降解。见Fig 2,3。
2.4 TLR4蛋白水平与ANP、NF-κBp65、TNF-α的相关性分析 TLR4蛋白水平与ANP mRNA水平增加呈正相关(r=0.878,P<0.01),而瑞舒伐他汀降低TLR4蛋白水平和ANP mRNA水平,TLR4蛋白水平与ANP mRNA水平降低呈正相关(r=0.798,P<0.01);在M组和R组,大鼠心肌组织内TLR4蛋白水平与NF-κB p65、TNF-α水平均呈正相关(TLR4蛋白水平与NF-κB p65水平,M组:r=0.768,与R组:r=0.697,P<0.05;TLR4蛋白水平与TNF-α水平,M组:r=0.705,与R组:r=0.687,P<0.05)。
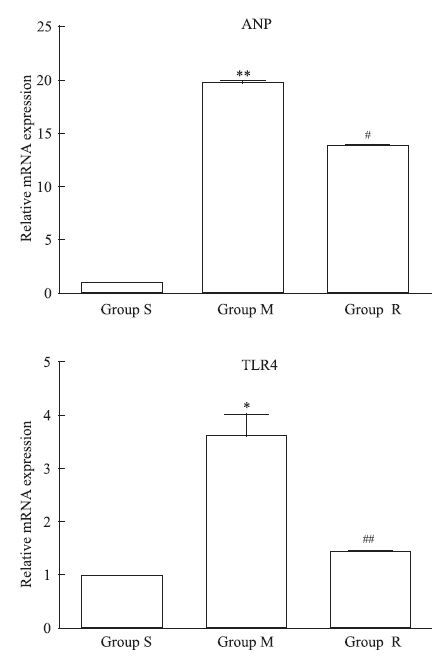
|
| Fig 1 The mRNA expression of ANP and TLR4 S:Sham group;M:Model group;R:Rosuvastatin+model group.P<0.05,**P<0.01 vs sham group;#P<0.05,##P<0.01 vs model group. |
压力负荷、容量负荷、神经内分泌因子等多种因素作用于心脏,可激活心肌细胞内MAPK、Ca2+及其依赖的信号通路、JNK/STAT等多种信号系统,各系统相互作用并通过级联放大反应,引起蛋白合成、细胞外间质沉积,ANP、β型肌球蛋白重链等胚胎性基因表达,导致心肌肥厚[9]。虽然这种代偿性反应可一定程度上增强心肌泵血功能,但长期的刺激作用促进心肌失代偿的发生,出现心力衰竭和恶性心律失常。
近年来研究表明,TLR4作为一种固有免疫系统的跨膜蛋白受体,除了能识别内毒素等物质,激活 免疫反应,还可与细胞损伤释放的物质反应,激活下游信号系统,在心肌肥厚发生发展过程中发挥重要作用 。拮抗TLR4及其下游NF-κB p65、TNF-α等的治疗可减轻大鼠的心肌肥厚,而这种作用不依赖于其对血压的影响[11]。本研究也证实,缩窄腹主动脉造成心脏压力负荷(后负荷)过重,导致心肌肥 厚,同时伴有心肌细胞TLR4表达增加,并向细胞膜聚集,促进IκBα磷酸化降解,增加NF-κB质核转移,介导TNF-α等炎症因子的表达。再次表明心肌TLR4信号系统激活参与压力负荷导致的心肌肥厚的病理生理过程。
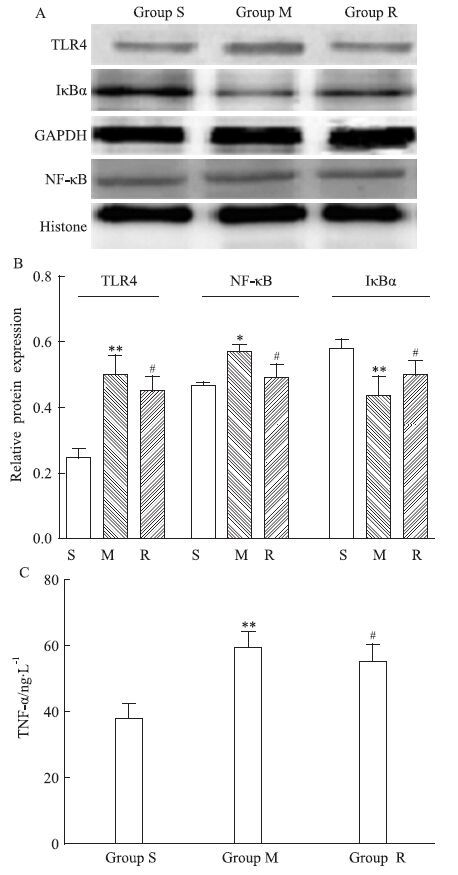
|
| Fig 2 The protein expression of TLR4,TNF-α,NF-κB,IκBα A:The band of Western blot;B:The results of Western blot;C: The results of ELISA;S:Sham group;M:Model group;R:Rosuvastatin+model group.P<0.05,**P<0.01 vs sham group;#P<0.05,##P<0.01 vs model group. |
他汀类药物除了具有调脂作用,还具有抑制心肌肥厚的作用[12]。已有文献报道,他汀类药物可影响JAK/STAT、Rho/Ras-ERK等多种信号系统及Ca通道,对多种动物模型的心肌肥厚起抑制作用 。尽管有诸多研究致力于他汀类药物抑制 心肌肥厚的作用机制,该抑制作用是否通过阻断TLR4/NF-κB/炎症因子通路这一途径尚不明确。
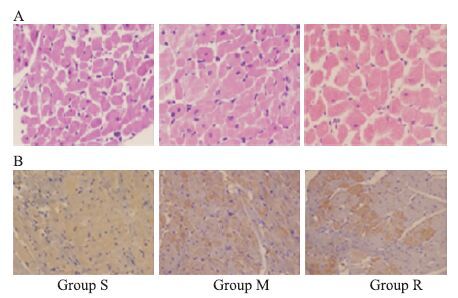
|
| Fig 3 HE staining and immunohistochemistry of the cardiomyocytes A:HE staining images(magnification 400×) Scale bar,16 μm;B:Immunohistochemistry images. The expression of TLR4(brown)(magnification 200×). S:sham group;M:model group;R:rosuvastatin+model group. |
本实验结果表明,瑞舒伐他汀可抑制压力负荷诱导的心肌肥厚,表现为:室壁厚度(LVPWd、IVSd)和心肌细胞直径明显的降低,心肌肥大基因ANP表达的减少。对心肌肥厚的抑制作用同时伴有TLR4、NF-κB、TNF-α的表达降低,IκBα降解减少。相关性分析表明:瑞舒伐他汀抑制ANP表达增加与其抑制心肌中TLR4蛋白表达呈正相关,TLR4蛋白水平又与心肌组织中NF-κB和炎症因子TNF-α水平呈正相关。结合上述TLR4/NF-κB/炎症因子信号通路在心肌肥厚中的重要作用,我们推测瑞舒伐他汀抑制心肌肥厚的作用可能与其下调心肌组织TLR4表达,抑制核转录因子NF-κB的质核转移与TNF-α等炎症因子的表达相关。
压力负荷可导致心肌肥厚、心力衰竭,伴有TLR4信号系统激活。瑞舒伐他汀可能通过下调该系统,发挥抑制心肌肥厚的作用。尽管瑞舒伐他汀如何下调TLR4信号系统仍需进一步研究,以上机制仍是瑞舒伐他汀发挥抑制心肌肥厚作用的重要途径之一。本课题组将对瑞舒伐他汀影响TLR4信号系统的具体机制做深入研究,为他汀类药物在心肌肥厚治疗上的应用提供新的理论基础。
( 致谢: 本实验在山东省千佛山医院中心实验室完成,感谢实验室所有老师的指导和帮助! )
| [1] | Rohini A, Agrawal N, Koyani C N, Singh R. Molecular targets and regulators of cardiac hypertrophy[J]. Pharmacol Res, 2010, 61 (4) : 269-80 doi:10.1016/j.phrs.2009.11.012. |
| [2] | Eissler R, Schmaderer C, Rusai K, et al. Hypertension augments cardiac Toll-like receptor 4 expression and activity[J]. Hypertens Res, 2011, 34 (5) : 551-8 doi:10.1038/hr.2010.270. |
| [3] | Riad A, Meyer zu Schwabedissen H, Weitmann K, et al. Variants of Toll-like receptor 4 predict cardiac recovery in patients with dilated cardiomyopathy[J]. J Biol Chem, 2012, 287 (32) : 27236-43 doi:10.1074/jbc.M112.369728. |
| [4] | 张静, 王洪新, 杨娟, 等. 黄芪多糖通过Toll样受体4/核转录因子NF- κB信号通路抑制异丙肾上腺素诱导的心肌细胞肥大[J]. 中华高血压杂志, 2014, 22 (2) : 157-62 . Zhang J, Wang H X, Yang J, et al. Astragalus polysacharides inhibites cardiomyocyte hypertrophy induced by isoproterenol via Tol-like receptor 4/nuclear factor-κB signal pathway[J]. Chin J Hypertens, 2014, 22 (2) : 157-62 . |
| [5] | Mason R P, Corbalan J J, Jacob R F, et al. Atorvastatin enhanced nitric oxide release and reduced blood pressure, nitroxidative stress and rantes levels in hypertensive rats with diabetes[J]. J Physiol Pharmacol, 2015, 66 (1) : 65-72 . |
| [6] | 廖颖, 曲秀芬, 刘丽, 等. 瑞舒伐他汀对压力超负荷肥厚大鼠心脏结构和交感神经重构的影响[J]. 中华医学杂志, 2009, 89 (34) : 2412-5 . Liao Y, Qu X F, Liu L, et al. Sympathetic nerve in rat with pressure overload left ventricular hypertrophy[J]. Natl Med J China, 2009, 89 (34) : 2412-5 . |
| [7] | Cittadini A, Monti M G, Iaccarino G, et al. SOCS1 gene transfer accelerates the transition to heart failure through the inhibition of the gp130/JAK/STAT pathway[J]. Cardiovasc Res, 2012, 96 (3) : 381-90 doi:10.1093/cvr/cvs261. |
| [8] | Dai D F, Hsieh E J, Liu Y, et al. Mitochondrial proteome remodelling in pressure overload-induced heart failure: the role of mitochondrial oxidative stress[J]. Cardiovasc Res, 2012, 93 (1) : 79-88 doi:10.1093/cvr/cvr274. |
| [9] | Rohini A, Agrawal N, Koyani C N, Singh R. Molecular targets and regulators of cardiac hypertrophy[J]. Pharmacol Res, 2010, 61 (4) : 269-80 doi:10.1016/j.phrs.2009.11.012. |
| [10] | Mehta J L, Ding Z, Liu S, et al. Hypertension, TLR4 activation in brainand cardiac hypertrophy[J]. Cardiovasc Res, 2014, 103 (1) : 3-4 doi:10.1093/cvr/cvu128. |
| [11] | Echem C, Bomfim G F, Ceravolo G S, et al. Anti-toll like receptor 4(TLR4) therapy diminishes cardiac remodeling regardless of changes in blood pressure in spontaneously hypertensive rats(SHR)[J]. Int J Cardiol, 2015, 187 : 243-5 doi:10.1016/j.ijcard.2015.03.190. |
| [12] | Liu J, Shen Q, Wu Y. Simvastatin prevents cardiac hypertrophy in vitro and in vivo via JAK/STAT pathway[J]. Life Sci, 2008, 82 (19-20) : 991-6 doi:10.1016/j.lfs.2008.02.012. |
| [13] | Takayama N, Kai H, Kudo H, et al. Simvastatin prevents large blood pressure variability induced aggravation of cardiac hypertrophy in hypertensive rats by inhibiting RhoA/Ras-ERK pathways[J]. Hypertens Res, 2011, 34 (3) : 341-7 doi:10.1038/hr.2010.229. |
| [14] | 范芳芳, 田秀青, 徐雪, 等. 他克莫司对大鼠心肌肥厚及TOLL受体4的影响[J]. 中国药理学通报, 2013, 29 (7) : 445-8 . Fan F F, Tian X Q, Xu X, et al. Effect of tacrolimus on cardiac hypertrophy and toll like receoptor 4 signaling pathway in myocardium[J]. Chin Pharmacol Bull, 2013, 29 (7) : 445-8 . |

