


2. 新乡医学院生理学与神经生物学教研室,河南 新乡 453003
2. Dept of Physiology and Neurobiology,Xinxiang Medical University,Xinxiang Henan 453003,China
肾血管性高血压(renovascular hypertension,RVH)是一种常见的继发性高血压,其发生的机制尚未完全明了。H2S是继一氧化氮(nitric oxide,NO)和一氧化碳(carbon monoxide,CO)之后被发现的第3种内源性气体信号分子 ,在各系统中发挥着重要的生理学及病理生理学作用[3]。研究表明,内源性H2S在维持正常血压和保持血管舒张功能方面非常重要,其内源生成减少也参与高血压等多种疾病的病理生理过程[4]。那么,外源性给予H2S能否降低肾血管性高血压大鼠的动脉血压,以及H2S对肾血管性高血压大鼠血管舒张功能的调节作用如何呢?本研究以2K1C法建立肾血管性高血压大鼠模型,观察H2S对肾性高血压大鼠血压及血管功能的调节作用并探讨可能的机制。
1 材料与方法 1.1 动物健康4~5月龄清洁级♂ Wistar大鼠,体质量为200~300 g,常规大鼠饲料及净化自来水饲养。待大鼠适应环境,血压稳定后,开始正式实验。
1.2 主要试剂与药品硫氢化钠(NaHS)、乙酰胆碱(ACh),购自sigma公司; eNOS、ET-1抗体,由Abcam公司提供;山羊抗兔多克隆抗体(二抗)由Proteintech公司提供;NaHS及PPG溶液于实验当天新鲜配制。
1.3 实验方法 1.3.1 模型制备与分组根据文献报道[5],制备两肾一夹(2K1C)肾血管性高血压模型。♂ Wistar大鼠在术前禁食。用30 g·L-1的水合氯醛(1 mL·100 g-1)腹腔注射麻醉,固定于鼠板,无菌操作,在左侧肾脏区域做切口,腹膜外进入,打开腹腔,暴露左侧肾脏。分离左侧肾动脉,把直径为0.20 mm的针灸针与血管长轴并置,并用手术丝线(4号)结扎,然后拔出针灸针造成左侧肾动脉狭窄,右肾未触及,假手术组方法相同但不结扎左肾动脉。模型判断标准:造模后血压比造模前高2.66 kPa(大于正常血压3个标准差)以上,且收缩压高于18.62kPa视为模型成功,达到肾血管性高血压的标准,血压未达到以上标准的模型大鼠弃之不用。造模成功大鼠随机分为2KIC组(n=7只),2KIC+NaHS组(n=8只),PPG组(n=7只)。另设假手术组6只。2KIC+NaHS组从术后第二日每日腹腔注射NaHS(56 μmol·kg-1)[6],PPG组每日腹腔注射0.25 mL PPG(37.5 mg·kg-1),假手术组、2KIC组每日腹腔注射0.25 mL无菌注射用水作为对照,连续用药4周。
1.3.2 血压测定术前及术后每周,采用尾容积法测清醒时大鼠的尾动脉收缩压(systolic blood pressure,SBP)。测量前大鼠预热10~15 min,将鼠尾套入尾套,待动物安静后充气测收缩压,重复3次,取平均值。
1.3.3 血管形态学观察颈总动脉用体积分数为0.1的甲醛固定、冲水、脱水、透明、浸蜡、石蜡包埋、切片、染色、封固。电脑图形分析仪检测颈总动脉外周径、壁厚、壁厚外周径比。
1.3.4 颈总动脉舒缩反应的测定采用RM-6240生物信号采集处理系统。取约3~4 mm的颈总动脉置于盛有K-H液的 37℃恒温浴槽中,将其一端挂于钢丝上,另一端与张力换能器相连,持续记录血管环张力变化。先用收缩剂去甲肾上腺素(Norepinephrine,NE 1 μmol·L-1)预收缩后,再累积加入ACh溶液,持续记录血管的张力变化。
1.3.5 免疫组化法测定颈总动脉eNOS,ET-1蛋白表达石腊切片(6 μm)常规脱腊至水,体积分数为0.03的H2O2室温孵育5~10 min。(92~98) ℃ 抗原热修复维持30 min,正常山羊血清封闭20 min,加一抗( 抗体稀释浓度为1 ∶ 100) ,同时滴加PBS代替一抗做阴性对照,置于4 ℃冰箱过夜。37 ℃烤箱复温1 h,PBS冲洗3 min×3 次,加入二抗,37 ℃ 烤箱孵育30 min,DAB显色,苏木精复染,脱水,透明,封片。
1.4 统计学方法数据用 x±s表示,单因素方差分析,应用SPSS13.0统计软件处理。
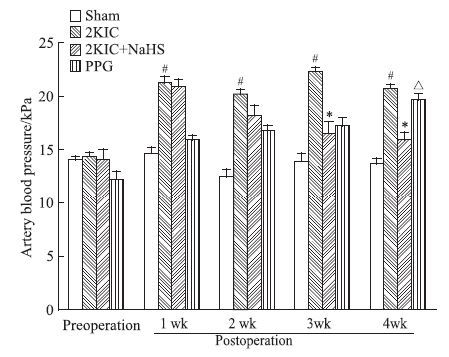
2 结果 2.1 血压的变化肾动脉狭窄术后1周,2K1C组大鼠血压即有明显升高,且明显高于sham组 ;2K1C+NaHS组血压升高,但与2K1C组相比,没有明显差异;PPG组血压比sham组略高,差异没有统计学意义;术后第2周开始,2K1C+NaHS组血压开始逐渐降低,术后3周与2KIC组比较差异具有显著性(P<0.05);PPG组血压逐渐升高,术后4周与sham组比较差异具有显著性(P<0.05)。
| Group | Sham group | 2KIC | 2KIC+NaHS | PPG |
| Preoperation | 14±0.4 | 14.4±0.33 | 14.14 ±0.88 | 12.25±0.72 |
| 1 wk postoperation | 14.63±0.55 | 21.29±0.51# | 20.92±0.61 | 15.91±0.4 |
| 2 wk postoperation | 12.52±0.57 | 20.19±0.43# | 18.17±0.9 | 16.77±0.49 |
| 3 wk postoperation | 13.97±0.69 | 22.34±0.32# | 16.51±1.04 | 17.22±0.68 |
| 4 wk postoperation | 13.67±0.55 | 20.75±0.35# | 15.91±0.67 | 19.62±0.56△ |
| #P<0.05 2K1C group vs sham group; P<0.05 2K1C+NaHS group vs 2K1C group; △P<0.05 PPG group vs sham group | ||||
在显微镜下观察结果表明,与假手术组大鼠比较,2KIC组及PPG组大鼠的血管外周径、壁厚及壁厚与血管外周径的比值均明显增加,差异具有统计学意义(P<0.05);2K1C+NaHS组血管形态结构明显改善(Tab 2)。
|
| Fig 1 Changes of rat tail artery blood pressure in different groups ( x±s,kPa) #P<0.05 2K1C group vs sham group; P<0.05 2K1C+NaHS group vs 2K1C group; △P<0.05 PPG group vs sham group |
| Group | n | Outer radius /μm | Wall thickness /μm | Ratio of wall thickness to outer radius |
| Sham | 6 | 276.36±18.2 | 50.1±13.7 | 0.181±0.09 |
| 2KIC | 7 | 301.67±13.86 | 67.1±18.1 | 0.222±0.067 |
| 2K1C+NaHS | 8 | 289.7±20.4 | 53.12±14.7△ | 0.183±0.08△ |
| PPG | 7 | 308.01±40.7 | 60.71±16.4 | 0.197±0.04 |
| P<0.05 2K1C,PPG vs sham;△P<0.05 2K1C+NaHS vs 2K1C | ||||
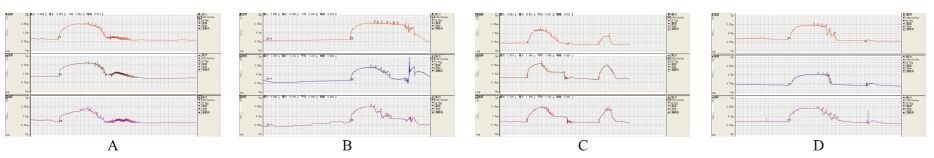
在各组均观察到ACh(10-8~10-4 mol·L-1)剂量依赖性地血管舒张反应。外源性给予H2S(2K1C+NaHS组)能明显增加模型大鼠内皮依赖性舒张反应,与2KIC组比较,差异有显著性(P<0.05)(Fig 2)。
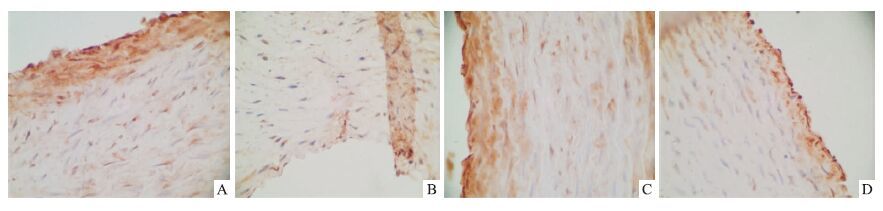
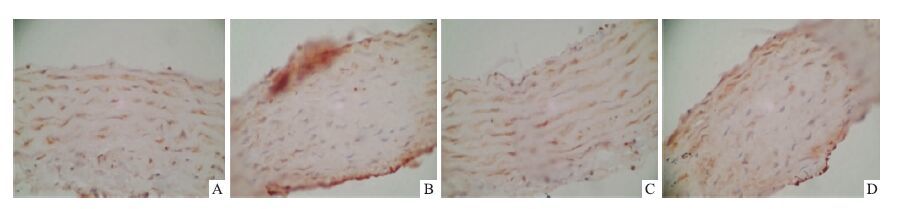
2.4 血管中eNOS;ET-1的表达见Fig 3,4。由图可见,2K1C和PPG组ET-1蛋白表达高于sham组(P<0.05),eNOS蛋白表达降低;与2K1C组比较,2K1C+NaHS组ET-1表达明显降低(P<0.05),eNOS蛋白表达有所升高,差异有显著性。
3 讨论在术后的第1周,2K1C组大鼠收缩压即明显升高,达到高血压模型诊断标准,表明模型制备成功。对肾血管性高血压大鼠外源性补充H2S(2K1C+NaHS组),升高的血压逐渐降低,提示H2S 不仅可以防止高血压的进一步发展,还可以降低已经升高 的肾血管性高血压大鼠的血压;以往的研究表明,内源性H2S参与基础血压的维持和高血压的发展[7]。PPG(DL-propargylglycine)为硫化氢代谢酶抑制剂,抑制内源性H2S的合成。我们给大鼠腹腔注射PPG,结果血压在术后1周略有升高,但没有统计学意义,可能与给药时间较短,对内源性H2S的抑制作用较弱有关。随着PPG的持续给药,体内H2S的生成逐步被抑制,血压也逐步升高并发展成高血压。这些都说明,体内H2S体系参与肾血管性高血压的形成和发展。
|
| Fig 2 Endothelium-dependent relaxation of carotid artery induced by Ach in different groups A:Sham group;B:2K1C group;C:2K1C+NaHS group;D:PPG group |
|
| Fig 3 The protein expression of eNOS in different groups A:Sham group;B:2K1C group;C:2K1C+NaHS group;D:PPG group |
|
| Fig 4 The protein expression of ET-1 in different groups A:Sham group;B:2K1C group;C:2K1C+NaHS group;D:PPG group |
有研究证实,H2S可以通过舒张血管平滑肌、抑制血管平滑肌细胞增殖而调节血管重构发挥抗高血压的作用[8]。本实验结果显示,肾血管性高血压大鼠由于血管平滑肌细胞增殖使血管壁变厚,壁厚与外周径的比值增大;外源性给予H2S后,血管壁厚及壁厚与外周径的比值均减小,说明H2S可以抑制血管平滑肌细胞增殖,抑制血管的重构。血管的内皮依赖性血管舒张反应结果也显示发生肾血管性高血压时血管舒张能力减弱,而H2S可改善ACh介导的血管舒张反应,改善血管的舒缩功能,抑制血压的升高。
有研究表明,内源性的H2S可以独立或与NO协同舒张血管平滑肌[9],H2S改善其内皮依赖的舒血管效应可能还与其调节内皮释放NO有关。本实验中,检测了NO/cGMP信号途径的关键酶eNOS,结果发现,模型组eNOS表达减少,进一步证明了NO减少在高血压的发展过程中发挥了重要作用,而H2S可以明显增加模型大鼠eNOS的表达,独立或与NO协同舒张血管,降低血压。内皮素(endothelin,ET)是迄今所知最强的缩血管物质[10],参与高血压状态的发生与维持。本研究检测了主要表达的ET-1的含量,发现在模型中ET-1表达较对照组明显升高,而外源性给与H2S可以明显增加降低大鼠ET-1的表达。
NO和ET的生成量及二者之间平衡的失调是动脉内皮受损的明显特征,血管内皮受损又导致其功能紊乱,而血管内皮功能紊乱最重要、最早期的表现就是血管内皮依赖性舒张功能的减弱或丧失,本实验模型组的实验结果也证实了这点。而H2S可以明显增加eNOS的表达,减少ET-1表达,恢复维持血管结构和功能的这种平衡,这可能是其改善血管的舒缩功能,抑制血压升高的机制之一。
( 致谢: 感谢新乡医学院生理学与神经生物学教研室李东亮教授和赵红岗老师给予本实验的指导和支持! )
| [1] | Yu X H, Cui L B, Wu K, et al. Hydrogen sulfide as a potent cardiovascular protective agent[J]. Clin Chim Acta, 2014, 437 : 78-87 doi:10.1016/j.cca.2014.07.012. |
| [2] | 李新娟, 魏林郁, 李超堃, 等. 硫化氢对大鼠局灶性脑缺血/再灌注损伤的保护作用及其机制[J]. 中国药理学通报, 2014, 30 (9) : 1271-5 . Li X J, Wei L Y, Li C F, et al. Protective effect of hydrogen sulfide on focal cerebral ischemia /reperfusion injury in rats and its mechanism[J]. Chin Pharmacol Bull, 2014, 30 (9) : 1271-5 . |
| [3] | Muellner M K, Schreier S M, Laggner H, et al. Hydrogen sulfide destroys lipid hydroperoxides in oxidized LDL[J]. Biochem J, 2009, 420 (2) : 277-81 doi:10.1042/BJ20082421. |
| [4] | Olas B. Hydrogen sulfide in hemostasis: friend or foe[J]. Chem Biol Interact, 2014, 217 : 49-56 doi:10.1016/j.cbi.2014.04.006. |
| [5] | Dussaillant G R, Gonzalez H, Cespedes C, et al. Regression of left ventricular hypertrophy in experimental renovascular hypertension: diastolic dysfunction depends more on myocardial collagen than it does on myocardial mass[J]. J Hypertension, 1996, 14 (9) : 1117-23 doi:10.1097/00004872-199609000-00012. |
| [6] | 吴代琴, 程友琴, 方颖, 等. 气体信使硫化氢在大鼠肾血管性高血压中的调节作用[J]. 中华老年心脑血管病杂志, 2006, 8 (11) : 748-51 . Wu D Q, Cheng Y Q, Fang Y, et al. Regulatory effect of endogenous hydrogen sulfide system on renovascular hypertension[J]. Chin J Geriatr Heart Brain Vessel Dis, 2006, 8 (11) : 748-51 . |
| [7] | 丁杨, 李艳, 余孝海, 钟明奎. 室旁核中硫化氢对大鼠血压和交感神经放电的影响[J]. 中国药理学通报, 2013, 29 (12) : 1695-8 . Ding Y, Li Y, Yu X H, Zhong M K. Effect of hydrogen sulfide in paraventricular nucleus on blood pressure and sympathetic nerve activity in rats[J]. Chin Pharmacol Bull, 2013, 29 (12) : 1695-8 . |
| [8] | 金红芳, 田悦, 闫辉, 等. 硫化氢对正常及自发性高血压大鼠主动脉平滑肌细胞PCNA和p-ERK蛋白表达的影响[J]. 中国药理学通报, 2008, 24 (2) : 160-5 . Jin H F, Tian Y, Yan H, et al. Effect of hydrogen sulfide on the expression of PCNA and p-ERK in the aortic smooth muscle cells of normal rats and spontaneous hypertensive rats[J]. Chin Pharmacol Bull, 2008, 24 (2) : 160-5 . |
| [9] | Wang R. Hydrogen sulfide: a new EDRF[J]. Kidney Int, 2009, 76 (7) : 700-4 doi:10.1038/ki.2009.221. |
| [10] | Yanagisawa M, Kurihara H, Kimura S, et al. A novel potent vasoconstrictor peptide produced by vascular cell[J]. Nature, 1988, 332 (3) : 411-5 . |
文章信息
-
文章历史
- 收稿日期: 2016-02-10
- 修订日期: 2016-04-22

