


基因治疗是指运用DNA转移来治疗甚至预防人类疾患。将DNA送入细胞的方法虽然很多,但进行基因治疗时,必须让多数的细胞都获得DNA,一般的DNA传送方法都无法达到此目标。由于病毒感染细胞的效率很高,因此适合做基因治疗的载体,将预转导的基因送入细胞内。腺病毒载体是现在基因治疗最为常用的治疗载体之一。腺病毒虽然不能长时间稳定表达,但其转移效率高的特点使其目前在治疗恶性肿瘤方面具有了其它病毒载体难以替代的优势[1-2]。
ASPP2是p53凋亡刺激蛋白(apoptosis stimulating protein of p53,ASPP)家族的一员,能特异性地调节 p53 依赖性凋亡作用。早在10多年前,ASPP2就被发现是p53的结合蛋白[4],它作为p53介导凋亡的正调节子的作用已经被明确证实。同时,ASPP2的生理学重要性也已经通过ASPP2缺陷型鼠的产生及特征分析展现出来[5-6]。我们现在已经知道ASPP2是一种单倍剂量不足型肿瘤抑制因子,在鼠的发育和肿瘤形成过程中是p53的重要激活剂。临床研究显示包括肝癌在内的多种肿瘤组织ASPP2表达下降,与肿瘤的发展、转移和预后密切相关[7-9],ASPP2可能是未来癌症治疗的一个新的重要靶点。
我们前期构建并大量扩增纯化了人ASPP2重组腺病毒,本实验依据《人基因治疗和制剂质量控制技术指导原则》[10]及《中国药典》三部(2010版)相关要求,结合该重组腺病毒的特点,针对关键质量特征,从重组腺病毒的鉴定、病毒颗粒数、滴度检测、目的蛋白表达、生物学活性以及复制型腺病毒(RCA)检测几方面对人ASPP2重组腺病毒进行质量分析,建立关键质量特征的质量控制方法,为其下一步研究奠定质量基础。
1 材料与方法 1.1 试剂与仪器DMEM高糖培养基、胎牛血清、胰酶、青链霉素购自美国Gibco公司;人ASPP2重组腺病毒由陕西师范大学生命科学学院夏海滨教授基因治疗研究室构建;人胚肾293T细胞、人肺癌A549、人肝癌HepG2和Huh7细胞株为本室保存。10 cm细胞培养皿、96孔、24孔细胞培养板购自美国Corning公司;ASPP2单克隆抗体购自美国Sigma公司;通用型基因组DNA提取试剂盒购自康为世纪公司;MTT 噻唑蓝购自美国Sigma公司。Nikon ECLIPSE TE2000-U倒置荧光显微镜;BioTeke ND5000超微量紫外可见分光光度计;Thermo Scientific 8000型恒温CO2培养箱;BACKMAN L-80XP 超速离心机;BioTeke CYTATION3细胞成像多功能检测系统;BIO-RAD DNA Engine PCR仪;Alpha Imager凝胶成像仪;Thermo Scientific Multiskan GO全波长酶标仪。
1.2 方法 1.2.1 PCR-电泳法鉴定腺病毒E2B和人ASPP2基因重组腺病毒由载体DNA和目的基因两部分构成。按照试剂盒方法提取病毒基因组DNA,通过对重组腺病毒载体结构基因E2B和目的基因ASPP2进行PCR扩增。PCR产物经1%琼脂糖凝胶电泳分子量鉴定。以灭菌纯水代替模板同步反应作为阴性对照。
E2B区引物序列为:上游引物5′-TCGTTTCTCAGCAGCTGTTG-3′,下游引物5′-CATCTGAACTCAAAGCGTGG-3′,扩增片段大小为880 bp。扩增条件为:94℃变性5 min;94℃变性20 s,55℃复性30 s,72℃延伸1 min,共40个循环;72℃延伸5 min[10]。
ASPP2的引物序列为:上游引物5′ -AGCTGCCATGGAGACCATCT-3′,下游引物5′- ACTGTTCTCCGTACTGGCAC-3′,扩增片段大小为220 bp。扩增条件为:95℃变性3 min;94℃变性1 min,55℃复性1 min,72℃延伸1 min,共3个循环;94℃变性30 s,55℃复性45 s,72℃延伸45 s,共27个循环;72℃延伸5 min。
1.2.2 UV-SDS法测定人ASPP2重组腺病毒病毒颗粒数用病毒保存液配制0.2% SDS;取等量的人ASPP2重组腺病毒待测液与0.2% SDS液混合;振荡混匀,56 ℃水浴中放置10 min;等温度降至室温时,瞬时离心。病毒保存液配制的0.2% SDS作为空白对照,测定波长260和280 nm处的吸光度值,平行实验2次。按公式计算:病毒颗粒数=A260 nm×稀释倍数×1.1×1012。
1.2.3 半数组织培养感染剂量(TCID50)法测定病毒滴度在实验前24 h,向96孔板每孔加入100 μL人胚肾293T细胞悬液,1×103个细胞;待测病毒液的稀释,按10倍稀释度(106~1013)稀释病毒样品;从孵箱中取出96孔板,在显微镜下确定每孔的细胞均生长良好。吸弃旧培养液,然后依次将106~1013稀释的病毒加入96孔板中,每一稀释度占用一行,每行10孔重复,每孔加入90 μL 病毒稀释液,而每行的第11~12孔均加入90 μL不含病毒的完全培养基作为对照;37℃培养10 d后观察细胞病变现象,并对CPE孔进行计数,计算每行的阳性率,计算病毒滴度(Spearman-Karber Method):病毒滴度=10(x+0.8)IU/mL,x=101~1012依次稀释度下CPE阳性率总和。公式使用条件:阴性对照没有CPE和生长抑制现象;加入最小稀释浓度病毒液的孔均有CPE。
1.2.4 Western blot方法检测人ASPP2重组腺病毒目的蛋白的表达取人ASPP2重组腺病毒,以MOI=100感染人肝癌HepG2和Huh7细胞,24 h后提取细胞蛋白;用BCA法进行蛋白定量;经8% SDS-PAGE,后将蛋白转至PVDF膜上;用ASPP2单克隆抗体1 ∶1 000稀释,二抗1 ∶2 000稀释;室温下孵育一抗2 h,用1×TBST洗膜3次;室温下孵育二抗1 h,用1×TBST洗膜3次;用ECL试剂盒检测,压片后显影。
1.2.5 人ASPP2重组腺病毒生物学活性测定培养肝癌Huh7细胞和HepG2细胞至对数生长期,消化并计数,将细胞悬液以每孔细胞数2 500个/100 μL培养液接种4块96孔板;次日加入相应滴度的病毒液(Huh7细胞病毒终浓度为1×107和1×108 pfu·mL-1,HepG2细胞病毒终浓度为5×106和5×107 pfu·mL-1),每个滴度同时做3个复孔;在病毒加入后的24、48、72、96 h时倾倒培养液,每孔加MTT(5 g·L-1)20 μL后,于37℃孵育4 h;倾倒板中液体并向每孔加入150 μL DMSO,振荡10 min,用酶标仪在490 nm波长处检测数值。实验重复3次。计算公式:生长抑制率/%=(1-ASPP2干预组/阴性对照)×100%
1.2.6 复制性腺病毒(RCA)的检测收集A549细胞并配成浓度为4×108·L-1的细胞悬液,共132 mL。接种细胞于11个12孔板,每孔4×105个细胞,置于孵箱,37℃、5% CO2培养过夜。将3×1010 VP待测样品稀释于120 mL DMEM完全培养基。移去12孔板内的培养基,并加入1 mL待检样品,一共感染10个12孔板。同时设定一板阴性对照,每孔加入1 mL完全培养基,置于孵箱,37℃培养14 d。在d 7补液,每孔加1 mL完全DMEM。结果判定:加入待检样品的10板均无致细胞病变效应(CPE)出现,同时阴性对照的细胞正常,无CPE产生,则判定病毒样品的RCA检测合格。
2 结果 2.1 人ASPP2重组腺病毒鉴定经1%琼脂糖凝胶电泳分析,ASPP2基因扩增产物可见220 bp的特异性条带,E2B基因扩增产物可见880 bp的特异性条带,与预期的扩增片段长度相符。见Fig 1。
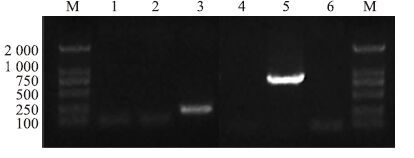
|
| Fig 1 Electrophoretic profile of PCR products of ASPP2 and E2B genes 1:negative control(ASPP2 gene);2:PCR products of 293T cells(ASPP2 gene);3:recombinant adenovirus(ASPP2 gene);4:PCR products of 293T cells(E2B gene);5:recombinant adenovirus(E2B gene);6:negative control(E2B gene);M:DNA marker 2000. |
病毒可以通过测定吸光度值来计算病毒总颗粒数,进行适当稀释后,使病毒液在260 nm处的吸光度值处于0~1.0之间,根据公式:病毒颗粒数=A260 nm×稀释倍数×1.1×1012计算重组ASPP2腺病毒的病毒颗粒数为5.6×1012 VP/mL。同时计算A260/A280的比值为1.21,落在规定值的1.2~1.3之间,初步分析结果显示人ASPP2重组腺病毒纯度达到要求。
病毒滴度的测定采用SFDA和FDA推荐的TCID50法,此方法已被用于测定许多病毒的滴度,病毒稀释液与细胞在96孔板进行培养,然后监测每孔是否出现CPE。根据公式计算后得到人ASPP2重组腺病毒的病毒滴度为2×1011 IU/mL。
病毒比活即病毒感染滴度与病毒颗粒数的比值(IU/VP)。目前,SFDA规定重组腺病毒作为基因治疗制品的比活性应高于3.3%。人ASPP2重组腺病毒的比活值为3.5%,符合SFDA规定的要求。
2.3 人ASPP2重组腺病毒目的蛋白的表达情况在确定目的基因存在后,还需要进一步验证存在于制剂中的目的基因经腺病毒载体介导后,是否可在靶细胞中表达目的蛋白。本实验通过人ASPP2重组腺病毒感染人肝癌HepG2和Huh7细胞后,检测细胞中目的蛋白的过表达情况。结果显示在病毒感染24 h,ASPP2腺病毒感染细胞比未感染细胞存在ASPP2蛋白的高表达现象。见Fig 2。
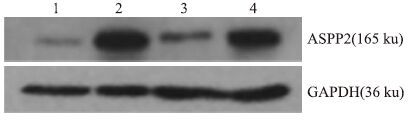
|
| Fig 2 ASPP2 protein expression in infected HepG2 and Huh7 cells by human ASPP2 recombinant adenovirus 1:HepG2 cells;2:HepG2 cells infected by human ASPP2 recombinant adenovirus;3:Huh7 cells;4:Huh7 cells infected by human ASPP2 recombinant adenovirus |
效应实验除了基因表达检测外,还应观察表达的目的蛋白是否产生特定的生物学功能。结果显示,与阴性对照腺病毒相比,人ASPP2重组腺病毒(剂量)在不同时间段都存在不同程度的生长抑制情况。当人ASPP2重组腺病毒在5×107 pfu/mL滴度下作用HepG2细胞72 h时的生长抑制率为50.5%;当人ASPP2重组腺病毒在1×108 pfu/mL滴度下作用Huh7细胞72h时的生长抑制率为61.69%,说明ASPP2对肝癌HepG2和Huh7细胞具有明显的生长抑制作用。见Fig 3。
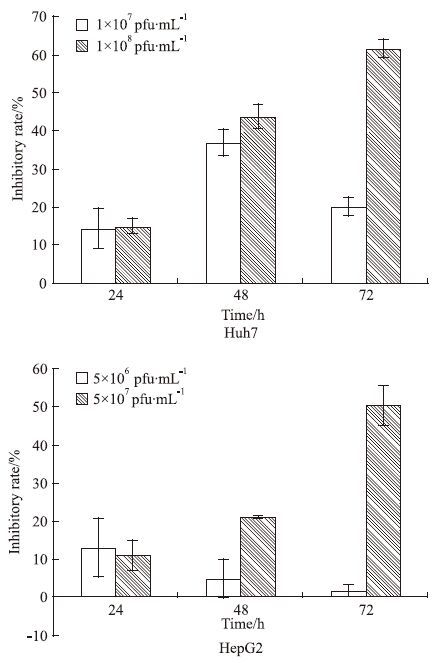
|
| Fig 3 Growth inhibitory effect of ASPP2 recombinant adenovirus on HepG2 and Huh7 cells |
由于复制型腺病毒(RCA)数量会随着293细胞的传代次数增加而增加,而RCA的产生会严重干扰重组腺病毒载体的使用效果,并带来安全隐患。RCA检测是重组腺病毒制品安全性检查的核心指标。目前,SFDA和FDA推荐采用A549细胞生物学方法检测RCA。非复制型腺病毒不会造成A549细胞产生CPE。规定标准为:每3.0×1010 VP中应不高于1RCA(即≤1RCA/3.0×1010 VP)。Fig 4显示,实验组加入重组腺病毒样品后,持续培养2周后未见CPE,而对照组293细胞则出现明显的CPE。结果表明重组ASPP2腺病毒中的RCA符合SFDA标准。
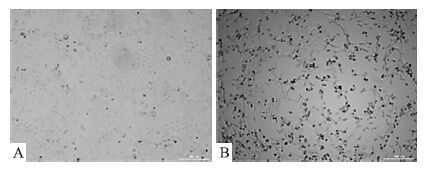
|
| Fig 4 RCA detection of ASPP2 recombinant adenovirus(×40) A:Human ASPP2 recombinant adenovirus infected A549 cells for 14 days;B:Human ASPP2 recombinant adenovirus infected 293 cells for 7 days |
癌症是一种获得性遗传疾病,通过引入治疗性肿瘤抑制基因或使癌基因失活,基因治疗有望成为一种非常有效的抗肿瘤治疗方式。其可产生针对每个肿瘤的精确遗传结构,因此能产生较低的全身毒性[11]。在众多肿瘤抑制基因中,p53是最具潜力的治疗性基因之一,作为“基因组卫士”,它在受到癌基因、DNA损伤以及氧化应激等刺激下,通过诱导细胞周期抑制、衰老以及凋亡等途径来发挥作用。而作为p53的结合蛋白,ASPP2在p53介导的凋亡基因转录的激活和细胞周期抑制上扮演重要角色[2],同时ASPP2也具有p53非依赖的肿瘤抑制作用[12-13],ASPP2可能成为未来肿瘤治疗的靶点之一。
临床应用腺病毒能够高水平瞬时表达外源基因,腺病毒能够促进分裂、不分裂细胞系的局部和系统性的基因递送和传导。与逆转录病毒不同,重组腺病毒基因组能够插入大量的外源DNA碱基,且不整合到宿主染色体上,这也是重组腺病毒的最大安全优势。作为基因治疗载体必需符合两个必要条件,一是进入细胞后无法复制,不会产生具有感染力的病毒。另一是能在试管内繁殖,并被组装成具有感染力的病毒颗粒[14]。因此,批量扩增的腺病毒制剂则需要严格的质量控制以保证药物安全有效。
腺病毒颗粒数的检测多采用A260紫外光吸收法,通过病毒基因组的光吸收值来计算,该方法要求病毒浓度和纯度都要足够高,同时此种方法不能区分感染型和缺陷型病毒颗粒。滴度代表具有感染能力的病毒颗粒数,它更为直观地反映能进入细胞表达目的蛋白的病毒颗粒,即有效剂量,是衡量腺病毒特性更为重要的指标。我们选择SFDA和FDA推荐的TCID50方法测定病毒滴度。这一方法的原理基于最高稀释度下293细胞中病变效应(CPE)的形成。该方法只需10 d就可以获得结果,而且人为因素对结果的影响较小,结果的重复性更高。同时将滴度与颗粒数相比可得到腺病毒制品的比活性,FDA和SFDA推荐增加比活的概念来完善对此类产品的质控,规定重组临床级制品的比活性必须大于3.3%。在重组腺病毒的扩增中,严格控制病毒种子的代数,尽量减少RCA的产生,以保证制剂的安全。
基因治疗的体外药效测定是评价其有效性的关键指标。一般情况下,在体外将重组病毒感染细胞并培养后,可通过Western blot定性实验或ELISA定量实验检测培养上清中的目的蛋白的表达。本实验中,将ASPP2重组腺病毒感染HepG2和Huh7细胞后,采用Western blot方法鉴定出目的基因在靶细胞中获得有效表达。在生物学活性测定中,为验证试验品是否具有抗肿瘤作用,我们选择了两种肝癌细胞HepG2和Huh7,将ASPP2重组腺病毒同时作用这两种细胞,观察到其可抑制肿瘤细胞的生长,证实了其体外具有抗肿瘤活性。
本实验根据《人基因治疗和制剂质量控制技术指导原则》及《中国药典》三部(2010版)相关要求,针对人ASPP2重组腺病毒的关键质量属性建立了质控方法,初步为该制品质量标准的建立和完善,保证其安全、有效、质量可控以及后续研究奠定了基础。
| [1] | Kay M A, Glorioso J C, Naldini L. Viral vectors for gene therapy: the art of turning infectious agents into vehicles of therapeutics[J]. Nat Med, 2001, 7 (1) : 33-40 . |
| [2] | 席聪, 安睿, 李海勋, 等. rAAV-PR39-ADM防治大鼠脑缺血/再灌注损伤的研究[J]. 中国药理学通报, 2015, 31 (5) : 641-7 . Xi C, An R, Li H X, et al. Research on prevention and treatment effect of Raav-PR39-ADM in cerebral ischemia reperfusion injury in rats[J]. Chin Pharmacol Bull, 2015, 31 (5) : 641-7 . |
| [3] | Samuels-Lev Y, O′Connor D J, Bergamaschi D, et al. ASPP proteins specifically stimulate the apoptotic function of p53[J]. Mol Cell, 2001, 8 (4) : 781-94 . |
| [4] | Gorina S, Pavletich N P. Structure of the p53 tumor suppressor bound to the ankyrin and SH3 domains of 53BP2[J]. Science, 1996, 274 (5289) : 1001-5 . |
| [5] | Vives V, Su J, Zhong S. ASPP2 is a haploinsufficient tumor suppressor that cooperates with p53 to suppress tumor growth[J]. Genes Dev, 2006, 20 (10) : 1262-7 . |
| [6] | Kampa K M, Acoba J D, Chen D, et al. Apoptosis-stimulating protein of p53(ASPP2) heterozygous mice are tumor-prone and have attenuated cellular damage-response thresholds[J]. Proc Natl Acad Sci USA, 2009, 106 (11) : 4390-5 . |
| [7] | Ma L, Chen Z M, Li X Y, et al. Nucleostemin and ASPP2 expression is correlated with pituitary adenoma proliferation[J]. Oncol Lett, 2013, 6 (5) : 1313-8 . |
| [8] | Mak V C, Lee L, Siu M K, et al. Downregulation of ASPP2 in choriocarcinoma contributes to increased migratory potential through Src signaling pathway activation[J]. Carcinogenesis, 2013, 34 (9) : 2170-7 . |
| [9] | Schittenhelm M M, Illing B, Ahmut F, et al. Attenuated expression of apoptosis stimulating protein of p53-2(ASPP2) in human acute leukemia is associated with therapy failure[J]. PLoS One, 2013, 8 (11) : e80193 . |
| [10] | 中国生物制品标准化委员会. 人基因治疗研究和制剂质量控制技术指导原则[R]. 北京:国家食品药品监督管理局, 2003. The State Biological Products Standardization Commission of the People’s Republic of China. Guidance for human gene therapy research and its products quality control[R]. Beijing: SFDA , 2003. |
| [11] | Chen G X, Zhang S, He X H, et al. Clinical utility of recombinant adenoviral human p53 gene therapy: current perspectives[J]. Onco Targets Ther, 2014, 7 : 1901-9 . |
| [12] | Trigiante G, Lu X. ASPP[corrected] and cancer[J]. Nat Rev Cancer, 2006, 6 (3) : 217-26 . |
| [13] | Sullivan A, Lu X, ASPP: a new family of oncogenes and tumour suppressor genes[J]. Br J Cancer , 2007,96(2): 196-200[J]. Br J Cancer, 2007, 96 (2) : 196-200 . |
| [14] | 林建伟,王饶高. 第二届药品技术审评研讨会论文集[C]. 北京,2003. Lin J W, Wang R G. Proceedings of the second symposium on drug technical review[C]. Beijing, 2003. |

