


利福平(rifampicin,RFP)做为目前预防和治疗结核病的一线药物,在临床上常与异烟肼合用以增强疗效。正常剂量短期服用利福平其肝毒性较小,而长期或大剂量则具有明显的肝毒性,利福平引起的肝损害是由于与蛋白结合、药物的肝肠循环延长、竞争性抑制胆红素的排泄、引起肝细胞紧密连接蛋白被破坏、肝内胆汁淤积[1],导致黄疽和肝细胞的坏死,但其分子机制未见有文献明确的阐述。本文通过给予小鼠180 mg·kg-1 30 d与90 mg·kg-1 90 d的利福平,观察利福平的肝毒性,并且检测其对肝脏胆汁酸代谢通路上相关基因的影响。
1 材料与方法 1.1 药品与仪器利福平胶囊(成都锦华,批号:131006);ALT测定试剂盒(南京建成,批号:20140615);TRIzol(大连宝生物公司);逆转录试剂盒(Applied Biosystems公司);SYBR Green预混液(美国BIO-RAD公司);实时荧光定量PCR仪(美国BIO-RAD公司,型号:CFX connect);多功能梯度PCR仪(德国Eppendoff);ChemiDoc XRS化学发光成像系统(美国BIO-RAD公司);CYP7A1抗体(abcam公司,ab65596,兔多克隆抗体);BSEP抗体(abcam公司,ab112494,兔多克隆抗体);Thermo Bis-Tris凝胶等。
1.2 实验动物与分组健康♂昆明种小鼠,体质量18~22 g,由重庆市第三军医大学大坪医院实验动物中心提供,于遵义医学院基础药理学实验室SPF级动物房饲养(许可证号:SYXK黔2014-003);自由进食、饮水,适应性喂养1周后开始给药,每天灌胃给药1次:设利福平180 mg·kg-1组,连续给药30 d;利福平90 mg·kg-1组,连续给药90 d;对照组给予相应体积的蒸馏水。
1.3 动物给药及取材小鼠按分组灌胃给药0.1 mL·10 g-1;分别给药30 d与90 d,末次给药后1 h麻醉,收集血清和肝脏组织。
1.4 Real time PCR检测基因表达检测肝组织中CYP7A1、FXR、SHP和BSEP mRNA的表达:肝组织100 mg采用TRIzol提取总RNA,通过紫外分光光度计检测总RNA的浓度与质量,以260/280的比值(1.8~2.0)确认RNA质量后再用于下一步实验:调整总RNA浓度为100 mg·L-1进行逆转录(37℃,15 min;85℃,5 sec),所得cDNA 进行SYBR Green PCR反应(退火温度60℃),PCR反应以β-actin作为内参照,所用特异性引物如Tab 1;结果采用相对定量法进行分析。
| GeneName | GenBankNumber | Forwardprimer(5′-3′) | Reverseprime(5′-3′) |
| β-actin | NM_007393 | CATCCGTAAAGACCTCTATGCCAAC | ATGGAGCCACCGATCCACA |
| CYP7A1 | NM_007824 | ATCCTGGCAAACAGAAATCG | GGCCAAGTCTGGTTTCTCTG |
| FXR | NM_009108 | TGGGTACCAGGGAGAGACTG | GTGAGCGCGTTGTAGTGGTA |
| SHP | NM_011850 | CTCATGGCCTCTACCCTCAA | GGTCACCTCAGCAAAAGCAT |
| BSEP | NM_021022 | GGACAATGATGTGCTTGTGG | CACACAAAGCCCCTACCAGT |
取100 mg肝组织,加入1 mL RIPA裂解液与PMSF,匀浆后离心取上清,经BCA蛋白定量试剂盒定量蛋白浓度,加入蛋白上样缓冲液95℃变性。10% Bis-Tris凝胶进行电泳,使用PVDF膜进行蛋白转膜,经封闭后,4℃孵育一抗过夜,TBST缓冲液洗膜后孵育二抗1 h,洗膜滴加化学发光液曝光显影。
1.6 数据统计分析所有数据用x±s表示,采用SPSS 18.0软件进行单因素方差分析统计。
2 实验结果 2.1 利福平对小鼠肝重系数的影响如Fig 1所示,小鼠30 d连续给予180 mg·kg-1利福平与90 d给予90 mg·kg-1利福平,给药组组肝重系数明显增加。
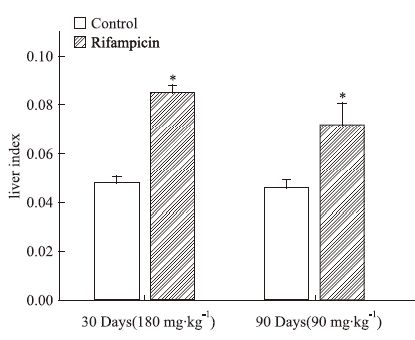
|
| Fig 1 The liver index of rifampicin 180 mg·kg-1 for 30 days and 90 mg·kg-1 for 90 days Rifampicin increased animal liver index in both groups( x±s,n=5). *P<0.05 vs control |
如Fig 2所示,小鼠连续给予利福平180 mg·kg-1 30 d后,利福平组血清谷丙转氨酶(ALT)明显增加;而连续给予利福平90 mg·kg-1 90 d,血清ALT含量虽有增加,但增加不多。
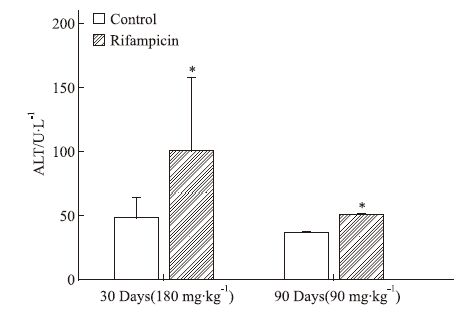
|
| Fig 2 The level of ALT by rifampicin 180 mg·kg-1 for 30 days and 90 mg·kg-1 for 90 days in serum. Rifampicin increased serum enzyme activities in mice(x±s,n=5). *P<0.05 vs control |
与空白组相比,肝脏细胞明显病变损伤,表现为肝细胞水肿、羽毛样变性与脂肪变性。见Fig 3。
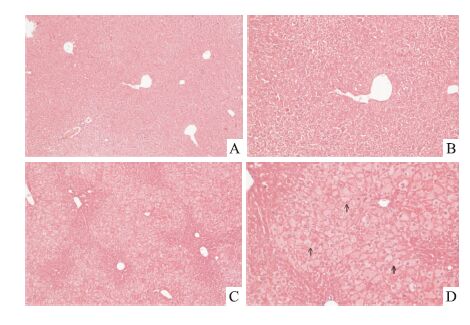
|
| Fig 3 Photomicrography of liver sections from the mice in the Rifampicin 180 mg·kg-1 for 30 days group Histopathology showed dramatically steatosis and spotted feathery-like degeneration.↑ feathery-like degeneration.A:Control(original magnification×100);B:Control(original magnification×200);C:Rifampicin(original magnification×100);D:Rifarmpicin(original magnification×200) |
与空白组相比,利福平组有明显肝细胞病理学改变:可见细胞肿涨,羽毛样变性;可发现其病理改变较利福平180 mg·kg-1 30 d组轻。见Fig 4。
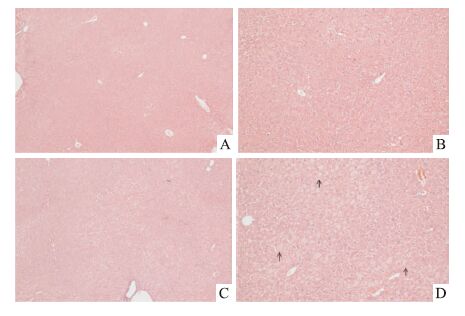
|
| Fig 4 Photomicrography of liver sections from the mice in the Rifampicin 90 mg·kg-1 90 days group Histopathology showed steatosis and spotted feathery-like degeneration.↑ feathery-like degeneration.A:Control(original magnification×100);B:Control(original magnification×200);C:Rifampicin(original magnification×100);D:Rifarmpicin(original magnification×200) |
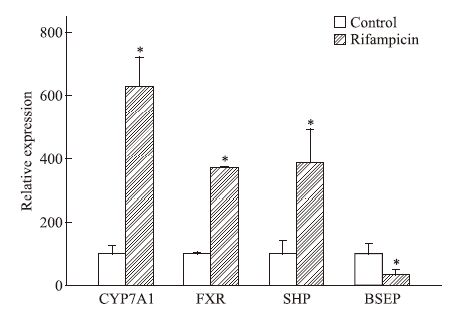
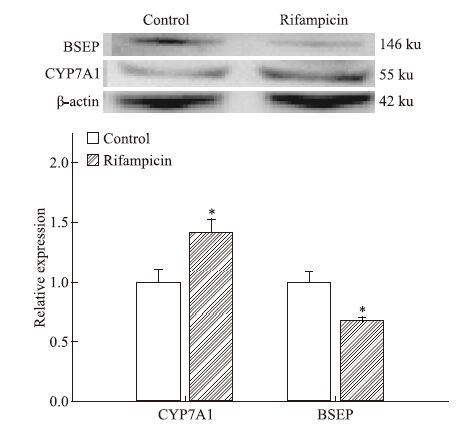
与空白组相比,利福平180 mg·kg-1 30 d组CYP7A1、FXR与SHP均呈现基因高表达现象,BSEP呈现低表达,见Fig 5。Western blot检测蛋白表达也证实CYP7A1表达增加,BSEP表达降低。见Fig 6。
|
| Fig 5 The relative expression of CYP7A1,FXR,SHP and BSEP mRNA in the mice liver of rifampicin 180 mg·kg-1 30 days group Rifampicin increased relative expression of CYP7A1,FXR and SHP; BSEP mRNA levels decreased in the mice liver(x±s,n=5). *P<0.05 vs control. |
|
| Fig 6 Protein expression of CYP7A1 and BSEP in the mice liver of rifampicin 180 mg·kg-1 30 days group Protein expression of CYP7A1 are increased and protein expression of BSEP was lower in rifampicin 180 mg·kg-1 30 days group(x±s,n=3). *P<0.05 vs control. |
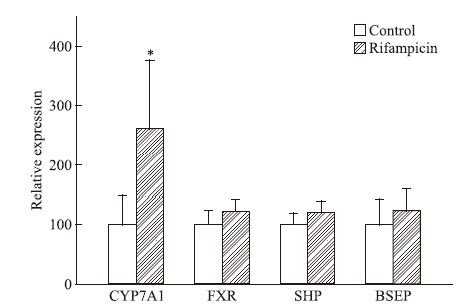
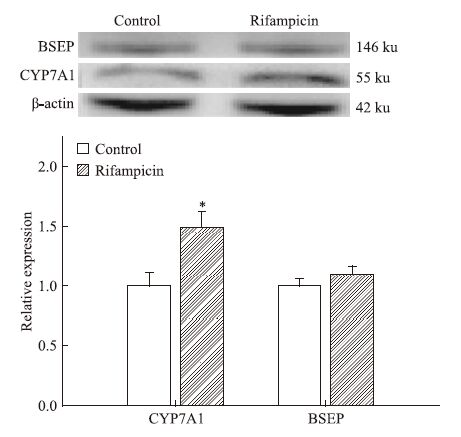
与空白组相比,利福平90 mg·kg-1 90 d组CYP7A1基因呈高表达,FXR、SHP与BSEP未出现明显变化,见Fig 7。Western blot检测蛋白表达也证实CYP7A1表达增加,BSEP表达无改变。见Fig 8。
|
| Fig 7 The relative expression of CYP7A1,FXR,SHP and BSEP mRNA in the mice liver of rifampicin 90 mg·kg-1 90 days group Rifampicin increased relative expression of CYP7A1 mRNA;Rrelative expression of FXR,SHP and BSEP mRNA has no change in the mouse liver(x±s,n=5).*P<0.05 vs control. |
|
| Fig 8 Protein expression of CYP7A1 and BSEP in the mice liver of rifampicin 90 mg·kg-1 90 days group Protein expression of CYP7A1 are increased in the rifampicin group,but the protein expression of BSEP does not change(x±s,n=3).*P<0.05 vs control group. |
抗结核药物引起的肝损害是药物性肝损害最常见的原因之一,一线抗结核药物利福平最常见的不良反应为肝毒性[2];利福平可导致以胆汁淤积为主的肝损伤[3],利福平作为肝药酶强诱导剂之一,与其他具有一定肝毒性的药物合用,可使发生致命性肝毒性的危险明显增加[4]。
结核病人一般需服用利福平半年以上,成人口服剂量为10~20 mg·kg-1:10 mg·kg-1为长期服用正常剂量,20 mg·kg-1为短时间大剂量给药。根据人与小鼠给药剂量体表面积换算法,本实验中设利福平180 mg·kg-1 30 d组与90 mg·kg-1 90 d组。
本实验中,小鼠口服利福平180 mg·kg-1 30 d,小鼠生理状态较差,皮毛黯淡无光,肝指数增加,血清ALT水平明显增高,肝细胞水肿、羽毛样变性,提示肝细胞胆汁淤积[5],证实利福平180 mg·kg-1 30 d具有肝毒性。服用90 mg·kg-1 利福平90 d后,其肝重系数亦增加,血清ALT水平虽有增加但仍在正常范围,肝组织病理切片发现90 d 90 mg·kg-1 利福平亦可引起肝细胞内胆汁淤积状病理改变。长期服用利福平,会引起小鼠胆汁淤积性肝损伤,但90 mg·kg-1 90 d利福平损伤较小,可能与其长期服药肝损伤自适应有关[6]。
胆固醇7α-羟化酶(CYP7A1)是肝细胞合成胆汁酸经典途径唯一的限速酶[7],CYP7A1的活性与胆汁酸的疏水程度呈明显负相关,而疏水性胆汁酸的肝内聚积是胆汁淤积性肝病肝损伤的主要原因;CYP7A1 基因位点上具有多个受体结合位点,多种核受体参与了针对CYP7A1 基因结合位点的调控,其中包括法尼醇受体(FXR)与小分子异源二聚体伴侣(SHP);FXR 是一个孤儿核受体,研究发现:内源性胆酸可以激活FXR,因此FXR也称为胆汁酸受体。SHP的表达可抑制胆汁酸合成相关基因及SHP自身的表达[8],SHP表达的增加还会减少胆汁酸被肝细胞再摄取[9]。FXR与胆酸结合后被激活,激活的FXR通过与SHP的反应元件单位结合,抑制其他核受体,进而抑制胆汁酸合成关键酶CYP7A1的表达,减少胆汁酸合成。
检测各组肝脏组织胆汁酸代谢相关基因表达情况,发现连续给予利福平180 mg·kg-1 30 d与90 mg·kg-1 90 d均可增加CYP7A1 mRNA表达,且180 mg·kg-1 30 d引起CYP7A1 mRNA表达增加更明显,检测蛋白表达情况也证实此现象;CYP7A1表达增加会引起肝细胞内胆汁酸合成增加,疏水性胆汁酸的肝内聚积,肝细胞内胆汁酸池过大则会引起机体肝脏的负反馈调节FXR/SHP 通路被激活,本实验也证实:FXR、SHP的mRNA表达增加。而连续给药90 mg·kg-1 90 d,FXR、SHP的mRNA表达未见明显变化,提示机体肝脏的FXR/SHP 负反馈调节通路未被激活。BSEP是肝细胞毛细胆管膜上重要的胆汁酸排泄载体[10]。可依赖ATP将胆汁酸通过肝细胞的小管膜分泌至胆汁中。抑制BSEP是药物性肝损伤的机制之一[11],其对利福平所致的肝损伤具有重要影响[12-13]。利福平180 mg·kg-1 30 d后可明显降低BSEP表达,90 mg·kg-1 90利福平未引起BSEP表达变化,提示180 mg·kg-1利福平给药30 d可引起BSEP介导的胆汁酸排泄减少。
小鼠口服利福平180 mg·kg-1 30 d与90 mg·kg-1 90 d均引起肝细胞合成胆汁酸经典途径的限速酶CYP7A1表达增加,引起胆汁淤积性肝损伤;180 mg·kg-1 30 d利福平还会引起胆汁酸排泄主要载体BSEP的表达降低,使肝损伤明显加重。
综上所述,利福平对小鼠具有明显的肝毒性,会引起的胆汁淤积性肝损伤;且其毒性与剂量的关系比给药时间的长短更为明显。利福平会引起胆汁代谢相关基因CYP7A1、BSEP的基因表达变化,可能是其导致胆汁淤积性肝损伤的机制之一。研究利福平引起的肝损伤机制将有助于减少利福平应用过程中的不良反应并为治疗不良反应提供依据[14-15]。
( 致谢: 本实验在陆远富教授与刘杰教授指导下,由徐永吉和李文楷完成。实验完成于贵州省遵义医学院基础药理省部共建教育部重点实验室;感谢实验室各位老师的支持与帮助;感谢王洋硕士研究生在实验过程中的帮助;感谢国家自然科学基金(81460632)的资助。 )
| [1] | Chen X, Zhang C, Wang H, et al. Altered integrity and decreased expression of hepatocyte tight junctions in rifampicin-induced cholestasis in mice[J]. Toxicol Appl Pharmacol, 2009, 240 (1) : 26-36 . |
| [2] | 贾忠, 吴晶, 马建军, 等. 一线抗结核药物肝损害的研究现状[J]. 中国防痨杂志, 2013, 35 (6) : 468-71 . Jia Z, Wu J, Ma J J, et al. Research of anti-tuberculosis drugs′ hepatotoxicity[J]. Chin J Ant Tuberc, 2013, 35 (6) : 468-71 . |
| [3] | 曹云海, 陈熙, 张程, 等. 利福平对小鼠肝细胞胆汁酸转运体 Bsep 和 Mrp2 表达与定位的影响[J]. 中国药理学通报, 2010, 26 (12) : 1581-6 . Cao Y H, Chen X, Zhang C, et al. Change of expression and localization of canalicular Bsep and M rp2 in rifampicin-induced cholestasis in mice[J]. Chin Pharmacol Bull, 2010, 26 (12) : 1581-6 . |
| [4] | 侯相瑜, 金晶, 李宏亮, 等. SIRT1 在丙戊酸对肝细胞毒性中的作用研究[J]. 中国药理学通报, 2015, 31 (1) : 31-4 . Hou X Y, Jin J, Li H L, et al. Valproic acid suppresses SIRT1 inducing hepatotoxicity[J]. Chin Pharmacol Bull, 2015, 31 (1) : 31-4 . |
| [5] | Li M K, Crawford J M. The pathology of cholestasis[J]. Semin Liver Dis, 2004, 24 (1) : 21-42 . |
| [6] | 蔡轶, 任晓非, 王巍, 等. 利福平致大鼠胆汁淤积性肝损伤适应性现象的研究[J]. 胃肠病学, 2013, 18 (3) : 134-8 . Cai Y, Ren X F, Wang W, et al. Adaptation Phenomenon of Cholestatic Hepatic Injury Induced by Rifampicin in Rats[J]. Chin J Gastroenterol, 2013, 18 (3) : 134-8 . |
| [7] | Chiang J Y. Bile acid metabolism and signaling[J]. Compr Physiol, 2013, 3 (3) : 1191-212 . |
| [8] | Lee Y K, Moore D D. Dual mechanisms for repression of the monomeric orphan receptor liver receptor homologous protein-1 by the orphan small heterodimer partner[J]. J Biol Chem, 2002, 277 (4) : 2463-7 . |
| [9] | Zollner G, Wagner M, Fickert P, et al. Role of nuclear receptors and hepatocyte-enriched transcription factors for Ntcp repression in biliary obstruction in mouse liver[J]. Am J Physiol Gastrointest Liver Physiol, 2005, 289 (5) : G798-805 . |
| [10] | 牛璐, 金晶, 陈攀, 黄民. 黄芩素对胆汁外排转运体MRP2和BSEP的影响[J]. 中国药理学通报, 2015, 31 (1) : 147-8 . Niu L, Jin J, Chen P, Huang M. Effect of baicalein on expression of M RP2 and BSEP in HepG2 cells[J]. Chin Pharmacol Bull, 2015, 31 (1) : 147-8 . |
| [11] | Kis E, Ioja E, Rajnai Z, et al. BSEP inhibition: in vitro screens to assess cholestatic potential of drugs[J]. Toxicol In Vitro, 2012, 26 (8) : 1294-9 . |
| [12] | 王莉, 宋育林, 何雪. PPARα激活可改善利福平合用异烟肼所致的大鼠肝损伤[J]. 安徽医科大学学报, 2014, 49 (8) : 1057-61 . Wang L, Song Y L, He X. Activation of peroxisome proliferator activated receptor alpha ameliorates Isoniazid and Rifampin induced liver injury in rats[J]. Acta Univ Med Anhui, 2014, 49 (8) : 1057-61 . |
| [13] | 庞纯, 蒋萍, 季莉莉. 黄芩素激活核转录因子Nrf2拮抗肝毒性的研究[J]. 中国药理学通报, 2014, 30 (4) : 546-9 . Pang C, Jiang P, Ji L L. Baicalein induced Nrf2 activation and its protection against hepatotoxicity[J]. Chin Pharmacol Bull, 2014, 30 (4) : 546-9 . |
| [14] | 陈攀, 李晶洁, 陈杰. 以核受体为靶标的胆汁淤积治疗药物研究进展[J]. 中国药理学通报, 2015, 31 (9) : 1195-8 . Chen P, Li J J, Chen J. Nuclear receptors as drug targets in cholestasis[J]. Chin Pharmacol Bull, 2015, 31 (9) : 1195-8 . |
| [15] | 曹玲娟, 龚慧, 颜苗, 等. Nrf2-ARE 信号通路参与肝脏疾病病理机制研究进展[J]. 中国药理学通报, 2015, 31 (8) : 1057-61 . Cao L J, Gong H, Yan M, et al. Research progress on Nrf2·ARE signaling pathway involved in liver disease pathological mechanism[J]. Chin Pharmacol Bull, 2015, 31 (8) : 1057-61 . |

