


Toll样受体4(toll-1ike receptor 4,TLR4)是介导天然免疫的一类重要的跨膜蛋白受体,与宿主细胞对各种微生物致病原的识别有关[1]。TLR4能特异性地识别病原相关分子模式(pathogen associated molecular patterns,PAMPs),通过跨膜信号转导将病原相关分子刺激信号转导入细胞内,通过髓样分化因子88(myeloid differentiation factor 88,MyD88)触发信号级联,使核因子-κB(nuclear factor kappa-B,NF-κB)抑制单位IκBα(inhibitor of κBα)发生磷酸化并降解,NF-κB与IκBα解离进入细胞核,与下游基因的启动子或增强子中的κB转录调控序列发生特异性结合,导致炎症相关基因的转录表达,最终引起炎症因子大量释放和炎症反应[2]。
豆蔻明(cardamonin,CDN),结构为2′,4′-二羟基-6′-甲氧基查尔酮,主要存在于姜科植物草豆蔻(Alpinia katsumadai Hayata)的种子中[3]。豆蔻明具有抗血小板聚集、抗肿瘤、抗诱变、抗炎、抗氧化和抗菌等多种生物活性[4]。大量研究表明,豆蔻明对炎症介质前列腺素E2(prostaglandin E2,PGE2)、一氧化氮(nitric oxide,NO)、肿瘤坏死因子(tumor necrosis factor,TNF)-ɑ、白介素(interleukin,IL)-1β和IL-6的抑制作用与抑制NF-κB信号通路有关[5]。TLR4是NF-κB的上游调控基因,有关豆蔻明对TLR4/NF-κB信号通路的调节作用仅见于我们前期的研究报道:豆蔻明对小鼠结肠黏膜炎性损伤的保护作用,可能与下调结肠组织的TLR4表达、抑制NF-κB及丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)活性和减少炎症介质释放有关[6]。本研究拟以LPS诱导的RAW 264.7细胞作为模型,进一步探讨豆蔻明对TLR4/NF-κB信号通路的调节作用,为豆蔻明的抗炎分子机制研究提供依据。
1 材料与方法 1.1 材料豆蔻明(C16H14O4,MW 270.28)购于上海纯优生物科技有限公司(纯度≥98%,批号P0242);RAW264.7小鼠单核/巨噬细胞购于中科院上海细胞所;DMEM、胎牛血清、TRIzol、DMSO和Tween-20购于美国Life Technologies公司;LPS购于美国Sigma公司;CCK-8试剂盒(Cell Counting Kit-8)购于上海前尘生物科技有限公司;Griess试剂盒购于南京建成生物工程研究所;蛋白酶抑制剂(protease inhibitor cocktail)和RIPA裂解液购于美国Thermo Fisher Scientific公司;反转录试剂盒及荧光定量PCR试剂盒购于日本TaKaRa公司;BCA蛋白定量试剂盒购于美国Thermo Fisher Scientific公司;iNOS、TLR4、MyD88、IκBα、p-p65、P-IκBα和β-actin抗体购自美国Cell Signaling Technology公司;ECL显影试剂盒购于美国Millipore公司。
1.2 方法 1.2.1 细胞培养及化学品处理RAW264.7细胞用含10%胎牛血清的DMEM培养基于37℃,5% CO2培养箱中培养,2 d换液1次,取对数期细胞用于实验。用 DMSO 溶解豆蔻明,配成0.1 mol·L-1储液,-20℃避光保存。使用前取出融化,漩涡振荡后按一定浓度加入到细胞,使加入细胞的DMSO终浓度为0.1%。空白/溶剂对照组DMSO浓度为0.1%。
1.2.2 细胞活力检测RAW264.7细胞悬液按照1×105每孔接种于96孔板,每组4个复孔。除溶剂对照孔外,其余每孔用CDN(0、1、5、15、25、50 μmol·L-1)预处理2 h,然后加入LPS(2 mg·L-1)共同孵育12 h和24 h。去培养基,每孔加入100 μL细胞培养液,再加入10 μL试剂盒自带CCK-8溶液,37℃孵育1 h,酶标仪测定吸光度值(A=450 nm)。实验结果以细胞存活率表示,细胞存活率/%=给药组/溶剂对照组×100%。
1.2.3 NO的测定采用Griess试剂法测定细胞培养上清液中总NO的含量。RAW264.7细胞悬液按照1×105每孔接种96孔板,每组6个复孔。除溶剂对照孔外,其余每孔用CDN(0、1、5、15、25、50 μmol·L-1)预处理2 h,然后加入LPS(2 mg·L-1)共同孵育24 h。按照Griess试剂盒操作步骤检测上清NO的含量。
1.2.4 RT-PCRRAW264.7细胞悬液按照2×106每孔接种6孔板,每组3个复孔。除溶剂对照孔外,其余每孔用CDN(0、5、15、25 μmol·L-1)预处理2 h,然后加入LPS(2 mg·L-1)共同孵育24 h。培养结束后,用TRIzol试剂提取总RNA并定量。按TaKaRa逆转录试剂说明书,取1 μg RNA反转录为cDNA。采用SYBR Green PCR试剂,在ABI 7300荧光定量PCR仪上进行PCR扩增和检测,PCR反应条件为95 ℃ 1 min预变性,95 ℃ 5s变性,60 ℃ 34 s退火,共40个循环。按照标准荧光定量PCR引物设计原则,使用Primer 5.0软件设计引物,引物由上海捷瑞生物工程有限公司合成(Tab 1)。每次扩增设置β-actin基因为内参照,用PCR仪自带软件进行荧光定量分析,得出Ct值,统计△△Ct值以比较各组mRNA的表达。
| Primer | Primer sequence |
| IL-6 | Sense: 5′ ACCACGGCCTTCCCTACTTC 3′ |
| Antisense: 5′ CATTTCCACGATTTCCCAGA 3′ | |
| TNF-α | Sense: 5′ CCCTCACACTCAGATCATCTTCT 3′ |
| Antisense: 5′ GCTACGACGTGGGCTACAG 3′ | |
| COX-2 | Sense: 5′ GAAGTCTTTGGTCTGGTGCCT 3′ |
| Antisense: 5′ GCTCCTGCTTGAGTATGTCG 3′ | |
| iNOS | Sense: 5′ GTTCTCAGCCCAACAATACAAGA 3′ |
| Antisense: 5′ GTGGACGGGTCGATGTCAC 3′ | |
| IL-1β | Sense: 5′ GCAACTGTTCCTGAACTCAACT 3′ |
| Antisense: 5′ ATCTTTTGGGGTCCGTCAACT 3′ | |
| MCP-1 | Sense: 5′ TTAAAAACCTGGATCGGAACCAA 3′ |
| Antisense: 5′ GCATTAGCTTCAGATTTACGGGT 3′ | |
| β-actin | Sense: 5′GGCTGTATTCCCCTCCATCG 3′ |
| Antisense: 5′ CCAGTTGGTAACAATGCCATGT 3′ |
RAW264.7细胞悬液按照2×106每孔接种6孔板,每组4个复孔。除溶剂对照孔外,其余每孔用CDN(0、25 μmol·L-1)预处理2 h,然后加入LPS(2 mg·L-1)共同孵育24 h。弃上清,用预冷的PBS洗涤3次,每孔加入300μl 含有蛋白酶抑制剂的RIPA裂解液,冰上反应30 min后,12 000×g 4℃离心15 min,按照BCA蛋白定量试剂盒说明书对上清液进行蛋白定量,10% SDS-PAGE凝胶电泳分离蛋白,然后转移至浸泡过甲醇的PVDF膜上,脱脂牛奶室温封闭1 h后,分别用一抗iNOS、TLR4、MyD88、p-p65、IκBα、p-IκBα(均为1 ∶ 1 000 稀释)及β-actin(1 ∶2 000稀释)于4℃ 孵育过夜。PBST缓冲液洗膜3次后,与标记有HRP的二抗共孵1 h,ECL显影。用Quantity One Software(Bio-rad Laboratories,USA)对蛋白条带进行定量分析,以β-actin表达作为内参。
1.2.6 统计学处理结果以x±s表示,用SPSS 18.0统计软件进行组间单因素方差分析及LSD检验。
2 结果 2.1 CDN对RAW264.7细胞活力的影响如Fig 1所示,RAW264.7细胞经CDN(0~50 μmol·L-1)预处理2 h,然后加入LPS(2 mg·L-1)共同孵育12 h和24 h后,与未经处理的细胞相比,细胞活力差异无显著性(P>0.05)。提示本研究所用CDN浓度剂量(0~50 μmol·L-1)及处理时间(12、24 h)对细胞无毒性。

|
| Fig 1 Effects of CDN on cell viability of RAW264.7 cells(n=4) |
如Fig 2所示,与正常对照组相比,LPS诱导的RAW264.7细胞上清中NO含量明显升高(P<0.01),CDN(0~50 μmol·L-1)可剂量依赖性抑制NO的产生,其中25 和50 μmol·L-1 CDN明显抑制LPS诱导的RAW264.7细胞上清液中NO的积累(P<0.01)。
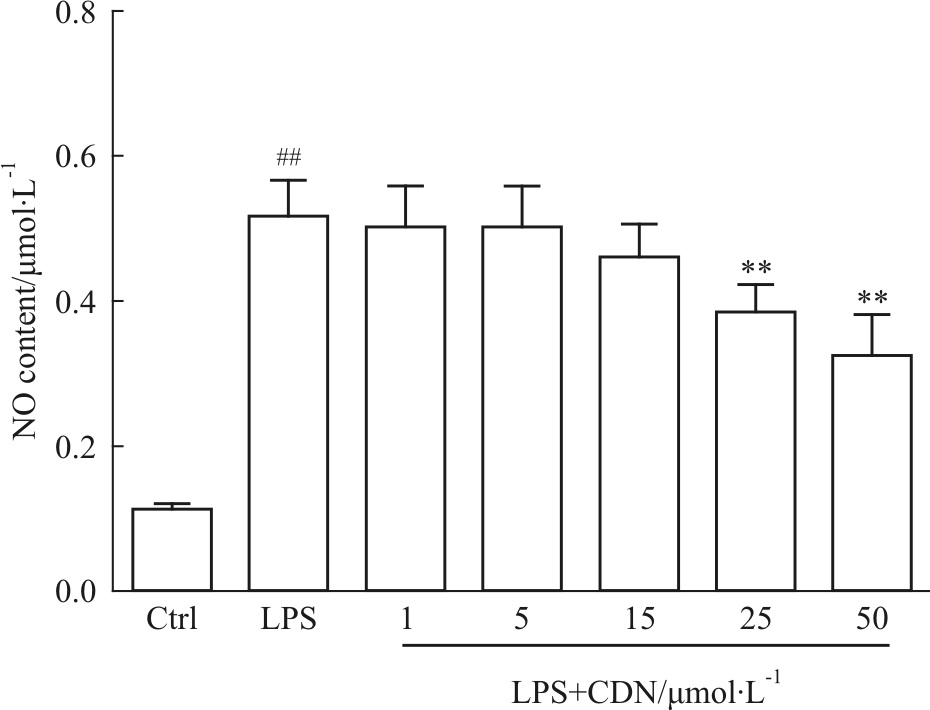
|
| Fig 2 Effects of CDN on production of NO in LPS-stimulated RAW264.7 cells(n=6) ##P<0.01 vs vehicle-treated cells;**P<0.01 vs LPS-treated cells |
正常对照组RAW264.7细胞中环氧合酶-2(COX-2)、诱导型NO合成酶(iNOS)、单核细胞趋化蛋白-1(MCP-1)、TNF-ɑ、IL-1β和IL-6的mRNA表达水平都很低,LPS刺激后表达量均明显升高(P<0.01),CDN(5、15、25 μmol·L-1)可剂量依赖性抑制上述基因的表达(Fig 3)。
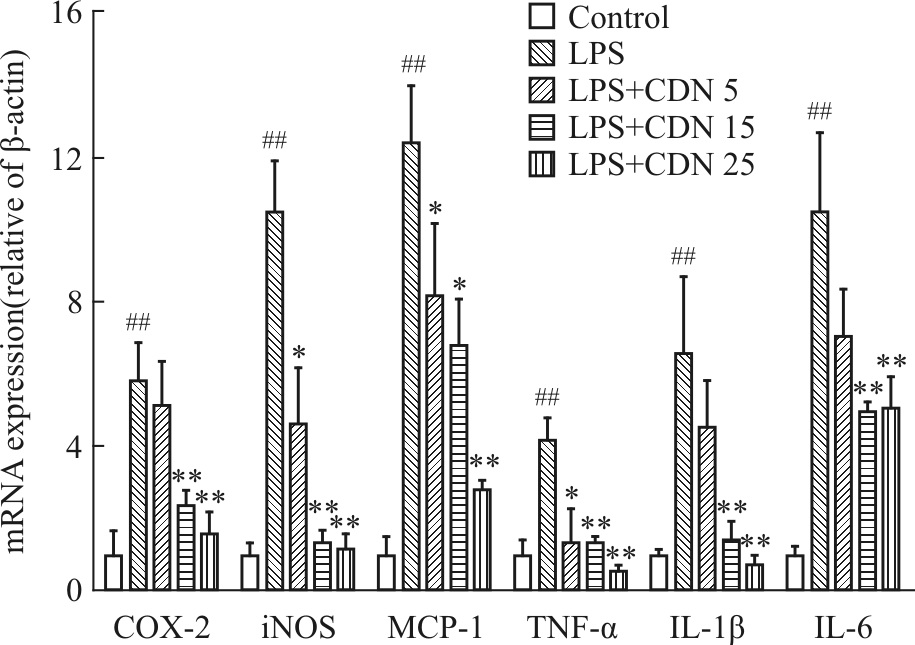
|
| Fig 3 Effects of CDN on mRNA levels of COX-2,iNOS,MCP-1,TNF-α,IL-1β and IL-6 in LPS-stimulated RAW264.7 cells(n=3) ##P<0.01 vs vehicle-treated cells;*P<0.05,**P<0.01 vs LPS-treated cells |
Western blot显示(Fig 4),CDN(25 μmol·L-1)可明显抑制LPS 诱导的RAW264.7细胞TLR4(P<0.01)、MyD88(P<0.01)、p-p65(P<0.01)、p-IκBα(P<0.05)和iNOS蛋白的表达(P<0.05),抑制LPS诱导的IκBα蛋白的降解(P<0.01)。

|
| Fig 4 Effects of CDN on signaling molecules expression of TLR4/MyD88/NF-κB/iNOS pathway in LPS-stimulated RAW264.7 cells(n=4) A:Western blot was performed and one representative experiment from three independent experiments was shown;B:Blots were quantified by densitometric analysis.##P<0.01 vs vehicle-treated cells;*P<0.05,**P<0.01 vs LPS-treated cells. |
LPS诱导的RAW264.7小鼠巨噬细胞模型,被广泛用于研究炎症反应,产生的过量NO会导致细胞损伤和组织坏死[7]。NO由iNOS催化合成,NO还可促进炎症介质前列腺素E2(PGE2)合成的限速酶COX-2的生成[8]。本研究表明,豆蔻明可剂量依赖性抑制RAW264.7细胞NO的产生,同时抑制iNOS、COX-2 mRNA的表达及iNOS蛋白的表达。据报道炎症细胞因子TNF-α、IL-1β、IL-6和化学因子MCP-1主要由单核巨噬细胞分泌,是早期炎症的标志物,在机体损伤、感染、免疫反应等情况下大量合成和释放,是炎症反应的促发剂[2]。本研究发现豆蔻明可剂量依赖性抑制RAW264.7细胞TNF-α、IL-1β、IL-6和MCP-1 mRNA表达。
NF-κB是启动机体免疫应答及炎性细胞因子表达的关键转录因子,静息状态下NF-κB以非活性的NF-κB/IκBα复合物形式存在于细胞质中,当细胞受到LPS刺激后,IκBα发生磷酸化并降解,NF-κB与IκBα解离后转移至核内,参与调节各种炎症介质基因的转录表达,如髓过氧化物酶(myeloperoxidas,MPO)、NO、TNF-α、IL-1β和IL-6等[2, 6]。目前已发现多种因素可以诱导NF-κB活化,包括细胞因子、LPS、蛋白激酶C和理化因素(X射线、氧化剂及化疗药物)等[9]。本研究发现豆蔻明可明显抑制LPS诱导的RAW264.7细胞p-p65和p-IκBα的表达及IκBα的降解,提示豆蔻明对NF-κB活性具有抑制作用,这与文献报道一致[4, 5]。
迄今人类TLRs家族成员至少已发现10种,TLR4是TLRs家族的一个重要亚型,在人体多种细胞中广泛表达,主要分布于内皮细胞、巨噬细胞、中性粒细胞、星形胶质细胞等[10]。TLR4的配体包括细菌脂多糖LPS、硫酸乙酰肝素、纤连蛋白-EDA、透明质酸和纤维蛋白原等,受损组织和坏死细胞也可以释放出TLR4的内源性激活物[2]。RAW264.7细胞表面具有TLR4病原模式识别受体,能识别外源性同源配体LPS,刺激信号通过TLR4转导至RAW264.7细胞内,激活转录因子NF-κB,进而启动炎症级联效应基因的表达。MyD88属于衔接蛋白家族成员,TLR4一旦被激活,可募集胞内段的衔接蛋白MyD88触发信号级联,激活NF-κB[6]。本研究发现豆蔻明可明显抑制LPS诱导的RAW264.7细胞TLR4和MyD88蛋白表达,提示豆蔻明可能通过下调RAW264.7细胞TLR4的蛋白表达,抑制其衔接蛋白分子MyD88,进而抑制NF-κB活化和iNOS蛋白表达,最终抑制NO的产生。
综上所述,豆蔻明通过抑制TLR4/MyD88/NF-κB/iNOS信号通路,进而抑制炎性介质NO的生成,从而减轻炎症反应。进一步研究应探讨其他的炎症信号通路。
( 致谢: 本文所有实验均在上海中医药大学中药研究所药理实验室完成,邓超、任改艳、孙阿宁和罗晓平负责细胞培养和检测,任改艳负责数据处理和统计分析,王峥涛和窦薇负责实验设计和论文撰写。 )
| [1] | Fort M M, Mozaffarian A, Stver A G, et al. A synthetic TLR4 antagonist has anti-inflammatory effects in twomurine models of inflammatory bowel disease[J]. J Immunol, 2005, 174 (10) : 6416-23 . |
| [2] | Zhang J, Dou W, Zhang E, et al. Paeoniflorin abrogates DSS-induced colitis via a TLR4-dependent pathway[J]. Am J Physiol Gastrointest Liver Physiol,, 2014, 306 (1) : G27-36 . |
| [3] | 乔春峰, 徐珞珊, 王峥涛, 等. 山姜素和豆蔻明的研究概况[J]. 中国野生植物资源, 2002, 20 (6) : 11-5 . Qiao C F, Xu L S, Wang Z T, et al. Progress in studies of alpinetin and cardamonin[J]. Chin Wild Plant Res, 2002, 20 (6) : 11-5 . |
| [4] | Gonalves L M, Valente I M, Rodrigues J A. An overview on cardamonin[J]. J Med Food, 2014, 17 (6) : 633-40 . |
| [5] | Kim Y J, Ko H, Park J S, et al. Dimethyl cardamonin inhibits lipopolysaccharide-induced inflammatory factors through blocking NF-kappaB p65 activation[J]. Int Immunopharmacol, 2010, 10 (9) : 1127-34 . |
| [6] | Ren G, Sun A, Deng C, et al. The anti-inflammatory effect and potential mechanism of cardamonin in DSS-induced colitis[J]. Am J Physiol Gastrointest Liver Physiol, 2015, 309 (7) : G517-27 . |
| [7] | 李晓红, 齐云, 蔡润兰, 等. 芦荟大黄素对LPS诱导的RAW264.7细胞NO生成及iNOS表达的影响[J]. 中国药理学通报, 2010, 26 (4) : 488-92 . Li X H, Qi Y, Cai R L, et al. Effect of lipopolysaccharide induced expression of inducible nitric oxide synthase by aloe-emodin in RAW264[J]. Chin Pharmacol Bull, 2010, 26 (4) : 488-92 . |
| [8] | 杨会军, 刘维超, 李兆福, 等. 痛风消颗粒对RAW264.7巨噬细胞COX-2和iNOSmRNA调控作用的研究[J]. 2014, 2014, 3 (8) : 25-42 . Yang H J, Liu W C, Li Z F, et al. On the regulatory effects of gout granule on RAW264[J]. On the regulatory effects of gout granule on RAW264.7 macrophage COX-2 and iNOS mRNA, 2014, 3 (8) : 25-42 . |
| [9] | 任改艳, 孙阿宁, 张晶晶, 等. NF-κB在细胞凋亡中调节作用的研究进展[J]. 中国药理学与毒理学杂志, 2015, 29 (2) : 323-7 . Ren G Y, Sun A N, Zhang J J, et al. Advances in roles of NF-κB in regulating pathways of apoptosis[J]. Chin J Pharmacol Toxicol, 2015, 29 (2) : 323-7 . |
| [10] | Sung M K, Park M Y. Nutritional modulators of ulcerative colitis:clinical efficacies an mechanistic view[J]. World J Gastroenterol, 2013, 19 (7) : 994-1004 . |

